INTRODUCCIÓN
Aunque por tradición se mantiene el nombre de vitamina (sustancia orgánica de origen exógeno, que es necesaria para las funciones vitales), en realidad la vitamina D es un complejo hormonal de síntesis mayoritariamente endógena. El sistema hormonal de la vitamina D está formado por diferentes metabolitos, que incluyen desde precursores o metabolitos de origen dietético a una larga lista de metabolitos de la cadena de síntesis endógena hasta el metabolito más activo, el 1-25 hidroxivitamina D o calcitriol1.
Respecto al aporte exógeno de «vitamina D», hay que tener en cuenta que son muy pocos los alimentos que contienen de forma natural cantidades significativas de la misma. Entre las fuentes naturales de vitamina D se encuentran los pescados grasos, como el salmón, y la yema de los huevos, si bien parte significativa de la misma puede ser desnaturalizada en el proceso de cocción de los alimentos. No obstante, hoy en día ya existen en el mercado una gran cantidad de alimentos suplementados con esta vitamina, como productos lácteos o cereales, que vendrían a paliar el déficit de aporte exógeno de vitamina D2,3. Cuando se habla de vitamina D de origen dietético, se hace referencia fundamentalmente a dos compuestos: la vitamina D2 o ergocalciferol (de origen vegetal), que se forma a partir del ergosterol, y la vitamina D3 o colecalciferol (de origen animal), que se forma a partir del 7 dehidrocolesterol4.
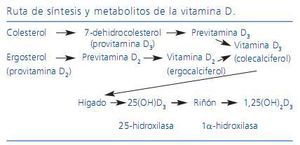
Sin embargo, la principal fuente de obtención de vitamina D en el ser humano sigue siendo la síntesis endógena a partir del 7-dehidrocolesterol. Este proceso tiene lugar en la piel, donde la radiación ultravioleta B del sol induce la conversión proteolítica del 7-dehidrocolesterol (denominado provitamina D3) a previtamina D3; seguido esto de una isomerización térmica a vitamina D3 (figura 1)3,5.
La activación metabólica de la vitamina D (producción de metabolitos con capacidad de estimular al receptor de la vitamina D) se produce en dos etapas. La primera es la hidroxilación del carbono 25 en el hígado a través de la 25-hidroxilasa, dando lugar a la 25-hidroxivitamina D (25(OH)D) (también denominada calcidiol o calcifediol o 25-hidroxicolecalciferol). Este metabolito centrará gran parte de la atención de esta revisión. La segunda etapa en la bioactivación de esta vitamina es la formación del 1,25-dihidroxivitamina D (1,25(OH) 2D) o calcitriol, que se produce en condiciones fisiológicas, principalmente en el riñón por medio de la 1α-hidroxilasa. Esta enzima se expresa de forma predominante en el epitelio tubular proximal, pero en el humano también se ha identificado en el túbulo distal. La 1α-hidroxilasa se estimula por la hormona paratiroidea (PTH) y se inhibe por el P sérico y por el FGF-23.
La capacidad de la 1α-hidroxilasa para sintetizar calcitriol disminuye según progresa la enfermedad renal crónica (ERC) por la pérdida de nefronas funcionantes. Esto contribuye a que se alteren las concentraciones de Ca y P sérico en sentido inverso. La tendencia a la hipocalcemia estimularía la síntesis de PTH, mientras que la hiperfosforemia, además de estimular la síntesis de PTH, inhibiría la 1α-hidroxilasa, siendo un mecanismo redundante en el estímulo de la PTH.
Por lo tanto, la disminución de la actividad de 1α-hidroxilasa ocurre a pesar del incremento compensatorio y estimulador de la PTH. Como consecuencia del descenso de la concentración sérica de calcitriol se produce una disminución de la absorción de Ca intestinal y una menor inhibición de la transcripción del gen de la PTH, no sólo por el descenso del calcitriol, sino también por disminución de receptores al calcitriol (VDR) de las glándulas paratiroides. Esta secuencia de eventos favorece la aparición del hiperparatiroidismo secundario. En las fases iniciales de la enfermedad renal crónica (ERC) estos cambios mantienen la homeostasis del Ca y P, pero posteriormente, con el agravamiento de esta situación, el hiperparatiroidismo progresa y se produce la enfermedad ósea y mineral asociada a la ERC, con sus manifestaciones óseas y extraesqueléticas6.
Sin embargo, parte de este déficit de calcitriol sistémico podría ser parcialmente paliado por otros tipos de células, que en condiciones específicas pueden contribuir a la síntesis de calcitriol7. La mayoría de tejidos y células normales o neoplásicas, entre otros, músculo, corazón, cerebro, vasos sanguíneos, mama, colon, próstata, páncreas, piel y sistema inmunitario, poseen receptores de vitamina D (VDR) y 1α-hidroxilasa; esta última es capaz de convertir localmente 25(OH)D en 1,25(OH)D o calcitriol.
Mientras que el calcitriol es la hormona biológicamente activa y ejerce su acción tanto por mecanismos endocrinos como autoparacrinos, el calcidiol es el indicador bioquímico clínico más importante del estado de repleción corporal de vitamina D5. Esta circunstancia sigue siendo tan relevante en pacientes con enfermedad ósea y mineral asociada a la ERC que la caracterización biológica de la misma mediante marcadores séricos incluye la cuantificación de calcidiol y PTH, pero no se considera necesaria la medición de la concentración sérica de calcitriol8.
FUNCIONES DEL SISTEMA HORMONAL DE VITAMINA D
Las funciones biológicas de la vitamina D son múltiples y se pueden resumir de forma simple en dos grandes grupos: funciones tradicionales o clásicas que regulan la homeostasis Ca-P y el metabolismo óseo, y funciones no clásicas en las que se engloban funciones autoparacrinas y efectos pleiotrópicos que se ejercen en todo el organismo5(tabla 1).
De las funciones clásicas de la vitamina D derivan las repercusiones patológicas habitualmente vinculadas a la carencia de la misma. La deficiencia crónica de vitamina D en niños y adolescentes provoca raquitismo, y en adultos osteomalacia, trastornos vinculados a la insuficiencia de la mineralización de la matriz ósea9. En las personas de edad avanzada, la deficiencia de vitamina D contribuye a la disminución de fuerza muscular e incremento de caídas2,10.
De sus acciones «no clásicas» depende la asociación que existe entre enfermedades no relacionadas con el metabolismo mineral y la carencia de vitamina D. Entre ellos, destacan la patogénesis y la progresión de hipertensión, las enfermedades cardiovasculares, la diabetes mellitus tipo I, la psoriasis, la esclerosis múltiple, el cáncer de colon y próstata2. Además, por estar involucrada en la regulación del crecimiento celular, su acción contribuye en prevenir la progresión tumoral por reducción de la angiogénesis e incremento de la diferenciación celular y apoptosis de las células cancerígenas3.
CONCEPTO DE SUFICIENCIA DE VITAMINA D: IMPORTANCIA DEL CALCIDIOL
El mejor indicador de los depósitos o el estado de replección de vitamina D en el organismo es la concentración de calcidiol11. Aunque no existe consenso absoluto entre los expertos sobre cuáles son los niveles «óptimos» de calcidiol, la mayoría de estudios sugieren que en población general la concentración mínima deseable es aquella que logra una adecuada supresión de PTH, una máxima absorción de calcio, una masa ósea adecuada y una reducción de caídas. La concentración sérica de calcidiol que cumple globalmente estos requisitos es, al menos, 30 ng/ml considerando óptimas las concentraciones de 40 ng/ml o incluso concentraciones discretamente superiores12. Se considera que existe hipovitaminosis cuando la concentración de calcidiol es de 20-30 ng/ml, insuficiencia cuando la concentración es de 10-20 ng/ml y deficiencia cuando los valores son inferiores a 10 ng/ml13.
En población general, la insuficiencia o deficiencia de vitamina D resulta en estímulo de la síntesis de PTH, hiperparatiroidismo secundario e incremento del remodelado óseo. En pacientes con ERC, contribuye a una mayor progresión del hiperparatiroidismo secundario y a la aparición de trastornos de mineralización10. En los adultos existe deficiencia o insuficiencia de calcidiol en porcentajes que oscilan entre 65 y 80%. Esto ocurre en todos los continentes, incluyendo Estados Unidos y Europa14-16. Existen varios factores responsables de esta situación.
En primer lugar, factores que afectan la síntesis cutánea de vitamina D. Así, las barreras físicas que atenúan la exposición a la radiación solar, como la ropa o las cremas solares, pueden reducir o eliminar completamente la producción de esta vitamina en la piel. Además, a latitudes por encima de 37º N y por debajo de 37º S, en los meses de invierno, la luz solar es insuficiente para inducir la síntesis cutánea. También existen otros factores biológicos que pueden producir la reducción de la síntesis cutánea de vitamina D, como son la pigmentación de la piel, algunos tipos de medicamentos, el contenido de grasa corporal, la malabsorción de grasas y la edad2.
En segundo lugar, los factores nutricionales previamente mencionados, si bien menos importantes, pueden influir en producir o mantener unos niveles bajos de vitamina D.
En tercer lugar, factores que pueden modificar el metabolismo de la vitamina D modificando la absorción intestinal (fibratos, resinas quelantes) o interrumpen la reabsorción intestinal de metabolitos de vitamina D (recirculación entérica), así como alteraciones hepáticas y renales que afectan la capacidad de la 25-hidroxilación y la 1α-hidroxilación, respectivamente. Además, el consumo de medicamentos como corticoides y antiepilépticos, entre otros, alteran la actividad de enzimas hepáticas y aceleran su catabolismo.
Además de los aspectos fisiopatológicos antes mencionados, se suman inconvenientes metodológicos, dado que existen importantes diferencias entre las técnicas utilizadas para la medición del calcidiol que pueden inducir un factor de confusión al comparar las concentraciones séricas de calcidiol1,17,18.
DÉFICIT DE VITAMINA D EN PACIENTES CON TRASPLANTE RENAL FUNCIONANTE
Si la deficiencia o la insuficiencia de vitamina D son relativamente frecuentes en la población general, diversos estudios indican que esta carencia es aún más constante y acusada en pacientes con ERC y en pacientes trasplantados fundamentalmente en el postrasplante inmediato10,19-21.
La importancia de mantener niveles séricos adecuados de calcidiol en pacientes con ERC y en pacientes con trasplante renal fue poco valorada durante muchos años. Se asumía que, ante una situación en la que la masa renal era insuficiente para transformar adecuadamente calcidiol en calcitriol, no había ninguna razón para monitorizar y mantener niveles óptimos de calcidiol.
La importancia del calcidiol se ha visto revitalizada después de observar en numerosos estudios epidemiológicos una elevada morbilidad y mortalidad asociadas a niveles reducidos de calcidiol22-25. Sin embargo, la importancia real y el interés en evaluar el calcidiol y conocer el estado de los depósitos de vitamina D en pacientes con insuficiencia renal crónica están condicionados por cuatro aspectos1,7:
- El calcidiol es el sustrato del calcitriol y, aunque en circunstancias normales la actividad 1α-hidroxilasa no es sustrato dependiente, en la insuficiencia renal crónica puede llegar a serlo; por tanto, a mayores concentraciones de calcidiol, hay mayor síntesis de calcitriol.
- Tanto el calctriol como el calcidiol son capaces de unirse y activar el receptor de vitamina D. La afinidad es muy superior para el calcitriol (1:2.400), pero la relación de concentración es favorable para el calcidiol (1.000:1).
- Algunas acciones de la vitamina D, como la absorción intestinal de calcio, son independientes del receptor de la vitamina D.
- Pero la existencia de 1α-hidroxilasa extrarrenal en muchos tejidos, como paratiroides, vasos, próstata, colon, en el sistema monocito/macrófago y células óseas, puede producir calcitriol de forma local a partir de su precursor, el calcidiol.
Como ya se ha comentado, los pacientes con trasplante renal también presentan niveles séricos reducidos de calcidiol, situación que es más manifiesta en los primeros meses postrasplante. En un estudio de Sadlier et al. en 112 pacientes, se observó una concentración media de calcidiol de 16,6 ng/ml21. En otro estudio similar, Stavroulopoulos et al. observaron una concentración media de 13,2 ng/ml en postrasplante y de 16,8 ng/ml en pacientes que ya llevaban varios años trasplantados26.
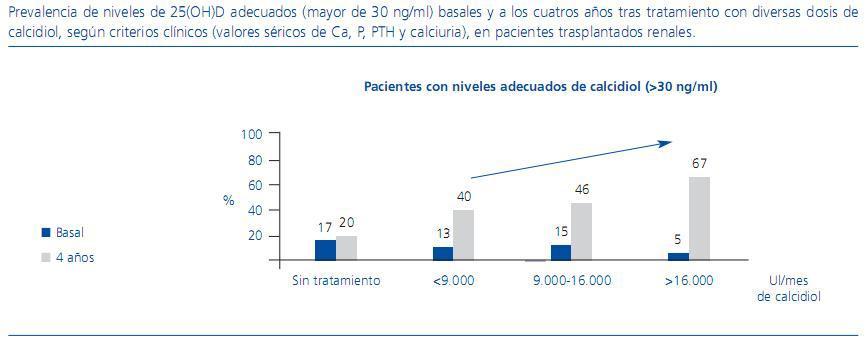
La prevalencia de niveles adecuados de calcidiol en nuestros pacientes trasplantados fue del 11%, muy similar a la observada en nuestra población general1. Ante dichos resultados, nos planteamos revisar retrospectivamente la situación, ampliando la muestra de pacientes trasplantados a 139 pacientes y observando la evolución tanto de los niveles de calcidiol como de la concentración de PTH tras más de cuatro años de seguimiento. Los pacientes recibieron tratamiento con calcidiol en función de los niveles basales de calcidiol y PTH, las cifras de Ca sérico y urinario, y otras consideraciones clínicas. Según la dosis de calcidiol prescrita, los pacientes se dividieron en cuatro grupos: los que no recibieron tratamiento, los que recibieron menos de 9.000 UI/mes, entre 9.000 a 16.000 UI/mes o aquellos que recibieron má 16.000 UI/mes. La edad media fue de 52,8 años, 86 varones y 53 mujeres, con un tiempo medio de trasplante de 4,6 años. La concentración media de 25(OH)D al inicio del periodo de observación fue de 20 ± 10 ng/ml. Se observaron niveles adecuados de 25(OH)D (>30 ng/ml) sólo en el 14% de los pacientes, insuficiencia (10-30 ng/ml) en el 71% y deficiencia (<10 ng/ml) en el 15% restante. Es decir, el 85% de los pacientes presentaban insuficiencia o deficiencia de calcidiol. Esta elevada prevalencia es muy similar a la publicada por otros autores en el primer año postrasplante, en el que se ha mencionado un 90% de insuficiencia o deficiencia de calcidiol26.
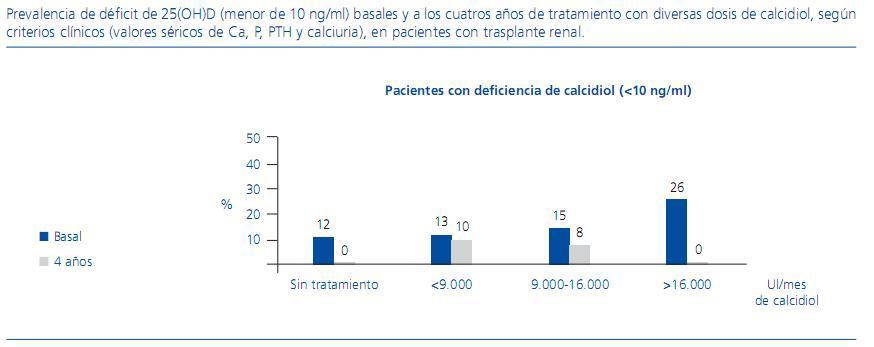
En nuestros pacientes, tras cuatro años de tratamiento según los criterios ya mencionados, la concentración media de calcidiol fue de 33 ± 20 ng/ml, con niveles adecuados de 25(OH)D (>30 ng/ml) en el 50% de los pacientes, insuficiencia (10-30 ng/ml) en el 44% y deficiencia (<10 ng/ml) en el 6%.
Como puede observarse en la figura 2, con nuestra pauta, el porcentaje de pacientes que alcanzaron niveles adecuados de calcidiol (>30 ng/ml) fue superior en todos los rangos de tratamiento, alcanzando los mejores resultados con la dosis mayor. La otra cara de la moneda, es decir, la prevalencia de estados deficitarios de calcidiol, fue de 0% a los 4 años, tanto en los pacientes que consideramos que no necesitaban tratamiento como en los que lo recibían en dosis elevadas (figura 3). Estos resultados remarcan que la adecuación personalizada de la dosis de calcidiol o de cualquier otro tipo de vitamina D permite obtener mejores resultados finales.
Otro aspecto de interés es la relación observada entre niveles séricos de calcidiol y valores de PTH. Al inicio del periodo de observación, la PTH se relacionó de forma positiva e independiente con la creatinina sérica (coeficiente estandarizado β 0,28; p = 0,001), y negativamente con las concentraciones séricas de calcidiol (coeficiente estandarizado β -0,22; p = 0,008) y P sérico (coeficiente estandarizado β -0,35; p = 0,0001) en el análisis multivariante. A los cuatro años de seguimiento, sólo se mantuvo significativa la relación negativa entre PTH y calcidiol (coeficiente estandarizado β -0,35; p = 0,017); todo ello ajustado por creatinina sérica, Ca, P, calcitriol, edad y sexo. Estos resultados sugieren un mayor peso del estatus de la vitamina D tras un largo periodo de suplementación, probablemente debido a la recuperación de la sensibilidad de las células paratiroideas a la vitamina D y el bajo nivel de apoptosis de las mismas27.
En concordancia con estos resultados, otro estudio reciente realizado en pacientes con trasplante renal a largo plazo también demostró una relación inversa entre calcidiol y PTH, si bien esta relación no se observó en trasplantados recientes26. El descenso de PTH observado tras la suplementación con calcidiol podría ser debido, al menos parcialmente, a un incremento secundario de la producción de calcitriol circulante o la producción de calcitriol a través de la activación local del calcidiol por 1α-hidroxilasa de las glándulas paratiroides. También podría deberse parcialmente al efecto directo del calcidiol, que es capaz de activar directamente el VDR y suprimir la transcripción del gen de la PTH28.
Las causas del déficit de calcidiol en pacientes trasplantados son múltiples. A las causas ya mencionadas en la población general y en pacientes con ERC, se añade el hecho de recibir tratamiento con fármacos inmunosupresores, que producen un incremento del catabolismo de calcidiol. Por otro lado, la recomendación que habitualmente se les hace a estos pacientes para que mantengan una baja exposición solar para prevenir la aparición de cáncer de piel y el uso de cremas solares de alta protección favorece la disminución de la síntesis cutánea de provitamina D. A esto se añade que las hospitalizaciones frecuentes favorecerían una escasa exposición al sol, especialmente en el primer periodo después del trasplante26.
RECOMENDACIONES SOBRE EL TRATAMIENTO CON VITAMINA D
En pacientes con ERC, las guías de la National Kidney Foundation/Kidney Disease Outcomes Quality Initiative (NFK-KDOQI) recomiendan mantener en estadios 1-5 de ERC niveles de calcidiol superiores a 30 ng/ml. Además, en estadios más avanzados (3-5), recomiendan valorar el tratamiento con calcitriol, α-calcidiol u otros activadores selectivos del receptor de vitamina D (AsRVD), como el paricalcitol.
En estas guías no existen recomendaciones específicas para pacientes con trasplante renal, si bien éstos deberían ser tratados de forma similar a los pacientes no trasplantados con filtrado glomerular similar29. A pesar de estas recomendaciones, un elevado porcentaje de pacientes con trasplante renal no reciben suplementos de colecalciferol o calcidiol, quizás por miedo a que el calcidiol elevado pueda inducir hipercalcemia, hipercalciuria o hiperfosfatemia, y por el desconocimiento que se tiene sobre el efecto positivo que tiene aumentar los niveles de calcidiol sobre el control de la concentración de PTH sérica14.
Otro aspecto en el que no existe consenso es el referente a la dosis de colecalciferol o de calcidiol (que son los dos compuestos farmacológicos que se pueden encontrar en España para suplementar a los pacientes) que se debe utilizar en pacientes con trasplante renal. En nuestra experiencia, consideramos que se puede utilizar la misma dosis que en población general sin ERC; esto mismo es válido para pacientes con ERC estadios 2-4.
En un estudio reciente en pacientes con trasplante renal, Courbebaisse et al. administraron colecalciferol 100.000 UI cada 15 días durante dos meses y posteriormente 100.000 UI al mes. Esta dosis incrementó los niveles séricos de calcidiol a valores >30 ng/ml, a la par que redujo los niveles de PTH sin incremento significativo de la calcemia o de la calciuria30. No obstante, no es necesario dar dosis tan elevadas para obtener estos resultados. En una revisión reciente, Holick recomienda como dosis de mantenimiento en pacientes con ERC estadio 2-5, 1.000 UI de vitamina D3 o 50.000 UI de vitamina D2. Nuestros resultados animan a realizar estudios controlados que permitan determinar con mayor precisión la dosis óptima de colecalciferol o calcidiol que se debe utilizar en pacientes con trasplante renal para mantener concentraciones de calcidiol superiores a 30 ng/ml, pero minimizando el riesgo de incremento de calcio sérico y urinario. De acuerdo con las guías K/DOQI, otro requisito indispensable para poder administrar cualquier metabolito de la vitamina D es la ausencia de hipercalcemia y mantener un producto CaxP adecuado (Ca <9,5 mg/dl y P <4,6 mg/dl)29.
La principal limitación para el tratamiento con vitamina D, 25(OH)D o con cualquier metabolito activo o activadores selectivos del receptor de vitamina D en el paciente trasplantado renal es la hipercalcemia. Tras el trasplante renal y debido al hiperparatiroidismo residual, existe una elevada incidencia de hipercalcemia que, según las series, oscila entre el 11-66%, dependiendo del tiempo postrasplante26. La posibilidad actual de utilización de calcimiméticos para el control del hiperparatiroidismo terciario en pacientes con trasplante renal puede permitir un mejor control de la enfermedad ósea y mineral asociada a la ERC en su conjunto31. Si bien la litiasis es una complicación infrecuente en el trasplante renal, un aumento mantenido de la calciuria podría incrementar potencialmente el riesgo litogénico. Además, estos pacientes pueden presentar, al igual que la población general, otras alteraciones metabólicas que predisponen al desarrollo de cálculos urinarios, como la hipocitraturia y la hiperoxaluria.
La elevación de los niveles séricos de calcidiol por encima de 30 ng/ml tiene un elevado margen de seguridad, dado que sólo se ha descrito toxicidad con concentraciones séricas superiores a 200 ng/ml32,33. Dado que no existen beneficios con niveles más elevados, alcanzar niveles de calcidiol de 30-50 ng/ml es hoy en día considerado clínicamente adecuado y seguro para el manejo de los pacientes con trasplante renal.
En resumen, los estados de insuficiencia de vitamina D en los pacientes trasplantados son muy frecuentes, como ocurre en la población general. La suplementación con calcidiol en dosis ajustadas a las características clínicas de los pacientes mejora de forma clara el estado de repleción con los posibles efectos positivos secundarios a la normalización de la misma. El objetivo de mejorar la sensibilidad y respuesta de la glándula paratiroidea se consigue en un porcentaje significativo de pacientes a medio-largo plazo.
Figura 1. Ruta de síntesis y metabolitos de la vitamina D.
Tabla 1. Funciones biológicas del sistema hormonal de la vitamina D
Figura 2. Prevalencia de niveles de 25(OH)D adecuados (mayor de 30 ng/ml) basales y a los cuatros años tras tratamiento con diversas dosis de calcidiol, según criterios clínicos (valores séricos de Ca, P, PTH y calciuria), en pacientes trasplantados renales
Figura 3. Prevalencia de déficit de 25(OH)D (menor de 10 ng/ml) basales y a los cuatros años de tratamiento con diversas dosis de calcidiol, según criterios clínicos (valores séricos de Ca, P, PTH y calciuria), en pacientes con trasplante renal