La fibrosis nefrogénica sistémica (FNS) es un proceso esclerosante multiorgánico secundario a la administración de contrastes basados en gadolinio en pacientes con enfermedad renal crónica (ERC) avanzada. Aunque raros, y generalmente asociados a otros procesos, se han descrito casos aislados de FNS en pacientes con ERC en estadio 3 y 4 (MDRD > 30 ml/ min/1,73 m2). Presentamos el caso de un varón de 54 años con ERC en estadio 3 secundaria a nefropatía IgA y hepatopatía crónica Child-A6 MELD-15 de origen etílico, que desarrolló FNS tras una única exploración radiológica con gadolinio, sin que pudieran demostrarse otros agentes causales. Además de exponer el caso, realizamos una revisión bibliográfica haciendo especial hincapié en la relación existente entre nefropatía y hepatopatía a la hora de desarrollar FNS tras exposición a gadolinio.
INTRODUCCIÓN
La fibrosis nefrogénica sistémica (FNS) es una entidad clínica rara que se presenta en pacientes con enfermedad renal crónica (ERC) avanzada tras la administración de contrastes basados en gadolinio (Gd) en la resonancia magnética (RM)1. Los radicales libres (Gd3+) producidos por la transmetilación y la formación de depósitos tisulares parecen la causa principal para desarrollar FNS2-5, si bien no la única, ya que se han encontrado múltiples factores coadyuvantes, entre ellos la hepatopatía crónica6.
Varios estudios confirman el riesgo de padecer esta enfermedad tras el uso de los contrastes con Gd en los pacientes con un filtrado glomerular (FG) < 30 ml/min/1,73 m2 7-9. Según el grado de ERC, las guías recomiendan evitar su utilización (FG < 15 ml/ min/1,73 m2) o bien valorar el riesgo/beneficio para el paciente (FG 15-29 ml/min/1,73 m2)10-12. No obstante, las guías no aclaran la actitud que se ha de seguir en pacientes con FG > 30 ml/ min/1,73 m2, o bien no consideran contraindicada la administración de Gd por presentar un riesgo muy bajo de desarrollar FNS, ni se considera la asociación a hepatopatía.
CASO CLÍNICO
Varón de 56 años con antecedentes personales de hipertensión arterial (> 10 años de evolución), hiperuricemia (artritis gotosa), hernia discal L5-S1, ERC estadio 3a de etiología no filiada (diagnosticado en 2007, con una creatinina basal de 1,5 mg/dl y MDRD 51 ml/min/1,73 m2), hepatopatía crónica de probable origen etílico (Child A 6, MELD 15), ictericia obstructiva y pancreatitis necrotizante (diagnosticado en 2010).
Acude a urgencias en marzo de 2013 por un cuadro clínico de 2 meses de evolución de edemas progresivos de los miembros superiores e inferiores, así como disminución franca de la diuresis. Además, muestra disnea progresiva hasta hacerse de mínimos esfuerzos. El paciente refiere ingesta crónica de colchicina e indometacina por episodios de podagra desde hace años.
A la exploración física se apreciaba tendencia a la hipertensión arterial, anasarca y signos indirectos de hepatopatía crónica. Analíticamente presentaba: glucosa 125 mg/dl, creatinina 2,9 mg/dl, urea 126 mg/dl, AST 79 UI/l, ALT 74 UI/l, GGT 73 UI/l, fosfatasa alcalina 134 UI/l, bilirrubina total 0,5 mg/dl, calcio 8,6 mg/dl, fósforo 5 mg/dl, sodio 140 mEq/l, potasio 5,4 mEq/l, magnesio 1,5 mg/dl, amilasa 20 g/dl, albúmina 3,8 g/dl, plaquetas 168.000 mm3, hemoglobina 11,9 g/dl, hematocrito 33,6 % y actividad de protrombina 99%. En el elemental y sedimento urinario presentaba: proteínas, hemoglobina y 10-15 hematíes/campo. La proteinuria cuantificada de 24 horas fue de 800 mg. Las serologías para virus hepáticos (hepatitis A, B y C) y virus de la inmunodeficiencia humana fueron negativas. Por otra parte, el estudio inmunológico resultó negativo para ANCA, anti-MBG, ANA y factor reumatoide, con cifras de inmunoglobulinas y complemento en rango normal.
Tras el tratamiento diurético intravenoso y la disminución de los edemas se apreció esclerosis cutánea de los cuatro miembros, así como microstomía, sospechándose un cuadro esclerodermiforme. Reinterrogado el paciente, refería tirantez de manos y pies de aproximadamente un año de evolución. Tras revisar la historia clínica, se comprobó que el paciente había sido sometido a una sola RM con gadolinio en 2010 durante su ingreso en Gastroenterología, para el estudio del cuadro colestásico previamente descrito. Se revisó también la función renal que presentaba el paciente al realizarse la RM, encontrándose en su situación basal con valores de creatinina de 1,5 mg/dl, y filtrado glomerular estimado mediante MDRD 51 ml/min/1,73 m2.
La ecografía abdominal evidenció datos de hepatopatía crónica, ligera esplenomegalia y riñones de tamaño normal con mala diferenciación corticomedular. El ecocardiograma transtorácico mostró disfunción sistólica grave con alteraciones segmentarias de la contractilidad e hipertrofia del ventrículo izquierdo.
Ante la sospecha de un cuadro glomerular se realizó una biopsia renal, que obtuvo ocho glomérulos, de los que tres se encontraban totalmente esclerosados. Se apreciaba proliferación mesangial segmentaria y focal con depósito PAS y plata positivo. El intersticio presentaba fibrosis submasiva con atrofia tubular importante. La inmunofluorescencia resultó positiva para IgA y C3, siendo el diagnóstico anatomopatológico de nefropatía IgA clase IV de la OMS13-15.
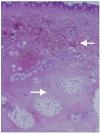
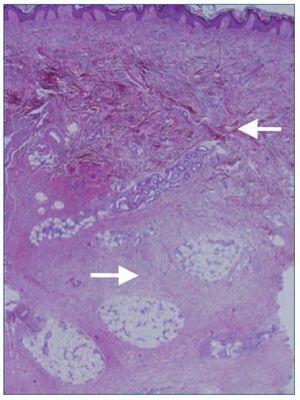
Por último, se realizaron dos biopsias cutáneas en las que se objetivó una fibrosis dérmica difusa que se extendía al panículo adiposo (figura 1). Se observaban fibroblastos entre los haces de colágeno. Dichos fibroblastos fueron positivos mediante inmunohistoquímica para el CD34. Los hallazgos histológicos fueron sugestivos de fibrosis nefrogénica4.
Figura 1. Biopsia cutánea. Fibrosis dérmica difusa (R). Paniculitis septal crónica (r).
Al alta el paciente fue seguido en consultas de Nefrología y Dermatología. Tras un año de evolución, la función renal se mantuvo estable, con MDRD 25-30 ml/min/1,73 m2.
A nivel cutáneo, la esclerosis no progresó, quedando limitada a manos, pies y labios, sin precisar tratamiento específico.
DISCUSIÓN
Descrita en 1997 por Cowper et al16, la FNS es una entidad rara que se manifiesta como un proceso esclerosante sistémico en pacientes con ERC avanzada que han recibido contraste basado en Gd durante la realización de una RM17,18. Si bien la administración de gadolinio y la presencia de ERC parecen factores indispensables para desarrollar la enfermedad, se especula con múltiples factores coadyuvantes, como la administración de EPO y/o hierro intravenoso, tipo y dosis de contraste administrado, procesos inflamatorios, cirugía vascular, hepatopatía crónica, trasplante hepático, etc.6,19,20.
La incidencia de la FNS varía según las series, pero se estima aproximadamente en 4,3 casos por 1.000 pacientes-año21. Hasta 2009 se habían descrito 315 casos, la práctica totalidad relacionados con ERC, fracaso renal agudo (FRA) y/o síndrome hepatorrenal22-26. A pesar de su baja incidencia, se trata de un cuadro multiorgánico, con una alta morbimortalidad y escasa respuesta al tratamiento5.
Con toda la evidencia científica acumulada y con el objetivo de prevenir esta enfermedad, organismos como la Food & Drug Administration12, el American College of Radiology11 o la Medicine and Healthcare products Regulatory Agency (MHRA)10 han centrado su atención en el desarrollo de guías para el uso de contrastes basados en Gd en pacientes con ERC. Por lo general, dichas guías desaconsejan su utilización en pacientes con FG < 15 ml/min/1,73 m2 y recomiendan cautela en FG 15-30 ml/ min/1,73 m2. Puesto que los casos descritos en pacientes con FG > 30 resultan anecdóticos6, la administración de Gd se admite como segura o no contraindicada en estos supuestos. Las referencias a la asociación de hepatopatía y ERC son muy escasas. La MHRA10, por ejemplo, contraindica el uso de Gd exclusivamente en el trasplante hepático.
Las guías también hacen referencia al tipo de contraste empleado, ya que parece existir una relación entre la estructura química de la molécula quelante de Gd y el riesgo de desarrollar FNS27,28. Actualmente existen nueve preparados comerciales basados en Gd, de los cuales la gadodiamida (Omniscan®, GE Healthcare) parece ser la más tóxica y por ello la que se recomienda evitar en pacientes con ERC. Cabe destacar que la evidencia al respecto es muy limitada; en primer lugar, por el tipo de estudios epidemiológicos disponibles, y en segundo lugar porque la gadodiamida es, con diferencia, el preparado comercial más empleado hasta la actualidad. Puesto que estos hallazgos y recomendaciones están provocando un cambio de tendencia en la utilización de los diferentes contrastes basados en gadolinio, es de suponer que en los próximos años aparezca evidencia más consistente en este campo.
Como ya hemos comentado, hasta la fecha pocos han sido los casos descritos en pacientes con ERC/FRA y hepatopatía asociada6. La mayoría presentaban enfermedad avanzada de ambos órganos y solo existe un caso descrito con enfermedad hepática avanzada (trasplante hepático complicado) y fracaso renal moderado (síndrome hepatorrenal con FG > 30 ml/min/1,73 m2), tras administración repetida de contraste con Gd29. Por otra parte, no parece existir asociación entre el riesgo de desarrollar FNS y la etiología de la enfermedad hepática o renal.
El caso descrito en nuestro centro presentó FNS con ERC estadio 3 secundaria a nefropatía IgA (FG de 51 ml/min/1,73 m2), hepatopatía crónica de origen enólico sin cirrosis (Child A 6, MELD 15) y una sola administración de contraste. No pudo encontrarse ninguna otra causa que justificara la aparición de FNS como administración de EPO o hierro intravenoso, inmunosupresores, reagudizaciones de sus procesos hepático y/o renal, etc. Por otra parte, llama la atención la benignidad del cuadro, que hace pensar que pudieran existir formas cutáneas limitadas, de evolución indolente y/o subclínica. Si así fuera, justificaría el escaso número de casos reportados en los que se asocian nefropatía y hepatopatía.
Con todo esto, entendemos que la FNS es un complejísimo proceso del que poco sabemos y en el que quedan muchas dudas por resolver. ¿Hasta qué punto la hepatopatía crónica desempeña algún papel en la FNS? ¿Cómo es la interacción de esta con los procesos renales, ya sean crónicos o agudos? ¿Qué otros factores pueden intervenir en el desarrollo de la FNS tales como fármacos, patologías intercurrentes, tipo y dosis de contraste administrado, etc.? Lo que parece en cualquier caso indiscutible es que los contrastes basados en gadolinio y la ERC avanzada son los factores principales, y que de alguna manera los procesos hepáticos constituyen una pieza más de esta desconocida enfermedad.
CONCLUSIÓN
Con todo lo expuesto, podría parecer lógico contraindicar el uso de contrastes basados en Gd en pacientes con ERC en estadios precoces y hepatopatía asociada, teniendo en cuenta la gravedad de la enfermedad. Sin embargo, tal decisión estaría basada exclusivamente en casos aislados e implicaría serios problemas diagnósticos y terapéuticos en estos pacientes, habitualmente ya complejos de por sí. Aunque no haya afirmaciones categóricas a este respecto en las principales guías, parece conveniente tener siempre en cuenta el equilibrio riesgo/beneficio a la hora de indicar una exploración radiológica con Gd en un paciente de estas características.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Correspondencia:
Miguel Seras
Servicio de Nefrología.
Hospital Universitario Marqués de Valdecilla.
Avda. Valdecilla, s/n. 39008 Santander.
mserasmozas@gmail.com