La hipertensión maligna acelerada es una entidad caracterizada por cifras de tensión arterial elevadas, retinopatía hipertensiva grave y afectación de órgano diana, siendo el más frecuentemente afectado el riñón (50 % de los casos). El caso clínico que describimos debutó como un fallo renal agudo y muestra todas las peculiaridades clínicas de esta entidad patológica. Para su diagnóstico fue preciso la realización de una biopsia renal, donde se observó la presencia del dato anatomopatológico definitorio: focos de necrosis fibrinoide arteriolar. Pese al tratamiento adecuado, con control de las cifras de tensión arterial, la insuficiencia renal fue irreversible, algo que ocurre en el 20 % de los casos, siendo preciso el inicio de tratamiento renal sustitutivo.
INTRODUCCIÓN
La hipertensión maligna acelerada es una patología caracterizada por cifras elevadas de presión arterial (PA), signos de retinopatía hipertensiva grave (grados III o IV) y, desde el punto de vista anatomopatológico, daño arteriolar con focos de necrosis fibrinoide. Suele ser frecuente la aparición de complicaciones asociadas a lesión de órgano diana, como accidente cerebrovascular, cardiopatía isquémica, fallo renal agudo/subagudo o microangiopatía trombótica. Presentamos a continuación el caso de una mujer con hipertensión arterial maligna acelerada y fallo renal agudo secundario.
CASO CLÍNICO
Mujer de 41 años que acude a urgencias refiriendo un cuadro clínico de disnea de esfuerzo y cefalea holocraneal resistente al tratamiento analgésico de 3 semanas de evolución, junto con astenia y sensación de pérdida de visión bilateral durante los últimos 7 días. Como antecedentes personales destacaban tomas aisladas de PA elevada, sin haber recibido nunca tratamiento médico y ovariectomía izquierda por torsión crónica con diagnóstico de teratoma maduro quístico. Sin antecedentes previos de nefropatía. Como antecedentes familiares, cabe destacar que su madre presentaba hipertensión arterial, con buen control farmacológico.
En la exploración física, su PA era de 190/110 mmHg, que no mejoró pese al tratamiento con los antihipertensivos empleados en urgencias (dos tomas de 25 mg de captopril y 20 mg intravenosos de furosemida). No presentaba soplos carotídeos, abdominales ni a otro nivel; la auscultación cardiopulmonar era normal, sin observarse ningún dato patológico a otro nivel. Como pruebas complementarias, se solicitó una analítica sérica, que mostró los siguientes valores: creatinina 4,3 mg/dl, urea 102 mg/dl, potasio 2,7 mmol/l, lactato deshidrogenasa 1.847 UI/l, hemoglobina 10,8 mg/dl, hematocrito 29,4 % y plaquetas 107.000/μl, y en orina se observaban 20-50 hematíes/campo junto con proteinuria de 150 mg/dl. Ante la sospecha diagnóstica, se realiza fondo de ojo que mostraba “signos de retinopatía hipertensiva grave con exudados algodonosos, alguna hemorragia en ambos ojos y edema de papila (grado IV de Keith-Wagener)”. Se decide su ingreso en Nefrología.
Una vez ingresada con sospecha de hipertensión maligna acelerada, con la intención tanto de filiar la etiología del cuadro clínico como de valorar su repercusión sistémica, se solicitan una ecografía renal (“riñones de tamaño normal, con mala diferenciación corticomedular, sin dilatación de vías”), una angiorresonancia magnética con gadolinio (“riñón izquierdo de 11,1 cm, riñón derecho de 10,5 cm. La arteria renal derecha presenta a 1 cm de su salida una discreta disminución de calibre de un 37 % no significativa. La arteria renal izquierda también presenta una discreta disminución de 1 cm, de un 27 %, que tampoco es significativa), una tomografía computarizada craneal (“sin lesiones significativas”) y un ecocardiograma (“ventrículo izquierdo con hipertrofia grave, sin alteraciones de contractilidad segmentaria y con fracción de eyección del 78 %. Disfunción diastólica con retraso de la relajación. Sin lesiones valvulares”). En el estudio analítico se confirmaban unos valores elevados de lactato deshidrogenasa (1.752 UI/l), observándose haptoglobina de 0 y presencia de 1-2 esquistocitos/campo. Se completó el estudio analítico sérico con autoinmunidad (ANA, ANCA, ENA, anti-DNA y anti-MBG), complemento, inmunoglobulinas, hormonas tiroideas y proteinograma, que resultaron normales y/o negativos, y en estudio urinario, proteinuria de 24 horas (1,8 g/24 h), así como catecolaminas y/o ácido vanilmandélico (valores inferiores a 110 μg/24 h y 7 mg/24 h horas, respectivamente).
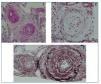
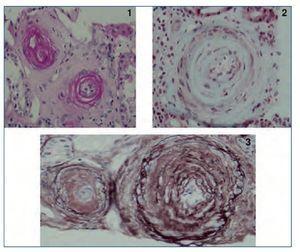
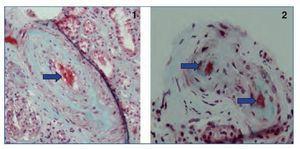
Para obtener el diagnóstico definitivo, se procedió a la realización de una biopsia renal percutánea (en ese momento, la paciente presentaba PA parcialmente controlada de 155/85 mmHg) que mostró, según el informe de anatomía patológica: “Cilindro renal en el que se identifican 29 glomérulos, 6 de ellos esclerosados. Algunos glomérulos muestran engrosamiento de la matriz mesangial con aumento de la celularidad, y en la mayoría de estos glomérulos las lesiones son segmentarias. Las arterias de gran calibre muestran engrosamiento fibroso de la íntima. En las arterias de mediano calibre y arteriolas se observa una luz vascular disminuida con engrosamiento de la íntima y presencia de imágenes “en capa de cebolla” en la pared vascular (figura 1). Existen, a su vez, algunos focos de necrosis fibrinoide en la pared de dichas arteriolas (figura 2). En resumen, biopsia compatible con nefropatía hipertensiva maligna.
Figura 1. Proliferación intimal de pequeña arteriola renal que produce imágenes “en capa de cebolla” en diferentes tinciones. 1) Pas. 2) tricrómico de Masson. 3) Perls.
Figura 2. Focos de necrosis fibrinoide en la pared de las arteriolas renales en la tinción de tricrómico de Masson.
Desde el punto de vista terapéutico, se comenzó tratamiento antihipertensivo, inicialmente con inhibidores de la enzima de conversión de la angiotensina (enalapril) y antagonistas de los receptores de la angiotensina II (valsartán) hasta alcanzarse las dosis máximas (20 mg cada 12 horas y 320 mg cada 24 horas). Se constató un irregular control de la PA, siendo preciso añadir nifedipino 30 mg cada 12 horas y carvedilol 25 mg cada 24 horas, consiguiéndose así un adecuado manejo de la hipertensión arterial. Clínicamente, se consiguió el cese precoz de la disnea y la cefalea que presentaba al ingreso, con progresiva desaparición de la astenia, así como sensación subjetiva de mejoría de la agudeza visual. Respecto a los trastornos iónicos, se normalizaron las cifras de potasio, presentando al alta un valor de potasio sérico de 3,9 mmol/l.
Pese a la mejoría de las cifras de PA, no se consiguió optimizar las cifras de función renal, presentando al alta una creatinina plasmática de 4,5 mg/dl con aclaramiento de creatinina de 16,2 ml/min, por lo que se derivó a consulta prediálisis tras optar la paciente por diálisis peritoneal como futura técnica renal sustitutiva.
DISCUSIÓN
La hipertensión maligna acelerada se define como la aparición de cifras muy elevadas de PA, generalmente (aunque no es necesario para su diagnóstico) con PA diastólica de 120 mmHg, junto con presencia en el fondo de ojo de hemorragias, exudados (retinopatía grado III de Keith-Wagener) o papiledema (grado IV de Keith-Wagener)1. La gravedad del cuadro clínico está relacionada con la afectación vascular que puede aparecer a nivel renal, cerebral o cardiológico, además de la habitual presencia de anemia hemolítica microangiopática, pudiendo llegar a suponer riesgo de muerte para el paciente. A su vez, en el momento del diagnóstico, no es infrecuente la aparición de síntomas inespecíficos como náuseas y vómitos, mareo, sensación disneica, somnolencia, malestar general, cefalea, debilidad y entumecimiento en los miembros2.
La etiología más frecuente se encuentra en relación con hipertensión arterial esencial, y oscila entre el 20 % y el 75 % de los casos según los estudios que lo valoren3. Si bien en décadas pasadas suponía una complicación para entre el 1 % y el 5 % de los hipertensos, en la actualidad su incidencia en estos pacientes es inferior al 1 % y se limita habitualmente a pacientes con mal cumplimiento terapéutico prolongado4. Entre las otras patologías que pueden generarla se encuentran el feocromocitoma, procesos sistémicos como el lupus eritematoso sistémico, la esclerosis sistémica o la panarteritis nudosa, las lesiones vasculorrenales, glomerulonefritis primarias (siendo la más frecuente la nefropatía IgA), el consumo de tóxicos (fundamentalmente cocaína) y ciertos fármacos como los anticonceptivos orales5. La asociación con estas patologías condiciona las pruebas diagnósticas que se deben realizar. Así, es necesario completar el estudio con análisis de autoinmunidad (ANA, ANCA y anti-DNA) y otras pruebas sugestivas de proceso sistémico (como complemento e inmunoglobulinas), catecolaminas en orina y ácido vanilmandélico, tóxicos en orina y pruebas de imagen para la valoración de la vasculatura renal (eco-Doppler, angio-TC o angio-RM)6.
La fisiopatología que genera las cifras muy elevadas de PA, al margen de las causas primarias de hipertensión descritas anteriormente, parece involucrar al eje renina-angiotensina-aldosterona7. A su vez, la lesión de los órganos diana está relacionada con las lesiones vasculares sobre la microcirculación sistémica, que generan procesos isquémicos de mayor o menor magnitud. Esa isquemia, a nivel de la microcirculación renal, genera una sobreproducción de renina como mecanismo protector para asegurar la perfusión del riñón, con el consecuente efecto negativo sobre la PA, retroalimentando y amplificando el proceso.
Hasta en el 50 % de los casos de hipertensión maligna acelerada se produce afectación renal, siendo el grado del daño renal oscilante entre el deterioro mínimo y reversible hasta la insuficiencia renal crónica terminal con necesidad de tratamiento renal sustitutivo. Esta situación, similar a la del caso que nos ocupa, ocurre en torno al 20 % de los casos de hipertensión maligna acelerada y daño renal8. Para el diagnóstico, si bien la presencia de los datos típicos de la patología (PA elevada con afectación grave del fondo de ojo) sumada al deterioro de la función renal es altamente indicativa de nefropatía hipertensiva maligna, el gold standard es la biopsia renal. En su valoración, aunque la lesión más llamativa y característica de la misma es la presencia de proliferación intimal que da lugar a las imágenes “en capa de cebolla”, la auténtica lesión definitoria de nefropatía hipertensiva maligna es la presencia de focos de necrosis fibrinoide en la pared de las arteriolas renales.
En relación con el tratamiento, al margen del manejo de las complicaciones asociadas, es fundamental, como cabría esperar, el manejo estricto de la PA. Inicialmente, es necesario un manejo agresivo de las cifras de PA, intentando alcazar cifras de PA diastólicas inferiores a 100 mmHg en 2-6 horas, evitando a su vez un descenso de la presión superior al 25 %, para lo cual incluso es preciso el empleo de medicación intravenosa como labetalol, nitroprusiato o urapidilo9. Sin embargo, dada la implicación del eje renina-angiotensina-aldosterona en la fisiopatogénesis de la hipertensión maligna, los fármacos de elección son los antagonistas de los receptores de la angiotensina II y los inhibidores de la enzima de conversión de la angiotensina, independientemente del grado de afectación renal que presente el paciente. Esto no contraindica el empleo de cualquier otro fármaco hipotensor, puesto que lo fundamental es normalizar la PA del paciente. Tal es la importancia de este tratamiento, que la supervivencia de los pacientes tratados adecuadamente es del 70 % a los 5 años, siendo inferior al 10 % en aquellos pacientes con inadecuado manejo de las cifras de PA10.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Correspondencia: Gonzalo Martínez-Fernández
Servicio de Nefrología.
Complejo Hospitalario Universitario de Albacete.
C/ Seminario, 4. 02006 Albacete.
gonzalomfer@hotmail.com