El Síndrome Hemolítico Urémico (SHU) es una anemia hemolítica microangiopática que afecta fundamentalmente al riñón y tiene su inicio en la lesión del endotelio capilar glomerular. En la mayoría de los pacientes el síndrome se asocia a infecciones gastrointestinales y diarrea causadas por E. coli (cepa O157:H7). En el 5-10% restante –de peor evolución, sin relación particular con infecciones y sin diarrea- la contribución de factores genéticos de predisposición es determinante. Numerosos estudios desde el final de la década del ’90 han establecido que estas formas “atípicas” de SHU (SHUa) se asocian frecuentemente con mutaciones y polimorfismos en genes que codifican proteínas del sistema del complemento. En esta revisión se resume cómo el análisis de estas asociaciones ha revelado los mecanismos patogénicos del SHUa y establecido importantes relaciones genotipo-fenotipo. Todo ello es relevante al diagnóstico del SHUa, al pronóstico de su evolución y al desarrollo y aplicación de estrategias terapéuticas.
SÍNDROME HEMOLÍTICO URÉMICO
El síndrome hemolítico urémico (SHU) es un trastorno de la microvasculatura, clínicamente definido por anemia hemolítica microangiopática (negativa en el test de Coombs) y trombocitopenia, que afecta preferentemente a los riñones, y que se manifiesta con hematuria, oligoanuria y fracaso renal1,2. El daño endotelial en la microvasculatura glomerular parece ser el primer episodio en la patogenia del SHU. Este daño se pone de manifiesto por el engrosamiento de la pared vascular, la inflamación del endotelio y su desprendimiento de la membrana basal glomerular. El daño endotelial dispara una cascada de acontecimientos que dan como resultado la formación de microtrombos de plaquetas y fibrina, que ocluyen las arteriolas y los capilares renales. La generación de esquistocitos (fragmentos celulares) a causa de la rotura de los eritrocitos que atraviesan esta microvasculatura parcialmente ocluida es característica del SHU3. Tradicionalmente, pueden distinguirse dos formas de SHU. La forma más frecuente (en el 90% de los casos) se denomina SHU clásico o típico y se asocia con diarrea provocada por infección por Escherichia coli, productor de la toxina Shiga (STEC), capaz de unirse a receptores Gb3 (globotriaosilceramida) de la superficie de las células endoteliales y provocar la destrucción de éstas de forma directa o a través de la activación de mecanismos inflamatorios y procoagulantes4,5. La mayoría de los pacientes con SHU-típico evolucionan satisfactoriamente al cabo de 2-3 semanas, si bien un 10% evolucionan hacia enfermedad renal crónica y un 25% desarrollan secuelas renales permanentes2.
El 10% de casos restantes presentan el SHUa, enfermedad rara, no asociada con diarrea y de peor pronóstico. La mayoría de los pacientes presentan recurrencias y más de un 50% desarrollan una insuficiencia renal terminal (IRT). Esta forma atípica de SHU tiene una incidencia de aproximadamente 2 casos por millón de habitantes y año, y una prevalencia de 1/105 niños en la Unión Europea. Numerosos estudios llevados a cabo en los últimos años han establecido que el SHUa posee un claro componente genético, y que se asocia con frecuencia con mutaciones y polimorfismos en genes que codifican proteínas del sistema del complemento.
ACTIVACIÓN Y REGULACIÓN DEL SISTEMA DEL COMPLEMENTO
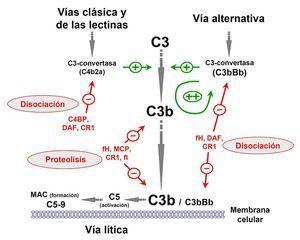
El sistema del complemento resulta esencial en la defensa frente a las infecciones por microorganismos, en el procesamiento de complejos inmunes, en la respuesta de anticuerpos y en la eliminación de restos apoptóticos. Consta de numerosas proteínas en el plasma y asociadas con las membranas celulares, que se organizan en tres vías de activación: la vía clásica, la vía de las lectinas y la vía alternativa (figura 1). La activación del sistema del complemento por cualquiera de las tres vías conduce a la formación de complejos multiproteicos inestables con actividad proteasa que se denominan C3-convertasas. Tanto la C3-convertasa generada por la vía clásica o por la vía de las lectinas (denominada C4b2a), como la C3-convertasa generada por la vía alternativa (denominada C3bBb), escinden la proteína C3 generando C3b, una molécula que es capaz de unirse covalentemente a las superficies responsables de la activación del complemento (patógenos, restos celulares, etc.). El depósito de C3b sobre estas estructuras facilita su posterior fagocitosis por células polimorfonucleares y macrófagos, e inicia el ensamblaje del complejo de ataque a la membrana que lleva a la lisis celular. El C3b que se genera por la acción de las C3-convertasas puede formar más C3-convertasa, produciéndose así una amplificacion exponencial de la activación inicial6 (figura 1).
El C3b se une indiscriminadamente tanto a patógenos como a tejidos y componentes celulares propios. Para evitar que cuando se active el complemento éste se consuma totalmente y para que, además, la activación del complemento no dañe tejidos y componentes celulares propios, existe un conjunto numeroso de proteínas que regulan su activación (figura 1). Un punto crítico en la regulación del complemento es disminuir la formación de C3b y, por ello, un número importante de proteínas reguladoras del complemento se encarga de disociar las C3-convertasas e inactivar la molécula de C3b mediante proteólisis. Este grupo incluye, factor H, proteína cofactora de membrana (MCP, CD46) y factor I. Gracias a esta regulación, la generación de C3b se mantiene a un nivel muy bajo en condiciones normales y cuando se activa el complemento, el depósito de C3b y su acumulación posterior se limitan a las superficies de los patógenos o a las estructuras responsables de esa activación.
SÍNDROME HEMOLÍTICO URÉMICO ATÍPICO Y COMPLEMENTO. MECANISMOS PATOGÉNICOS
Lesión causada por el complemento
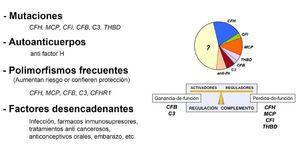
Se sospechaba desde hacía tiempo que el sistema del complemento estaba implicado en la patogenia del SHUa, ya que se habían identificado algunos pacientes con déficit de factor H7, pero no ha sido hasta hace poco tiempo que se ha demostrado la existencia de una estrecha asociación entre el SHUa y las mutaciones en las proteínas del complemento factor H, MCP, factor I, factor B y C38-18.
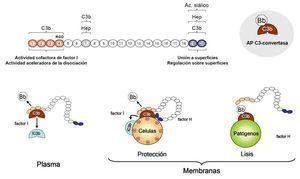
Las mutaciones en factor H asociadas con SHUa son prototípicas del defecto en el complemento que caracteriza a esta patología. El factor H es un regulador que actúa en el plasma, controlando la homeostasis del sistema del complemento, y sobre las superficies celulares, evitando el daño a los componentes propios. Las mutaciones en factor H asociadas con SHUa se agrupan en la región C-terminal de esta molécula. Su consecuencia es que disminuyen la protección de las superficies celulares al daño accidental producido por la activación del complemento, pero no afectan a la regulación del complemento en el plasma19 (figura 2).
El caracterización funcional de las mutaciones asociadas con SHUa encontradas en otros genes del complemento, como MCP, factor I, factor B o C3 y el desarrollo de un modelo en ratón de SHUa20, han confirmado las hipótesis anticipadas en los estudios con factor H, y han demostrado que el SHUa se produce por la pérdida de regulación de la activación del complemento sobre las superficies celulares propias. Este concepto de lesión causada por el sistema del complemento justifica (como veremos más adelante), la aplicación de estrategias inhibidoras del complemento en el tratamiento del SHUa.
Diversos estudios llevados a cabo en varios laboratorios han establecido que aproximadamente un 40-60% de los pacientes con SHUa son portadores de mutaciones puntuales en heterocigosis en genes del complemento y que dichas mutaciones causan la desregulación de la vía alternativa del complemento (figura 3). Es importante señalar que la desregulación de la vía alternativa del complemento que caracteriza al SHUa puede producirse tanto por una disminución en la actividad de las proteínas reguladoras como por una actividad anormalmente elevada de las C3-convertasas. Así, mientras que las mutaciones en factor H, MCP y factor I incapacitan a estas proteínas para realizar su función reguladora, las mutaciones en factor B o en C3 son mutaciones «ganancia de función» que dan como resultado una C3-convertasa más activa. Del mismo modo, es también importante señalar que las proteínas del complemento factor H, factor I, factor B y C3 son proteínas plasmáticas sintetizadas fundamentalmente por el hígado, mientras que MCP se localiza en las superficies celulares. Estas características poseen importantes implicaciones en la aplicación de tratamientos con plasma y en el trasplante renal en los pacientes con SHUa (como se verá posteriormente).
Concurrencia de varias mutaciones o teoría de los multiple hits
La penetrancia de la enfermedad en los portadores de mutaciones en alguno de los genes del complemento es aproximadamente del 50%. De hecho, es habitual que en familias en las que se han identificado mutaciones en los genes del complemento, sólo algunos de los portadores de mutaciones en estos genes desarrollen la enfermedad. Además, la presentación clínica de la enfermedad entre familiares puede variar de manera significativa. Existen casos familiares de SHUa en los que algunos pacientes presentan manifestaciones más leves que se resuelven casi sin secuelas, mientras que en otros la enfermedad se manifiesta a edades muy tempranas y evoluciona muy rápidamente hacia IRT. También existe una gran heterogeneidad clínica entre pacientes no emparentados portadores de la misma mutación. Todo ello sugiere que deben existir factores adicionales (genéticos y ambientales) que modulan el desarrollo y la evolución de la enfermedad.
La búsqueda sistemática de mutaciones en pacientes con SHUa en genes del complemento y la realización de estudios de asociación de casos y controles mediante el uso de polimorfismos genéticos en genes candidatos o marcadores genéticos distribuidos a lo largo del genoma humano ha identificado que algunas variantes genéticas de los genes CFH y MCP, frecuentes en la población normal, modulan la penetrancia y la gravedad de la enfermedad en portadores de mutaciones en genes de complemento17,21,22. Estas observaciones, junto con el hecho de que un porcentaje significativo de pacientes de SHUa (7-10%) tienen mutaciones en más de un gen del complemento, indican que la coincidencia de diferentes factores genéticos de riesgo para presentar SHUa es un factor determinante para el desarrollo de la patología. En apoyo de esta hipótesis de multiple hits22, se ha observado que los individuos afectados de SHUa en familias que presentan más de un factor de riesgo son los que acumulan el mayor número de factores de riesgo.
Formas autoinmunes de síndrome hemolítico urémico atípico
Entre los pacientes con SHUa hay un grupo (un 5-10% del total en función de las cohortes), sin mutaciones en el factor H o en otros genes del complemento, que presenta autoanticuerpos antifactor H con consecuencias similares a las de las mutaciones en el factor H 23,24. Los autoanticuerpos antifactor H asociados con SHUa van dirigidos contra la región C-terminal de la molécula del factor H y bloquean específicamente la capacidad del factor H de regular la activación del complemento sobre las superficies celulares. Aunque el significado de estos anticuerpos en la patogenia del SHUa no está completamente establecido, su asociación con el inicio o con las recurrencias de la enfermedad indica una relación causal con ésta. El título de anticuerpos puede disminuir de forma espontánea con el tiempo, por lo que es importante realizar la búsqueda de estos anticuerpos al inicio del SHUa. De hecho, los autoanticuerpos antifactor H tal vez sean la explicación a posteriori de algunos casos de SHUa para los que no se ha encontrado un defecto genético en los genes del complemento. La existencia de autoanticuerpos contra otras proteínas del complemento en pacientes con SHUa es una posibilidad actualmente en estudio.
Búsqueda de nuevos genes asociados con el síndrome hemolítico urémico atípico
A pesar de los espectaculares avances de estos últimos años, existe todavía un 30-40% de pacientes con SHUa en los que se desconoce el gen o genes responsables de una posible susceptibilidad genética y en los que no se detecta la presencia de anticuerpos antifactor H. En términos generales, estos pacientes no son diferentes de los que presentan mutaciones en los genes de complemento, por lo que es posible que otros genes de complemento no analizados todavía puedan ampliar la lista de genes asociados con el SHUa en los próximos años.
Recientemente, se ha descrito que mutaciones en la proteína anticoagulante trombomodulina están asociadas con el SHUa25. Análisis funcionales sugieren que estas mutaciones predisponen a SHUa porque alteran la regulación del complemento en superficies celulares. Si bien estos resultados concuerdan con la desregulación del complemento característica de SHUa, son necesarios más estudios adicionales que confirmen esta asociación en otras cohortes.
Factores desencadenantes
El SHUa es una patología compleja, poligénica y multifactorial, en la que participan tanto factores genéticos como ambientales. La pérdida de actividad de factor H o factor I en el plasma, de MCP en las superficies celulares, la generación de autoanticuerpos antifactor H o la presencia de mutaciones «activadoras» en factor B o C3, predisponen al SHUa porque impiden una regulación adecuada del complemento sobre las superficies celulares. En este contexto, una situación que dispare la activación del complemento en la microvasculatura no se podrá controlar de modo apropiado sobre las células del endotelio vascular, y ocasionará su destrucción y la formación de microtrombos de plaquetas y fibrina que ocluirán las arteriolas y los capilares renales. Es previsible que en un futuro próximo se vayan definiendo mejor los factores desencadenantes del SHUa en individuos susceptibles. Hoy día, se acepta que entre los pródromos del SHUa se encuentran los siguientes: las infecciones (frecuentemente del aparato respiratorio), los fármacos inmunosupresores, los tratamientos anticancerosos, los anticonceptivos orales y el embarazo, entre otros.
CORRELACIONES GENOTIPO-FENOTIPO. RELEVANCIA DE LAS MUTACIONES EN LA EVOLUCIÓN Y TRATAMIENTO DE LOS PACIENTES CON SÍNDROME HEMOLÍTICO URÉMICO ATÍPICO
Los datos generados en distintas cohortes de pacientes en diferentes países coinciden en señalar que la presentación clínica de la enfermedad está relacionada con el hecho de tener o no mutaciones en genes del complemento y, sobre todo, con el gen particular que está mutado. Así, por ejemplo, mutaciones en factor H se asocian, por lo general, con una presentación más agresiva y con secuelas más importantes, mientras que los pacientes con mutaciones en MCP son los que tienden a evolucionar mejor3. Este hecho resalta la importancia de un diagnóstico genético rápido y completo; se deben analizar todos los genes asociados con el SHUa para identificar las posibles mutaciones en cada uno de estos genes. Un diagnóstico molecular apropiado requiere la interpretación cuidadosa de los resultados genéticos en el contexto de la presentación clínica de los pacientes.
Tratamientos con plasma
La infusión de plasma o la plasmaféresis son las estrategias terapéuticas empleadas habitualmente tras la aparición de un primer episodio de SHUa y han permitido disminuir la mortalidad de un 50 a un 25%26,27. El Grupo Europeo de trabajo en SHU (European Working Group on HUS) ha publicado recientemente las pautas que se aconseja seguir en el tratamiento del SHUa28. La infusión de plasma permite reemplazar los reguladores del complemento con mutaciones «pérdida de función» por proteínas funcionales, mientras que la plasmaféresis sería oportuna para la eliminación de las proteínas con mutaciones «ganancia de función», o de los autoanticuerpos antifactor H. En el caso de mutaciones en un regulador de membrana celular como MCP, la infusión de plasma o la plasmaféresis no deberían tener efecto alguno. De hecho, es una observación generalizada que la evolución de estos pacientes no mejora por el tratamiento con plasma29.
Trasplante renal en pacientes con síndrome hemolítico urémico atípico
Antes o después, los enfermos con SHUa se enfrentan a la necesidad del trasplante renal. En este sentido, es importante considerar también que la experiencia acumulada en estos últimos años muestra, de una manera inequívoca, que el resultado del trasplante se ve muy influido por el gen del complemento que está mutado en los pacientes con SHUa30.
Los pacientes sometidos a trasplante presentan con frecuencia una recurrencia de la enfermedad en el riñón trasplantado31. En el caso de mutaciones en el factor H o en el factor I, proteínas plasmáticas sintetizadas principalmente en el hígado, la recurrencia es de aproximadamente el 80%. Sin embargo, en los pacientes con mutaciones en el regulador de membrana MCP, el éxito del trasplante es muy elevado, debido a que el MCP expresado en las células del riñón trasplantado corrige el defecto genético del paciente. En estos casos, la recidiva de la enfermedad en el órgano trasplantado es sólo del 20%.
Aunque existen pocos pacientes trasplantados con mutaciones en el factor B o en C3, los datos de los que se dispone sugieren que, en el caso de mutaciones en el factor B, las recurrencias son más elevadas y los pacientes tienen un peor pronóstico que en los casos de mutaciones en C318. Del mismo modo, son muy pocos los casos de pacientes trasplantados con mutaciones en más de un gen. En estos pacientes la experiencia del trasplante ha sido buena cuando una de las mutaciones ocurre en MCP32.
En los trasplantes realizados en pacientes con autoanticuerpos antifactor H, realizar una plasmaféresis antes del trasplante que disminuya el título de autoanticuerpos parece ser una buena opción para evitar las recurrencias. Si, además, esta práctica se combina con estrategias para disminuir la producción de anticuerpos (p. ej., la administración de rituximab), se aumentan las probabilidades de éxito y se evitan recurrencias33,34.
Con el objetivo de evitar los problemas de recidivas asociados con el trasplante renal en pacientes portadores de mutaciones en el factor H, se han realizado trasplantes simultáneos de riñón e hígado (fuente mayoritaria del factor H circulante), con resultados mucho más favorables si el doble trasplante se combina con una plasmaféresis preoperatoria, junto con infusiones de plasma durante y después de la intervención, para permitir al hígado trasplantado que produzca suficiente factor H que evite la activación del complemento en los órganos trasplantados30,35. Muy recientemente se ha planteado que la aplicación profiláctica de eculizumab (véase más adelante) es una alternativa al trasplante combinado hígado-riñón en pacientes con mutaciones en el factor H36.
Es importantísimo señalar que el trasplante de un órgano de donante vivo emparentado con el paciente está contraindicado por el alto grado de recurrencia de la enfermedad en el injerto y el elevado riesgo para el donante37. Si este tipo de trasplante es la única posibilidad, se recomienda un análisis genético completo en el donante para evaluar la presencia de mutaciones o polimorfismos que confieran riesgo de desarrollar SHUa, sabiendo que un resultado negativo en estos análisis no excluye por completo el riesgo para el donante.
INHIBIDORES DEL COMPLEMENTO
La caracterización de los mecanismos patogénicos del SHUa indica que la aplicación de terapias basadas en la utilización de inhibidores del complemento podría ser eficaz para prevenir o reducir el daño causado por la activación del complemento. En este sentido es, además, alentador observar que detrás de la aparente complejidad que plantea la existencia de tantos y tan diferentes factores de riesgo asociados con SHUa, la «autolesión» causada por el complemento se considere «el mecanismo patogénico» que subyace a esta enfermedad, incluso en pacientes en quienes no se ha identificado un defecto genético en el complemento. Según esto, y al margen de que pacientes concretos puedan beneficiarse de tratamientos específicos, el bloqueo del complemento puede representar una terapia universal para todos los pacientes con SHUa.
En la actualidad, existen varios inhibidores del complemento con potencial aplicación en el SHUa. Uno de ellos es el concentrado de factor H purificado del plasma, designado por la Agencia Médica Europea en 2007 como «medicamento huérfano» (http://www.emea.europa.eu/pdfs/human/comp/opinion/52123506en.pdf) y actualmente en desarrollo preclínico. Otro que ha despertado grandes expectativas, y que ya se ha utilizado bajo las condiciones de uso compasivo para tratar a algunos pacientes con SHUa, es el eculizumab, un anticuerpo monoclonal que se une a la proteína del complemento C5, evitando su activación y que el complemento proceda por la vía lítica dañando las superficies celulares. Eculizumab está aprobado para el tratamiento de la hemoglobulinuria paroxística nocturna (PNH), una patología relacionada con la pérdida de reguladores del complemento y lisis de los eritrocitos producida por la desregulación del complemento en su superficie.
Informes recientes han señalado que el tratamiento con eculizumab mejora la función renal durante la recurrencia del SHUa en los pacientes, antes38 y después del trasplante renal39. Incluso se ha indicado su utilidad como tratamiento profiláctico y para evitar la recurrencia en pacientes portadores de mutaciones en el factor H que van a recibir un trasplante36. En la actualidad están en marcha ensayos clínicos multicéntricos para valorar la eficacia del tratamiento con eculizumab en pacientes que han respondido bien (http://clinicaltrials.gov/ct2/show/NCT00838513), o que son refractarios (http://clinicaltrials.gov/ct2/show/NCT00844844) a las terapias con plasma. Los resultados de estos ensayos, iniciados en 2009, se harán públicos a finales de 2010.
CONCLUSIONES
Hemos resumido en este trabajo los importantes avances que se han producido en los últimos años en el estudio de los mecanismos patogénicos del SHUa a través de la caracterización funcional variantes genéticas del factor H y otras proteínas del complemento asociadas con esta patología. Hoy día se considera al SHUa un paradigma de patología causada por la desregulación del complemento sobre las superficies celulares. Estos avances, junto con la generación de modelos animales apropiados, están guiando el desarrollo de terapias para la prevención y tratamiento del SHUa basado en la utilización de inhibidores del complemento. Del mismo modo, la experiencia acumulada en estos últimos años indica que un conocimiento individualizado y preciso de los factores genéticos de riesgo a SHUa facilita el tratamiento de los pacientes, ya que anticipa en muchos casos su respuesta al plasma y al trasplante renal. Este conocimiento de los factores genéticos de predisposición de los pacientes también será útil en el diseño de ensayos clínicos apropiados que determinen la eficacia de futuras terapias.
CONCEPTOS CLAVE
1. El síndrome hemolítico urémico atípico es consecuencia de la lesión producida por el complemento en el endotelio de la microvasculatura renal.
2. Más del 50% de los pacientes con síndrome hemolítico urémico atípicoa presentan una o más mutaciones en genes del complemento o anticuerpos antifactor H.
3. Un estudio genético completo facilita el tratamiento de los pacientes, y anticipa en muchos casos su respuesta a las terapias con plasma y al trasplante renal.
4. La aplicación de tratamiento basados en la inhibición del complemento puede ser una solución universal para los pacientes con síndrome hemolítico urémico atípico.
Figura 1. El complemento.
Figura 2. Activación y regulación por factor H de la vía alternativa del complemento en el plasma y en superficies celulares.
Figura 3. Factores de riesgo en el síndrome hemolítico urémico atípico.