La gammapatía monoclonal de significado renal (GMSR) se debe principalmente al depósito de cadenas livianas. Incluye enfermedades como la amiloidosis y lesiones descritas como glomerulonefritis proliferativas con depósitos monoclonales de inmunoglobulinas y glomerulopatía por depósitos de C3. Se asocia con alta morbilidad, por lo que el diagnóstico y tratamiento quimioterápico precoz son cruciales para el mejor pronóstico renal.
La GMSR es más prevalente en pacientes mayores de 50 años y varía según el sexo por uno u otro trastorno específico. El síndrome de Fanconi fue reportado en 2004 por la Clínica Mayo, que concluyó que la quimioterapia con agentes alquilantes no mejoró los parámetros renales, la disfunción tubular ni tampoco la filtración glomerular.
Se presenta el caso de un varón de 67 años, que ingresa por lumbalgia de 2 meses de evolución asociada a dolor en ambos miembros inferiores e impotencia funcional. Se realizó punción aspirativa de medula ósea por laboratorio, con células plasmáticas en el 0,25%, y laboratorio con HCO3 de 16 mEq/l; componente monoclonal gamma del 27,3%; B2 microglobulina elevada; inmunofijación sérica para cadena kappa de 2.030 mg/dl; proteinuria de 24 h de 2,6 g/día; en orina presentó glucosuria, uricosuria y fosfaturia. Se realizó biopsia renal con diagnóstico de tubulopatía proximal por cadenas livianas kappa con inclusiones cristalinas.
Inició esquema quimioterápico con ciclofosfamida, bortezomib y dexametasona (CYBORD). Evolucionó con disfunción multiorgánica y posteriormente falleció.
INTRODUCCIÓN
Las gammapatías monoclonales son un grupo de patologías que se caracterizan por la sintesis anómala de inmunoglobulinas (Ig) resultantes de un mismo clon de células plasmáticas. Su depósito puede darse teniendo a la molécula completa de la Ig o de cualquiera de sus elementos, como las cadenas pesadas, ligeras o ambas. Estos depósitos pueden presentarse en cualquier tejido.
El International Myeloma Working Group clasificó las diferentes gammapatías monoclonales mediante criterios simples y prácticos para la actividad clínica diaria. Como la gammapatía monoclonal de significado incierto (MGUS), en que la paraproteína circulante requiere de un componente M sérico menor a 3 g/dl, células plasmáticas en medula ósea < 10%, ausencia de lesión de órgano y sin clinica atribuible a la discrasia de las células plasmáticas1. En contraste, el cuadro con mayor compromiso hematológico, ya denominado mieloma múltiple, se define con una proteína M sérica mayor a 3 g/dl, presencia de más del 10% de celulas plasmáticas en médula ósea y/o lesión de órganos, representados en las siglas en inglés CRAB (hipercalcemia, insuficiencia renal, anemia, enfermedad ósea)2,3.
Si se etiqueta a la MGUS como una patología en la que no se presenta clínica atribuible a la paraproteinemia, ausencia de enfermedad maligna, pero con compromiso renal debido al depósito de Ig o sus componentes, entonces se debe excluir a esta entidad y se denominará como gammapatía monoclonal de significado renal (GMSR).
La enfermedad renal es una complicación frecuente de las gammapatías monoclonales y se manifiesta con una amplia gama de lesiones (tubulares, glomerulares, vasculares e intersticiales); asimismo, la presentación clínica es en forma de síndrome nefrótico, proteinuria aislada o insuficiencia renal rápida y progresiva; la afectación renal por las paraproteinemias monoclonales es multifactorial y no está del todo descifrada; estos patrones se determinan en su mayor parte por las características fisicoquímicas de la Ig monoclonal4. Hay 2 principales afectaciones renales asociadas a las gammapatías monoclonales. El primero de los trastornos renales requiere la secreción de la molécula completa de la Ig o parcialmente, y solo se observa cuando hay una alta proliferación de células B y la lesión típicamente es la precipitación de la cadena liviana (CL) a nivel tubular que se conoce como riñón de mieloma, en el que la lesión tubular es en los segmentos distales y requiere instaurar quimioterapia urgente5,6. Asimismo hay una entidad infrecuente en la que los depósitos de CL son intracapilares-glomerulares, que se conoce como macroglobulinemia de Waldenström7. El segundo trastorno renal también se debe a la secreción de la Ig monoclonal en patologías de bajo potencial maligno, por ejemplo, la enfermedad de depósito de inmuglobulina monoclonal (MIDD), en la que solo el 20% tiene evidencia de mieloma múltiple en el momento del diagnóstico8, y un 8% de los pacientes padecen de amiloidosis (AL) primaria9. En estas 2 situaciones clínicas previamente descritas, no es la cantidad de Ig sintetizada la que produce la lesión renal sino el dominio variable de la Ig.
Los pacientes con discrasias de células plasmáticas o GMSR pueden desarrollar la lesión del epitelio tubular proximal conocida como de síndrome de Fanconi, y se produce cuando la CL libre se somete a polimerización dentro del sistema lisosomal del epitelio tubular proximal para formar cristales intracelulares que son las características distintivas de este síndrome. Esto ocasiona peroxidación lipídica y, finalmente, se genera la apoptosis de las células tubulares proximales, que interfiere con los cotransportes acoplados al sodio y produce aminoaciduria, acidosis, fosfaturia y glucosuria, que se reflejan en este caso10.
CASO CLÍNICO
Paciente de 67 años de edad, sexo masculino, sin antecedentes de relevancia, con cuadro clínico de 2 meses de evolución de lumbalgia asociada a dolor en ambos miembros inferiores de intensidad 8/10 y con impotencia funcional, motivo por el cual consulta.
En el momento del ingreso el paciente estaba asintomático y la exploración física era normal. Se le realizó analítica, en la que se evidenció: creatinina, 0,7 mg/dl (0,8-1,3 mg/dl); urea, 60 mg/dl (20-30 mg/dl), hematocrito, 39% (36-44%); glóbulos blancos, 4.500 células/µl (4.000-11.000 células/µl); plaquetas, 150.000 células/µl (150.000-450.000 células/µl); sodio, 139 mEq/l (134-145 mEq/dl); potasio, 3,0 mEq/l (3,5-4,5 mEq/l); cloro, 114 mEq/l (100-106 mEq/l); calcio, 8,2 mg/dl (8-10 mg/dl); fósforo, 2,1 mg/dl (3-4,5 mg/dl); pH sérico, 7,25; HCO3, 16 mEq/l, y ácido úrico, 3,2 mg/dl (4-7 mg/dl).
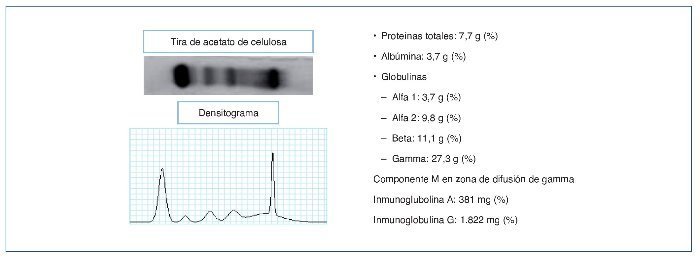
Inicialmente se interpretó como una lumbalgia. Por falta de mejoría clínica se realizó tomografía de columna lumbosacra, sin evidencia de lesión estructural. Se solicitó proteinograma electroforético, que reportó: proteínas totales, 7,7 g/dl (6-8 g/dl); albúmina, 3,5 g/dl (3,5-5,5 g/dl); alfa 1, 3,7% (5-8%); alfa 2, 9,8% (8-13%); beta, 11% (11-17%); gamma, 27,3% (15-25%); componente M en las zonas de las gammaglobulinas (fig. 1); beta-2-microglobulina, 6 mg/l (1,4-3,2 mg/l).
Figura 1. Proteinograma electroforético.
La cuantificación de gammaglobulinas séricas fue: IgA, 381 mg/dl (70-400 mg/dl); IgG, 1.822 mg/dl (700-1.600 mg/dl), e IgM, 168 mg/dl (40-320 mg/dl). Se realizó inmunofijación sérica: kappa, 2.030 mg/dl (620-1.350 mg/dl), y lambda, 599 mg/dl (313-723 mg/dl).
En la analítica urinaria se realizó un examen de orina con: pH, 6 (5,5-7); densidad urinaria, 1.010 g/l (1.005-1.035 g/l); glucosuria, +++/++++; proteinuria de 24 h, 2,6 g/día (0,15 g/día); uricosuria 24 h, 1.100 mg/24 h (250-750 mg/24 h); fosfaturia, 1.600 mg/24 h (800-1.300 mg/24 h); excreción fraccional de ácido úrico, 42,21%; inmunofijación de la orina presenta 2 bandas de precipitación proteica homogénea, una correspondiente a IgG-kappa y otra a cadena kappa; kappa, 212 mg/dl (0-5 mg/dl), y lambda, negativo.
Citometría de médula ósea: serie granulocítica, 48%; eosinófilos, 0,5%; monocítica, 2,9%; linfocitos T, 4,8%; linfocitos T CD4, 1,6%; linfocitos TCD8, 2,9%; linfocitos B, 1,7%; plasmocitos, 0,55%. Se detectó un 0,25% de células plasmáticas con fenotipo aberrante (el 46% del total de las células plasmáticas con kappa intracitoplasmático) y aumento relativo de la serie eritroide.
El cuadro se interpretó como MGUS. Fue evaluado por el servicio de nefrología, que realizó seguimiento en conjunto con hematología. A los 12 meses evolucionó con deterioro de la función renal presentando creatinina de 1,3 mg/dl, aclaramiento de creatinina en 24 h de 42 ml/min y proteinuria en 24 h con un valor de 2,7 g/día.
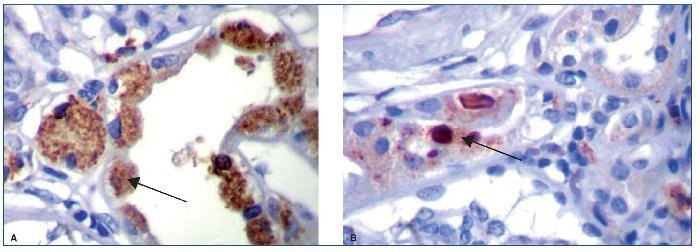
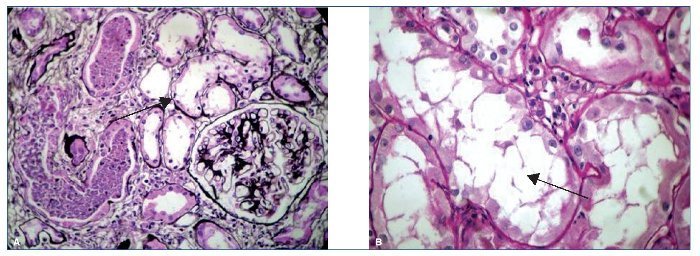
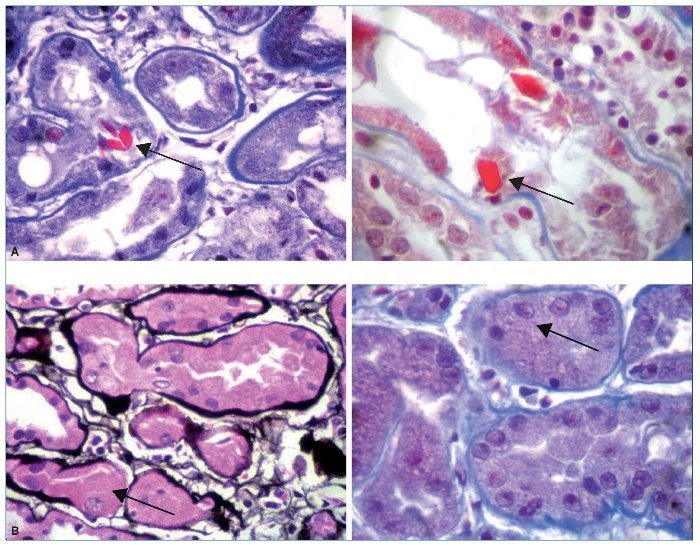
Se realizó inmunofijación sérica, en la que se detectó una banda proteica homogénea correspondiente a CL kappa y en orina también se evidenció CL kappa. Por deterioro de la función renal se decidió realizar punción para biopsia renal, en la que se obtuvo el diagnóstico: tubulopatía proximal por CL kappa con inclusiones cristalinas (figs. 2 a 4).
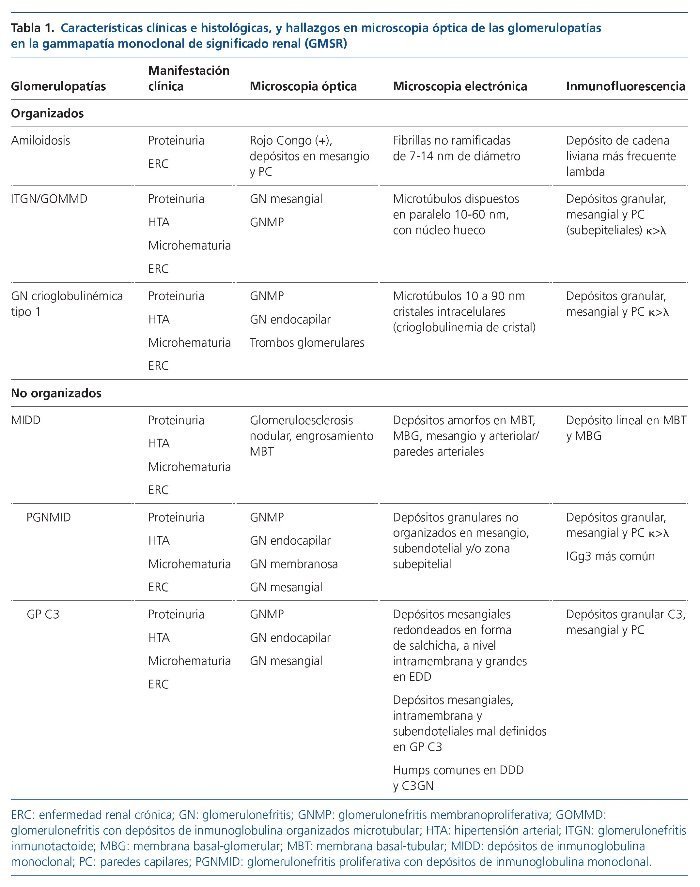
Figura 2. Hallazgos histopatológicos en biopsia renal de paciente con gammapatía monoclonal de significado renal (GMSR). A) Cadena liviana kappa en citoplasma de células tubulares. B) Cadena liviana kappa e inclusiones cristalinas.
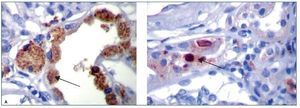
Figura 3. Hallazgos histopatológicos en biopsia renal de paciente con gammapatía monoclonal de significado renal (GMSR). A) Glomérulo sin alteraciones y túbulos dilatados con restos celulares necróticos. B) Lesión tubular aguda. Vacuolización, pérdida del ribete en cepillo.
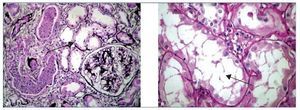
Figura 4. Hallazgos histopatológicos en biopsia renal de paciente con gammapatía monoclonal de significado renal (GMSR). A) Inclusiones cristalinas en túbulos proximales. B) Túbulos proximales revestidos por células con citoplasma amplio y granular.
Evolucionó con insuficiencia renal, con creatinina de 1,3 mg/dl, aclaramiento de creatinina de 42 ml/min y proteinuria de 2,7 g/día en un lapso de 12 meses. Por esta progresión se indicó esquema quimioterápico con ciclofosfamida, bortezomib y dexametasona (CYBORD). Antes del inicio del tratamiento presentó dolor abdominal grave, y se le diagnosticó peritonitis diverticular con disfunción multiorgánica y posteriormente falleció.
DISCUSIÓN
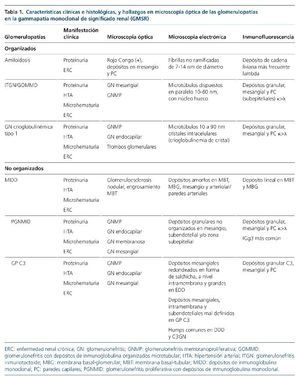
Las lesiones renales asociadas a las GMSR pueden producir lesión según donde se sitúe la Ig monoclonal, que puede ser tubular, intersticial, vascular y glomerular. Dentro de las glomerulopatías por depósitos no organizados se encuentran la enfermedad de MIDD, la glomerulonefritis proliferativa con depósitos de Ig monoclonal y la glomerulopatía C3 con gammapatía monoclonal.
Conformando el grupo de las glomerulopatías que incluyen depósitos organizados se encuentran la AL, la amiloidosis de cadena pesada, la amiloidosis de CL y pesada, la glomerulonefritis con depósitos microtubulares organizados de Ig, la glomerulonefritis inmunotactoide y la glomerulonefritis crioglobulinémica tipo I (tabla 1)11.
Con respecto a las lesiones tubulares, principalmente las del túbulo proximal, como es la presentación clínica del caso, estas son fenómenos histopatológicos explicados por CL tubulopáticas, ya que no hay reportados en la literatura casos justificados por cadenas pesadas. Un estudio de 5.410 biopsias renales en pacientes con gammapatías monoclonales reportó que el 25% de las biopsias fueron diagnosticadas como patología renal asociada a cadenas ligeras o pesadas. De estos casos, aproximadamente el 46% fueron clasificados como lesiones centradas en los túbulos proximales. Estas tubulopatías proximales se dividieron en 4 grupos definidos por características inmunomorfológicas12:
1. Tubulopatía proximal sin inclusiones citoplasmáticas.
2. Tubulopatía asociada con inflamación intersticial.
3. Tubulopatía proximal con inclusiones citoplasmáticas.
4. Tubulopatía proximal con indigestión/constipación lisosomal.
El diagnóstico de tubulopatía proximal necesita un alto grado de sospecha clínica y además la presencia de la monoclonalidad, junto con la evaluación de un servicio de nefropatología entrenado que correlacione la microscopia óptica y la inmunofluorescencia con el cuadro clínico13. Se deben utilizar anticuerpos policlonales que pueden detectar epítopes de cadena ligera o inmunomarcación ultraestructural, que es una técnica con mayor sensibilidad14.
El paciente del caso clínico presentaba una tubulopatía proximal que se documenta por glucosuria euglucémica, hipofosfatemia con hiperfosfaturia, acidosis tubular tipo II asociada al componente monoclonal, y la presunción diagnóstica de una GMSR, por lo que se realizó biopsia-punción renal con diagnóstico de tubulopatía proximal por CL kappa con inclusiones cristalinas.
Las 4 lesiones que se han identificado desde el punto de vista histológico tienen una correlación con las manifestaciones clínicas del paciente. Las 2 primeras son la tubulopatía sin inclusiones citoplasmáticas y la asociada a inflamación intersticial. Se caracterizan por un deterioro lento o rápido de la función renal. Por el contrario, los otros 2 patrones producen lesiones características del síndrome de Fanconi, en las que las manifestaciones clínicas son acidosis tubular tipo II, fosfaturia, hiperuricemia y glucosuria euglucémica. Es de vital importancia poder identificar estas lesiones, porque tienen influencia directa en el pronóstico de los pacientes15.
Dentro de los distintos mecanismos de daño renal presentados por la GMSR pueden estar implicados otros fenómenos fisiopatológicos como la secreción de diversos factores biológicos y humorales, por ejemplo, la secreción de factores de crecimiento endotelial presentes en el síndrome de POEMS (polineuropatía, organomegalia y endocrinopatías monoclonales). Es por eso que el reconocimiento temprano del tipo de GMSR es crucial, ya que determina el tratamiento y tiene un fuerte impacto en el pronóstico renal16.
CONCLUSIÓN
La GMSR puede producir lesión renal según donde se ubique la proteína monoclonal, y puede ser glomerular o tubular. Para determinar la ubicación de dicha lesión y la gravedad del cuadro clínico es fundamental la realización de una biopsia renal, que evaluará un nefropatólogo experimentado.
La proteína monoclonal puede producir lesión directa por el depósito o de forma indirecta a través de actividad de autoanticuerpos como la GPC3. Es importante conocer esta patología para realizar un diagnóstico temprano e iniciar un tratamiento adecuado, con el objetivo de disminuir el riesgo de progresión a la enfermedad renal terminal.
Conflicto de intereses
Los autores declaran que no tienen conflicto de intereses potencial relacionado con los contenidos de este artículo.
Correspondencia: José Lucas Daza
Servicio de Nefrología.
Hospital de Clínicas José de San Martín.
Araoz, 323. 1414 Buenos Aires. Argentina.
drlucasdaza@gmail.com