DEFINICIÓN
La poliquistosis renal autosómica dominante (PQRAD) es una enfermedad monogénica multisistémica, que se caracteriza predominantemente por la presencia de múltiples quistes renales bilaterales, así como por manifestaciones extrarrenales (quistes en otros órganos, anomalías vasculares, cardíacas, digestivas y musculoesqueléticas), que se desarrollan en grado variable1.
EPIDEMIOLOGÍA
La PQRAD es la enfermedad renal hereditaria más frecuente, con una prevalencia que se estima entre 1:400 y 1:1.000, y es la tercera causa de insuficiencia renal terminal (IRT)2. Es una enfermedad que ocurre en todo el mundo y que afecta a todas las razas por igual. En todo el mundo, la tasa de incidencia anual de IRT causada por PQRAD es de 8,7 y 6,9 casos por millón (1998-2001 en los Estados Unidos), de 7,8 y 6,0 casos por millón (1998-1999 en Europa), para hombres y mujeres, respectivamente3,4.
ETIOLOGÍA Y GENÉTICA
La PQRAD se hereda de forma autosómica dominante con penetrancia completa, por lo que cada hijo de un padre afectado tiene un 50% de probabilidades de heredar el gen mutado. Es una enfermedad genéticamente heterogénea, en la que existen 2 genes identificados: PKD1 (en el cromosoma 16p13.3; 85% de los casos) y PKD2 (en el cromosoma 4q21-23; 15% de los casos).
Los individuos con mutaciones en PKD1 tienden a tener una presentación clínica más severa, pero existe una gran variabilidad interfamiliar e intrafamiliar. La mayoría de los individuos con mutaciones en PKD1 desarrollan IRT a una edad media de 54,3 años; por el contrario, más de un 50% de los individuos con mutaciones en PKD2 tienen una adecuada función renal a dicha edad (edad media de IRT, 74,0 años). Factores genéticos y medioambientales modificadores serían responsables de la gran variabilidad intrafamiliar respecto a la gravedad de las manifestaciones renales y extrarrenales5.
Análisis recientes de la población del estudio CRISP (Consortium of Imaging Studies to assess the Progression of Polycystic Kidney Disease) revelaron que los riñones de pacientes con mutaciones en PKD1 tenían un tamaño dos tercios mayor que los de los pacientes con mutaciones en PKD2 de la misma edad; el tamaño renal estaría asociado con la gravedad de la enfermedad. La mayor gravedad de los pacientes con PKD1 se debería al desarrollo de un número mayor de quistes a una edad más temprana y no a una mayor velocidad de crecimiento de los quistes (figura 1 A y B)6. Un mayor número de quistes en PKD1 a una edad más temprana concuerda con un modelo two-hit de quistogénesis, porque el gen PKD1 es un blanco mayor para las mutaciones. En este modelo, se hereda un gen PKD1 o PKD2 mutado de un progenitor y un gen normal del progenitor no afectado. En una segunda etapa, el gen normal sufre una mutación somática y queda, de esta manera, desactivado.
Evidencias de modelos animales con PQRAD indican que existen otros mecanismos genéticos que pueden producir la aparición de quistes. La insuficiencia haploide (una sola copia del gen es incapaz de proporcionar la producción suficiente de proteína para asegurar una función normal)7, o efecto dominante negativo (el producto del gen afectado influye de forma adversa la función del producto del gen normal), pueden contribuir al desarrollo de quistes en la PQRAD.
PATOGENIA
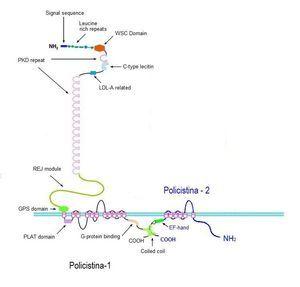
Poliquistina-1 (PC1, aproximadamente 460 kDa) y poliquistina-2 (PC2, aproximadamente 110 kDa) son las proteínas codificadas por PKD1 y PKD2, respectivamente, y ambas glicoproteínas están asociadas a la membrana (figura 2). Las poliquistinas constituyen una distinta subfamilia (TRPP) de canales receptores transitorios de potencial (TRP). La PC1 (4303 aa) posee la estructura de un receptor o molécula de adhesión, y está compuesta por un gran sector extracelular N-terminal (3.074 aa), 11 dominios transmembrana (1.032 aa), y una región C-terminal (197 aa) intracelular8. La región extracelular se compone de una variedad de dominios, entre los que se incluyen 12 dominios PKD (asociados con interacciones entre proteínas y entre proteínas e hidratos de carbono), un dominio receptor egg jelly (dominio REJ) y un sitio proteolítico (dominio GPS). La región C-terminal interactúa con la PC2 modulando su actividad. Existen evidencias de que ambas proteínas forman un complejo cuyo papel principal sería la regulación del calcio intracelular. La PC2 es un canal catiónico no selectivo, con elevada permeabilidad al calcio. Tanto la PC1 como la PC2 se encuentran ubicadas en los cilios primarios. La PC2 también se encuentra en el retículo endoplásmico, donde interactúa con receptores de trifosfato de inositol (IP3R) y de rianodina (RR). Estos dos receptores controlan la liberación de calcio de los depósitos intracelulares. En los cilios primarios, el complejo de poliquistinas percibe y traduce la estimulación mecánica en una entrada de calcio, la cual desencadena una mayor liberación de calcio por el retículo endoplásmico.
La disminución de una de las dos poliquistinas (PC1 o PC2) por debajo de un nivel crítico da como resultado un cambio fenotípico que se caracteriza por la incapacidad de mantener la polaridad celular, un aumento en la tasa de proliferación y apoptosis, la expresión de un fenotipo secretorio y la remodelación de la matriz extracelular. Los mecanismos moleculares implicados en estos cambios fenotípicos incluyen la alteración en la homeostasis del calcio intracelular, la activación del adenosín monofosfato cíclico (AMPc), receptores tirosín-quinasa, mammalian target of rapamycin(mTOR), la vía Wnt canónica y otros mecanismos de señal intracelular9.
ANATOMÍA PATOLÓGICA
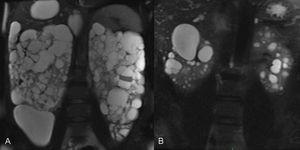
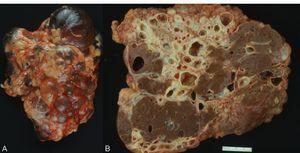
Los quistes se originan como dilataciones focales de los túbulos renales; luego pierden la conexión con éstos. En los estadios iniciales de la enfermedad, el parénquima renal tiene una apariencia relativamente normal. En el estadio terminal, los riñones son muy grandes, presentan innumerables quistes llenos de líquido y contienen tan sólo parches aislados de parénquima relativamente normal rodeado de abundante tejido fibroso (figura 3 A y B). El sistema colector se encuentra habitualmente distorsionado.
DIAGNÓSTICO
Es muy importante asesorar correctamente al paciente acerca de los beneficios y de las desventajas que suponen realizar un diagnóstico de certeza. Entre los beneficios se incluyen la posibilidad de planificación familiar, de detección y tratamiento temprano de las complicaciones de la enfermedad y la posibilidad de selección de familiares no afectados genéticamente para un trasplante renal. Algunas desventajas incluyen la posible discriminación asociada con un diagnóstico positivo en un seguro de enfermedad o en el medio laboral.
En individuos mayores de 18 años, con antecedentes familiares de PQRAD, el diagnóstico se establece sobre todo mediante pruebas radiológicas. La ecografía renal es el estudio de imagen habitualmente empleado debido a su inocuidad y a su bajo coste. Actualmente, los criterios ultrasonográficos de Ravine modificados10 (tabla 1) son los más aceptados para establecer el diagnóstico. La sensibilidad de estos criterios es de casi un 100% para individuos de 30 años o más y para individuos más jóvenes con mutaciones PKD1, pero sólo de un 67% para individuos con mutaciones de PKD2 de menos de 30 años.
Estos criterios no son válidos para técnicas radiológicas más sensibles como la tomografía computarizada (TC) y la resonancia magnética (RM); los criterios de diagnostico ultrasonográficos pueden ser aplicados en TC o RM a quistes que midan >1 cm de diámetro. La TC y la RM abdominales son de gran utilidad para establecer un diagnóstico diferencial o como criterio pronóstico. Cuando no existen antecedentes familiares de PQRAD, un aumento de tamaño renal bilateral y la presencia de quistes, con o sin quistes hepáticos, permiten establecer un diagnóstico presuntivo en ausencia de otras manifestaciones indicativas de una enfermedad quística renal diferente.
ANÁLISIS GENÉTICOS
Existen pruebas genéticas que pueden emplearse para establecer un diagnóstico definitivo cuando los resultados radiológicos son inconcluyentes. A pesar de que en la mayoría de los casos éstos no son necesarios para el diagnóstico de PQRAD, pueden ser importantes para establecer un diagnóstico definitivo, especialmente en personas jóvenes que puedan ser potenciales donantes vivos.
Las pruebas genéticas pueden hacerse por análisis por enlace (linkage) o por análisis de ADN directo. El análisis por enlace (linkage) utiliza marcadores microsatélite altamente informativos que flanquean PKD1 y PKD2, y requiere un diagnóstico preciso, al igual que tener un número suficiente de familiares afectados disponibles y dispuestos a someterse a las pruebas. El gran tamaño, la complejidad de PKD1 y la notable heterogeneidad alélica complican las pruebas moleculares por análisis de ADN directo. Hoy día, aproximadamente un 85% de las mutaciones pueden detectarse por medio de secuenciación directa.
No es frecuente la realización de pruebas genéticas para establecer un diagnóstico prenatal o preimplantacional debido al curso relativamente benigno de la enfermedad.
DIAGNÓSTICO DIFERENCIAL
En ciertas ocasiones, es necesario establecer un diagnóstico diferencial con otras enfermedades quísticas del riñón. Los principales diagnósticos diferenciales de PQRAD se presentan en la tabla 2.
CARACTERÍSTICAS CLÍNICAS
Manifestaciones renales
Desarrollo y crecimiento quístico
El desarrollo de los quistes renales en la PQRAD comienza desde la etapa embrionaria; estos quistes continúan aumentando de tamaño durante la vida del individuo. El estudio CRISP es el que ha proporcionado la mejor información clínica acerca del crecimiento y desarrollo de los quistes. Una de las más importantes conclusiones de este estudio fue la existencia de dos distintas fases en el proceso de quistogénesis: la fase de iniciación (dependiente de la mutación genética) y la fase de crecimiento (independiente de la mutación). En dicho estudio, 241 pacientes no urémicos fueron seguidos prospectivamente con RM anuales. El volumen total renal y los volúmenes quísticos aumentaron de forma exponencial. Los valores iniciales de volumen total renal fueron de 1.060 ± 642 ml y el aumento medio en 3 años fue de 204 ml o un 5,3% por año. El valor inicial de volumen total renal predijo el índice subsiguiente de incremento del volumen renal y se asoció con un descenso de la tasa de filtración glomerular (GFR) en pacientes con un volumen inicial renal total superior a 1.500 ml.
Anomalías de la función renal
Con frecuencia, existe una disminución en la capacidad de concentración de la orina, que puede manifestarse aun desde estadios tempranos de la enfermedad. Esta disminución en la capacidad de concentración puede deberse bien a una alteración de la arquitectura medular por los quistes o bien a un defecto celular directamente relacionado a la alteración de la función de la poliquistina. Algunos estudios han sugerido que el defecto en la capacidad de concentración de la orina y los niveles elevados de vasopresina en sangre pueden contribuir a la quistogénesis. La disminución de la excreción urinaria de amonio puede contribuir a los valores bajos de pH en la orina y a una aciduria hipocítrica que, asociados, predisponen a la formación de cálculos.
Hipertensión
La hipertensión arterial (HTA) es la manifestación más frecuente de la PQRAD y el principal factor que contribuye a la progresión de la enfermedad. El desarrollo de HTA está precedido de una disminución de flujo sanguíneo renal. Esta última puede detectarse en individuos jóvenes, aun cuando las cifras de presiones arteriales (PA) sistólica y diastólica (PAS y PAD) se encuentren en los valores normales11.
Aproximadamente un 50% de los pacientes con PQRAD de edades comprendidas entre los 20 y 30 años, que mantienen una función renal normal, tienen HTA (PA >140/90 mmHg); este porcentaje aumenta a casi el 100% en pacientes con IRT. La HTA suele desarrollarse en general antes de que exista una disminución en el GFR y está acompañada de un aumento de la fracción de filtración, de un manejo inadecuado del sodio y una extensa remodelación de la vasculatura renal.
La fisiopatología del desarrollo de la HTA en la PQRAD es complejo y depende de varios factores que se interrelacionan entre sí. Todavía no existe una clara evidencia de si la HTA está causada por un mal funcionamiento endotelial o vascular relacionado con la disminución de la expresión de la poliquistina, o si se debe a una isquemia intrarrenal causada por el crecimiento de los quistes. La asociación entre tamaño renal y prevalencia de HTA apoya la hipótesis de que el estiramiento y la compresión del árbol vascular por la expansión de los quistes causa isquemia y activa el sistema renina-angiotensina. La expresión de PC1 y PC2 en músculo liso vascular y endotelio, junto con un aumento de contractibilidad del músculo liso vascular y una deficiencia de vasorrelajación dependiente del endotelio, indican que la alteración primaria de la función de poliquistina en la vasculatura también puede contribuir al desarrollo temprano de HTA.
Es muy posible que la activación local del sistema renina-angiotensina desempeñe un papel importante en el desarrollo de la HTA. Por el contrario, existe controversia sobre si la angiotensina circulante contribuye de manera decisiva al desarrollo de la HTA en los pacientes con PQRAD. Otros factores propuestos como contribuyentes a la HTA en la PQRAD incluyen un aumento de actividad del sistema nervioso simpático y de los niveles de endotelina-1 en el plasma, y la resistencia a la insulina.
El diagnóstico de HTA en la PQRAD suele realizarse en una etapa avanzada de la enfermedad. La detección y el tratamiento tempranos de ésta son de suma importancia, ya que la enfermedad cardiovascular es la principal causa de muerte en estos pacientes. La PA descontrolada aumenta el riesgo de proteinuria y de hematuria, con el consiguiente declive acelerado de la función renal, aumenta la morbilidad y mortalidad debida a enfermedad cardíaca valvular y aneurisma, e incrementa las complicaciones materno-fetales durante el embarazo.
Dolor
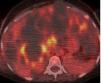
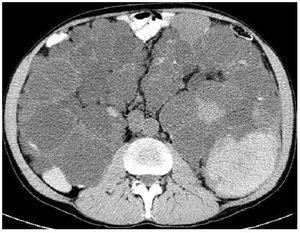
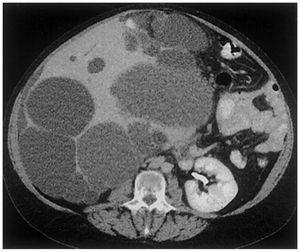
El dolor es el síntoma más frecuente (aproximadamente en el 60%) referido por pacientes adultos12,13. El dolor puede ser de aparición aguda, generalmente relacionado con hemorragia intraquística (figura 4), tránsito de cálculos o infección en las vías urinarias, o puede ser un dolor crónico. El dolor crónico parecería asociarse con la tracción del pedículo renal, la distensión de la cápsula renal o la compresión de las estructuras vecinas. Algunos pacientes presentan dolor crónico en la fosa renal sin ninguna etiología identificable, aparte de los quistes.
El epitelio de revestimiento intraquístico, mediante la producción de factor de crecimiento endotelial vascular, puede promover la angiogénesis con la consiguiente hemorragia intraquística y hematuria macroscópica. Los episodios sintomáticos probablemente subestiman la frecuencia de los quistes hemorrágicos, ya que más del 90% de los pacientes con PQRAD tienen quistes hiperdensos (TC) o hiperintensos (RM), que reflejan un contenido de sangre o proteínas elevado. La mayoría de hemorragias se resuelven en 2-7 días. Si los síntomas persisten más de una semana, o si el episodio inicial ocurre en un paciente mayor de 50 años, es importante recurrir a exámenes adicionales con el fin de descartar una neoplasia renal.
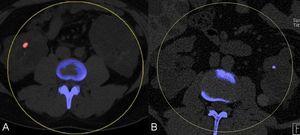
Los cálculos renales son otra causa frecuente de dolor agudo en los pacientes con PQRAD; se estima que aproximadamente un 20% de los pacientes los presenta. La composición de dichos cálculos es generalmente de ácido úrico y/o de oxalato de calcio. Los factores metabólicos predisponentes incluyen un bajo pH urinario, una baja concentración de citrato urinario y una excreción de amonio disminuida. Por otra parte, la estasis urinaria secundaria a la distorsión de la anatomía renal también puede estar implicada. Una TC abdominal con y sin contraste es la mejor técnica radiológica para detectar pequeños cálculos de ácido úrico que pueden ser muy tenues en radiografías simples. Las nuevas técnicas de TC con energía dual permiten diferenciar entre cálculos compuestos de ácido úrico y cálculos con contenido cálcico, una distinción importante para la elección de la terapéutica adecuada (figura 5 A y B). Los cálculos pueden ser difíciles de diferenciar entre calcificaciones de la pared de los quistes o intraparenquimatosas. Cuando solamente se obtiene una TC con contraste los cálculos pueden pasar desapercibidos.
Al igual que en la población general, las infecciones urinarias son más frecuentes en la mujeres que en los hombres. La TC y la RM permiten la detección de quistes complicados y proporcionan definición anatómica, pero los hallazgos no son específicos, por lo que no es posible realizar el diagnóstico de un quiste infectado. La radiología nuclear (gammagrafía con galio-67 o con leucocitos marcados con indio-111) puede ayudar, pero es posible obtener resultados falsamente negativos y positivos. Cuando el cuadro clínico y el radiológico son sugerentes, y los cultivos de sangre y orina son negativos, debe considerarse la aspiración de los quistes.
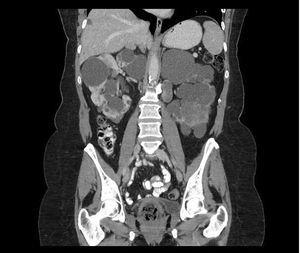
El carcinoma de células renales no es una causa frecuente de dolor en pacientes con PQRAD. La frecuencia no es superior a la de la población general, aunque puede presentarse a una edad más temprana, con frecuentes síntomas constitucionales y una proporción más elevada de tumores sarcomatoides, bilaterales, multicéntricos y metastásicos (figura 6). Frente a la presencia de una masa sólida en la ecografía o una masa con calcificaciones espiculadas en la TC o en la RM, y captación de contraste en la TC, se debe sospechar un carcinoma.
Insuficiencia renal
El desarrollo de insuficiencia renal es muy variable. Aproximadamente un 50% de los pacientes con PQRAD se encuentran en IRT a los 60 años de edad. A partir de que el paciente se encuentra en insuficiencia renal, el índice medio de declive de GFR es de aproximadamente 4,4-5,9 ml/min/año. Los pacientes con PKD1 llegan a la IRT a una edad media inferior a los pacientes con PKD2 (54,3 frente a 74,0). Otros factores que influyen en el curso clínico de la enfermedad incluyen el sexo masculino (particularmente en PKD2), diagnóstico antes de los 30 años, primer episodio de hematuria antes de los 30 años, inicio de hipertensión antes de los 35 años, hiperlipemia y colesterol HDL bajo.
Existen varios factores que contribuyen al declive de la función renal. El estudio CRISP ha confirmado que existe una clara asociación con el aumento de tamaño renal14 y ha demostrado que el volumen renal y de los quistes es el factor predictivo más importante de declive de función renal. Por otra parte, el flujo sanguíneo renal (o resistencia vascular) constituye un factor pronóstico independiente11 y podría explicar los casos en los que el declive de la función renal parece desproporcionado respecto a la gravedad de la enfermedad quística. En algunos pacientes, el abuso de analgésicos puede contribuir a la progresión de la IRT.
Manifestaciones extrarrenales
Enfermedad poliquística hepática
La enfermedad poliquística hepática (EPQH) es la manifestación extrarrenal más frecuente y se asocia con ambos genotipos: PKD1 y PKD2. La EPQH también puede presentarse como una enfermedad genética distinta, en ausencia de quistes renales (figura 7). Al igual que la PQRAD, la EPQH es genéticamente heterogénea, con dos genes identificados (PRKCSH en el cromosoma 19 y Sec63 en el cromosoma 6).
En la PQRAD, los quistes hepáticos suelen detectarse más tardíamente que los quistes renales. La frecuencia de los quistes hepáticos aumenta con la edad y raramente se observan en niños. La prevalencia en RM en el estudio CRISP fue del 58% en participantes de 15 a 24 años, del 85% en los de 25 a 34 años y del 94% en los de 35 a 46 años15.
La mayoría de los quistes hepáticos deriva de una proliferación excesiva de los ductos biliares, perdiendo luego la conexión con el conducto de origen. Estos quistes se encuentran recubiertos por una capa de células epiteliales de características fenotípica y funcional similares a las del epitelio biliar, y presentan una capacidad secretoria y proliferativa aumentada. El número y el volumen de quistes hepáticos es mayor en las mujeres que en los hombres.
Observaciones clínicas han indicado un efecto estrogénico en el crecimiento de los quistes hepáticos, ya que la enfermedad es más grave en mujeres que han tenido múltiples embarazos o que han tomado anticonceptivos orales o terapia de remplazo de estrógenos. Estudios recientes no sólo han confirmado la presencia de receptores de estrógenos en las células epiteliales que recubren a los quistes, sino que también han demostrado la sensibilidad proliferativa de dichas células en presencia de estrógenos16.
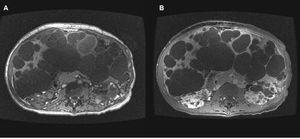
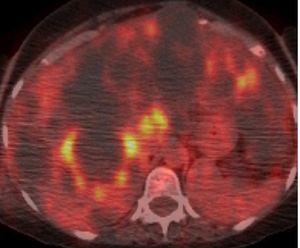
A pesar de que la EPQH es generalmente asintomática, algunos pacientes suelen experimentar complicaciones agudas o crónicas. Las complicaciones agudas más frecuentes de la EPQH incluyen infección y hemorragia intraquística. La infección quística suele presentarse con dolor localizado, fiebre, leucocitosis, velocidad de sedimentación elevada y, a menudo, fosfatasa alcalina elevada. Generalmente es monomicrobiana y causada por enterobacteriáceas. Una TC o una RM suelen diferenciar entre una infección o una hemorragia (figura 8 A y B). La tomografía por emisión de positrones con 18-fluorodesoxiglucosa (TEP-FDG) puede ser de gran utilidad en la identificación de quistes infectados en hígados poliquísticos (figura 9). Las complicaciones crónicas se deben generalmente a un agrandamiento masivo del hígado o a un efecto de masa debido a un quiste único dominante o a un grupo limitado de quistes. Los síntomas más frecuentes debidos al efecto de masa incluyen disnea, saciedad precoz, reflujo gastroesofágico y dolor lumbar mecánico. Otras complicaciones causadas por el efecto masa incluyen obstrucción del flujo eferente venoso hepático, compresión de la vena cava inferior, compresión de la vena porta o compresión del conducto biliar, que se manifiesta como ictericia obstructiva.
Otras anomalías hepáticas que pueden observarse en pacientes con PQRAD incluyen una dilatación ligera del conducto biliar común (hasta en un 40% de los pacientes estudiados con TC), y menos frecuentemente fibrosis hepática congénita, adenomas de la ampula de Vater y colangiocarcinoma.
Quistes en otros órganos
Los quistes en las vesículas seminales ocurren en un 40% aproximadamente de los pacientes, y no causan infertilidad. En un 9% de los pacientes mayores de 30 años pueden detectarse quistes pancreáticos por medio de una ecografía abdominal17. Éstos son, casi siempre, asintomáticos y, muy raramente, presentan pancreatitis recurrente. Es poco probable la asociación con el carcinoma de páncreas y posiblemente represente sólo una coincidencia casual. En un 8% aproximadamente pueden encontrarse quistes en la aracnoides. Éstos en general son asintomáticos y no requieren tratamiento, pero pueden aumentar el riesgo de hematoma subdural18,19. Los divertículos de la duramadre se han observado en un 1,7% aproximadamente y en pocas ocasiones pueden presentarse con hipotensión craneal debida a un escape de líquido cefalorraquídeo. No se han observado asociaciones con quistes de ovario.
Manifestaciones vasculares
Algunos estudios han demostrado que tanto PKD1 como PKD2 pueden desarrollar complicaciones vasculares. Las alteraciones vasculares más frecuentes incluyen aneurismas intracraneales y dolicoectasias, disecciones de aorta torácica y arteria carótida, y aneurismas de arteria coronaria. El alto nivel de expresión de PC1 y PC2 en el músculo liso vascular y en las células endoteliales sostiene la teoría de que estas anomalías vasculares se deben a las alteraciones en la función de las poliquistinas.
En aproximadamente un 8% de los pacientes con PQRAD se diagnostica un aneurisma intracranenal (AI) asintomático; este número aumenta hasta un 16% en pacientes con historia familiar de aneurismas o hemorragia subaracnoidea (HSA). En su gran mayoría, los AI son asintomáticos, pero también pueden presentarse con síntomas focales debidos a la compresión de estructuras vecinas (como parálisis de un nervio craneal o convulsiones), o como HSA. Ésta, con una morbilidad y una mortalidad combinadas del 35-55%, es la complicación extrarrenal más devastadora, que da como resultado la muerte precoz o la discapacidad de los pacientes con PQRAD. La edad media en la que ocurre la rotura es inferior a la de la población general (39 frente a 51 años).
Manifestaciones cardíacas
El prolapso de la válvula mitral es la anomalía más frecuente y se produce hasta en un 25% de los pacientes. También puede encontrarse insuficiencia aórtica asociada con una dilatación de la raíz aórtica. A pesar de que pueden progresar con el tiempo, no suelen requerir el reemplazamiento valvular. La ecocardiografía diagnóstica no está indicada, excepto que se detecte un soplo al auscultar. Los derrames pericárdicos suelen ocurrir con mayor frecuencia que en otras nefropatías crónicas (el 35 frente al 9%) y se deben, posiblemente, a un aumento de la distensibilidad del pericardio parietal. Aunque estos derrames pueden ser de volumen considerable, en general son bien tolerados y no tienen importancia clínica.
Enfermedad diverticular
La diverticulosis colónica y la diverticulitis son más frecuentes en pacientes que han desarrollado IRT secundaria a la PQRAD; no se ha encontrado asociación en pacientes que todavía no han desarrollado IRT. Debido a que la diverticulosis puede asociarse con un defecto en el músculo liso, la asociación entre diverticulosis y PQRAD podría explicarse por la presencia de PC1 y PC2 en el músculo liso intestinal y una función alterada de éstas20.
TRATAMIENTO
La finalidad de los tratamientos actuales es limitar la morbilidad y la mortalidad debidas a las complicaciones de la enfermedad.
Tratamiento específico
Hipertensión
El tratamiento de la HTA en los pacientes con PQRAD es una medida esencial, ya que acelera el declive de la función renal y agrava las complicaciones extrarrenales. El o los antihipertensivos de elección, o la cifra óptima de PA, todavía no se han determinado. Los inhibidores de la enzima de conversión de la angiotensina (IECA) y los antagonistas del receptor de angiotensina (ARA), además de controlar la PA, aumentan el flujo sanguíneo renal, tienen pocos efectos secundarios, y podrían tener propiedades renoprotectoras adicionales. A pesar de que los estudios clínicos no han podido demostrar el efecto beneficioso de los IECA en el mantenimiento de la función renal, la mayoría de estos estudios han estado limitados por insuficiente poder estadístico, seguimientos cortos, gran diversidad de función renal, y el uso de dosis insuficientes.
El seguimiento prolongado de los pacientes con PQRAD en el estudio MDRD (Modification of Diet in Renal Disease) mostró un retraso en el inicio de la insuficiencia renal terminal y una reducción en el resultado conjunto de insuficiencia renal terminal y mortalidad en el grupo de PA baja (de los que un 51% tomaban IECA), comparado con los del grupo de presión arterial estándar (de los que un 32% tomaban IECA)21.
Hasta que se disponga de más información, parece razonable controlar la PA a menos de 130/80 mmHg con un régimen que incluya un IECA y/o un ARA. Un estudio en marcha (HALT-PKD) ha sido diseñado con el propósito de determinar si un tratamiento combinado con un IECA y un ARA es superior a un tratamiento único con IECA en retrasar la progresión de la enfermedad quística en pacientes con enfermedad renal crónica en estadioo 1 o 2, o en enlentecer el declive de la función renal en pacientes con enfermedad renal crónica en estadio 3. El HALT-PKD también determinará si un objetivo más bajo de presión arterial (<110/75 mmHg) es superior a un objetivo estándar (<130/80 mmHg) en el grupo de pacientes con función conservada.
Dolor
Como primera medida deben excluirse las causas de dolor que puedan requerir una intervención quirúrgica (infecciones, cálculos o tumores). Los analgésicos no opioides son de primera elección, aunque debe evitarse la administración a largo plazo de agentes nefrotóxicos. Los narcóticos deben reservarse para episodios agudos, ya que el uso crónico puede producir dependencia física y psicológica. En pacientes con dolor crónico, es muy importante la modificación del estilo de vida y evitar actividades que lo agraven. Los antidepresivos tricíclicos y las intervenciones poco invasivas, como el bloqueo del nervio esplácnico con anestésicos locales o esteroides, también pueden ser útiles en el tratamiento del dolor crónico.
Cuando las medidas conservadoras son insuficientes, puede recurrirse a la aspiración de quistes de gran tamaño guiada por ecografía o TC, o se pueden utilizar agentes esclerosantes que previenen la reacumulación de líquido. En pacientes con múltiples quistes, la fenestración laparoscópica o quirúrgica a través de una lumbotomía, la denervación laparoscópica o una simpaticosplanicectomía toracoscópica, pueden ser beneficiosas. La nefrectomía está indicada en pacientes sintomáticos con IRT.
Hemorragia quística
Las episodios de hemorragia intraquística en general remiten de forma espontánea y responden a un tratamiento conservador con reposo en cama, analgésicos e hidratación. En raras ocasiones, con sangrados más severos que causen hematoma subcapsular o retroperitoneal y produzcan inestabilidad hemodinámica, es necesario hospitalizar al paciente.
Infección quística
Cuando existe la sospecha de infección quística es necesario recurrir a estudios de imagen (TC o RM). Las infecciones quísticas a menudo son difíciles de tratar; el fallo terapéutico puede deberse a una penetración insuficiente de los antibióticos en el interior de los quistes. Los agentes lipofílicos penetran en los quistes de forma apropiada. El drenaje percutáneo o quirúrgico de los quistes infectados pueden ser necesario si la fiebre persiste por más de 1-2 semanas de terapia antimicrobiana apropiada. Si la fiebre recurre tras suspender los antibióticos, deben excluirse otras complicaciones, como obstrucción, absceso perirrenal o cálculos.
Nefrolitiasis
El tratamiento es similar al de pacientes sin PQRAD. El citrato de potasio y una alta ingestión de líquidos son el tratamiento de elección para la litiasis de ácido úrico, la nefrolitiasis de calcio con hipocitraturia y los defectos de acidificación distal. La litotricia extracorpórea por onda de choque y la nefrotolitotomía percutánea dan buenos resultados sin excesivas complicaciones.
Enfermedad renal en estadio terminal
Se ha referido que los pacientes con PQRAD toleran mejor la diálisis que los pacientes con otras causas de IRT; esto podría deberse a niveles más elevados de eritropoyetina y hemoglobina, o a una comorbilidad más baja. La diálisis peritoneal no está contraindicada a pesar del tamaño renal y un riesgo más alto de hernias en estos pacientes.
El trasplante renal es el tratamiento de elección para la IRT en pacientes con PQRAD. Las complicaciones después del trasplante no son mayores que en la población general. La nefrectomía antes del trasplante se reserva para pacientes con antecedentes de quistes infectados, hemorragias frecuentes o aumento masivo del tamaño renal.
Poliquistosis hepática
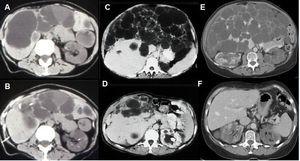
La mayoría de casos de PQH son asintomáticos y no requieren tratamiento. Cuando existen síntomas, el tratamiento se dirige a reducir el volumen quístico y el tamaño hepático. Se debe evitar tomar estrógenos y fármacos que favorezcan la acumulación de AMPc (p. ej., cafeína). Se ha sugerido que los antagonistas de los receptores H2 y los inhibidores de la bomba de protones puedan disminuir la producción de secretina y la secreción de líquido intraquístico. En caso de que sean necesarias medidas invasivas (aspiración percutánea, fenestración laparoscópica o resección hepática) para reducir el volumen quístico o el tamaño hepático, la selección del tipo de intervención depende de la anatomía y de la distribución de los quistes (figura 10).
Aneurisma intracraneal
La mayoría de los AI en pacientes con PQRAD son pequeños, en la circulación anterior y con un riesgo de rotura no superior al de los AI encontrados de forma esporádica. Las indicaciones para un diagnóstico presintomático en pacientes con buena expectativa de vida incluyen: antecedentes familiares de AI o HSA, rotura previa de un aneurisma, preparación para cirugía mayor, profesiones de alto riesgo (p. ej., pilotos de aviación) y ansiedad por parte del paciente, a pesar de recibir la información apropiada. La RM con angiografía (RMA) es el método de elección; la TC con angiografía es una alternativa satisfactoria cuando no existen contraindicaciones para el contraste intravenoso.
Si la RMA es negativa, se recomienda reestudiar a los pacientes con buena expectativa de vida a intervalos de 5 años. Cuando se detecta un aneurisma asintomático, la recomendación dependerá de la edad del paciente, del estado general, de los antecedentes previos de hemorragia de otro aneurisma, de factores dependientes del aneurisma (tamaño, ubicación y morfología) y de la accesibilidad para un tratamiento quirúrgico o endovascular.
En pacientes con aneurismas pequeños (<7 mm) asintomáticos, en general se recomienda un tratamiento conservador, ya que algunos estudios han demostrado que el riesgo de rotura es bajo. Inicialmente deberán repetirse los estudios radiológicos anual o semianualmente, y una vez documentada la estabilidad del aneurisma, puede ser suficiente una revaluación menos frecuente. Debe recomendarse el abandono del tabaco y un tratamiento agresivo de la HTA y de la hiperlipidemia.
Terapias novedosas
Un mejor conocimiento de la fisiopatología y la disponibilidad de modelos animales han permitido el desarrollo de fármacos prometedores para ensayos clínicos.
Antagonistas de vasopresina
Estudios recientes en modelos animales han demostrado que la regulación de los niveles de AMPc por vía de los receptores V2 puede inhibir drásticamente el desarrollo de quistes renales22-24. El consumo de una cantidad elevada de agua también ejerce un efecto protector por sí solo, en el desarrollo de poliquistosis renal en ratas PCK; probablemente esto se debe a la inhibición de la secreción de vasopresina. Recientemente, se han completado estudios clínicos en fase II con tolvaptan (antagonista con alta potencia y selectividad para el receptor de vasopresina V2 humano) y un estudio en fase III se encuentra en marcha.
Análogos de la somatostatina
La somatostatina actúa sobre los receptores SST2 e inhibe la acumulación de AMPc no sólo en el riñón sino también en el hígado. La octreotida, un análogo sintético de la somatostatina, ha demostrado causar un enlentecimiento en el aumento de tamaño de quistes renales y hepáticos en modelos animales de PQR25 y en riñones poliquísticos. Tres recientes estudios prospectivos aleatorizados con control y octreotida o lanreotida durante 6-12 meses mostraron una reducción en el volumen hepático en pacientes con PQH y buena tolerancia26-28.
Inhibidores mTOR
Estudios realizados en numerosos modelos experimentales de poliquistosis renal han mostrado que la rapamicina y everolimus (inhibidores de mTOR) retrasan la expansión de los quistes y protegen la función renal29-33. Estudios retrospectivos en pacientes con PQRAD, realizados después del trasplante, han demostrado una reducción significativa en el volumen de los riñones y de los hígados poliquísticos en pacientes tratados con sirolimus comparado con pacientes tratados con inhibidores de la calcineurina30,34. Sin embargo, estudios aleatorizados con everolimus y sirolimus durante períodos de 18-24 meses no han podido demostrar de manera consistente un retraso en el aumento de tamaño renal o un enlentecimiento en la progresión del declive en la función renal35,36.
Otras estrategias dirigidas contra los mecanismos moleculares que se encuentran alterados en la PQRAD han demostrado tener resultados prometedores en modelos animales, pero aún no han sido probados en estudios clínicos. Dichos fármacos incluyen: activadores del canal de calcio de la PC2 (triptolide), metformina, agonistas del receptor gamma activado por el proliferador peroxisómico, inhibidores o antagonistas de los transportadores y canales requeridos para la secreción de cloruro (inhibidores de CFTR), e inhibidores de la sintetasa de glucosilceramida. Otros fármacos que han sido efectivos en ensayos preclínicos y que muestran posible utilidad para el tratamiento de la PQR en humanos incluyen inhibidores de Erb-B1 (receptor de factor de crecimiento epidérmico) y Erb-B2, Src, MEK, y quinasas dependientes de ciclinas.
CONCLUSIONES
La PQRAD es la enfermedad renal hereditaria más frecuente (1:400-1:1.000), y se caracteriza predominantemente por la presencia de múltiples quistes renales bilaterales y manifestaciones extrarrenales (quistes en otros órganos; anomalías vasculares, cardíacas, digestivas y musculoesqueléticas). Es genéticamente heterogénea; con 2 genes identificados, PKD1 (cromosoma 16p13.3, en el 85% de los casos) y PKD2 (cromosoma 4q21-23, en el 15% de los casos). Los individuos con PKD1 tienden a tener una presentación clínica más grave (IRT 54,3 frente a 74,0 años) y la mayor gravedad se debería al desarrollo de un número mayor de quistes a una edad más temprana. La HTA es la manifestación más frecuente y el principal factor contribuyente en la progresión de la enfermedad. La PQH es la manifestación extrarrenal más frecuente, pero la HSA debida a la rotura de un AI es la complicación extrarenal más devastadora; ambas se asocian con mutaciones en PKD1 y PKD2.
CONCEPTOS CLAVE
1.
1. La poliquistosis renal autosómica dominante está causada por mutaciones en PKD1 o PKD2, y se caracteriza sobre todo por quistes renales bilaterales y un grado variable de manifestaciones extrarrenales (quistes en otros órganos, anomalías cardiovasculares, digestivas y musculoesqueléticas).
2. Los individuos con PKD1 tienden a tener una presentación clínica más grave (insuficiencia renal terminal 54,3 frente a 74,0 años) y una mayor gravedad que se debería al desarrollo de un número mayor de quistes a una edad más temprana.
3. La hipertensión arterial es la manifestación más frecuente y el principal factor contribuyente en la progresión de la enfermedad.
4. La finalidad de los tratamientos actuales es de limitar la morbilidad y la mortalidad debidas a complicaciones de la enfermedad.
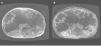
Figura 1. Imagen de resonancia magnética en 2 pacientes de 48 años de edad con mutaciones en PKD1 (A) y PKD2 (B).
Figura 2. Diagrama de las proteínas de PKD1 y PKD2.
Figura 3. Aspecto macroscópico de poliquistosis renal autosómica dominante (PQRAD) vista desde la superficie externa del riñón (A) y corte en el que se ven quistes hepáticos en PQRAD (B).
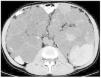
Figura 4. Imagen de tomografía computarizada en un paciente con poliquistosis renal masiva.
Figura 5. Tomografía computarizada de energía dual que permite la caracterización de la composición de los cálculos renales.
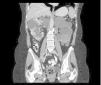
Figura 6. Tomografía computarizada de una paciente mujer de 62 años de edad.
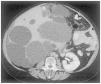
Figura 7. Tomografía computada que muestra numerosos quistes hepáticos en un paciente con poliquistosis hepática autosómica dominante (PQHAD) sin afectación renal.
Figura 8. Resonancia magnética de una paciente mujer de 45 años de edad.
Figura 9. Imagen de tomografía por emisión de positrones con 18-fluorodesoxiglucosa (TEP-FDG) que demuestra una intensa captación circular de FDG en la pared de un quiste hepático, lo que sugiere una infección intraquística.
Figura 10. Imágenes tomográficas de poliquistosis hepática (PQH).
10905_16025_15423_es_tabla_1.docx
Tabla 1. Diagnóstico de poliquistosis renal autosómica dominante
10905_16025_15424_es_tabla_2.docx
Tabla 2. Diagnóstico diferencial