Hemos realizado un Modelo de Estudio de Costes de las diferentes modalidades de Terapia Sustitutiva Renal en España, mediante un Modelo de Markov determinístico con proyección de hasta 15 años. Se han planteado dos modificaciones experimentales: un aumento de la tasa de comienzo programado de diálisis hasta el 75% y un aumento del uso de la DP como tratamiento inicial de hasta el 30%, así como una combinación de ambos objetivos.
Resultados: las medidas propuestas aumentan la supervivencia de los pacientes, con una ganancia de hasta 23.198 años de vida, y a pesar del aumento de pacientes tratados, suponen un ahorro de casi 500 millones de Euros en 15 años. Deducidas las inversiones necesarias para lograr estos objetivos, el ahorro continua siendo de casi 125 millones de Euros. Un aumento de la Eficacia del tratamiento que conlleva una reducción de costes es importante para la Calidad y sostenibilidad del Sistema Sanitario.
Conceptos Clave:
La Terapia Sustitutiva Renal consume el 2.5% del presupuesto del Sistema Nacional de Salud y más del 4% del de Atención Especializada.
Es bueno que los médicos conozcamos los Costes de las terapias que aplicamos, para contribuir a la sostenibilidad del Sistema. De otra forma, otros tomarán las decisiones equivocadas.
Las dos modalidades fundamentales de Diálisis tienen una eficacia similar, pero costes diferentes.
El coste de la sesión supone sólo la mitad del coste total de la terapia en HD y dos tercios del total en la DP.
En este aspecto al menos, podemos aspirar a parecernos a países más desarrollados que el nuestro, y además con un coste inferior al actual.
INTRODUCCIÓN
La insuficiencia renal crónica (IRC) es la única enfermedad en la que en la actualidad es posible la sustitución de la función de un órgano vital de forma que se mantiene la vida de firma prolongada y con una calidad de vida y rehabilitación muy aceptables. La Terapia Sustitutiva Renal (TSR) es un tratamiento muy costoso, sin que podamos comparar su eficiencia con otras terapias de soporte vital, ya que hasta el momento no es posible la sustitución de ningún otro órgano vital con el mismo grado de rehabilitación de los pacientes.
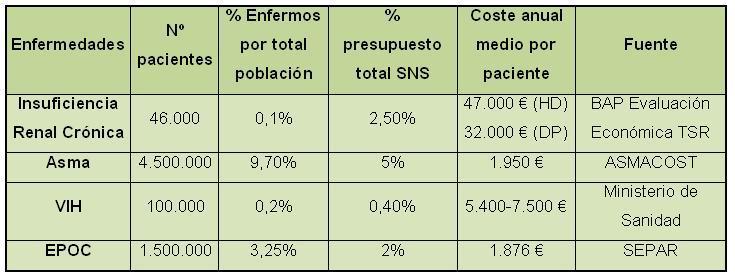
Las implicaciones económicas de la TSR son muy importantes (Tabla I). Es la terapia crónica más cara en Atención Especializada, con un coste medio por paciente 6 veces mayor que el del SIDA. Una terapia aplicada a uno de cada 1.000 ciudadanos pero que consume el 2.5% del presupuesto del SNS y más del 4% del de Atención Especializada. Cada año inician TSR unos 6.000 pacientes nuevos y la prevalencia crece un 3%1.
Por este motivo, y más en períodos de crisis como el actual, se plantea la sostenibilidad a largo plazo de esta terapia y consideramos importante la mejora de su eficiencia antes de que nos veamos abocados a restricciones en la aplicación del tratamiento.
Aunque no podamos aplicar fácilmente comparaciones con otras terapias, los costes de la TSR superan algunas definiciones de ¿ineficiencia¿ como los 35.000 a 50.000 $/AVAC (año de vida ajustado por calidad)2,3. Pero sí que podemos comparar la eficiencia de las diferentes TSR (Hemodiálisis, Diálisis Peritoneal y Trasplante Renal), y hacerlo en nuestro medio y con las características de accesibilidad y equidad que caracterizan al Sistema Sanitario Español.
La TSR puede realizarse mediante tres modalidades fundamentales (Hemodiálisis, Diálisis Peritoneal y Trasplante Renal) que tienen costes muy diferentes. En la actualidad un 48% de los pacientes en TSR en España están trasplantados, un 46% en HD y un 6% en DP1. Resulta de especial interés evaluar el coste de las modalidades de TSR, con el objeto de conocer cuál resulta más eficiente4. Pero la eficiencia no es el único parámetro que define la opción terapéutica a elegir. Por la elevada comorbilidad de los actuales incidentes en TSR y la carencia de suficientes órganos para trasplante, el trasplante renal solo es aplicable a menos del 20% de los pacientes en diálisis, por lo que la mayoría de los incidentes y prevalentes en TSR deben dializarse, y tendrán que elegir entre la Hemodiálisis o la Diálisis Peritoneal domiciliaria.
Cuando los pacientes con Enfermedad Renal Crónica Avanzada (ERCA) tienen la posibilidad de elegir libremente la técnica de diálisis, su elección debería ser determinante en la terapia a aplicar. Pero no suele suceder de esta forma en la mayoría de los pacientes5, como puede deducirse del artículo de JL Pastor y JC Julián, en este mismo número.
La terapia de sustitución renal utilizada se indica o escoge por motivos en gran parte no asistenciales6, y en una elevada proporción de los casos, sin que haya tiempo para una adecuada información al paciente que posibilite su elección5. Es por tanto esencial que los posibles ahorros derivados de una elección de terapias más eficientes se destinen a mejorar la asistencia clínica prediálisis de forma que el inicio de la TSR se realice de forma programada, posibilitando la información y la elección de modalidad por el paciente. El objetivo de este estudio es tanto contribuir a la sostenibilidad de la terapia crónica más cara, como mejorar la eficacia y la supervivencia de los pacientes dializados.
OBJETIVO:
Desarrollar una evaluación económica del programa sanitario integral de terapia renal crónica sustitutiva, siempre desde la perspectiva del Ente Financiador (la Administración Pública), mediante la elaboración de un modelo de Markov7,8 que permita comparar el coste-efectividad de varias estrategias posibles en la implementación de los distintos tratamientos disponibles.
METODOLOGÍA:
La información relativa a efectividad clínica expresada en años de vida ganados (AVGs) y años de vida ajustados por calidad (AVACs) se obtuvo de una búsqueda bibliográfica en plataformas de revistas electrónicas Medline EMBASE, CRD, Cochrane Library Plus; en Boletines Oficiales de Comunidades Autónomas; así como en la base de datos de costes sanitarios OBLIKUE9; y en fuentes estadístico-administrativas (Instituto Nacional de Estadística).
Los datos de coste y efectividad fueron incluidos en un modelo de Markov determinístico diseñado para el tratamiento integral de la Insuficiencia Renal Terminal (HD, DP y TX), que consideraba la entrada de nuevos pacientes en el sistema (pacientes incidentes) y que contemplan un horizonte temporal a 5, 10 y 15 años. Además de proyectar en el tiempo la situación actual real de la TSR, se consideraron diferentes escenarios alternativos de diferente utilización de las modalidades de TSR:
Escenario 1: Los parámetros del modelo reflejan la situación actual.
Escenario 2: Se aumenta la proporción de incidentes que inician la TSR de forma programada (hasta el 75%).
Escenario 3: Se aumenta la proporción de incidentes programados en DP (hasta el 30%) y se reduce en consecuencia la incidencia de programados en HD, dejando la incidencia en TX constante.
Escenario 4: Es una combinación de las alternativas 2 y 3, al mismo tiempo.
Los Objetivos planteados en estos Escenarios son alcanzables. De hecho, en algunos hospitales españoles se alcanzan o superan. Vistos desde algunas CCAA pudieran parecer difíciles, pero los cambios propuestos comienzan a ser rentables aunque no se alcancen los Objetivos utilizados en el estudio, ya que ninguna de las Inversiones propuestas es previa a la terapia de los pacientes.
Para el cálculo de los costes asociados a la enfermedad se aplicó la tasa de variación del Índice de Precios de Consumo (IPC) aplicable en el campo de la medicina. Siguiendo las pautas de guías internacionales como la de Canadá, EEUU, u organismos como el National Institute for Clinical Excellence en el Reino Unido, se ha aplicado una tasa de descuento anual del 3% a los costes ya que se reconoce que el valor del dinero actual tiene más valor que el futuro. Respecto a los beneficios y siguiendo un criterio conservador, se ha optado por aplicar la misma tasa que a los costes aunque por ejemplo, el NICE en el año 2004, proponía el 1,5%.
Finalmente, el manejo de la incertidumbre en el modelo se realizó a través de un primer análisis preliminar univariado que permitió conocer el peso de los distintos parámetros en los resultados finales. Tras este análisis, se realizó un análisis multivariado a través de un análisis de escenarios de la alternativa 4 incrementando un 5% los costes de DP a la vez que se disminuye en el mismo porcentaje la utilidad de DP.
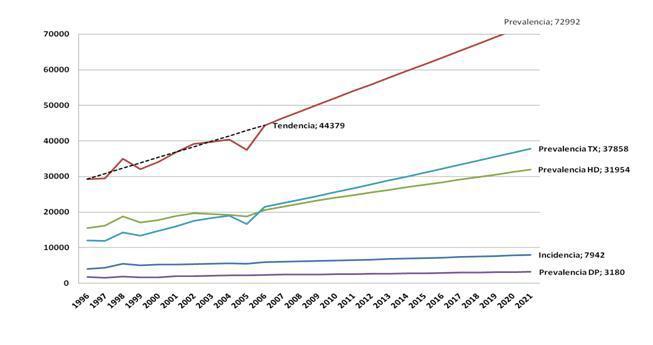
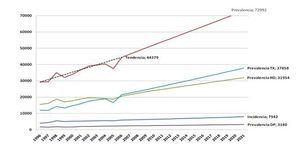
Transiciones: Se definen cuatro estados de salud: Hemodiálisis (HD), Diálisis Peritoneal (DP), Trasplante (TX) y Muerte (M), siendo posible la transición, en ambos sentidos, entre todos los estados (excepto en el caso de M, que es un estado absorbente). Partiendo de los últimos datos ponderados disponibles de prevalencia e incidencia proporcionados por la SEN, el modelo realiza una simulación de la evolución de la patología en un horizonte temporal de 15 años. Las probabilidades de Transición se resumen en la Figura 1.
Prevalencia Se parte de los datos ponderados de prevalencia registrados por la SEN para el año 2006 (44.379 pacientes). Esta prevalencia se reparte entre los tres estados de acuerdo con las proporciones observadas de prevalentes en el año 2006 en ese registro: HD (46,36%), DP (5,24%) y TX (48,40%). A partir de estos datos, la prevalencia en cada ciclo y estado vendrá determinada por la aplicación de la matriz de probabilidades de transición.
Incidencia Se parte de los datos ponderados de incidencia registrados por la SEN1 para el año 2006 (5.901 pacientes). Se estima que los pacientes incidentes crecen a una tasa constante del 2%, respecto al ciclo anterior, y se reparten entre los estados según las proporciones observadas de incidencia registradas por la SEN en el año 2006: HD (86,17%), DP (12,45%) y TX (1,38%). Actualmente en España10 inciden de forma programada apenas un 53% de los pacientes en HD. Además, asumimos que sólo el 5% de los pacientes no programados inciden en DP, dado que, en su mayor parte, apenas han contactado con el nefrólogo y, por tanto, la información recibida ha sido menor. A partir de los datos anteriores, es posible derivar las proporciones de incidencia de programados para el conjunto de los estados.
Probabilidades de transición (Figura 1) Las probabilidades se aplican, en cada ciclo, sobre el total de pacientes incidentes y prevalentes, y determinan el estado que ocuparán dichos pacientes durante el siguiente ciclo.
Las probabilidades de mantenerse en HD y DP se derivan del análisis de supervivencia13 publicado con pacientes españoles. Las probabilidades de transición de HD y DP a TX se estimaron a partir de los datos registrados por la SEN, asumiendo que los pacientes en DP tienen mayor probabilidad de ser trasplantados que los pacientes que se encuentran en HD (datos obtenidos de Registros SEN y UNIPAR-CAPV). Una vez obtenidas estas probabilidades, se obtienen de forma inmediata las probabilidades de transición entre las dos modalidades de diálisis, que también se contrastaron con los datos existentes. Lo mismo en relación con la probabilidad de mantenerse en TX, mientras que las probabilidades de realizar transiciones desde este estado hacia HD y DP se obtuvieron a partir de los datos publicados por el informe UNIPAR, CAPV 2005-2008.
En los diferentes escenarios tenidos en cuenta, las probabilidades de transición permanecen fijas, con excepción de la probabilidad de muerte en HD, que varía de acuerdo con la proporción de pacientes incidentes programados en el sistema: la mortalidad de los pacientes incidentes no programados en HD es 2,6 veces superior a la de los pacientes incidentes programados. Esta probabilidad de muerte se define como una media ponderada de la probabilidad de muerte de incidentes y prevalentes en HD, estando la primera de ellas afectada por los cambios en la proporción de pacientes programados en HD.
Utilidades El concepto de utilidad trata de representar una medida del grado de preferencia que muestran las personas a propósito de un estado de salud específico, poniéndolo en relación a otros estados de salud distintos14. Normalmente se representan con valores numéricos, donde 0 representa el peor estado de salud o la muerte. Por el contrario, el valor 1 representa un estado de salud óptimo o perfecto. Las utilidades que aparecen en el estudio se calcularon a partir de una base de datos de BAP Health Outcomes (Proyecto FIS 96/1327) en la que se utilizó el cuestionario SF-3615. No se apreciaron diferencias significativas en la utilidad media entre HD y DP (p>0.05), mientras que la utilidad media en TX es significativamente superior respecto a las otras dos (p<0.05). Estos datos son similares a los ya encontrados en estudios anteriores16,17.
En cuanto a la posible diferencia de efectividad entre la diálisis peritoneal ambulatoria continua (DPCA) y la peritoneal automatizada (DPA), se ha seguido la revisión18, de tres ensayos clínicos con 139 pacientes, en el que no se encontraron diferencias significativas respecto a mortalidad, al riesgo de peritonitis, al cambio de modalidad original de DP o, por último, respecto a la función renal residual. Por ello no se ha diferenciado en efectividad entre las dos variantes de DP.
Cálculo de las medidas de efectividad y eficiencia. En cada ciclo, los AVGs se definen como la supervivencia total al final del ciclo sobre el total de incidentes y prevalentes que existían al inicio. Los AVACs se definen de la misma manera, pero ajustando los AVGs por la utilidad de cada estado. Un paciente puede obtener como máximo 1 AVG dentro de cada uno de los ciclos e igualmente, podría conseguir 1 AVAC si la terapia o el tratamiento que recibe además de mantenerlo vivo ese año, consigue que lo haga con una calidad de vida óptima.
En cuanto a las medidas de eficiencia, se ha tenido en cuenta el cálculo de las medidas de coste-efectividad medio de cada escenario (frontera de eficiencia), el cálculo del Beneficio Neto Sanitario (BNS): Incremento de efectividad ¿ (Incremento de costes / Umbral) >0, así como el cálculo del Ratio Coste-Efectividad Incremental (RCEI): Incremento de costes / Incremento de efectividad.
Otros parámetros El modelo permite limitar el número de trasplantes que se realizan por año, para reflejar la lista de espera que existe en esta intervención. Además, se puedo optar por incluir o no los costes indirectos en los resultados. Finalmente, es posible modificar la tasa de descuento utilizada.
RESULTADOS:
Describiremos los costes y las medidas de efectividad de cada una de las escenarios. En segundo lugar, los valores coste-efectividad medios a partir de los cuales se construye la frontera de eficiencia para analizar de forma comparativa las opciones evaluadas. Todo ello con un horizonte temporal de 15 años.
Costes Sin tener en cuenta los costes de la prediálisis por considerar que son comunes para las alternativas analizadas.
Costes directos Acceso vascular en hemodiálisis
Fístula arteriovenosa interna (FAVI) nativa radiocefálica
FAVI húmero-cefálica nativa
FAVI húmero-basílica
Prótesis de PTFE
Catéter venoso central tunelizado
En el caso de pacientes programados, el número medio de FAV por paciente es 1, el número medio de implantaciones de catéteres es 0,1 y el número de estancias en el hospital es 0,5 días. En los pacientes no programados, el número medio de FAV por paciente es 1,3, se considera una media de catéteres por paciente de 1,63 y un número total de estancias en el hospital por paciente de 710. Con estos parámetros y los datos obtenidos de la base de datos de costes sanitarios OBLIKUE (697,9¿ para una FAV y 901,47¿) para un catéter) y 337.13¿ de coste de estancia en el hospital, obtenemos un coste final por paciente y año de:
Pacientes programados: 956,61¿
Pacientes no programados: 4.736,59¿
Costes directos en diálisis peritoneal
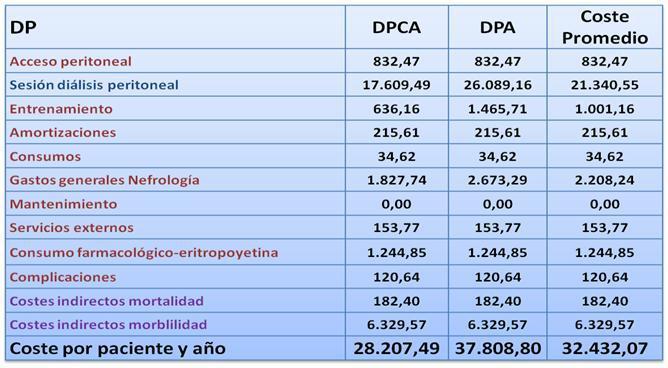
Implantación de un catéter peritoneal permanente: 832,47¿ por paciente y año4. Entrenamiento (DP) 143,02¿), considerando tanto la DPCA como la DPA, entrenamiento con o sin Ingreso4. El coste Incluye personal, material sanitario, fármacos y otros.
Se consideró una media de 7 sesiones de entrenamiento en una o dos semanas. De este modo, el coste por paciente y primer año en concepto de entrenamiento es de 1.001,14¿.
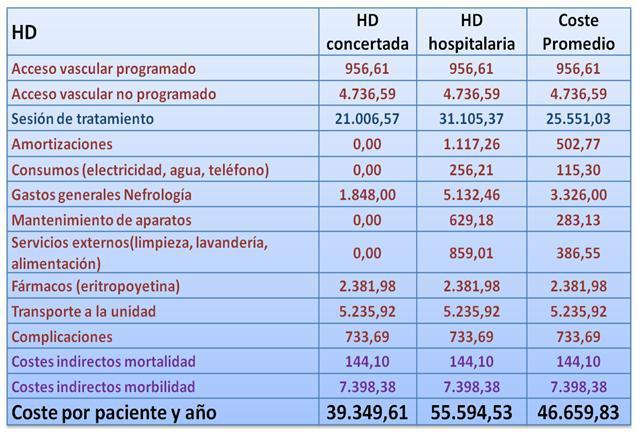
Sesión de hemodiálisis Nos basamos en OBLIKUE, donde aparecen diferentes tarifas procedentes de Boletines Oficiales de diversas Comunidades Autónomas. Se tuvieron en cuenta las tarifas referidas al coste de la sesión de HD concertada y así se calculó el coste de Sesión de Hemodiálisis concertada en 134,66¿/sesión.
El coste de la sesión de hemodiálisis hospitalaria, se basó en el recogido en OBLIKUE procedente de un estudio publicado en 2001, siendo el coste de la sesión 197,42¿.. valorando el problema de los pacientes con medidas de aislamiento por patología viral contagiosa, consideramos una diferencia del 20% en cuanto a necesidades de personal. De este modo, el coste de la sesión de HD hospitalaria en el caso de un paciente con HCV es de 209,03¿. Ponderando la prevalencia de estos paciente en HD obtenemos un coste medio por sesión de 199,39¿.. Para obtener el coste por paciente y año se hizo el cálculo en base a un esquema de tres sesiones semanales, que supone 156 sesiones al año. El coste obtenido es de 25.551,03¿.
Sesión de diálisis peritoneal También con OBLIKUE, recogiendo las tarifas de Boletines Oficiales de diferentes CCAA, obteniendo un coste medio de la sesión de diálisis peritoneal continua ambulatoria de 41,03¿ y de diálisis peritoneal automatizada de 64,25¿. Ponderando las prevalencias de cada modalidad (DPCA: 56%; DPA: 44%) se obtiene un coste medio de la sesión de DP de 51,24¿. Este coste no incluye la solución de bicarbonato y de poliglucosa que se detalla a continuación:
Suplemento por bicarbonato en domicilio del paciente, por día: 12¿ (BOPV, 2007)
Suplemento por solución de poliglucosa, por día: 6,04¿
Ponderando que un 40% de los pacientes en DP utilizan solución de poliglucosa y de bicarbonato (y que este uso va en aumento), el coste medio ponderado de una sesión de DP es de 58,46¿. La diálisis peritoneal tiene un régimen de tratamiento diario, por lo que el coste por paciente y año será 21.340,55¿.
Consumo farmacológico No hemos entrado a considerar las diferencias en consumo farmacológico de las modalidades de diálisis, debido a que en gran parte se deben a las diferentes prevalencias de comorbilidad. Únicamente lo consideramos para la medicación inmunosupresora del trasplante y para la Eritropoyetina.Recombinante Humana (EPO rhu) en HD y DP. En diversos estudios1,4 se describe que el porcentaje de pacientes que reciben tratamiento sustitutivo con EPO rhu es del 57 en HD y 39% en DP. A su vez, se requiere una mayor dosis de EPO rhu en pacientes en HD en comparación con los pacientes en DP19, concretamente, 119,40 unidades por kg y por semana en HD frente a 62,40 unidades por kg y por semana en DP20. A partir de los precios PVL y aplicando una rebaja del 30% habitual en los Hospitales públicos españoles, obtenemos un coste de la EPO de 2.381,98¿ en hemodiálisis y 1.244,85¿ en diálisis peritoneal (por paciente y año).
Complicaciones del acceso vascular:
Fistulografía y trombectomía quirórgica 1.991¿ (DOGA, 2005),
Con trombólisis mecánica o endovascular 2.405,76¿
Con trombólisis farmacomecánica 221,12¿
Tras la ponderación obtenemos un coste medio de las complicaciones del acceso de 1.539,53¿.
Los pacientes con FAV (81% de los pacientes en HD) sufren 0,25 trombosis al año, frente a 0,5 trombosis sufridas por los pacientes portadores de catéter (10%) y 0,5 sufridas por los pacientes con prótesis PTFE (9%) según la guía KDOQI.
De esta manera, el coste del tratamiento de la trombosis del acceso vascular estimado, por paciente y año, es de 458,01¿.
En la estenosis, el coste de la ATP, 3.966,68¿, se ha obtenido de OBLIKUE, mientras que el coste de la revisión quirúrgica se ha estimado en función de las estancia hospitalaria que requiere la técnica, concretamente, dos días de ingreso, asumiendo un coste de 337,13¿ por día. El 80% de los pacientes con estenosis son tratados con el primer método y el 20% restante se someten a revisión quirúrgica, así, el coste estimado del tratamiento en función de dicha distribución es de 275,68¿ por paciente y año.
En total, el coste anual estimado en concepto de complicaciones del acceso vascular, es de 733,69¿ por paciente.
Complicaciones del acceso peritoneal: La complicación más frecuentes en la diálisis peritoneal es la peritonitis. Su incidencia se establece en un episodio cada dos años4,21. Los costes incluyendo laboratorio, personal, material sanitario y fármacos4 son :
Peritonitis DPCA: 236,37¿
Peritonitis DPA: 247,53¿
Ponderando (DPCA: 56%; DPA: 44%) aunque sin considerar una diferente tasa de peritonitis en las dos modalidades, se calculó un coste medio ponderado de la peritonitis de 241,28¿. El coste por paciente y año estimado es de 120,64¿.
Amortizaciones, consumos, mantenimiento, servicios externos, y gastos generales: basándonos en los cálculos del Grupo de Costes de la SEN obtenemos:
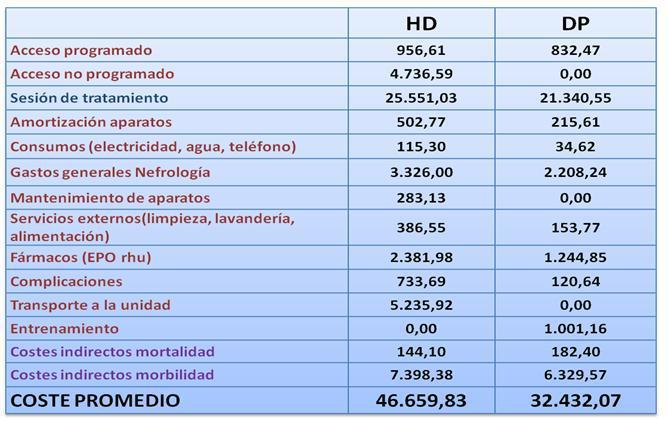
Amortizaciones: 502,76¿ en HD y 215,61 en DP
Mantenimiento: 283,13¿ en HD
Serv. Externos: 386,55¿ en HD y 153,77 en DP
Los Gastos Generales se detallan en la Tabla II:
La media ponderada de Gastos Generales en HD es de 3.326¿ y en DP 2.208¿.
Los consumos (teléfono, agua electricidad, etc.) se establecen en 115,29¿ para HD y 34,62¿ para DP (por paciente y año).
Transporte sanitario: Es un capítulo importante que varía en función del medio utilizado por los pacientes de hemodiálisis para acudir al hospital o al centro concertado. Se distinguió entre transporte urbano e interurbano y si se usaba una ambulancia, un taxi o un vehículo propio. Aunque es variable en las diferentes CCAA, se ha considerado que un 62,35% de los pacientes utilizan un taxi, un 23,65% acuden al hospital en ambulancia y un 14% en vehículo propio4,22.
Transporte urbano: taxi 5.686.982,89¿;
ambulancia 4.871.240,96¿
vehículo propio-446.206,56¿.
Transporte interurbano- taxi 58.197.099,00¿
ambulancia 32.040.731,78¿
vehículo propio- 4.528.434,973¿.
Coste medio por paciente y año en HD de 5.183,56¿
Trasplante: El coste recogido de OBLIKUE es 28.764,2¿. (MSC 2006). Para completar este coste se sumaron los reingresos, revisiones y medicación correspondientes al primer año del trasplante23 cuyo importe es de 10.733,27¿ y, los importes que perciben los centros hospitalarios, por cada acto de extracción de órganos y tejidos (7.638,86¿). De modo que el coste total de trasplante el primer año suma 47.136,33¿. Además de los costes cuantificados se producen otros derivados del mayor número de guardias localizadas del servicio de Nefrología debido a los trasplantes realizados, guardias de enfermería, etc., pero dichos importes no han sido tenidos en cuenta en la estimación de este coste debido a la imposibilidad de su cuantificación. En cuanto a los costes directos que conlleva el trasplante en los años sucesivos, se ha obtenido un coste agregado por paciente y año de 6.477,23¿. (OBLIKUE).
Costes indirectos Los estimamos mediante la Teoría del Capital Humano. Es el método de valoración económica más extendido y tradicional. Se contemplan la reducción de ganancias brutas de los pacientes en el futuro debido a la morbilidad o mortalidad producida por la enfermedad y se determinan a partir de los salarios de esa persona, de su probabilidad de supervivencia y de la tasa de descuento que se aplique. Obviamente existen problemas para la estimación de ciertas partidas (productividad doméstica perdida por los pacientes, tiempo de ocio perdido por cuidadores, etc), por lo que sólo se consideran aquellas cuya información es fiable:
Coste por la productividad laboral perdida a causa de la mortalidad.
Coste por la productividad laboral perdida a causa de la morbilidad.
La mortalidad prematura supone un coste derivado de la pérdida de productividad laboral de los fallecidos, por ello se calculan los Años Potenciales de Vida Laboral Perdidos (APVLP), considerando la jubilación a los 65 años.
Se consideró que el 27,6% de los pacientes en diálisis peritoneal siguen trabajando frente al 12,5% de pacientes en hemodiálisis (Unidad de Información de Pacientes Renales de la Comunidad Autónoma del País Vasco, 2006 a 2008) En el caso de los pacientes trasplantados, se asumió un 46%24.
Con estos datos analizados en función de edades medias de incidentes, mortalidad, etc, estimamos que el Coste de Productividad Laboral Perdida por Mortalidad Prematura es 144,10¿ en HD, 182,40¿ en DP y 72,84¿ en Trasplante (por paciente y año).
El Coste de Productividad Laboral Perdida por Morbilidad es muy superior, y lo estimamos en 7.398,38¿ en HD, 6.329,57¿ en DP y 4.955,57¿ en Trasplante (por paciente y año).
En resumen, los costes anuales por paciente asociados a las diferentes técnicas de Terapia Sustitutiva Renal se recogen en las tablas III, IV y V.
RESULTADOS EN SALUD:
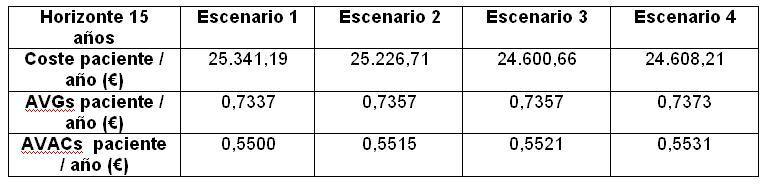
La correcta aplicación de las modificaciones asistenciales propuestas en los Escenarios 2, 3 y 4, implica una aumento de Calidad del Tratamiento, que aumenta la Supervivencia y por tanto el número de pacientes tratados en un horizonte de 15 años (Tabla VI). Lógicamente al haber más pacientes, aumenta el gasto asistencial, aunque el coste por paciente tratado sea inferior. En la Tabla VII se detallan los costes por paciente y año y las ganancias en Años de Vida brutos (AVG) y Ajustados por Calidad (AVAC).
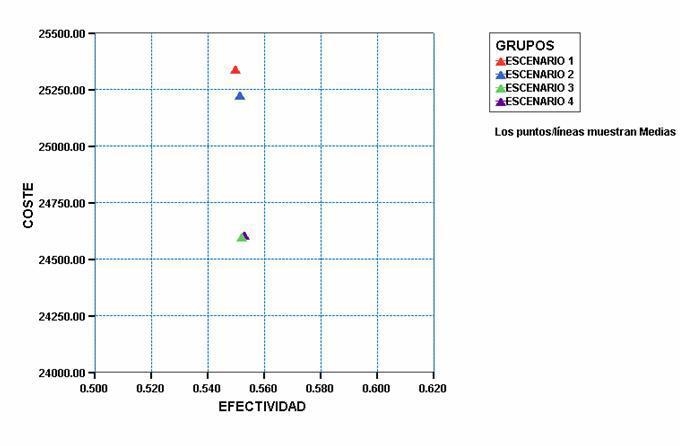
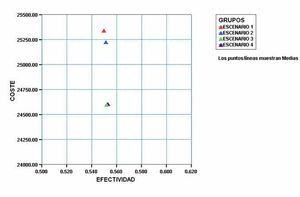
De una forma más gráfica (Figura 3) se puede apreciar que las modificaciones propuestas producen una reducción significativa de costes, sobre todo en los Escenarios 3 y 4, con un pequeño aunque significativo aumento de la efectividad del tratamiento expresada en AVACs.
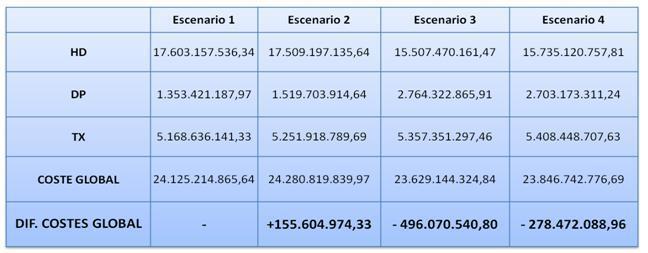
RESULTADOS EN AHORRO DE COSTES: El modelo estima para cada año, en un horizonte temporal de 15 años, el coste total de cada estado en cada escenario, así como el coste total (suma del coste de los tres estados). A partir de estas cifras, se obtuvo la diferencia de costes totales entre los diferentes escenarios planteados y la situación actual (Tablas VII, VIII y IX)
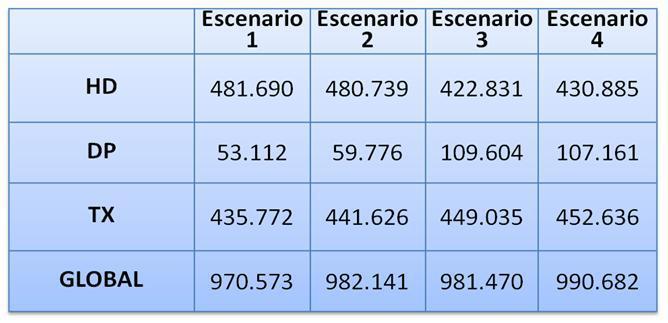
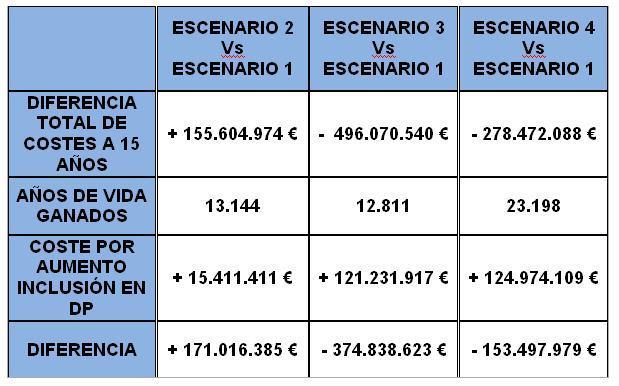
El aumento de pacientes incidentes programados produce per se un ahorro de 114,48¿ por paciente y año. El aumento de supervivencia derivado del comienzo programado de la diálisis produce lógicamente un mayor número de pacientes prevalentes y un mayor coste total. Por ello, en este escenario es en el único en que un aumento de Calidad Asistencial no supone un ahorro de Costes (aunque tampoco un gran incremento). El escenario 2 supondría, respecto del escenario 1, un coste añadido de 155.604.974,33¿ en un horizonte temporal de 15 años. En el escenario 3, la proporción de incidentes programados permanece constante en el conjunto de los estados, pero aumentamos la proporción de incidentes en DP y reducimos la incidencia de programados en HD, dejando la incidencia en TX constante. El coste en este escenario es de 24.600,66¿ estimado para un horizonte temporal de 15 años. Este escenario supone un ahorro de costes con respecto a la situación actual, de 496.070.540,80¿ en 15 años. Los Años de Vida Ganados en este escenario respecto al escenario 1, son 12.811 en dicho horizonte temporal.
El escenario 4: Es una combinación de los escenarios 2 y 3, al mismo tiempo, es decir, se aumenta la proporción de pacientes incidentes programados aumentando también la de incidentes en diálisis peritoneal. Al igual que en el caso anterior, aumenta la supervivencia pero el decremento del coste por paciente y año estimado en el escenario 4, esto es, 24.608,21¿, con respecto al que supondría la situación actual, compensa el coste derivado de un mayor número de pacientes e incluso supone un ahorro de 278.472.088,96¿. El incremento de la supervivencia en relación al primer escenario, en un horizonte temporal de 15 años, es de 23.198 Años de Vida Ganados.
INVERSIONES
Coste de consultas de enfermedad renal avanzada: Para lograr las mejoras de efectividad y ahorros de costes expresados en los Escenarios propuestos, lógicamente hace falta alguna inversión. Los costes de mejorar la a Consulta de ERA se calculan con una estimación de añadir 4 consultas de 2,5 horas semanales pmp y asumiendo un coste de 40¿/hora de prolongación de jornada (BOJA, 2006). Resultaría un coste anual de 858.412,11¿ para el conjunto del SNS español. Éste sería el coste de pagar al médico especialista en nefrología que ocuparía una consulta de nefrología en horario de tarde y al que se le pagaría en función de lo arriba descrito. El coste descontado correspondiente a 15 años, es 10.247.668,03¿
Costes del aumento de la inclusión de pacientes en Diálisis Peritoneal
No sería necesario un refuerzo de plantilla, sino un sistema de incentivos. Tomando como referencia (aunque parezca vergonzoso si se cuenta fuera de España) que la retribución del complemento de refuerzo de plantilla de facultativos especialistas es de 9¿/hora (Acuerdo de 23 de diciembre de 2004, del Consell de la Generalitat), hemos aplicado estos valores y los del párrafo anterior, por cada 20 pacientes de más tratados durante el año en esta técnica de TSR. Con estos datos hemos calculado los costes totales de la Inversión necesaria para lograr los resultados anteriores y lo resumimos en la Tabla IX.
Como se observa, el coste calculado puede ser perfectamente asumible con el ahorro de costes que supondría para la Administración algunas de los escenarios planteados en este análisis.
CONCLUSIONES A partir de los resultados presentados cabe destacar lo primero, que al ser el trasplante la técnica con mejor relación coste-efectividad, las Administraciones Sanitarias deberán seguir apoyando el programa de trasplante renal como lo hacen actualmente, garantizando que los profesionales tienen a su disposición todos los medios necesarios para su buen funcionamiento.
Respecto a las modalidades de diálisis, que es la forma de terapia para el 98.7% de los pacientes incidentes, y la modalidad definitiva para el 80% de la población renal incidente, se han propuesto modificaciones en el acceso y la distribución de las terapias en dos escenarios a 15 años: en el Escenario 2 se aumenta la proporción de pacientes incidentes programados respecto de los no programados (medida exigible por ser un parámetro de Calidad Asistencial). En el Escenario 3 se mantiene la proporción de pacientes incidentes programados, pero aumenta la proporción de incidentes en diálisis peritoneal. Y en el Escenario 4 se aumenta la proporción de pacientes incidentes programados aumentando también la de incidentes en diálisis peritoneal.
La puesta en marcha de las modificaciones propuestas, para cada escenario, en el proceso asistencial de la terapia sustitutiva de la IRCT, conduciría a un ahorro de costes considerando un horizonte de 15 años, de 496,07 y 278,47 millones de euros respectivamente para los escenarios 3 y 4. También se debe tener en cuenta que, dichos escenarios, producen un aumento relativo de la proporción de pacientes en DP frente a HD, y que la DP utiliza menos personal para tratar al mismo número de pacientes, luego, además de un ahorro de costes suponen una optimización de los recursos humanos dedicados a diálisis.
Respecto a la efectividad, cualquiera de los tres escenarios 2, 3 ó 4 proporcionan más Años de Vida Ganados (AVGs) y más Años de Vida Ajustados por Calidad (AVACs) que la alternativa de no realizar modificación alguna sobre lo actual (escenario 1), si bien estas ganancias son discretas. Concretamente, los Años de Vida Ganados en cada escenario respecto al escenario 1, en un horizonte temporal de 15 años, son 13.144, 12.811 y 23.198 en los escenarios 2, 3 y 4 respectivamente (incremento de la supervivencia total en relación al primer escenario).
Atendiendo a la relación coste-efectividad, poniendo en relación el incremento de los costes con el incremento de la efectividad, de cada escenario (2, 3 y 4) respecto del escenario de no hacer nada (escenario 1), se comprueba la mejor relación coste-efectividad de los escenario 3 y 4, que a similar efectividad son más eficientes que el 2. En refuerzo de lo anterior, incluso la peor situación simulada del escenario 4 (análisis de robustez del método) es más eficiente que la actual política sanitaria por lo que se plantea como un escenario con un pronóstico mucho más favorable que el actual.
El Beneficio Neto Sanitario para cada una de los escenarios (2, 3 y 4), tomando como umbral la disposición de la Administración a pagar la cifra de 30.000 ¿/AVAC, se ha cifrado en 0,0052 para la alternativa 2 vs 1; 0,0268 para la 3 vs 1 y 0,0275 para la 4 vs 1.
COMENTARIO FINAL: El propósito principal de este trabajo y sus propuestas no es el ahorro de costes. Somos ante todo médicos y lo que este trabajo propone es un aumento de Calidad Asistencial traducida en mejoría de la Supervivencia y de la Calidad de Vida de los pacientes. Si además podemos contribuir a la sostenibilidad del Sistema Sanitario, tanto mejor. Pero un principio fundamental en la Gestión es la reinversión parcial de lo ahorrado en mejorar las Inversiones de quien genera el ahorro. El actual modelo de Gestión Sanitaria basado en los Procesos Agudos (y quirúrgicos) y dirigido por la presión social y mediática de las Listas de Espera, se olvida a menudo a las terapias crónicas. Sin embargo es en lo Crónico en donde más fácilmente se puede mejorar la eficiencia. La familiarización de los médicos con los Costes derivados de su actividad es un elemento fundamental para plantear mejoras y reinversiones de un dinero que es de todos.
Figura 2.
Figura 3.
Tabla 1.
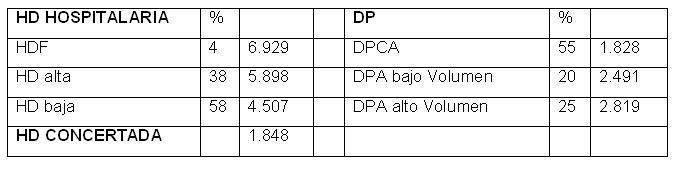
Tabla 2. Gastos Generales aplicables a HD y DP
Tabla 3. Gastos anuales en Pacientes en HD Concertada y Hospitalaria
Tabla 4. Gastos anuales en Pacientes en DPCA y DPA
Tabla 5. Costes anuales comparados en pacientes promedio en HD o DP
Tabla 6.
Tabla 7.
Tabla 8.
Tabla 9.