INTRODUCCIÓN
El citomegalovirus (CMV) es un virus ADN de la familia Herpesviridae. En la población general, la infección por CMV tiene una gran prevalencia que aumenta con la edad, infectándose hasta dos tercios de los individuos y persistiendo de forma latente en el organismo del huésped de forma indefinida. Mientras que en la población general esta infección se presenta de manera asintomática o mínimamente sintomática en forma de síndrome mononuclear, en la población de pacientes sometidos a trasplante renal la infección por CMV puede derivar en una gran variedad de manifestaciones clínicas y de afectación de diversos órganos que se asocian con una morbilidad y una mortalidad significativas. La administración de fármacos inmunosupresores para la prevención del rechazo inmunológico está directamente relacionada con el aumento del riesgo de enfermedad por CMV, concretamente con el uso de terapias de inducción y de derivados del ácido micofenólico1-3.
Las manifestaciones clínicas de la enfermedad por CMV son inespecíficas, por lo que se hace necesaria la utilización de técnicas microbiológicas más específicas para el diagnóstico. Sin embargo y aunque las técnicas para la detección del CMV han mejorado de forma sustancial en la última década, su interpretación se hace difícil, por lo que es preciso poner en contexto estas técnicas, la situación clínica del paciente y el tipo de muestra analizada. En este sentido, aunque el aislamiento del CMV podría parecer definitivo para el diagnóstico de un determinado cuadro clínico, éste podría estar causado por otros microorganismos. Por otro lado, la histología constituiría el diagnóstico definitivo, pero en la gran mayoría de los casos esto no es posible.
INFECCIÓN–ENFERMEDAD
Un aspecto importante a tener en consideración es la diferencia que existe entre infección y enfermedad por CMV.
Infección por citomegalovirus
Implica la detección del virus CMV en el organismo mediante cultivos, técnicas de biología molecular o la confirmación del contacto con el virus mediante técnicas serológicas (seropositividad a IgG).
Para el diagnóstico de infección reciente o primoinfección, es necesario la seroconversión con aparición de anticuerpos IgM anti-CMV, un incremento de cuatro veces o más del título de IgG preexistente o la detección del virus mediante cultivos o técnicas de biología molecular en pacientes previamente no infectados.
Hablamos de infección activa en aquellos pacientes con serología positiva IgG que presentan datos de replicación activa del virus detectada mediante cultivos o técnicas de biología molecular. En caso de serología positiva sin datos de replicación del virus, se trataría de una infección latente4,5 (Grado de recomendación: basado en consenso).
Enfermedad por citomegalovirus
Para su diagnóstico, precisa que se añada a la evidencia de infección por CMV la presencia de síntomas clínicos compatibles. Según los síntomas clínicos, podemos distinguir entre el síndrome viral-mononuclear y la enfermedad invasiva. El síndrome viral consiste en un cuadro febril inespecífico, acompañado con frecuencia de leucopenia. Cuando la enfermedad produce una afectación de uno o más órganos en forma de neumonitis, hepatitis, enterocolitis, encefalitis, coriorretinitis, etc., hablamos de enfermedad invasiva6-9 (Grado de recomendación: basado en consenso).
DIAGNÓSTICO PRETRASPLANTE
Se realiza mediante serología CMV IgG y constituye la base fundamental para estratificar el riesgo de infección y/o enfermedad y planificar las estrategias de prevención.
Mediante la determinación de IgG anti-CMV, clasificamos tanto a los donantes como a los receptores de un trasplante renal en seropositivos o seronegativos.
Un aspecto importante a tener en cuenta es la necesidad de confirmar la seronegatividad del receptor en el momento del trasplante, ante la posibilidad de su seroconversión desde la última determinación de anticuerpos previa al trasplante8 (Grado de recomendación: basado en consenso).
DIAGNÓSTICO POSTRASPLANTE
Cultivos
Mediante el cultivo en fibroblastos humanos, el CMV puede ser aislado a partir de muestras de distintos orígenes, como sangre, orina, líquido cefalorraquídeo, lavados bronquiales o biopsias de tejidos. Sin embargo, el tiempo prolongado que se necesita para el crecimiento en el medio de cultivo que, dependiendo de los casos, puede llegar a ser de hasta 6 semanas, impide que se utilice en la práctica clínica habitual.
La detección del antígeno temprano del CMV en medios de cultivo (cultivos de Shell-vial), utilizando anticuerpos monoclonales dirigidos contra este antígeno en muestras de sangre, orina, etc., indica replicación «temprana» del virus en las células. Los resultados de esta técnica habitualmente, se obtienen en un plazo de 2 a 3 días. Actualmente, esta técnica ha sido desplazada por los nuevos métodos diagnósticos disponibles10.
Serología para citomegalovirus (IgM/IgG)
En la actualidad, no se considera de utilidad clínica la utilización de la serología para el diagnóstico de la enfermedad por CMV en el postrasplante renal11,12 (Grado de recomendación: basado en consenso).
Antígeno pp65 de citomegalovirus
La técnica conocida como antigenemia de CMV consiste en la detección de la proteína pp65 en leucocitos polimorfonucleares neutrófilos de sangre periférica, mediante anticuerpos monoclonales dirigidos contra este antígeno. La sensibilidad y la especificidad de esta técnica para el diagnóstico de infección por CMV es alta y tiene una buena correlación con la viremia12-16.
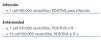
La mayor limitación de la técnica es la falta de criterios estándar para la interpretación de un mismo resultado entre laboratorios, al depender de un observador experimentado para su interpretación. Otros inconvenientes son la necesidad de un tiempo corto para el procesamiento de la muestra, y ser una técnica manual y laboriosa. Por el contrario, es un método diagnóstico de bajo coste económico en relación con las técnicas de biología molecular, como la reacción en cadena de la polimerasa (PCR). Esta técnica no es interpretable en el caso de presentar el paciente una neutropenia de menos de 1000 n/ucl11,14. Aunque no existe un consenso extendido, es más importante la tendencia de la antigenemia que un punto de corte concreto. Por otro lado, los criterios de positividad son distintos para la infección que para la sospecha de enfermedad por CMV. El resultado se expresa en número de neutrófilos positivos para el Ag pp65 de cada 100.000. Para el diagnóstico de infección, un Ag pp65 CMV > 1 cel/100.000 neutrófilos es significativo. Para la enfermedad por CMV, el punto de corte varía según la serología del paciente; si el paciente es seronegativo, el diagnóstico de enfermedad se haría si el Ag pp65 es >_ 1 cel/100.000 neutrófilos. En el caso de ser seropositivo, el diagnóstico de enfermedad se realizaría con Ag pp65 > 10 cel/100.000 neutrófilos (tabla 1).
La aplicación de esta técnica tiene fundamentalmente tres utilidades. La primera, tal como se ha mencionado previamente, es el diagnóstico de infección-enfermedad. La segunda es el tratamiento anticipado como criterio para empezar el tratamiento. Y terce-ra, para monitorizar la respuesta al tratamiento ya instaurado11,17-19 (Grado de recomendación: débil).
Carga viral-Reacción en cadena de la polimerasa-Citomegalovirus
Actualmente, la PCR constituye la técnica de elección en el diagnóstico de la infección por CMV, al ser una técnica más sensible que la antigenemia. Sin embargo, existe una dificultad a la hora de definir la negatividad de la PCR e instaurar por tanto los puntos de corte para establecer el diagnóstico, al poderse detectar ADN viral en pacientes sin enfermedad activa12,20-25.
En general, podemos decir que se trata de una técnica objetiva y rápida, aunque el equipo necesario tiene un alto coste.
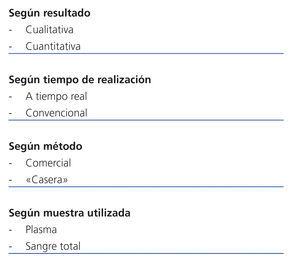
Las técnicas de PCR las podemos dividir en cualitativas o cuantitativas, y en comerciales automatizadas o «caseras». Además, dependiendo de si la reacción en cadena se detecta de forma inmediata o tras 12-24 horas, la PCR es «tiempo real» o convencional, respectivamente (tabla 2). La muestra utilizada puede ser sangre total que ofrece una mayor sensibilidad y proporciona un reflejo más real de la infección-enfermedad por CMV o plasma, que tiene como ventajas una más fácil realización de la técnica y una mayor automatización. Existen diversas técnicas comerciales automatizadas, como el COBAS® AMPLICOR, LightCycler® (Roche Diagnostics, Indianapolis, IN), el sistema de captura híbrida (Digene Corporation, Gaithersburg, MD) o el Abbott RealTime CMV assay (Abbott Laboratories, Abbott Park, Illinois), para la realización de la PCR cuantitativa. Sin embargo, con frecuencia se realizan diversas técnicas no comerciales o «caseras» en el laboratorio de microbiología, lo que implica que las cargas virales entre los distintos ensayos nos sean comparables por las diferencias en el diseño de la técnica. Las ventajas respecto a las técnicas comerciales son un menor riesgo de contaminación o una mayor rapidez en la obtención del resultado. Bien sea una técnica comercial o «casera», se recomienda que la PCR sea cuantitativa a tiempo real25,26.
Cualquier valor positivo de PCR de CMV se considera indicativo de infección. Aunque cualquier grado de positividad debe poner en alerta sobre el desarrollo de enfermedad, se sugieren como resultados sospechosos de enfermedad > 500 copias en plasma en receptores de trasplante renal seronegativos (R-) y > 1000 en plasma en seropositivos (R+). Sin embargo, la cinética de replicación viral es más importante que un valor único y aislado de carga viral. Para comparar los resultados de carga viral en sangre total respecto a plasma, es necesario conocer la equivalencia (10 veces más en sangre respecto al plasma); 500 cp/ml en plasma equivalen a 5000 cp/ml en sangre total27,28 (tabla 3) (Grado de recomendación: débil).
La utilidad de estas técnicas es, por un lado, el diagnóstico de la infección por CMV (siendo de elección frente a la antigenemia) y, por otro, la monitorización en la terapia anticipada19,29-31 (Grado de recomendación: fuerte).
Puede utilizarse en la monitorización del tratamiento, pero existe una dificultad en el momento de definir la negatividad de la PCR, sugiriéndose suspender el tratamiento con < 500 cp/ml31 (tabla 3) (Grado de recomendación: débil).
La propuesta de cronograma de monitorización sería:
1. Terapia anticipada: -Quincenal hasta el tercer mes. -Mensual hasta el 6.º mes. -Posteriormente individualizada.
2. Profilaxis primaria.
3. Postratamiento. (Grado de recomendación: basado en consenso).
pp67-ácido ribonucleico mensajero
La proteína pp67 es una proteína del CMV que indica una replicación viral activa. La técnica NucliSENS® (bioMérieux) es una técnica de amplificación de ácidos nucleicos (NASBA) que detecta el ácido ribonucleico mensajero que codifica la proteína pp67. Se trata de una técnica cualitativa, menos sensible que las técnicas de PCR de ADN y no se recomienda en el trasplante de órganos sólidos11,32.
Genotipo gB
Mediante esta técnica se analiza el genotipo del gen que codifica la glucoproteína (gB) de la envuelta del virus. Existen cuatro tipos: genotipo gB 1 a 4. El más frecuente es el genotipo gB2. Aunque pueden existir otras cepas por coinfección a lo largo del tiempo, no parece tener relevancia ni relación con la clínica33.
Enfermedad invasiva
En casos de antigenemia negativa o falta de respuesta al tratamiento empírico para el diagnóstico definitivo de enfermedad invasiva, puede ser necesario la realización de otras pruebas o biopsias que incluyen la identificación de cuerpos de inclusión, antígeno viral o ADN viral por inmunohistoquímica o PCR. Esta circunstancia acontece con relativa frecuencia en los casos de enfermedad invasiva del tracto digestivo11,26 (Grado de recomendación: débil).
TEST DE SENSIBILIDAD ANTIVIRAL
Técnicas fenotípicas
Determinan la concentración de antiviral que inhibe la replicación del virus. Se trata de un proceso lento que precisa de unas cuatro semanas para la obtención de los resultados. Existen tres técnicas: la reducción de placa, la inhibición de síntesis proteica y la
citometría de flujo14,26 (Grado de recomendación: basado en consenso).
Técnicas genotípicas
Detectan mutaciones en los genes UL54 y UL97 del CMV, aunque no existe una clara correlación con las técnicas fenotípicas.
El gen UL97 es esencial para la fosforilación del ganciclovir a su forma activa. El gen UL54 es la diana de acción de los fármacos antivirales. Una mutación a este nivel puede conferir una resistencia al ganciclovir, al foscarnet y al cidofovir. La mayoría de las mutaciones de estos genes se encuentran asociadas.
Se recomienda el estudio de estas mutaciones en los casos de no respuesta al tratamiento14,26 (Grado de recomendación: basado en consenso).
CONCEPTOS CLAVE
1. En la enfermedad por CMV, a los datos de infección viral se debe añadir la existencia de síntomas clínicos compatibles.
2. La indicación de las técnicas serológicas de CMV en trasplante renal es la clasificación de los donantes y receptores en seronegativos o seropositivos, y no en el diagnóstico de infección activa o enfermedad por CMV.
3. La antigenemia de CMV (pp65), aunque de utilidad en el diagnóstico de infección activa, en el tratamiento anticipado y en la monitorización del tratamiento, tiende a ser relegada a favor de las técnicas de biología molecular (PCR).
4. En la actualidad, la técnica de elección para el diagnóstico de la infección por CMV es la PCR cuantitativa a tiempo real.
5. Tanto para la técnica de antigenemia como para la PCR cuantitativa, es más importante la tendencia en el tiempo que una determinación aislada.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Tabla 1. Interpretación de la antigenemia (Ag pp65) como predictor de infección o enfermedad por citomegalovirus en trasplante Renal
Tabla 2. Tipos de técnicas de la reacción en cadena de la polimerasa
Tabla 3. Interpretación de la carga viral como predictor de enfermedad por citomegalovirus en trasplante renal