El déficit de vitamina D se asocia a distintas patologías, siendo especialmente significativa con la morbimortalidad en pacientes con enfermedad renal crónica (ERC). La pérdida progresiva de la función renal conduce a una reducción de calcitriol y alteración de la homeostasis de calcio, fósforo, FGF-23 y PTH, entre otros, los cuales influyen a su vez sobre la activación del receptor de vitamina D (RVD) y el desarrollo de hiperparatiroidismo secundario (HPS). El RVD media las acciones biológicas tanto de la vitamina D como de sus análogos sintéticos, actuando sobre distintos genes; existe una estrecha asociación entre niveles bajos de calcitriol y la prevalencia del HPS. Así, la activación de los RVD y la restricción de fósforo, entre otros, desempeñan un papel importante en el tratamiento de la «alteración óseo-mineral asociada a la ERC». La Sociedad Española de Nefrología, dada la uniforme e importante asociación con mortalidad y niveles altos de fósforo, aconseja su normalización, así como la de los niveles de calcidiol. Igualmente considera que, aparte de la utilización de activadores selectivos/no selectivos de RVD para la prevención y tratamiento del HPS, se podría asegurar la activación de los RVD en pacientes en diálisis, con vitamina D nativa o incluso bajas dosis de paricalcitol, independientemente de la PTH, dado que algunos estudios de cohortes y un metaanálisis reciente han observado una asociación entre el tratamiento con vitamina D activa y la disminución de la mortalidad en pacientes con ERC. En general, se considera que es razonable utilizar toda esta información para individualizar la toma de decisiones.
Vitamin D deficiency has been linked to many different pathologies, especially with morbimortality in patients with chronic kidney disease. The progressive loss of renal function leads to calcitriol deficiency and homeostatic changes in calcium, phosphorus, FGF-23 and PTH, among others. All these changes can also influence vitamin D receptor (VDR) activation and the development of secondary hyperparathyroidism (SHPT). The biologic actions of both vitamin D and its synthetic analogues are mediated by binding to the same VDR, acting on different genes. There is a narrow relationship between low levels of calcitriol and SHPT. The combined approach of VDR activation and phosphate restriction, among others, plays an important role in the early treatment of the chronic kidney disease-mineral and bone disorder (CKD-MBD). The Spanish Society of Nephrology, in order to reduce the uniform and significant association with CKD-associated mortality, calcidiol and high phosphate levels suggests normalization of phosphate as well as calcidiol levels in both CKD and dialysis patients. Moreover, it considers that, in addition to selective/non selective activation of VDR for the prevention and treatment of SHPT, VDR could be activated in dialysis patients by native vitamin D or even low paricalcitol doses, independently of PTH levels, as some cohort studies and a recent metaanalysis have found an association between treatment with active vitamin D and decreased mortality in patients with CKD. In general it is considered reasonable to use all this information to individualise decision making.
INTRODUCCIÓN
El presente trabajo ha sido el resultado de una reunión de consenso llevada a cabo por especialistas españoles sobre los efectos del paricalcitol sobre el metabolismo óseo-mineral, encontrándose en proceso un segundo documento centrado en sus efectos pleiotrópicos.
El déficit de vitamina D se ha asociado a distintas patologías, como la hipertensión, la diabetes, el cáncer o la insuficiencia cardíaca en la población general, pero es especialmente significativa y homogénea su asociación con la morbimortalidad de los pacientes con enfermedad renal crónica (ERC). La comprensión del papel que desempeña el receptor de la vitamina D (RVD) y los efectos de su activación ha cambiado drásticamente en los últimos años. Así, varios estudios han analizado los efectos diferenciales entre distintos activadores (agonistas) de los RVD, el nuevo concepto de activación selectiva de este y se ha ampliado el espectro de la vitamina D a sus efectos pleiotrópicos extraesqueléticos y a su participación en el llamado síndrome cardiorrenal1-4.
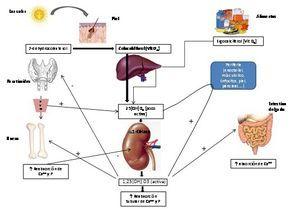
En la vía metabólica de la vitamina D intervienen diferentes factores que van desde la incorporación de la vitamina D al organismo hasta su llegada a los órganos implicados en la homeostasis del calcio y el fósforo, así como los mecanismos por los que se produce la activación del RVD en estos órganos (figura 1)5,6.
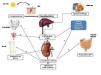
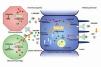
La vitamina D es más una hormona que una vitamina esencial, en el sentido de que no necesariamente procede de fuentes exógenas (alimentos), sino que puede ser producida a partir de la exposición cutánea a la radiación solar ultravioleta B. Como hormona, se desplaza por el sistema circulatorio a órganos o células distantes para coordinar su fisiología y comportamiento, estando clásicamente adscrita a la regulación del metabolismo del calcio, promoviendo el crecimiento y remodelado adecuado del hueso. Sin embargo, ahora se sabe que además tiene efectos autocrinos o paracrinos en otros tejidos extrarrenales como la piel, la próstata, los ganglios linfáticos, el intestino, la mama, el páncreas, la médula espinal, el cerebro o la placenta, o el sistema circulatorio, entre otros, en los que hay actividad de la enzima 1α-hidroxilasa (necesaria para la producción local de calcitriol) o en los que también existen RVD (figura 2)6. Los RVD son ubicuos y muy abundantes en los órganos que participan en el metabolismo del calcio, tales como: el intestino, aumentando la absorción de calcio y fósforo; el riñón, que regula la reabsorción de calcio y fósforo, así como la síntesis de calcitriol (1,25 (OH)2-vitamina D3 o 1,25D) a través de la hormona paratiroidea (PTH) y el complejo factor de crecimiento fibroblástico 23 (FGF-23)/Klotho; el hueso, en el que la vitamina D interviene tanto en la regulación del recambio óseo como especialmente en su mineralización adecuada; y las glándulas paratiroides, sobre las que actúa inhibiendo la síntesis y la secreción de PTH. Todas las acciones biológicas, tanto de la vitamina D como de sus análogos sintéticos, son mediadas por su unión al RVD. En los distintos tejidos, la vitamina D y algunos de sus metabolitos pueden actuar en casos de enfermedad o lesión, así como también como mecanismo regulador7. Los otros efectos de los ligandos del RVD, no relacionados con el metabolismo del calcio, son múltiples, siendo los más destacados sus efectos antiproliferativos, inductores de la diferenciación e inmunomoduladores. De hecho, ya existen fármacos agonistas del RVD que se utilizan para el tratamiento de la psoriasis (calcipotriol, tacalcitol) con escasa absorción sistémica y se han sugerido aplicaciones de ligandos para el tratamiento de procesos inflamatorios (artritis reumatoide, artritis psoriásica), dermatológicos (además de la psoriasis, para el fotoenvejecimiento), osteoporosis, cáncer de mama o de próstata y desórdenes autoinmunes8.
En el contexto de la ERC, la pérdida progresiva de la función renal conduce a la reducción de calcitriol y una homeostasis alterada de calcio, fósforo, PTH, FGF-23 y megalina, entre otros, y que a su vez influyen por distintas interacciones sobre la activación de los RVD, ya sea de modo directo o indirecto. Cuando desciende el filtrado glomerular (FG), los niveles bajos de calcitriol pueden detectarse antes que la elevación de la PTH, por lo que, junto a la restricción de fósforo, parece importante activar los RVD de forma temprana en estos pacientes siempre que no altere de modo significativo el control del fósforo9. El 49 % de los pacientes de un estudio transversal de una cohorte ambulatoria que se llevó a cabo en 153 centros y 1814 personas presentaron niveles bajos de calcitriol y altos de PTH, independientemente de los niveles de su precursor el calcidiol (25 (OH)-vitamina D)9. En este trabajo también se confirmó, como es bien conocido, la estrecha asociación entre niveles bajos de calcitriol y prevalencia del hiperparatiroidismo secundario (HPS), de modo que el HPS estuvo presente en este estudio en el 56 % de los pacientes que presentaban un FG10 < 60 ml/min/1,73 m2. Sin embargo, es necesario también tener en cuenta que ahora es bien conocido que antes de los descensos en los niveles de calcitriol se observa un aumento de FGF-23, fosfatonina también responsable de la disminución de la actividad 1-α-hidroxilasa y aumento de la actividad de la 24-hidroxilasa, por lo que es importante prevenir en fases tempranas de la ERC la retención de fósforo (aún sin hiperfosfatemia)11,12. Por otra parte, la disminución del cofactor Klotho es otro fenómeno precoz de la ERC y del complejo CKD-MBD (Chronic Kidney Disease-Mineral and Bone Disorder)13 y parece que la activación de los RVD podría resultar potencialmente beneficiosa al aumentar su expresión, como ha sido demostrado en dos modelos experimentales14,15.
Actualmente todas las guías internacionales sugieren la medición de los niveles de calcidiol o 25-OH vitamina D (que no de calcitriol) en los pacientes con ERC. Los niveles de calcidiol suponen la expresión bioquímica de una adecuada exposición y almacenamiento de vitamina D y se ha visto que es muy prevalente (> 80 %) la presencia de insuficiencia o deficiencia de vitamina D en esta población. Asimismo, se ha observado una estrecha asociación entre niveles bajos de calcidiol plasmático (precursor del calcitriol) y morbimortalidad cardiovascular, tanto en la ERC como en la población general. El calcidiol plasmático es de 100 a 1000 veces menos potente que el calcitriol, pero sus concentraciones plasmáticas son un orden magnitud superior (ng/ml frente a pg/ml)6. Sin embargo, es de destacar que, si bien la suplementación con vitamina D nativa (D3 o colecalciferol, D2 o ergocalciferol) puede disminuir los niveles de PTH16, esta observación no es uniforme en pacientes con ERC17. En España es ampliamente utilizado también directamente el calcidiol oral (calcifediol o Hidroferol®), aunque se debe ser cuidadoso en su uso dada su actividad y su prolongada vida media6. Es importante tener en cuenta que estos derivados sirven para suplementar o corregir la deficiencia de vitamina D (normalizar los niveles de calcidiol), pero la restitución de los niveles de calcidiol no suele ser suficiente para la corrección del HPS del paciente renal. Además, su eficacia no es solo muy inferior a la vitamina D activa (calcitriol, paricalcitol) o los calcimiméticos para reducir el HPS en pacientes con ERC, sino que hasta ahora solo se ha demostrado asociación entre suplementación con vitamina D nativa y beneficios pleiotrópicos sistémicos subrrogados de enfermedad cardiovascular en una publicación18, pero nunca, ni siquiera en análisis epidemiológicos retrospectivos de cohortes, sobre supervivencia global o cardiovascular, a diferencia de las formas activas de la vitamina D19-21. Por último, aunque solo en modelos experimentales22, cabe mencionar que terapias combinadas de vitamina D activa (por ejemplo, paricalcitol) y calcidiol parece que podrían aumentar los beneficios de la activación de los RVD. No obstante, en la clínica se desconoce el balance apropiado entre estos compuestos para maximizar los efectos de la activación y el balance sobre las vías de degradación (24-hidroxilasa), mucho menos conocidas y estudiadas.
Con todas estas consideraciones, y más allá del HPS y la osteodistrofia renal, la activación de los RVD junto a la restricción de fósforo, entre otros, parecen desempeñar un papel importante en el tratamiento de la «alteración óseo-mineral asociada a la ERC», correspondiente al acrónimo inglés cada vez más utilizado de CKD-MBD9,23,24. El complejo CKD-MBD da un carácter sistémico a dichas perturbaciones que, además, aparecen de forma precoz en el curso de la ERC25,26. Entre los efectos sistémicos de la activación de los RVD destacan sus beneficios sobre el árbol cardiovascular y su estrecha asociación con la disminución de la morbimortalidad, así como incluso sus potenciales acciones sobre la progresión de la ERC (tabla 1)1,4,8,20,27.
ACTIVADORES NO SELECTIVOS Y SELECTIVOS DE LOS RECEPTORES DE LA VITAMINA D
Existen distintos tipos de vitamina D y, así, en la tabla 2 vemos una clasificación de la nomenclatura utilizada para sus distintos tipos y los activadores de los RVD según la Kidney Disease: Improving Global Outcomes (KDIGO) y adaptada de otras publicaciones28.
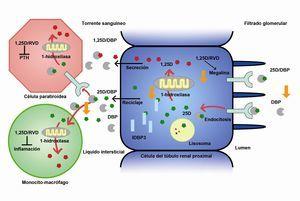
El RVD es un miembro de una superfamilia de receptores nucleares que actúa como un factor de transcripción ligando-dependiente de numerosos genes relacionados con la síntesis y secreción de PTH y otras proteínas relacionadas con el metabolismo mineral, el crecimiento celular y la diferenciación celular. Un activador del receptor de la vitamina D (ARVD) se une al RVD, transpone al núcleo donde se heterodimeriza con el receptor retinoide (RXR). El complejo resultante se une al elemento de respuesta de la vitamina D (VDRE, acrónimo inglés de vitamin D responsive element) en la región promotora de los genes (ADN) diana, reclutando factores de transcripción y moléculas co-reguladoras (activadoras o inhibidoras de la transcripción), adquiriendo la posibilidad de actuar sobre los múltiples genes diana de la vitamina D. Por ejemplo, la unión del complejo RVD/RXR a un VDRE negativo en el promotor del gen de la PTH suprime la transcripción de esta (figura 2)6,29. Existen diferentes ARVD: además de la forma natural calcitriol, hay distintos análogos sintéticos de la vitamina D2 y D3 con indicación para regulación del metabolismo fosfo-cálcico, como el alfacalcidiol, el doxercalciferol, el falecalcitriol, el maxacalcitol y el paricalcitol. El calcitriol es la vitamina D activa natural propiamente dicha, siendo aproximadamente 500-1000 veces más activo que su precursor 25-hidroxicolecalcifero6,29. Paricalcitol y maxacalcitol son considerados como activadores selectivos del RVD (AsRVD).27,28
En cuanto a la diferencia entre los análogos y sobre sus efectos a nivel de los diferentes órganos diana, la distinción está relacionada con, entre otros factores, la afinidad a la proteína circulante unida a la vitamina D (DBP, acrónimo inglés de vitamin D binding protein). Por ejemplo, se ha demostrado que el maxacalcitol es de unas 600 veces menos afín a la DBP que el calcitriol30; por ello, su vida media es más corta y se depura más rápidamente de la circulación. Además, la DBP disminuye el acceso del análogo a los tejidos diana y, por ello, ayuda a evitar una potencial intoxicación. Normalmente, la vitamina D es degradada por la 24-hidroxilasa (que es inducida también por el FGF-23), hidroxilando el carbono 24 de las cadenas laterales e induciendo su inactivación biológica. Los análogos de la vitamina D, al unirse al RVD en los tejidos, pueden permanecer más tiempo en estos, comprometiendo así el metabolismo de la vitamina D. También se ha demostrado que los análogos tienen menor afinidad al RVD que el calcitriol31, pero la regulación diferencial de la 24-hidroxilasa en los tejidos diana condiciona su vida media32.
Por otra parte, los AsRVD interaccionan de modo diferencial con los mencionados cofactores (coactivadores y/o correpresores) y, basándose en las diferencias conformacionales producidas entre estas moléculas, se puede modificar la expresión génica cuando este heterodímero RVD/RXR se une al VDRE de la región promotora del ADN específico, dando lugar a efectos selectivos de la transcripción de ADN en diferentes células y tejidos. El calcitriol muestra una afinidad por el RVD diez veces superior al AsRVD paricalcitol27,31. No obstante, esta diferencia no es uniforme para todos los tejidos corporales, siendo relativa fundamentalmente a los tejidos intestinal y óseo, ya que la afinidad de paricalcitol por el RVD de las glándulas paratiroideas es 3-4 veces inferior a la de calcitriol. Paricalcitol es menos activo que calcitriol en la inducción de la homodimerización (RVD:VD) y la heterodimerización RVD: coactivador 3 asociado al receptor (RAC3), y más activo que calcitriol en la inducción de la heterodimerización RVD:RXR y RVD: proteína 1 interaccionante con los receptores de glucocorticoides (GRIP1)33.
El interés en la síntesis farmacológica de AsRVD como el paricalcitol y maxacalcitol aparece como consecuencia de la necesidad clínica de ampliar la ventana terapéutica de las formas clásicas de la vitamina D e intentar disminuir el riesgo de hipercalcemia e hiperfosfatemia asociado al uso de los derivados no selectivos calcitriol o alfacalcidol. Los AsRVD permiten inhibir la síntesis y la secreción de la PTH de un modo más eficiente y con un menor impacto sobre la absorción intestinal del calcio y el fósforo. Debido a esto, se les atribuye un menor riesgo de hipercalcemia, hiperfosfatemia y niveles del producto calcio-fósforo elevados, evitándose así posibles efectos derivados de las altas concentraciones de estos metabolitos en sangre, entre los cuales podría encontrarse la deposición pasiva extraesquelética de calcio y fósforo en forma de calcificaciones vasculares o valvulares. Es más, a tales efectos se han observado efectos selectivos de los
AsRVD también sobre la expresión génica en varios tipos de células y tejidos, entre ellos, la expresión de moléculas involucradas en el proceso de calcificación vascular. Utilizando la tecnología de microarrays de ADN para evaluar los perfiles de expresión génica en las células del músculo liso vascular incubadas con calcitriol o paricalcitol, se ha observado que, aunque gran parte del perfil de expresión fue similar, paricalcitol activa y desactiva genes diferentes de calcitriol. Esto no se explica por diferencias de dosis. De este modo, en un modelo experimental de calcificación vascular activa se ha observado que el paricalcitol, a diferencia del calcitriol, no aumenta la expresión del factor de transcripción Cbfα1 (RunX2) que activa una de las vías de señalización para la transformación de las células musculares lisas en células de estirpe ósea34. Asimismo, estas observaciones se han ampliado in vitro, demostrándose que paricalcitol previene la activación de la vía Wnt/β-catenina inducida por fósforo y también reduce la calcificación infrarregulando la expresión de BMP2 y otros marcadores de fenotipo osteoblástico, junto con los niveles de β-catenina y sus genes diana35,36.
En otros estudios con microarrays en células de carcinoma de colon, calcitriol y paricalcitol exhiben diferentes perfiles
de regulación génica en diferentes dosis. Aunque las diferentes dosis de AsRVD pueden haber estado involucradas en tales casos, la expresión génica diferencial sugiere que los efectos diferenciales de los AsRVD pueden, en parte, constituir la base para la selectividad de los AsRVD6,29.
En modelo de ratas nefrectomizadas 5/6, cuando se compara paricalcitol con el calcitriol, su efecto, a igualdad de dosis, es entre tres y cuatro veces menor sobre los niveles de PTH y diez veces menor sobre los niveles de calcio y fósforo, lo que le confiere un mayor margen terapéutico en la prevención y el tratamiento del HPS en etapas precoces de la ERC, así como en pacientes en hemodiálisis, y con un potencial menor impacto sobre la calcificación vascular35-38. Además, si bien no hay datos de esta última acción en humanos, Malluche et al.39 afirman a partir de datos experimentales que los análogos de la vitamina D paricalcitol y maxacalcitol podrían controlar los niveles de PTH con una menor supresión del remodelado óseo que el inducido por calcimiméticos.
Finalmente, los AsRVD como el paricalcitol han demostrado ser más eficaces que la vitamina D2 nativa (ergocalciferol) en disminuir los niveles de PTH en pacientes con ERC en estadios 3 o 4 con deficiencia de vitamina D e HPS17. Aunque se han demostrado estrechas asociaciones de los niveles plasmáticos de calcidiol con morbimortalidad general y cardiovascular tanto en la población general como en pacientes con ERC y/o diálisis, así como la existencia de algunos efectos pleiotrópicos en pacientes en hemodiálisis con el uso de colecalciferol18, como se ha mencionado antes, todavía no existe ningún análisis que muestre asociación entre el uso de vitamina D nativa (suplementos) con mejoría de la supervivencia.
ESTUDIOS COMPARATIVOS ENTRE ACTIVADORES SELECTIVOS Y NO SELECTIVOS DEL RECEPTOR DE LA VITAMINA D Y CAMBIOS DE NO SELECTIVOS A SELECTIVOS
Como se ha mencionado con anterioridad, el principal objetivo del desarrollo de AsRVD es disminuir el exceso de PTH y prevenir la hiperplasia de la glándula paratiroidea manteniendo los efectos beneficiosos de la vitamina D y minimizando los efectos indeseables sobre los niveles séricos de calcio y fósforo, así como la potencial inducción de calcificación vascular, sobre todo en presencia de niveles elevados de fósforo. De este modo, en las guías KDIGO 200940 y especialmente en las actuales guías de la Sociedad Española de Nefrología 2011 se considera que es razonable valorar la presencia/ausencia de calcificación vascular para dirigir la terapia del complejo CKD-MBD, debido a su estrecha asociación con mortalidad41.
En la tabla 342-54 se muestran los diferentes estudios comparativos existentes entre los AsRVD, el placebo y/o otras alternativas terapéuticas.
En un reciente análisis aleatorizado, prospectivo y originalmente de diseño cruzado, se comparó alfacalcidol con paricalcitol intravenoso en 80 pacientes en hemodiálisis55 durante un período corto de 16 semanas. La proporción de pacientes que alcanzó una reducción del 30 % en los niveles de PTH en las últimas 4 semanas de tratamiento fue del 82 % en el grupo tratado con alfacacidol y del 93% en el grupo tratado con paricalcitol. Asimismo, un 18 % y un 31 % de los pacientes tratados con alfacalcidol y paricalcitol, respectivamente, alcanzaron el criterio de éxito terapéutico definido como niveles de PTH < 300 pg/ml, con niveles de fosfato < 1,8 mmol/l y de calcio ionizado < 1,3 mmol/l. En ningún caso las diferencias alcanzaron la significación estadística, si bien hay que decir que, desafortunadamente, debido al efecto período, no hubo acceso a los datos del cruce de tratamiento y solo fue analizado el período de intervención inicial de 16 semanas para 80 pacientes de los 117 estimados en el cálculo del tamaño muestral.
En un estudio recientemente publicado56 se analiza la ratio coste-efectividad incremental del paricalcitol frente al alfacalcidol en una hipotética cohorte de pacientes con ERC. Los autores concluyen que paricalcitol ofrece beneficios a corto y largo plazo en términos de economía de la salud y que el modelo utilizado en el estudio sugiere que el uso de paricalcitol en pacientes con ERC temprana puede ser coste-efectivo desde la perspectiva del Servicio Nacional de Salud Británico (NHS), comparado con el uso de un activador de los RVD no selectivos. Hay otras dos evaluaciones económicas, una en Estados Unidos, en la que se comparan paricalcitol y calcitriol intravenosos57, y otra en Alemania58, en la que se compara paricalcitol intravenoso con calcitriol oral y alfacalcidol intravenoso. Ambos trabajos también concluyen que paricalcitol tiene una mejor relación coste-efectividad.
Por último, un estudio randomizado, doble-ciego, desarrollado por Sprague et al.46 que ha evaluado la seguridad y la eficacia de paricalcitol por vía intravenosa y calcitriol en la supresión de las concentraciones de PTH en pacientes en hemodiálisis. De este estudio se ha concluido que el tratamiento con paricalcitol reduce las concentraciones de PTH más rápidamente (p = 0,025) y con menos episodios sostenidos de hipercalcemia y aumento de Ca x P (p = 0,008) que el tratamiento con calcitriol.
ESTUDIOS COMPARATIVOS ENTRE ANÁLOGOS DE LA VITAMINA D O PARICALCITOL Y CALCIMIMÉTICOS
Los estudios aleatorizados, prospectivos, con inclusión de calcimiméticos en su diseño (CONTROL, TARGET, OPTIMA) comparaban la terapia estándar con cualquier derivado activo de la vitamina D y la inclusión de un calcimimético, valorando sus consecuencias. En la tabla 4 se recogen los dos estudios directamente comparativos, con distintas estrategias y algoritmos, entre paricalcitol o análogos de la vitamina D y calcimiméticos, denominados ACHIEVE59 e IMPACT60,61.
El estudio IMPACT es un ensayo clínico fase IV multicéntrico, multinacional, aleatorizado y con un seguimiento más largo de 28 semanas, en el que se compara el tratamiento con paricalcitol intravenoso (estrato IV) o paricalcitol oral (estrato oral) en monoterapia (cinacalcet de rescate) frente a cinacalcet más dosis bajas de vitamina D, en pacientes hemodializados. El análisis de eficacia mostró que la proporción de pacientes que alcanzó el objetivo de mantener los valores de PTHi entre 150-300 pg/ml durante las semanas 21-28 (período de evaluación) fue mayor en el grupo de paricalcitol que en el de cinacalcet y vitamina D. Las diferencias fueron estadísticamente significativas cuando se comparaba el estrato IV o los dos estratos combinados, pero no lo fueron cuando se comparaba el estrato oral. La heterogeneidad de los países involucrados entre los asignados al grupo oral o IV, así como potenciales diferencias entre el tipo de vitamina D usada en asociación con cinacalcet entre el grupo oral o IV (alfacalcidol oral o doxercalciferol IV, respectivamente), podrían explicar al menos parcialmente estas diferencias. Por otra parte, análisis secundarios recientemente publicados62 muestran que un mayor porcentaje de pacientes tratados en la rama paricalcitol conseguían niveles de PTH en los niveles objetivos clásicos (150-300 pg/ml) tanto en el estrato oral como en el endovenoso, en comparación con los pacientes de la rama de cinacalcet. Por otra parte, los niveles de FGF-23 aumentaron con paricalcitol. Dado que el riesgo de mortalidad en pacientes en diálisis parece estar globalmente disminuido con paricalcitol19,63,64, se desconoce cuál es el potencial efecto deletéreo de este incremento de FGF-23 (asociado a mayor mortalidad) o el potencial incremento beneficioso de Klotho mencionado con anterioridad14. En cualquier caso, parece recomendable no alterar significativamente el balance de calcio y fósforo de los pacientes con ERC.
Por otra parte, los análisis farmacoeconómicos preliminares del estudio IMPACT revelaron que el coste del tratamiento con paricalcitol fue menor que el de cinacalcet más vitamina D65 y que los costes asociados a los quelantes de fósforo fueron similares en ambos grupos de tratamiento, de tal forma que el coste total (fármaco en estudio más quelantes) en el grupo de paricalcitol fue un 41 % menor que en el grupo de cinacalcet más vitamina D66.
En otra publicación donde se muestran los resultados del estudio ACHIEVE se observó que cinacalcet combinado con análogos de vitamina D no fue significativamente más efectivo que los análogos de vitamina D en alcanzar el objetivo primario del estudio (guías K/DOQI, PTH 150-300 y Ca x P < 55, 21 % frente a 14 %, p = 0,231), a diferencia de objetivos secundarios, principalmente debido a un 19 % de pacientes en el grupo de cinacalcet que presentaron niveles de PTH por debajo del rango normal. Además, también fue un tratamiento más costoso67.
Sobre todos estos estudios se debe reconocer que, aunque son aleatorizados, tienen elementos criticables desde el punto de vista del diseño, se observaron notables dificultades de inclusión, tanto en la fase de screening como tras el lavado, se producían pérdidas de pacientes no estimadas a priori y se desconocían o no se analizaban algunos datos potencialmente importantes, como el contenido de calcio del baño en diálisis (definido como intervalos).
En este sentido, el estudio prospectivo EVOLVE (EValuation Of cinacalcet therapy to Lower cardioVascular Events) recientemente publicado es el ensayo clínico más ambicioso realizado en este campo68. En él se aleatorizaron 3883 pacientes con HPS moderado-severo a recibir cinacalcet o placebo frente a terapia estándar (derivados de la vitamina D y/o quelantes del fósforo). Tras una exposición media de 21,2 meses en el grupo de cinacalcet frente a 17,5 meses en el grupo placebo, cinacalcet no redujo significativamente el objetivo primario compuesto de mortalidad o eventos cardiovasculares mayores (riesgo relativo 0,93; intervalo de confianza al 95 % 0,85-1,02; p = 0,11) en el análisis primario no ajustado y por intención de tratar. Sin embargo, creemos que no podemos considerar este ensayo como negativo, sino inconcluyente. Esto es así debido en gran parte a una importante pérdida de potencia estadística que se derivó de la menor incidencia de eventos a los inicialmente esperados, lo que obligó a la extensión del estudio. Por otra parte, se produjeron importantes sesgos para interpretar los resultados derivados del elevado número de pacientes que abandonaron cinacalcet en la rama de tratamiento (por los efectos secundarios habituales del fármaco) y los que recibieron cinacalcet comercial en la rama teórica del placebo (hasta un 20 % de los pacientes)68. En el análisis por intención de tratar, por definición, los primeros fueron analizados como si hubieran recibido cinacalcet durante toda la duración del estudio y los segundos como si nunca lo hubieran recibido. A diferencia del estudio IMPACT, en el EVOLVE los pacientes tratados con cinacalcet presentaron niveles de PTH significativamente inferiores, siendo estas diferencias explicables por las distintas características de las personas incluidas y los distintos algoritmos terapéuticos utilizados.
Las recomendaciones de la Sociedad Española de Nefrología para el manejo de las alteraciones del metabolismo óseo-mineral en los pacientes con ERC recuerdan que las alteraciones en los valores séricos de calcio, fósforo, PTH, fosfatasa alcalina y vitamina D, entre otros, se han asociado con aumento de mortalidad en los pacientes con ERC y/o diálisis, aunque todavía no exista una prueba definitiva de causalidad. El estudio EVOLVE, por supuesto, tampoco permite negar la importancia del control de estos parámetros sobre la morbimortalidad de los pacientes en diálisis. Así, las guías de práctica clínica aconsejan la normalización del fósforo en todos los pacientes, siempre que se usen medidas razonables, dada la uniforme e importante asociación con mortalidad de los niveles altos de fósforo en pacientes con ERC41. También aconsejan la normalización de los niveles de calcidiol en todos los estadios, y algunos autores opinan que, aparte del uso de los ARVD y de los AsRVD para la prevención y tratamiento del HPS (para los que la presencia o no de calcificaciones vasculares y/o valvulares, tendencia a la hipercalcemia o a la hiperfosfatemia pueden ser factores determinantes a la hora de escoger de modo razonable entre unos u otros): «una dosis mínima entre 1-5 mg semanales de paricalcitol debería mantenerse para asegurar la activación de los RVD» en pacientes en diálisis41, independientemente del objetivo del control de hiperparatiroidismo. De hecho, en una publicación italiana reciente69, se asocia el uso de paricalcitol a una mejoría de la supervivencia en pacientes en diálisis, incluso con niveles de PTH inferiores a 150 pg/ml. Esta opción debe tener en cuenta el riesgo, posiblemente menor con paricalcitol, de provocar enfermedad ósea adinámica y favorecer así las calcificaciones vasculares, frente al potencial riesgo del aumento de mortalidad asociado a la falta de activación de los RVD ocasionado por la suspensión de los ARVD en este contexto.
En general, aunque debemos admitir que muchas recomendaciones y sugerencias en este campo no se basan en evidencias tipo 1A (escasas en Nefrología), sí se reconoce que es razonable utilizar toda esta información para individualizar la toma de decisiones.
Conflictos de interés
Los autores declaran los siguientes conflictos de interés potenciales:
El Dr. Jordi Bover ha dado conferencias esponsorizadas por Abbott, Amgen, Genzyme y Shire. También ha participado en comités asesores nacionales e internacionales de Abbott, Amgen y Genzyme.
Dr Alberto Martinez ha recibido ayudas a la investigación y ha dado conferencias esponsorizadas por Abbott, Amgen, Boëhringer-Ingelheim, Esteve, Janssen-Cilag, Novartis, Roche y Shire. También ha participado en “advisory boards” (comité asesor) de Abbott, Amgen, Esteve, Roche y Shire.Dr. Egido ha desempeñado labores de asesor científico de Abbott, ha recibido financiación a la investigación y ha dado conferencias esponsorizadas por Abbott.
Abbvie ha financiado el desarrollo de esta publicación por Meisys. Patricia Ortega de Meisys ha llevado a cabo la redacción médica y el apoyo editorial a los autores para el desarrollo de esta publicación. Abbvie ha tenido la oportunidad de revisar y comentar el contenido de la publicación; sin embargo, han sido los autores los que han tomado todas las decisiones referentes al contenido de la misma.
Figura 1. Vía metabólica de la vitamina D
Figura 2. Mecanismo renal de activación del receptor de la vitamina D
11796_19115_37968_es_11796_tabla1.doc
Tabla 1. Acciones esqueléticas y extraesqueléticas de la vitamina D
11796_19115_37969_es_11796_tabla2.doc
Tabla 2. Nomenclatura de la vitamina D y los activadores de los receptores de la vitamina D
11796_19115_37970_es_11796_tabla3_copy1.doc
Tabla 3. Supresión de hormona paratiroidea y efectos sobre los niveles de calcio y fosfato: paricalcitol frente a placebo y paricalcitol frente a calcitriol. Adaptado de Gravellone et al (42)
11796_19115_37971_es_11796_tabla4_copy1.doc
Tabla 4. Estudios comparativos entre paricalcitol y calcimiméticos