INTRODUCCIÓN
El tejido óseo constituye el componente principal del esqueleto. Sus funciones son mecánicas ¿conformación corporal, anclaje muscular y locomoción, protección y asiento de órganos vitales¿ y metabólicas ¿reserva mineral, fundamentalmente de calcio y fósforo, y participación en la regulación del equilibrio ácido-base¿. Como tejido es extraordinariamente dinámico, para poder permitir tanto la adecuación a los requerimientos mecánicos de cada momento como para ejercer sus funciones metabólicas, siendo diana de numerosos sistemas hormonales (PTH, vitamina D o esteroides sexuales, entre otras) y productor de otros factores de la regulación de la homeostasis mineral, como el FGF 231.
Cuando por razones fisiológicas (envejecimiento, declive hormonal sexual) o patológicas aumentan los requerimientos metabólicos del hueso, éste es capaz de mantener la homeostasis mineral sistémica durante largos periodos, a costa de poner en riesgo su propia integridad como tejido, que se manifiesta fundamentalmente por la disminución de su resistencia mecánica y, consecuentemente, la aparición de fracturas.
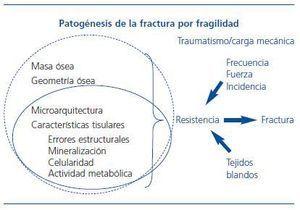
La fracturas por fragilidad son aquellas que se producen por un traumatismo o carga mecánica mínima, que en condiciones normales serían incapaces de producir la fractura (caída de su altura, acceso de tos, carga de una bolsa de la compra o apoyo en el alfeizar de la ventana)2. En su patogenia se implican tanto factores óseos (calidad y cantidad) como factores extraóseos (figura 1)3.
El concepto de calidad ósea surge para diferenciar los componentes fundamentales que condicionan la resistencia ósea: masa ósea (cantidad de tejido), geometría ósea (disposición espacial/tamaño) y calidad ósea (aspectos relacionados con la microarquitectura y composición del tejido óseo)3.
La incorporación conceptual de «alteración de la resistencia ósea» como núcleo definitorio del incremento de riesgo de fractura en los pacientes con esteoporosis4, enfermedad más frecuente vinculada al desarrollo de fracturas por fragilidad, ha supuesto el reconocimiento de las limitaciones que tiene la evaluación de la masa ósea como predictor clínico más relevante del riesgo de fractura5 y el desarrollo de nuevas técnicas o enfoques para explicar los mecanismos fisiopatológicos y la respuesta terapéutica de la enfermedad6.
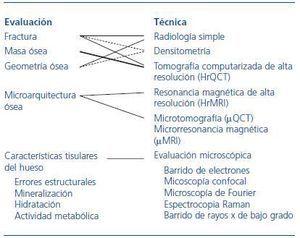
Las características físicas y químicas que pueden influir en la calidad biomecánica de cada hueso, ordenadas en una escala física cuantitativa, irían desde su morfología global, la cantidad de masa ósea, su disposición microarquitectónica, hasta aspectos moleculares de la estructura y enlaces entre las fibras de colágeno, e incluso el tamaño o la alineación de los cristales del componente mineral7,8. La fractura sería la síntesis o prueba fehaciente de la baja resistencia del hueso. El resto de los componentes y las técnicas que permiten su evaluación se recogen en la figura 2.
ENFERMEDAD ÓSEA ASOCIADA A ENFERMEDAD RENAL CRÓNICA Y FRACTURAS
Los trastornos en el metabolismo óseo y mineral son extraordinariamente prevalentes ¿por no decir consustanciales¿en la enfermedad renal crónica (ERC), y constituyen una importante causa de morbilidad, disminución de calidad de vida y de mortalidad cardiovascular9.
La disminución de la resistencia ósea, junto con las alteraciones de parámetros bioquímicos (calcio, fósforo, PTH y vitamina D), alteraciones en el remodelado óseo, trastornos de la mineralización del tejido óseo, alteraciones en el volumen y la microarquitectura ósea, alteraciones del crecimiento, calcificaciones vasculares y de otros tejidos blandos, forman en su conjunto la enfermedad ósea y mineral asociada a la ERC10. El incremento del riesgo de fractura se ha descrito tanto en pacientes en diálisis como en etapas tempranas del deterioro de función renal o en pacientes trasplantados11. El incremento de riesgo de fractura en pacientes con ERC estadio 5 (ERC-5) multiplica por 10 a 100 veces el riesgo de fractura de cadera, especialmente en los menores de 65 años en los que la incidencia de fractura de cadera es muy baja en la población general12. Otros tipos de fracturas también tienen una incidencia superior a la de la población general13. El incremento del riesgo de fractura en pacientes con ERC-5 es el equivalente a un envejecimiento de 10 a 20 años en la población general13,14.
Los factores de riesgo de fractura en los pacientes con ERC son los mismos que los de la población general (edad, sexo femenino, bajo peso, menopausia, historia personal y familiar de fracturas por fragilidad, frecuencia de caídas, fármacos) y factores específicos como trasplante, consumo de glucocorticoides y valores séricos inadecuados de PTH (alta o baja)11.
Las pruebas de imagen, junto con una correcta historia clínica y pruebas analíticas complementarias, pueden contribuir a establecer el grado de afectación ósea y, en definitiva, la probabilidad de fractura por fragilidad para actuar terapéuticamente con mayor o menor intensidad.
RADIOLOGÍA SIMPLE
Por su difusión, disponibilidad y bajo coste, la exploración del esqueleto mediante radiología simple está al alcance de todos en la práctica clínica. Además de hallazgos radiológicos más o menos característicos del hiperparatiroidismo secundario de la ERC, la exploración radiológica de la columna vertebral es de gran utilidad.
El dolor de espalda es el síntoma más frecuente tanto en población general «sana» como en pacientes con enfermedades crónicas y en pacientes de edad avanzada. La radiología de la columna vertebral permite evaluar trastornos de la estática de la columna vertebral ¿frecuentemente asociados a dolor funcional¿, trastornos degenerativos artrósicos, fracturas vertebrales y calcificaciones vasculares aórticas15.
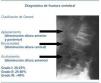
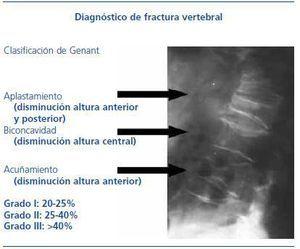
Existen diversos criterios diagnósticos y grados de gravedad de fractura vertebral. El que se ha impuesto en la práctica clínica es el de Genant et al., esquematizado en la figura 316.
Además, el diagnóstico de fractura vertebral tiene algunas particularidades que merecen ser resaltadas:
- Hasta 2/3 de las fracturas vertebrales son asintomáticas u oligosintomáticas17, y sólo objetivables radiológicamente. Por el contrario, en el resto de las fracturas la simple anamnesis permite establecer el diagnóstico.
- La fractura vertebral es la que mayor relación guarda con el estado del tejido óseo, y como tal es la que mejor se puede prevenir, con fármacos que actúan sobre el hueso6.
- Las fracturas vertebrales son un importante factor de riesgo de fracturas futuras. Los pacientes con una o más fracturas vertebrales prevalentes tienen un riesgo absoluto de fractura del 10 al 25% en el año siguiente18; el riesgo de fractura vertebral o de cadera se multiplica por 5-6 en los 4 años siguientes19.
- Las fracturas vertebrales se asocian de forma independiente con la mortalidad, tanto en población general como en pacientes en hemodiálisis20,21.
El aspecto de la radiología simple, que hoy en día tiene mayor interés dentro del estudio de pacientes con ERC, es la valoración de las calcificaciones vasculares. Aunque existen métodos más complejos en la cuantificación del daño vascular, basados en ultrasonidos y técnicas de tomografía computarizada22, con la radiología convencional se puede sacar una información muy valiosa. Las recomendaciones de KDIGO consideran que la placa lateral del abdomen es una herramienta útil en la detección de calcificaciones vasculares a través de simples evaluaciones semicuantitativas de las mismas23-25.
Una de las escalas utilizadas clasifica a las calcificaciones aórticas en: - Grado 0: ausencia de calcificaciones; - Grado 1 (leves-moderadas): cuando se observan varias calcificaciones puntiformes aisladas o una calcificación lineal visible de longitud inferior a la altura de dos cuerpos vertebrales o una placa densa o varias poco densas: - Grado 3 (gravedad): cuando se observan calcificaciones lineales de longitud igual o superior a la altura de dos cuerpos vertebrales o dos o más placas densas26.
Mediante la utilización de esta escala se ha observado que el 78% de los pacientes en hemodiálisis tienen algún tipo de calcificación aórtica y hasta un 57% de grado 3, duplicando a la observada en población general de su misma edad y sexo27.
Además, en la ERC-5, la presencia y la gravedad de las calcificaciones vasculares se asocian con un mayor riesgo de fractura vertebral y con una mayor mortalidad20,28,29.
DENSITOMETRÍA ÓSEA
La evaluación indirecta cuantitativa de la masa ósea se puede llevar a cabo mediante diferentes técnicas densitométricas. Todas ellas se fundamentan en la variación que produce el tejido óseo mineralizado sobre agentes físicos. Por su aplicación clínica, se pueden clasificar entre las que permiten evaluar hueso axial y los que exploran huesos periféricos, ya que, por la metodología que emplean, no pueden acceder a huesos con abundante tejido blando adyacente.
Las técnicas axiales (DXA: dual X-ray absorptiometry; QCT: quantitative computed tomography) permiten explorar vértebras y cadera. Mientras que la QCT permite sustraer y analizar el hueso trabecular y cortical de forma diferenciada, la DXA evalúa conjuntamente el hueso trabecular y cortical. La mejor precisión de la DXA, su menor exposición radiológica (0,5 mSv; 20 veces menos que QCT) y la ausencia de radiación de dispersión han hecho que la DXA sea el patrón de oro en la evaluación incruenta de la masa ósea30.
Densitometría radiológica de doble energía (DXA)
La DXA se ha impuesto como técnica densitométrica por diferentes razones31,32:
- Permite explorar sectores anatómicos donde asientan las fracturas por fragilidad epidemiológicamente más relevantes ¿columna vertebral y extremidad proximal del fémur¿.
- Tiene una excelente precisión que permite evaluar cambios evolutivos en la densidad mineral ósea (DMO) en plazos razonables (18-24 meses).
- La relación entre la evolución de la masa ósea y la edad es concordante con la epidemiología de las fracturas por fragilidad.
- Permite cuantificar la respuesta terapéutica de la masa ósea. Destacar que puede existir disociación entre la respuesta del DMO en hueso axial y periférico, pese a observarse disminución del riesgo de fractura en ambos tipos de huesos.
- La exposición radiológica es baja y predice el riesgo de fractura en cualquier sector anatómico de manera similar a la densitometría periférica.
Sin embargo, para su utilización correcta como predictor del riesgo de fractura, para el diagnóstico de osteoporosis con los criterios de la OMS y, en definitiva, para sustentar todas las atribuciones e incluso las limitaciones que como técnica posee, se debe partir de una premisa básica: que sea realizada e interpretada de forma correcta. Por ello se deben tener en cuenta una serie de consideraciones.
Los diferentes densitómetros DXA se basan en el mismo principio: generación de una imagen digitalizada de un determinado sector anatómico en función de la atenuación de dos haces colimados de rayos X, de alta y baja energía. Aunque existen diferencias en los tipos de filtros, número de detectores y emisores de rayos X, sistema de calibración y algoritmos para la selección de áreas de interés, son estos dos últimos los responsables de que no sean idénticos los valores obtenidos por densitómetros de diferentes marcas comerciales31.
El cálculo de la densidad se realiza a través de un proceso matemático que se inicia con la diferenciación del tejido óseo respecto a los tejidos blandos ¿diferencial de la captación del haz de baja y alta energía¿, la determinación del área explorada (cm2), determinación del contenido mineral óseo (CMO, g) y con el cociente de ambos. Así se obtiene, en cada subsector de la región ósea explorada, la densidad por unidad de superficie (DMO, g/cm2) (figura 4).
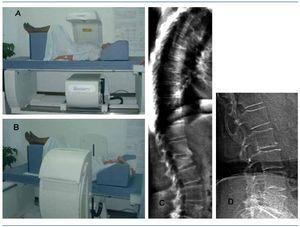
Existen programas específicos para la exploración lateral de columna lumbar, antebrazo, exclusión de material protésico y análisis de escoliosis, así como densitómetros que permiten la exploración del cuerpo entero, aportando información no sólo de la DMO, sino también de la composición corporal de los tejidos blandos. Las últimas generaciones de densitómetros DXA, provistos de multiemisores y multirreceptores, incorporan brazos móviles que permiten la exploración lateral de la columna vertebral con el paciente en decúbito supino, reducen extraordinariamente el tiempo de exploración y permiten obtener de forma estandarizada y automática índices morfométricos e imágenes de posible fractura vertebral, tanto de la columna lumbar como de la columna dorsal; ventajas de gran valor en la identificación de fracturas en pacientes de alto riesgo33. La calidad de imagen y la facilidad del posicionamiento del paciente permiten, además, establecer puntuaciones del grado de calcificación de la aorta abdominal34 (figura 5).
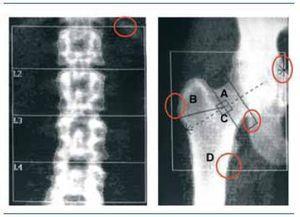
Para la realización de cualquier densitometría y para cada sector anatómico (cadera, columna lumbar, antebrazo etc.) existen procedimientos estandarizados que están perfectamente definidos por la ISCD (International Society of Clinical Densitometry)35. En la figura 4 se observan los puntos clave de control de calidad de una densitometría correctamente realizada.
También hay que considerar la posibilidad de artefactos que desvirtúen los valores de masa ósea obtenidos. Las interferencias producidas por alteraciones anatómicas (escoliosis, artrosis, fracturas vertebrales, calcificaciones vasculares, clips metálicos) y alteraciones en la composición de tejidos blandos. Incluso cambios en el contenido graso medular tienen influencia en todas las técnicas, aunque siempre se mencione para la densitometría DXA, al ser la más ampliamente difundida. En el caso de pacientes con ERC que reciben carbonato de lantano, éste puede artefactar el resultado en columna lumbar si está presente en el tubo digestivo en el momento de la exploración. En algunos casos, la presencia de artefactos no modificables, hace necesario realizar la densitometría en otro sector anatómico o utilizar otra técnica alternativa36.
La posibilidad de explorar diferentes sectores anatómicos no implica que todos tengan el mismo valor a la hora de establecer el diagnóstico siguiendo los criterios de la OMS2. Por ejemplo, la densitometría lateral de la columna lumbar o DMO de cuerpo entero no están aceptadas para el diagnóstico de osteoporosis. Las regiones en las que son aplicables los criterios de la OMS son la columna lumbar en proyección posteroanterior y la extremidad proximal del fémur. La Sociedad Internacional de Densitometría Clínica (ISCD) recomienda para el diagnóstico clínico de osteoporosis el empleo del valor menor de los observados en columna lumbar, cuello femoral, cadera total y trocánter, y excluye taxativamente el triangulo de Ward. En aquellos casos en los que, por problemas de artefactos, no se puedan realizar determinaciones axiales o en los hiperparatiroidismos, primarios, en los que predomina la pérdida de masa ósea cortical, se recomienda la evaluación del 1/3 medio del radio35. Para los estudios de seguimiento de la DMO de la extremidad proximal de fémur, se recomienda utilizar la cadera total por su mejor precisión35.
Una vez obtenida la DMO en un determinado paciente, ésta debe ser considerada en función de los valores de su población de control, bien respecto al pico de masa ósea de la población joven sana (puntuación T), o bien respecto a su grupo de edad y sexo (puntuación Z). En ambos casos se transforma el valor de la DMO en desviaciones estándar respecto al valor medio poblacional. La estandarización debe realizarse utilizando valores poblacionales válidos, a ser posible de la misma población estudiada. Se dispone de un amplio estudio de DMO de columna vertebral y de cadera, en varones y mujeres españoles, cuyos valores se recogen en la tabla 137,38. Aunque fueron obtenidos con un densitómetro Hologic, es posible la conversión o la estandarización de estos valores a otros densitómetros DXA39. A nivel internacional, se ha propuesto como referencia de normalidad, por su tamaño muestral y metodología de reclutamiento, los valores obtenidos en el estudio de población norteamericana NHANES III, que sólo dispone de valores de DMO de cadera40.
Desde que se definieron los criterios de la OMS2, la fortaleza de la DXA como técnica diagnóstica radica en su probada capacidad para categorizar a la población en función de la DMO y en su poder predictivo de nuevas fracturas. Cada reducción de una desviación estándar implica un incremento medio de 1,5 a 2 veces en el riesgo de fractura41. No obstante, que un determinado paciente no esté englobado en la categoría diagnóstica de osteoporosis no le exime del riesgo de fractura por fragilidad ¿la DMO es una variable continua y los umbrales mencionados resultan de un consenso en función de características epidemiológicas generales, y no tienen en cuenta otros componentes que participan en la resistencia del tejido óseo¿. Por ello, actualmente se tiende a utilizar los valores de la DMO no como un criterio único, sino como un factor de riesgo más a la hora de establecer el riesgo absoluto de fractura para un determinado paciente. Así, el comité de expertos de osteoporosis de la OMS ha desarrollado la herramienta FRAX (Fracture Risk Assessment Tool) para considerar y ponderar diversos factores de riesgo clínico, incluyendo o no la DMO de cuello de fémur en el riesgo de fractura42.
En el caso de la enfermedad ósea asociada a la ERC, en general se observan valores de DMO algo más bajos que los de la población general43, de los que se ha sugerido que tendrían cierta capacidad predictiva del riesgo de fracturas. Este aspecto es todavía incierto y quizás de un valor inferior al que tiene en la población general11. En cualquier caso, hay que tener presente que las diferentes formas de afectación ósea asociadas a la ERC pueden cursar con valores de volumen óseo normal, alto o bajo (además de la posibilidad de estar afectada o no la mineralización), y que, por lo tanto, la cuantificación de la masa ósea desempeña un papel sólo complementario en la valoración del riesgo de fractura y en la capacidad de evaluar, de forma precisa y no invasiva, la evolución de la misma.
Respecto a la utilización de la densitometría en la monitorización del paciente, es importante conocer qué se entiende por cambio mínimo significativo entre dos determinaciones de DMO. El cambio mínimo significativo se obtiene multiplicando el coeficiente de variación o precisión de la técnica en el sector anatómico evaluado, multiplicado por 2,77, y es aproximadamente 3% en columna lumbar y 5% en cuello femoral. El intervalo de tiempo que debe transcurrir para realizar un control evolutivo mediante densitometría ósea va a depender de dicho cambio valorable y del cambio esperado en función de las características del paciente o del tratamiento que esté realizando. En DXA axial, el tiempo medio sería de 18-24 meses para un paciente con remodelado óseo elevado o en tratamiento activo44.
Otras técnicas densitométricas
La DXA evalúa de forma conjunta el hueso cortical y el hueso trabecular. Dado que algunas formas de enfermedad ósea asociada a la ERC afectan de forma diferente al hueso cortical y trabecular, la evaluación por separado de los dos tipos de hueso siempre ha tenido un gran atractivo. Así, se ha observado que la masa ósea en columna evaluada por QCT ¿densidad volumétrica de tejido trabecular puro¿ se correlaciona positivamente con el volumen óseo trabecular cuantificado por histomorfometría en biopsia transilíaca45. A la par, utilizando equipos de QCT periféricos, también se ha observado una mayor pérdida de masa ósea cortical en radio46. Pese a esa mayor capacidad de la QCT de discriminar en subrogados intermedios, no se ha demostrado un mejor comportamiento global del mismo en la predicción del riesgo de fractura47. Ambos tipos de hueso participan en la resistencia ósea, y la sustracción en función de la densidad radiológica del hueso cortical puede considerar parte del mismo (canceizado por efecto de un exceso de PTH) como hueso trabecular, supravalorando la densidad cortical y viceversa.
TOMOGRAFÍA Y RESONANCIA MAGNÉTICA NUCLEAR DE ALTA RESOLUCIÓN
El desarrollo de nuevas tecnologías de alta resolución (inferiores a 100 micras frente a las 350-400 micras de la tomografía y resonancia magnética convencional) ofrecen imágenes estructurales y parámetros convencionales de la histomorfometría clásica (volumen cortical, espesor cortical, número e interconectividad de las trabéculas, etc.) y han introducido el concepto de biopsia virtual48. Además, pueden permitir mediante el análisis de elementos finitos la modelización y el cálculo de la resistencia ósea (del componente de la microarquitectura) y evaluar los posibles cambios en la misma49,50.
Estas tecnologías todavía no han alcanzado el desarrollo suficiente para su aplicación en la práctica clínica diaria (largos periodos de tiempo precisos para la adquisición de la imagen y para su análisis informático). En algunos casos que se han testado en el contexto de estudios clínicos, pese a la espectacularidad de las imágenes mostradas, no han mostrado capacidad de mejorar la información de cambios globales de manera superior a la DXA51.
CONCLUSIONES
Las técnicas de imagen nos permiten una evaluación de la repercusión estructural de la enfermedad ósea y mineral asociada a la ERC. La radiología simple es de extraordinaria importancia para establecer la causalidad de algunas manifestaciones clínicas del paciente, que pueden no estar vinculadas al estado de salud ósea, la presencia de fracturas por fragilidad, el riesgo de futuras fracturas y el riesgo cardiovascular.
La determinación de la masa ósea mediante DXA, aunque tiene sus limitaciones, permite evaluar la repercusión cuantitativa de la enfermedad y, junto con los factores de riesgo clínico de fracturas por fragilidad, mejorar la predicción del riesgo de fractura, además de permitir monitorizar los cambios de la misma secundarios al tratamiento. Los DXA de nueva generación permiten cuantificar la DMO, evaluar la presencia de fracturas y las calcificaciones aórticas de forma precisa, en pocos minutos y con una escasa exposición radiológica. No obstante, son necesarios estudios prospectivos para evaluar su utilidad en pacientes con ERC.
Las tecnologías emergentes van a permitir establecer medidas precisas de las características microestructurales del hueso y la resistencia ósea dependiente de las mismas.
Con todo, la extraordinaria riqueza biológica y patogénica de la enfermedad ósea y mineral asociada a la ERC hace que el abordaje de la misma deba ser conjunto: estructural, biológico y, en muchos casos, incluso histológico. La incorporación de nuevos elementos al arsenal terapéutico ¿análogos de vitamina D, calcimiméticos, nuevos captores de fósforo¿ justifican nuevos esfuerzos en la valoración de las repercusiones tisulares y clínicas de los mismos.
Figura 1. Variables relacionadas con la calidad ósea de un determinado hueso como elemento mecánico (círculo discontinuo) y del propio tejido óseo (óvalo continuo), y su ubicación en la patogénesis de la fractura por fragilidad.
Figura 2. Variables relacionadas con la resistencia del hueso y técnicas de evaluación.
Figura 3. Diagnóstico radiológico de fractura vertebral. Criterios y grado de Genant
Figura 4. Localización de puntos de referencia sobre la imagen de la DXA para garantizar un adecuado análisis de la misma. A la izquierda, presencia de la 12.ª costilla. A la derecha, márgenes necesarios para el análisis de la extremidad proximal del fémur.
Figura 5. Disposición del paciente para la realización de una DXA convencional (A), giro del brazo del densitómetro para permitir el barrido lateral de toda la columna vertebral (B). Imagen de la columna vertebral lateral con identificación de fracturas vertebrales
Tabla 1. Valores del pico de masa ósea DMO (g/cm2) en población sana española, en diferentes sectores anatómicos para Hologic