1. Prevalencia
La prevalencia de la hipertensión arterial (HTA) en los pacientes con diabetes mellitus tipo 2 (DM2) es 1,5-2 veces superior que en pacientes no diabéticos. Por otra parte los hipertensos tienen un riesgo 2,5 veces superior de desarrollar diabetes mellitus tipo 21.
De esta forma entre un 50 y un 60% de los diabéticos son hipertensos, porcentaje que aumenta con la edad y con la presencia de nefropatía. En los pacientes DM2 con microalbuminuria la prevalencia de HTA es del 90 % y en pacientes con macroalbuminuria es del 93 %2. En el estudio DIAPA3, realizado en pacientes diabéticos de diferentes centros de salud de toda la geografía española, se observó una prevalencia de HTA conocida del 66,7%. Además, del total de diabéticos sin HTA conocida, un 52% tenía cifras de presión arterial (PA) por encima de 130/85 mmHg. Ello nos da una idea de la importancia de la HTA en la DM2.
2. Significado pronóstico de la hipertensión arterial en la diabetes mellitus tipo 2
La HTA es un factor de riesgo para el desarrollo de complicaciones cardiovasculares en la diabetes mellitus, tanto macrovasculares (cardiopatía isquémica, insuficiencia cardiaca, enfermedad cerebral vascular y arteriopatía periférica) como microvasculares (nefropatía, retinopatía y neuropatía). El 75% de las complicaciones macrovasculares que se presentan en los diabéticos son debidas a las HTA1. El tratamiento de la HTA reduce dicho riesgo vascular4.
3. Patogenesis de la HTA en la DM2
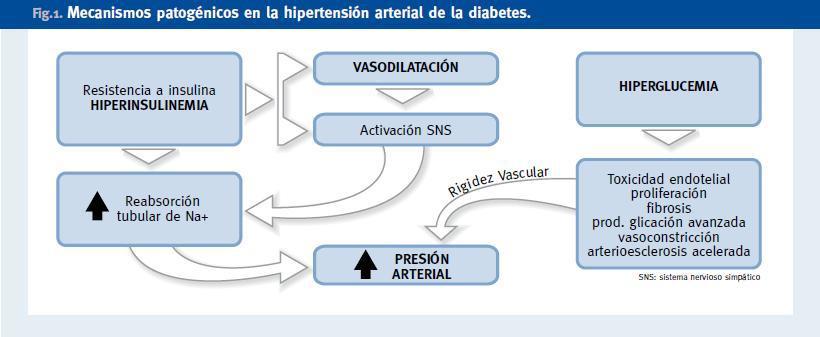
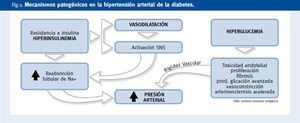
Son múltiples los factores que influyen de manera simultánea en el desarrollo de HTA en la DM2 y probablemente la influencia de cada uno de ellos varía en cada paciente. Además de la presencia de nefropatía, los factores fundamentales que condicionan una elevación de la presión arterial en la DM2 se relacionan con dos aspectos básicos: un aumento del volumen extracelular y un incremento de las resistencias vasculares periféricas. Sobre el primero actuarían los efectos derivados del hiperinsulinismo y la hiperglucemia; sobre el segundo, los derivados de la activación simpática y la rigidez arterial (Figura 1). Es por ello que el tratamiento de la HTA en la DM2 deberá ir dirigido a tratar de evitar y mejorar dichos mecanismos patogénicos por medio de medidas higiénicodietéticas y, si es necesario, fármacos.
3. 1. Nefropatía
Las alteraciones hemodinámicas y metabólicas que acompañan a la DM2 derivan en un incremento de presión intraglomerular, condicionando una proliferación de matriz y celularidad mesangial, un incremento del grosor de la pared del capilar y la consiguiente esclerosis glomerular que caracterizan a la nefropatía diabética5. El desarrollo de nefropatía diabética es un factor aditivo en la génesis de la HTA del diabético junto los que se mencionan a continuación.
3. 2. Hiperinsulinemia
La hiperinsulinemia, ya sea por resistencia a la insulina o por su administración exógena, favorecería el incremento de la presión arterial mediante la activación del sistema nervioso simpático y favoreciendo la retención de sodio6.
3.3. Retención de sodio y expansión de volumen
La HTA en la DM2 se asocia a un incremento del sodio corporal total. En la hiperfiltración y primeras fases de la nefropatía, la hiperglucemia por un mecanismo insulino-dependiente actúa sobre el túbulo proximal renal produciendo incremento en la reabsorción de sodio. Esta sobrecarga salina incrementa la presión arterial, pudiendo revertir o mejorar este efecto con la restricción de sal. Por otra parte, la hiperglucemia crónica favorece el paso de agua libre del espacio intracelular al extracelular contribuyendo a una expansión de la volemia6.
3.4. Incremento de la reactividad vascular y rigidez arterial
La hiperglucemia mantenida puede contribuir al incremento de la rigidez arterial favoreciendo una serie de cambios vasculares. En dichos cambios influye la toxicidad directa de la hiperglucemia sobre las células endoteliales, inducción de fibrosis por sobreexpresión de fibronectina y colágeno y acúmulo de productos de glicación avanzada en la pared del vaso incrementando su rigidez6. A todo ello se añade el estado de vasoconstricción incrementado en la arterioesclerosis acelerada característica de la vasculatura diabética. Este estado de rigidez vascular contribuye a que predomine el componente sistólico o PA sistólica en la HTA del paciente con DM2, de más difícil tratamiento y control.
4. Cifras objetivo de presión arterial
El objetivo del tratamiento del diabético tipo 2 con HTA es reducir el riesgo vascular global, tratando de evitar o retrasar la aparición de complicaciones cardiovasculares. Por ello el enfoque terapéutico no debe estar dirigido solamente a tratar la HTA sino a un abordaje multifactorial de todos los factores que puedan desempeñar un papel patogénico dichas complicaciones.
En los últimos años, aunque existe una mayor concienciación acerca del abordaje multifactorial del riesgo vascular en el paciente diabético, todavía se está muy lejos de lograr un control óptimo de los mismos. En un reciente análisis del Third National Health and Nutrition Examination Survey (NHANES III) se mostró que solamente el 37 % de los diabéticos presentaban HbA1c < 7 %, el 35,8 % mostaron cifras de PA < 130/80 mmHg, el 51,8 % presentaban cifras de colesterol < 200 mg/dl, y finalmente solo el 7,3 % tenían control óptimo de la HbA1c, PA y colesterol7. En España, el estudio PRESCAP 2006 muestra que solo el 15.1 % de los diabéticos tienen niveles de presión arterial con control óptimo (< 130/80 mmHg)8.
Ello nos indica que todavía queda mucho por hacer, siendo necesario establecer unas estrategias mas adecuadas para un mejor y más intenso tratamiento de los distintos factores de riesgo vascular en el paciente diabético. Profundizar en el conocimiento de las distintas opciones terapéuticas en el tratamiento de la HTA en la DM2 debe contribuir a un óptimo control de la misma, así como a perder infundados temores que han rodeado el uso de determinados fármacos en este tipo de pacientes.
4.1.- ¿Por qué 130/80 mm Hg?
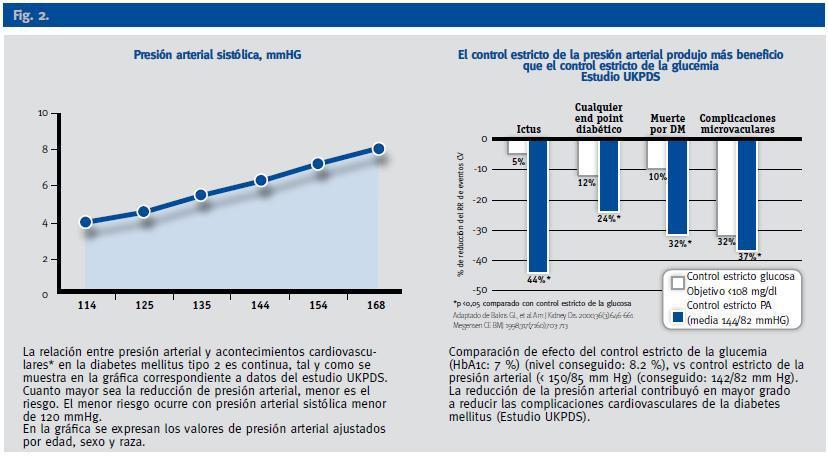
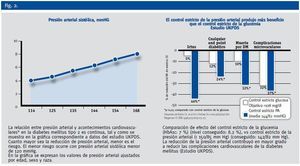
La relación entre PA y riesgo cardiovascular es continua. Cuanto mayor sea la reducción de la presión arterial en los pacientes diabéticos, menor será el riesgo (Figura 2). Los análisis epidemiológicos han mostrado cualquier elevación de la PA por encima de > 115/75 mm Hg estan asociados a un aumento en las complicaciones cardiovasculares y mortalidad en pacientes con y sin DM29.
En el estudio UKPDS (United Kingdom prospective Diabetes Study)10 se mostró que un descenso de tan solo 10 mmHg en la PA sistólica se asociaba a una reducción de un 12 % el riesgo de padecer un evento cardiovascular. Tanto este estudio como el ABCD11 mostraron que a partir de una PA mayor de 130 mm Hg, el riesgo cardiovascular aumenta de una forma significativa. Por otra parte, en el subgrupo de diabéticos del estudio HOT, los pacientes con una PA diastólica inferior a 80 mm Hg presentaban menos eventos cardiovasculares12.
Basado en los anteriores estudios, tanto el informe del Joint National Committee 7 (7 JNC)13, la Guía Europea de HTA14, documento de la Asociación Americana de Diabetes15 y el Documento de Consenso sobre evaluación y tratamiento de la HTA en España16 establecen como objetivo diana en los pacientes con DM una presión arterial inferior a 130/80 mm Hg, y en pacientes con proteinuria > 1gr/día las cifras objetivo son 125/75 mm Hg14. Así pues, este umbral ha demostrado ser más efectivo para la prevención cardiovascular y renal.
No obstante los pacientes incluidos en los ensayos clínicos raramente han conseguido llegar a los objetivos terapéuticos establecidos en las guías. Aunque es controvertido el obtener una respuesta definitiva en base únicamente a los anteriores estudios, las guías nos ayudan con sus recomendaciones a establecer unos objetivos de carácter práctico en el tratamiento de la HTA en estos pacientes.
El estudio UKPDS10 demostró que el control de la PA ofrece más ventajas sobre la prevención de eventos cardiovasculares que el control glucémico ambos de forma aislada. Mínimos descensos en la PA, especialmente en la sistólica, ejercían un importante beneficio sobre las complicaciones cardiacas, vasculares y renales. Pero no solo el tratamiento antihipertensivo ofrecía más ventajas que el control glucémico, sino que además los beneficios cardiovasculares derivados de su control se detectaban antes17 (Figura 2).
5. Medidas Higienico Dietéticas
Es de capital importancia dedicar tiempo a explicar a los pacientes la trascendencia de llevarlas a cabo, por el beneficio que de ello se deriva. Estas medidas por si mismas y de forma aislada no logran conseguir las cifras objetivo de PA del paciente diabético, pero permiten reducir los requerimientos farmacológicos además de contribuir a prevenir otras complicaciones.
Estas medidas se enumeran en la Tabla 1.
6. Tratamiento Farmacológico: actitudes
6.1. ¿Cuándo debe iniciarse el tratamiento farmacológico?
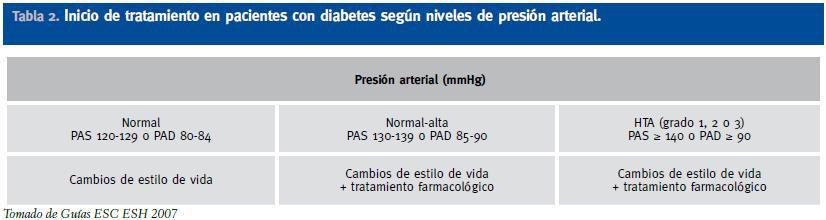
El primer paso es confirmar el diagnóstico de HTA mediante las mediciones adecuadas y repetidas16. Una vez diagnosticada la HTA, se decidirá si iniciar medidas higiénicodietéticas y cambios en el estilo de vida de manera aislada o simultáneamente con tratamiento farmacológico. Tanto el estudio VALUE como el ASCOT han mostrado que la rapidez en el control de la PA se asocia a mejores resultados en la morbimortalidad, que se muestran ya a los pocos meses del inicio del tratamiento. Por ello las nuevas guías europeas de HTA han reducido prudentemente el periodo de cambios en el estilo de vida indicados antes de iniciar el tratamiento farmacológico, en relación a las guías previas (Tabla 2).
Cuando la PA inicial está elevada (130-139/85-89 mmHg) la decisión respecto a la intervención farmacológica depende del grado de riesgo. La mayoría de estudios han mostrado que la reducción de la PA en diabéticos se asocia a una reducción en la aparición de episodios cardiovasculares mortales y no mortales18-19.
De la misma forma, reducciones de PA a valores mas bajos (< 125/75 mmHg) se asocian a reducciones en albuminuria y proteinuria(20) y a reducciones en la progresión renal. Esto justifica la recomendación de iniciar el tratamiento farmacológico simultáneamente con los cambios en el estilo de vida en pacientes en los que la PA no está elevada, sino que es normal-alta, siempre que haya diabetes mellitus o enfermedad cardiovascular14,16. Cuando se haya decidido iniciar tratamiento farmacológico, éste se debe considerar como parte del tratamiento integral del riesgo cardiovascular y de protección renal.
6.2. Monitorización y ¿hasta cuanto bajar?
Recientemente se ha publicado el más amplio estudio para evaluar el tratamiento antihipertensivo en la DM221. El estudio ADVANCE ha incluido mas de 11.000 DM2 hipertensos y normotensos, demostrando que al reducir una media de PA sistólica de 5.6 mm Hg con una combinación fija de un IECA y diurético vs placebo se consigue en cinco años una reducción en la mortalidad del 14 %, en eventos coronarios un 14 % y en complicaciones renales un 21 %.
Los objetivos de la terapia antihipertensiva se muestran en la tabla 3. Una vez iniciado el tratamiento, la respuesta se comprobará en unas 3-4 semanas. Si el paciente presenta HTA estadio 3 (> 180/110 mm Hg) o riesgo muy alto, este periodo se puede acortar porque el paciente se puede beneficiar de un control precoz de la PA. Se utilizarán, a ser posible, fármacos de acción prolongada que sean eficaces durante 24 horas y permitan la dosis única diaria.
No obstante, todavía existe una importante distancia entre el porcentaje de pacientes tratados y aquellos que están con nivel recomendado por las guías. Para evitar este problema es necesario tener en cuenta algunos aspectos. En primer lugar, el control de la HTA es más difícil en los pacientes diabéticos que en los no diabéticos debido a las características fisiopatológicas previamente mencionadas. En segundo lugar, no existe una curva J para la mortalidad relacionada con el control de la PA en los pacientes diabéticos, excepto en aquellos con enfermedad coronaria. En estos, la reducción excesiva de la PA diastólica (< 60 mm Hg) puede comprometer la perfusión coronaria (en diástole) e incrementar la morbimortalidad por cardiopatía isquémica. No se recomienda reducir la PA sistólica por debajo de 110 mmHg4. Por último, en los pacientes de edad avanzada, especialmente aquellos con cifras de presión arterial más elevadas y no tratados previamente, se intentará conseguir los objetivos de una forma progresiva en el tiempo (en el transcurso de varias semanas o un máximo de dos-cuatro meses) para evitar una hipotensión significativa. Muchas veces el nivel a partir del cual hay que bajar la PA es aquel que el paciente tolere para ir aproximándose de forma progresiva al objetivo ideal de PA en la DM2. De esta forma, excepto en estas dos últimas situaciones, hay que tener en cuenta que un control precoz de la PA se asocia a un mayor beneficio en el riesgo cardiovascular.
Para conseguir los niveles de PA recomendados en las guías se requieren al menos dos fármacos en la mayoría de los pacientes. En una reciente revisión, el 60-75 % de los diabéticos hipertensos requirieron dos o más fármacos para el control de la PA22. En pacientes con cifras de PA > de 20 mm Hg sobre el nivel objetivo de PA sistólica o > 10 mm Hg sobre el nivel objetivo de la PA diastólica se deberá iniciar tratamiento con una combinación de dos fármacos por su superior efectividad sin temer a producir exceso de control de la PA (7 JNC)11. Algunos estudios han demostrado que la administración de una combinación de fármacos administrados en el mismo comprimido logra un mejor cumplimiento que la misma combinación pero en comprimidos diferentes23.
Otro aspecto a considerar es evitar la inercia clínica, situación en la que el médico debido a diversas razones no inicia o no intensifica el tratamiento antihipertensivo cuando el grado de control es inadecuado (PA ≥ 130/80 mmHg en este caso). Entre estas razones pueden enumerarse el desconocimiento de las guías clínicas, desacuerdo con las mismas, falta de conocimiento del problema o el prestar mas atención a otros problemas del diabético, menospreciando la importancia del control de la PA, que como anteriormente se ha comentado tiene un efecto pronóstico mayor incluso que el control de la glucemia. El papel de la enfermería en la consulta del paciente diabético es fundamental, estimulándole a la realización de las medidas no farmacológicas, ayudando en el cumplimiento terapéutico pues frecuentemente está polimedicado e instruyéndole para la automedida de la PA en su domicilio.
El tratamiento precoz de la HTA es muy importante en el diabético ya que logra una mayor prevención de las complicaciones cardiovasculares, minimiza la progresión a retinopatía y nefropatía y probablemente ejerza un efecto beneficioso al evitar una mayor rigidez vascular condicionada por la HTA no tratada.
7. Grupos Farmacológicos en el Tratamiento de la HTA en la DM2
Aunque todos los grupos farmacológicos han demostrado beneficio potencial en el tratamiento de la HTA en la DM2 y en la morbimortalidad, los fármacos bloqueadores del sistema renina angiotensina-aldosterona (SRAA), inhibidores de la enzima conversiva de la angiotensina (IECAs) y antagonistas de los receptores de la angiotensina II (ARA II), ejercen un beneficio adicional al disminuir la albuminuria, retrasar la progresión de la enfermedad renal, reducir el riesgo de enfermedad cardiovascular y mostrar efectos beneficiosos sobre la resistencia a la insulina y la aparición de diabetes de novo. Estos resultados se han mostrado también en diabéticos normotensos o pacientes con alto riesgo cardiovascular. Todo ello hace que sean los agentes de elección para inicio del tratamiento. En la tabla 5 se muestran los sucesivos escalones o pasos en el tratamiento farmacológico de la hipertensión arterial en la DM2.
7.1. Bloqueadores del sistema renina angiotensinaaldosterona (IECA s-ARA II )
La adscripción de los ARA II a la terapéutica antihipertensiva se produjo aproximadamente diez años más tarde que aparecieran los IECAs. Aunque los efectos clínicos de aquellos parecían idénticos a los demostrados con los IECA, su mecanismo de acción no es enteramente similar pues producen una inhibición más completa de la angiotensina II sin afectar a la enzima conversiva. Esto se tradujo en una menor prevalencia de efectos secundarios, derivados principalmente por la ausencia de tos (5-20 % con los IECA) y prácticamente del angioedema (0,1 ¿ 0,2 % con los IECA). Inicialmente, su indicación básica fue la sustitución de un tratamiento con IECA no tolerado por tos24. Sin embargo, en los años siguientes numerosos ensayos clínicos demostraron que los ARAII tienen una efectividad antihipertensiva similar a los IECA25, y un efecto cardioprotector y renoprotector26-29 comparable a la de dichos fármacos.
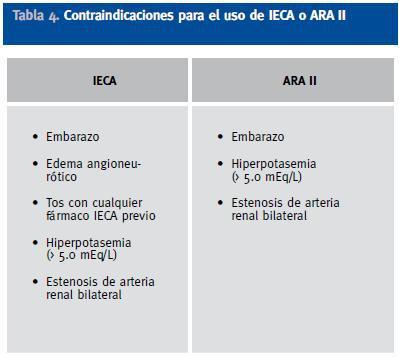
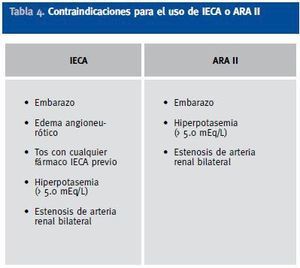
El papel renoprotector de los IECAs-ARA II se ha mostrado en múltiples ensayos clínicos en los cuales dicho efecto parece haber sido independiente del grado de control de la presión arterial. Aunque sean el primer escalón en el tratamiento de la HTA en la DM2, para conseguir el objetivo de PA en la diabetes se requerirá en al menos 2 de cada 3 casos utilizar combinaciones terapéuticas. Y a pesar de que son los grupos farmacológicos mejor tolerados, se deberá prestar especial atención a sus posibles efectos secundarios, puesto que son la principal causa de falta de adherencia terapéutica. En la tabla 4 se muestran las contraindicaciones para el uso de IECA o ARA II.
7.1.1. E studios con IECA -ARA II en prevención primaria y secundaria de la nefropatía diabética.
- En relación a la prevención primaria (pacientes normoalbuminuricos), el estudio BENEDICT(29) demostró que trandolapril tanto en monoterapia como asociado a verapamilo fue capaz de disminuir la tasa de aparición de microalbuminuria en pacientes diabéticos tipo 2 normoalbuminuricos (cociente albúmina/creatinina en orina < 30 mg/g).
- En la nefropatía diabética incipiente (cociente albúmina/creatinina en orina entre 30-300 mg/g):
- En el subestudio MICRO-HOPE18, el tratamiento de un IECA (ramipril) frente a placebo redujo en un 24 % el riesgo de progresión de microalbuminuria.
- El estudio IRMA-230, Irbesartán en dosis de 300 mg consiguió reducir el riesgo relativo de aparición de proteinuria en un 70 %.
- El estudio MARVAL31 demostró que valsartán comparado con amlodipino era capaz de reducir la microalbuminuria y revertirla a normoalbuminuria en un 30 % de los casos.
- El estudio DETAIL32 comparó el efecto renoprotector de telmisartán frente a enalapril en DM2 con diferentes grados de albuminuria (4-1.011 μg/min) midiendo el filtrado glomerular por isotópos radiactivos, mostrando una similar eficacia renoprotectora tanto de un IECA como un ARA II.
- En nefropatía diabética establecida los estudios IDNT33 y RENAAL26 han demostrado un claro beneficio de los ARA II en términos de renoprotección para un grado de control de la PA similar (IDNT: irbesartán vs amlodipino o placebo. RENAAL: losartán 50-100 mg/día vs placebo).
Un análisis ¿post hoc¿ del estudio RENAAL27 mostró que el factor de riesgo mas relevante para la progresión de la nefropatía fue el mayor grado de proteinuria tanto al inicio del estudio como a los seis meses de tratamiento. Es por ello que uno de los objetivos adicionales del tratamiento de la HTA en el paciente diabético es intentar conseguir la máxima reducción de la proteinuria (< 0,3-0,5 g/24 horas).
La elección entre IECAs o ARA II en la DM no se puede hacer en base a estudios ya que no hay análisis comparativos en diabéticos salvo el estudio DETAIL32 que mostró igual eficacia en ambos. Los ARA II son fármacos con una excelente tolerancia sin presentar algunos efectos adversos de los IECA (por ejemplo la tos), y ello puede influir en su elección. Existen vías enzimáticas alternativas que actúan sobre la producción de angiotensina II, como las quimasas producidas a nivel del miocardio, y esta vía no está bloqueada por los IECAs. El bloqueo directo del receptor de la angiotensina II evita su activación por otros posibles mecanismos. Los bloqueadores del SRAA tienen por otra parte un perfil positivo sobre el metabolismo hidrocarbonato al mejorar la sensibilidad a la insulina.
Todos estos argumentos establecen la indicación de fármacos que bloqueen el SRAA como primera opción de tratamiento en la HTA del diabético.
7.1.2. Bloqueo dual: IECA + ARA II
La combinación ARA II con IECA en nefropatía diabética ha sido poco estudiada. En ensayos con escaso número de pacientes y tiempos de seguimiento cortos se ha comprobado que produce una reducción adicional del grado de proteinuria34-35.
Recientemente se ha publicado el estudio ONTARGET36 que analizó comparativamente la efectividad de la asociación Ramipril y Telmisartán versus la monoterapia con estos mismos agentes. El número de pacientes incluido (todos con elevado riesgo CV y 37 % diabéticos) fue de 25.600 y el seguimiento de 56 meses. La morbimortalidad CV fue similar en los tres brazos del tratamiento. Sin embargo, el bloqueo dual se asoció con una mayor proporción de efectos adversos.
7.1.3.- I nhibidores directos de la renina
La utilización de IECA y/o ARA II ha supuesto un importante avance en el tratamiento de la nefropatía diabética en cualquiera de sus fases evolutivas. Su efecto renoprotector está directamente ligado con su capacidad para reducir la microalbuminuria-proteinuria. Sin embargo, aproximadamente, un 30-50 % de casos con nefropatía diabética establecida evolucionan en el plazo de 10 años (si antes no han fallecido por complicaciones CV) a enfermedad renal terminal. Son necesarias otras estrategias terapéuticas. Un nuevo grupo de agentes antihipertensivos, los inhibidores directos de la renina (Aliskirén es su único representante en la actualidad), ha sido incorporado al arsenal terapéutico. Su efectividad antihipertensiva parece similar a la de los IECA y ARA II en pacientes con HTA esencial. Un trabajo recientemente publicado muestra que aliskiren que tiene un efecto antiproteinúrico adicional cuando se añade a 100 mg de Losartán37. La confirmación de este superior efecto renoprotector (y de su aparente buena tolerabilidad) necesita de estudios con mayor número de pacientes y tiempos de seguimiento prolongados.
7.2.- Diuréticos
Aunque los diuréticos producen alteraciones metabólicas en el paciente diabético, su administración a dosis bajas se ha seguido de una reducción de los eventos cardiovasculares38. La restricción de sal y los diuréticos contribuyen al control de la HTA en el paciente diabético a través de una disminución del capital de sodio corporal y del volumen extracelular. El mecanismo por el que los diuréticos favorecen la aparición de hiperglucemia parece estar relacionado con la reducción de la conversión de proinsulina a insulina en presencia de hipokaliemia o por una inhibición directa del diurético sobre la secreción de insulina por el páncreas.
Los efectos metabólicos dependen del tipo de diurético y de las dosis administradas. La mayoría de estudios con diuréticos se han realizado con clortalidona cuya biodisponibilidad es similar a la hidroclorotiazida, pero la vida media es de 48 horas y una mayor relación dosis/respuesta, lo que hace que la clortalidona sea un diurético mucho más potente y con más efectos secundarios que la hidroclorotiazida. La administración de dosis bajas de hidroclorotiazida (12.5¿25mg) pueden evitar el desarrollo de hipokaliemia y otras alteraciones metabólicas asociadas (dislipemia e hiperuricemia)13. La adición de un diurético mejora la eficacia antihipertensiva de los IECAs o ARA II y su administración conjunta reduce el riesgo de hipokaliemia inducida por aquellos.
Por todo ello, y dado que la gran mayoría de los hipertensos diabéticos necesitan más de un fármaco para el control óptimo de la presión arterial, la combinación en un solo comprimido de un bloqueador del SRAA y un diurético4, preferiblemente a baja dosis (12.5 mg/día), constituye el tratamiento de elección de inicio en el diabético hipertenso.
En el caso de que el paciente no realice una dieta hiposódica puede ser necesario aumentar la dosis de la hidroclorotiazida a 25 mg/día, a sabiendas de que puede acentuar los efectos secundarios metabólicos citados.
En pacientes con glucosa anómala en ayunas o con presencia de componentes del llamado síndrome metabólico (obesidad abdominal, hipertrigliceridemia, HDL-c bajo) o con factores predisponentes (sedentarismo, carga genética de DM de mal pronóstico), en los que interesa minimizar las alteraciones metabólicas derivadas del tratamiento farmacológicos, el segundo fármaco de elección podría ser un antagonista de los canales del calcio. Recientemente, el estudio STAR39 ha demostrado que en pacientes hipertensos con glucosa anómala en ayunas, la administración de una combinación de un IECA (trandolapril) con una antagonista del calcio (verapamil) en dosis fija reduce el riesgo de aparición de diabetes de novo comparado con una combinación de losartán e hidroclorotiazida.
Por otra parte, en los pacientes con una creatinina sérica superior a 1,5-1,7 mg/dl o con un filtrado glomerular inferior a 30-40 ml/min, se deben utilizar diuréticos de asa (furosemida o torasemida).
7.3.- Antagonistas de los canales del calcio
Este grupo farmacológico se encuentra entre los antihipertensivos más eficaces, especialmente si se quiere alcanzar el objetivo de PA < 130/80 mm Hg. Para conseguir dicha cifra el 65 % de los pacientes requieren dos o más fármacos40. En el estudio RENAAL26, el 80 % de los pacientes en ambos grupos recibían antagonistas del calcio para conseguir el control de la PA. Constituyen, por tanto, los fármacos de 2º o 3º escalón en el tratamiento de la HTA en el diabético. Una de las limitaciones es que un significativo porcentaje de pacientes, hasta el 20 ¿ 30 %, desarrollan edema maleolar. Este efecto secundario es menos frecuente con antagonistas del calcio no dihidropiridinicos (verapamil)41 y con antagonistas del calcio de nueva generación (manidipino, barnidipino y lercanidipino). Por otra parte, parece que este efecto secundario también es menos frecuente cuando se administra de forma conjunta con un bloqueador del SRAA. Ello puede deberse a que la venodilatación inducida por el bloqueador del SRAA disminuye el secuestro de líquido intersticial en el lecho capilar inducido por la vasodilatación arteriolar del antagonista del calcio.
7.4.- Betabloqueantes
A pesar de que ejercen unos claros efectos negativos sobre el metabolismo hidrocarbonado, especialmente asociados a diuréticos, los betabloqueantes han demostrado reducir la morbimortalidad en pacientes con DM210. No obstante en el estudio LIFE28, un ARA II (losartán) mostró mayor beneficio sobre los eventos cardiovasculares que el atenolol. Los betabloqueantes presentan otros problemas relevantes en el diabético como el enmascaramiento de las crisis hipoglucémicas y la posible exacerbación de la enfermedad vascular periférica, altamente prevalente en estos pacientes. Los efectos secundarios y su tolerancia van a depender, entre otros aspectos, de su cardioselectividad.
Los betabloqueantes son de indicación inequívoca en pacientes con cardiopatía isquémica o con insuficiencia cardiaca (asociados a IECAs o ARA II y diuréticos). Los betabloqueantes más usados son el atenolol, bisoprolol, metoprolol, nebivolol y carvedilol. En la insuficiencia cardiaca se recomienda iniciar con dosis bajas e ir incrementándolas progresivamente. Metoprolol tiene la ventaja sobre atenolol que tiene un porcentaje importante de metabolización extrarrenal. Por ello se puede utilizar en pacientes con disminución del filtrado glomerular sin problemas de acumulación.
Carvedilol es un fármaco que combina efecto betabloqueante no selectivo y antagonista alfa adrenérgico con algunas ventajas sobre los betabloqueantes clásicos, especialmente en cuanto a tolerancia y ausencia de efecto perjudicial sobre el metabolismo hidrocarbonato. Se recomienda, en insuficiencia cardiaca, iniciar a dosis bajas (6.25 mg/12 h) e ir incrementando progresivamente.
7.5.- Otros fármacos
Con frecuencia no se logra un óptimo control de la PA a pesar de administrar tres o cuatro fármacos. Los fármacos a considerar en el siguiente escalón son los bloqueadores alfa. Entre ellos el más usado es la doxazosina que es eficaz en el control de la presión arterial, además de presentar un excelente perfil metabólico y mejorar la resistencia a la insulina. También ejerce un efecto beneficioso en varones con hipertrofia benigna de próstata. Se recomienda su administración por la noche. Su forma de presentación de liberación retardada evita el efecto secundario más relevante de este fármaco que es la hipotensión ortostática. Se debe tener cierta precaución cuando se administre en pacientes con insuficiencia cardiaca que no reciban diuréticos ya que en el brazo de pacientes con doxazosina del estudio ALLHAT40 se detectó mayor prevalencia de insuficiencia cardiaca. Se recomienda asociar diuréticos previamente para evitar este efecto.
Otros fármacos a utilizar son los agentes de acción central como la moxonidina, que actúan sobre los receptores imidazólicos que modulan la actividad del sistema nervioso simpático, en vez de actuar directamente sobre este, reduciendo las resistencias vasculares periféricas. No tiene efecto perjudicial sobre el metabolismo hidrocarbonado. Entre sus efectos secundarios destaca la sedación y sequedad de boca en un 2-5% de los pacientes.
8. Precauciones en el manejo de IECA -ARA II
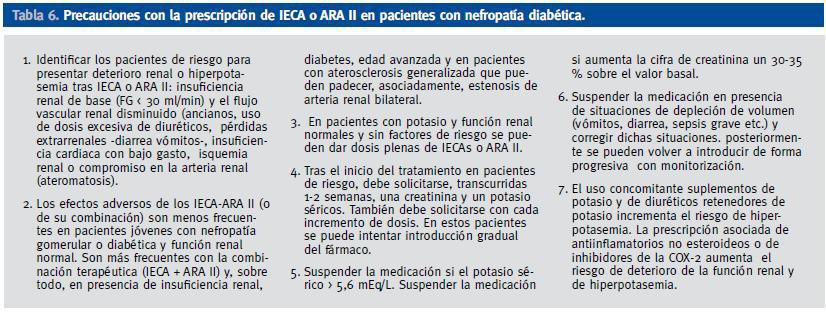
Tras el inicio del tratamiento con fármacos que bloqueen el SRAA se deben tener algunas precauciones, especialmente relacionadas con el posible deterioro en la función renal y el desarrollo de hiperpotasemia. Estas precauciones, no tienen por qué ser universales, sino en aquellos que tengan factores de riesgo para desarrollarlas.
8.1.- Deterioro renal tras IECA -ARA II
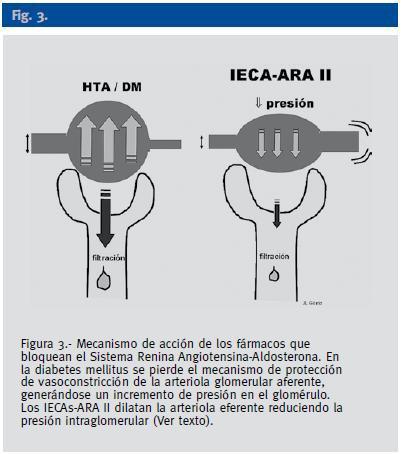
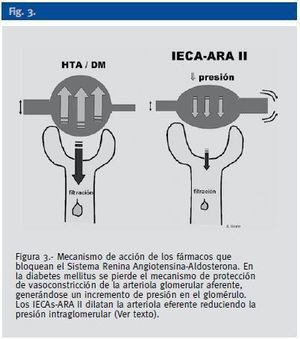
En el paciente diabético se pierde precozmente la capacidad autorreguladora del flujo vascular intrarrenal, con lo que la PA sistémica se transmite al capilar glomerular que debe soportar presiones de filtración muy superiores a las fisiológicas. Con la administración de IECAs y/o ARAII se produce un efecto deseado renoprotector de disminución de la presión en el capilar glomerular derivada de la mayor expresión de receptores de angiotensina II en la arteriola eferente respecto de la aferente. Esta caída en la presión hidrostática en el capilar glomerular puede seguirse de un deterioro del filtrado glomerular (Figura 3). Las circunstancias que incrementan el riesgo de deterioro de la función renal en el paciente diabético tratado con IECAs o ARAII son aquellas en las que o bien existe una insuficiencia previa evidente o latente, debida a una pérdida de masa nefronal, en especial con filtrados glomerulares inferiores a 30 ml/min, o bien existe un flujo vascular renal disminuido derivado del uso de diuréticos, pérdidas extrarrenales, insuficiencia cardiaca con bajo gasto o compromiso en la arteria renal, (vg estenosis bilateral de origen aterosclerótico) (Figura 3).
Si existe algún factor potencialmente reversible debe ser corregido antes de la administración de IECA-ARA II. Idealmente estos fármacos deberían introducirse de manera gradual y en dosis crecientes. En pacientes sin los citados factores de riesgo para desarrollar deterioro renal y que presenten un potasio basal normal no es imprescindible realizar un control analítico tras el inicio del tratamiento. Por el contrario, en aquellos que muestren factores de riesgo, como insuficiencia renal, K ≥ 5,0 mEq/L o que presenten hipotensión tras la primera dosis del fármaco es recomendable realizar un control de función renal y potasio a los 7-14 días de haber iniciado el tratamiento.
La detección de un discreto deterioro del filtrado glomerular, con incremento de la creatinina sérica < 25-30 %, tras iniciar el tratamiento con IECA o ARA II no debe constituir motivo de retirada ya que puede ser simplemente expresión de la pretendida disminución de la presión de filtración en el capilar glomerular, habiéndose relacionado con un mejor pronóstico a medio y largo plazo. En el Collaborative Study Group Trial of Captopril en diabetes tipo 1, los pacientes que presentaron mayor deterioro renal tras IECA mostraron un mayor enlentecimiento en la progresión posterior de la nefropatía42.
8.2.- Riesgo de hiperpotasemia tras IECA -ARA II
En condiciones fisiológicas puede eliminar todo el potasio que se le oferte. La hiperpotasemia aparece en pacientes con insuficiencia renal (dificultad para su excreción) o por alteraciones en la distribución del mismo (intra o extracelular, como en la acidosis metabólica, o por insuficiencia suprarrenal). Por ejemplo, si un paciente con función renal normal multiplica por cuatro la ingesta de potasio, solo se incrementará el potasio en sangre en 0,5 mEq/l, y la cifra de potasio sérico raramente llegará al nivel de 5,0 mEq/l.
No obstante existen dos excepciones:
1.- Una de ellas son los pacientes con creatinina ¿aparentemente normal¿ o insuficiencia renal oculta (vg creatinina sérica 1,2-1,3 mg/dl) en los que el filtrado glomerular está descendido (< 60 ml/min), ya sea por edad del paciente o especialmente en mujeres o personas con poca masa muscular en las que la creatinina sérica no es el mejor marcador de función renal. En esta situación la capacidad de excreción renal de potasio puede verse disminuida por el efecto antialdosterónico derivado de la toma de IECAs-ARA II, que puede agravarse si el paciente, además, ingiere una dieta rica en potasio o recibe otros fármacos, tales como los antiinflamatorios no esteroideos, que pueden interferir con el manejo renal de sodio y potasio.
2.- La segunda circunstancia es la presencia de un hipoaldosteronismo hiporreninémico. Esta situación es bastante común en pacientes afectos de nefropatía diabética y se ha relacionado con un déficit de aldosterona secundario a un defecto en la conversión de la prorrenina en renina43. Esta situación se puede agravar especialmente por la administración concomitante de fármacos como antiinflamatorios no esteroideos, IECAs y ARA II.
Los factores favorecedores de la hiperkaliemia son la edad avanzada, diabetes mellitus con potasio basal elevado, insuficiencia renal, depleción de volumen, uso de sales de potasio como suplemento, tratamiento previo con IECAs-ARA II, antiinflamatorios no esteroideos, espironolactona, amiloride, ß-bloqueantes, altas dosis o combinaciones de los anteriores tratamientos e hipoperfusión tisular (ateromatosis generalizada)44. En todos estos casos se recomienda realizar un control analítico a los 7 o 14 días de haber iniciado el tratamiento (Ver tabla 6)
¿Qué hacer si el paciente presenta hiperpotasemia?
Si la cifra es > 5,5 mEq/L:
1.- Restringir los alimentos con alto contenido en potasio (frutas, frutos secos, dátiles, higos secos, pasas, productos derivados del chocolate y las setas). No tomar ¿sal de régimen¿ ya que contiene cloruro potásico. Los caldos concentrados (avecrem y similares) así como la leche en polvo tienen alto contenido en sodio y potasio.
2.- Si persiste la hiperpotasemia, se pueden utilizar diuréticos de asa (furosemida o torasemida) o añadir resinas captadoras de potasio (Poliestireno sulfonato cálcico), 1 sobre de 15 g después de comida y cena, teniendo en cuenta que el sabor no es agradable y que produce cierto grado de estreñimiento (dosis dependiente). Hay que corregir la acidosis metabólica (bicarbonato sódico) si está presente.
3.- Finalmente si continúa con niveles > 5,5 mEq/L, puede asumirse que el paciente tiene hipoaldosteronismo hiporeninémico y que no está indicado el uso de bloqueantes del SRAA. Se utilizarán diuréticos, antagonistas del calcio, doxazosina o incluso betabloqueantes (aunque tienen un efecto inhibidor de la renina, pero menos potente que los IECA-ARA II), siendo el objetivo controlar igualmente la presión arterial (< 130/80 mm Hg).
Finalmente y dentro del control global del riesgo CV en el diabético se sugiere reducir la cifra de LDL colesterol a niveles < 70 mg/dl en todos los pacientes con enfermedad vascular aterosclerótica establecida sobre todo en cardiopatía isquémica45. Sin embargo, en relación con el control glucémico dos ensayos muy recientes46-47 no han apoyado la necesidad de reducir la HbA1c a cifras < 6,5 % pues parece aumentar la morbimortalidad de origen CV. Se aconseja mantener el objetivo de HbA1c < 7 %.
En resumen, el control estricto de la PA hasta cifras menores de 130/80 mm Hg en los pacientes con DM2 reduce la morbimortalidad cardiovascular y renal en mayor grado que el control del resto de las complicaciones. Para ello es necesaria la asociación de más de un fármaco antihipertensivo, iniciando la terapéutica con fármacos que bloqueen el sistema renina angiotensina aldosterona. Esta actitud debe formar parte del abordaje multifactorial del control de los factores de riesgo en el paciente diabético.
PUNTOS CLAVE
La hipertensión arterial (HTA ) presenta una alta prevalencia en el paciente con diabetes mellitus tipo 2 y supone un importantísimo factor de riesgo cardiovascular.
La hiperinsulinemia, retención de sodio y el incremento de la reactividad vascular son los principales mecanismos patogénicos de la HTA en el diabético, y por ello las dianas a tratar.
El control estricto de la presión arterial (< 130/80 mmHg) en el diabético es fundamental para conseguir reducir la morbimortalidad cardiovascular. Para ello se necesitarán al menos dos o tres fármacos, además de las medidas higiénicos dietéticas, siendo recomendable la utilización de combinaciones farmacológicas fijas.
La utilización de fármacos que bloqueen el Sistema Renina Angiotensina Aldosterona ha demostrado conseguir efecto beneficioso sobre la aparición y desarrollo de albuminuria y progresión de la enfermedad renal, además de los efectos derivados de la reducción de la presión arterial.
Figura 1. Mecanismos patogénicos en la hipertensión arterial de la diabetes
Tabla 1. Medidas no farmacológicas para el control de la presión arterial en la diabetes mellitus
Tabla 2. Inicio de tratamiento en pacientes con diabetes según niveles de presión arterial
Figura 2.
Tabla 3. Objetivos de la terapia antihipertensiva en diabéticos y pacientes de alto riesgo CV
Tabla 4. Contraindicaciones para el uso de IECA o ARA II
Tabla 5. Tratamiento farmacológico de la hipertensión arterial en la diabetes mellitus tipo 2
Tabla 6. Precauciones con la prescripción de IECA o ARA II en pacientes con nefropatía diabética
Figura 3.