El trasplante renal de donante vivo es la mejor opción para la mayoría de pacientes con enfermedad renal crónica en estadio 5, pero en un tercio de los casos se ve limitada por incompatibilidad ABO y/o HLA entre donante y receptor. Para resolver esta situación, las alternativas son la donación renal cruzada y la desensibilización, cada una con ventajas e inconvenientes. La desensibilización está al alcance de cualquier programa de trasplante renal, puede hacerse en situación de prediálisis y permite unos buenos resultados de supervivencia (paciente e injerto) a medio y largo plazo, con un aceptable perfil de complicaciones y una buena relación coste-beneficio.
En esta revisión analizaremos las principales controversias que afectan al proceso de desensibilización: tipo de aféresis, inmunosupresión, objetivos para realizar el trasplante con seguridad, perfil de las complicaciones (quirúrgicas, inmunológicas, infecciosas) y resultados, entre otros aspectos, y mencionaremos nuestra propia experiencia tras 48 trasplantes ABO incompatibles.
INTRODUCCIÓN
El trasplante renal (TR) de donante vivo es la mejor opción para la mayoría de pacientes con enfermedad renal crónica en estadio 5, pues permite obtener los mejores resultados funcionales y de supervivencia. Sin embargo, en torno a un 30% de las parejas donante-receptor son incompatibles, ya sea en grupo sanguíneo ABO y/o por la presencia de anticuerpos donante específicos anti-HLA. En esta situación, o se descarta el trasplante de vivo o, si se mantiene esta opción, las alternativas comprenden la donación renal cruzada (DRC) o la desensibilización (DS), alternativas que, en ocasiones, son complementarias más que antagónicas1.
La DRC es la mejor opción, pero se ve limitada por el número de parejas, los grupos sanguíneos de la pareja donante-receptor y el nivel de sensibilización HLA. La DS es más costosa, el nivel de inmunosupresión, mayor, lo que conlleva riesgos, y los resultados son inferiores a los obtenidos con un donante compatible (aunque superiores a los de la diálisis), sobre todo cuando coexisten incompatibilidad ABO y sensibilización HLA; por el contrario, permite elegir el momento del trasplante, lo que incluye la posibilidad de efectuarlo antes de que el paciente entre en diálisis, una situación ideal desde el punto de vista clínico, psicológico y también económico.
Las glucoproteínas del sistema ABH se expresan en la membrana de los eritrocitos y en múltiples tejidos y órganos. A nivel renal, en el epitelio de los túbulos contorneado distal y colector y en el endotelio vascular (capilares, arterias y venas), lo que explica el elevado riesgo de rechazo agudo mediado por anticuerpos tras un TR ABO incompatible —ABOi— (aunque el riesgo es bajo en caso de donante grupo A2 para receptor grupo O con títulos bajos de isoaglutininas). La intensidad de la expresión antigénica tisular es muy importante y podría explicar por qué algunos paciente presentan un rechazo humoral con títulos bajos de isoaglutininas y, por el contrario, otros lo hacen con títulos elevados2.
Tan pronto como en 1955, David Hume expresó su escepticismo acerca de que el TR ABOi fuese factible y esta idea se mantuvo varias décadas más; de hecho en las guías de la EDTA de 2000 todavía se consideraba como una contraindicación absoluta. Tras una primera experiencia en Bélgica en 1982, fue a partir de 1987 en Japón, debido a la escasez de donantes fallecidos, y posteriormente en Escandinavia, Estados Unidos y últimamente en Corea, Australia, Países Bajos, España, etc., que el TR de donante vivo ABOi se convirtió en una opción comúnmente aceptada para paliar el déficit de donantes3-6. Estas experiencias han hecho modificar las citadas guías, que actualmente lo incluyen como una opción terapéutica más7. En nuestro país, varios centros, incluido el nuestro, han iniciado este tipo de trasplantes a lo largo de la última década.
TRASPLANTE RENAL ABO INCOMPATIBLE: CONTROVERSIAS
A pesar de la creciente evidencia disponible, en ausencia de estudios controlados y aleatorizados, existen numerosas controversias, que distan de estar resueltas, dentro de los esquemas de DS (acomodación) en este tipo de trasplantes. Puede decirse que hay tantos esquemas de DS como centros realizan trasplantes ABOi, aunque las diferencias, con frecuencia, suelen ser menores.
Cuando se habla de DS se está hablando de modulación de la respuesta inmunológica mediante una o varias de las siguientes opciones:
• Depleción de anticuerpos mediante plasmaféresis —PFS— (recambios plasmáticos) o inmunoadsorción (IA).
• Reducir la producción de anticuerpos con esplenectomía (ya abandonada) o rituximab (RTX).
• Actuar de forma pleiotrópica sobre la respuesta inmune con inmunoglobulina intravenosa (IgIV).
• Inhibición de la activación del complemento con eculizumab.
• Nivel de inmunosupresión adecuado.
El objetivo es reducir el nivel de anticuerpos por debajo de un umbral prefijado, con el objetivo de minimizar el riesgo de rechazo agudo mediado por anticuerpos, que pueda comprometer la viabilidad del injerto.
Los temas de controversia más habituales son:
• Técnica de aféresis: PFS, IA, ninguna.
• Papel del RTX: siempre, cuándo, dosis.
• Utilidad de la IgIV.
• Método para cuantificar isoaglutininas.
• Tipo de inmunosupresión.
• Necesidad de aféresis postrasplante.
• Acomodación.
• Papel de las biopsias de protocolo.
• Perfil de las complicaciones (quirúrgicas, infecciosas, inmunológicas, tumorales).
• Resultados (frente a los del trasplante compatible o la diálisis).
• Impacto económico.
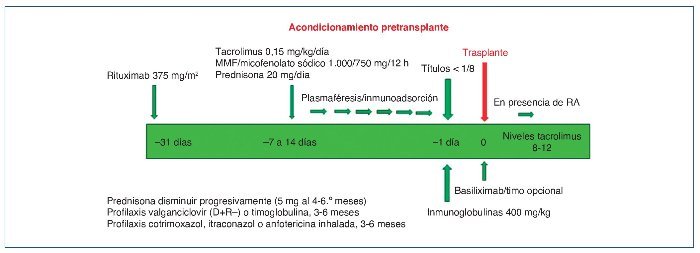
Estos puntos son los que se van a analizar en esta revisión, en función de la evidencia publicada y de nuestra propia experiencia basada en 48 TR ABOi, realizados en el período 2008-2018. Nuestro esquema de DS ABO está representado en la figura 1.
Figura 1. Protocolo de acondicionamiento de trasplante renal ABOi en A Coruña.
MMF: micofenolato mofetilo; RA: rechazo agudo.
Técnicas de aféresis
Todas las técnicas de aféresis disponibles, básicamente PFS, PFS de doble filtración (DF) e IA, son eficaces para reducir el nivel de anticuerpos (isoaglutininas) en el receptor de un TR ABOi2,8-10. En general, las columnas específicas (tipo Glycosorb ABO), que básicamente extraen isoaglutininas, son más eficientes, mejor toleradas y con menos efectos adversos11,12; por el contrario, tienen el inconveniente de que pueden reducir los niveles de anticuerpos IgG frente a antígenos polisacáridos del neumococo y Haemophilus (no afectan al nivel de anticuerpos frente al tétanos o la difteria). Su impacto clínico es desconocido10,12. Las columnas de IA no específica (tipos Therasorb, Immunosorba o Globaffin, etc.) son menos eficientes para extraer isoaglutininas de tipo IgM e inmunoglobulinas de subclase IgG313. La utilización de cada una de ellas dependerá de circunstancias locales o disponibilidad; por ejemplo, en Estados Unidos no se utilizan columnas de IA al no estar aprobadas por la FDA. En Europa, en general, se utilizan la IA (específica o no) y la PFS; en Estados Unidos, la PFS, y en Japón la DF, y, en menor medida, la PFS.
El coste económico de la IA es 2-3 veces superior al de la PFS (coste 600-1.000 euros/sesión), aunque el diferencial podría reducirse haciendo sesiones de IA más intensivas (3-5 volúmenes plasmáticos en cada sesión), lo que permitiría reducir más rápidamente los títulos de isoaglutininas, con una buena tolerancia, aunque la experiencia con estos tratamientos intensivos es limitada y no está claro si podrían saturar las columnas en pacientes con títulos altos de isoaglutininas10. Algún estudio ha recomendado la reutilización de las columnas de IA Glycosorb ABO14, pero el procedimiento no está estandarizado y el fabricante no se responsabiliza de sus consecuencias. Las columnas no específicas Therasorb son regenerables y, por tanto, reutilizables. Evidentemente pueden combinarse varias técnicas en un mismo paciente, por ejemplo PFS e IA, con el objetivo de reducir costes y efectos adversos.
El límite máximo de isoaglutininas para aceptar la DS varía entre programas; en general suele ser ≤ 1:512, aunque algunos programas aceptan títulos superiores15. Los pacientes con títulos muy altos son difíciles de desensibilizar, no solo por el elevado número de aféresis precisas (coste, efectos adversos), sino también por el rebote de anticuerpos que se produce después de cada procedimiento, lo que impide llegar al título objetivo para trasplantar con seguridad. En la mayoría de pacientes, los títulos basales de IgG suelen ser superiores a los de IgM. Es importante repetir los títulos de isoaglutininas al inicio de la DS, pues pueden variar significativamente respecto a controles previos, en relación con la propia técnica o porque realmente varíen, en relación con eventos inmunizantes o simplemente de forma fisiológica.
Otro aspecto que se debe considerar es el número de aféresis necesario para trasplantar, que dependerá del título basal de isoaglutininas, del procedimiento de aféresis empleado (tipo de técnica, volumen de plasma tratado por sesión) y del título objetivo prefijado por cada programa. Aunque el título de isoaglutininas para trasplantar varía entre centros, la mayoría acepta cifras < 1:8 (IgG e IgM), aunque algunos aceptan 1:16 e incluso 1:32, pero estas cifras hay que ponerlas en caución, toda vez que se pueden haber cuantificado mediante métodos poco precisos, con un alto nivel de subjetividad2. Normalmente, después de un procedimiento de aféresis estándar los títulos se reducen 2-3 pasos, para rebotar de forma variable, en general 1-2 pasos, lo que permite avanzar en la DS.
En nuestra experiencia, con un título objetivo < 1:8 , los pacientes con un título inicial de IgG < 1:32 necesitaron menos sesiones de aféresis (2,3 ± 1,5), mayormente PFS (89%), que aquellos con un título 1:32-1:256, que necesitaron 5,6 ± 1,2 sesiones, y en el 79% se utilizó la PFS; por último, los que presentaban títulos mayores de 1:256 (límite, 1:512) necesitaron 10,3 ± 2,9 sesiones, y se utilizó IA en el 30% o ambas técnicas, IA + PFS, en el 60%. Estos datos son similares a los publicados en la literatura4,9.
Cuando se han comparado diversas estrategias de IA en relación con la evolución, no se han encontrado diferencias en la reducción de los títulos de isoaglutininas, complicaciones, función renal, incidencia de rechazo o supervivencia del paciente o del injerto9. Cuando se han comparado IA y PFS, algún estudio no ha encontrado diferencias en la supervivencia del paciente o del injerto (censurada)5, mientras que otros señalan que ambas supervivencias son mejores en los pacientes tratados con IA16.
Un último punto que hay que considerar es la necesidad de aféresis en pacientes con títulos basales bajos de isoaglutininas (< 1:16). En un estudio del Hospital Clínic de Barcelona, basado en 16 TR ABOi con títulos basales < 1:16, tratados con RTX y PFS, y un título objetivo < 1:8, precisaron una media de 1,7 PFS, aunque los pacientes con títulos < 1:8 precisaron una o ninguna. No se hicieron PFS después del trasplante17. En otro estudio con 16 trasplantes y títulos basales ≤ 1:16, tratados con inmunosupresión basada en basiliximab y triple estándar, sin aféresis, la supervivencia del paciente y del injerto fue del 100% (a 3 años). Solo un paciente (con anticuerpos anti-HLA) desarrolló un rechazo agudo mediado por anticuerpos18. Estos y otros estudios indican que el esquema de DS debe de ser individualizado, cara a reducir costes y efectos adversos. Es factible, sin embargo, que los pacientes con títulos bajos de isoaglutininas puedan beneficiarse del empleo de PFS pretrasplante, a través de la depleción de mediadores proinflamatorios, y reducir el riesgo de rebote de isoaglutininas en el período postrasplante inmediato, un período crítico para el desarrollo de acomodación.
Papel del rituximab
El RTX es un anticuerpo monoclonal quimérico murino-humanizado frente al antígeno de membrana CD20, presente en los linfocitos B maduros y sus precursores, pero no en las células plasmáticas. Actúa por citotoxicidad (directa, mediada por anticuerpos y mediada por complemento) e inducción de apoptosis. Antes de su utilización, la esplenectomía se consideraba casi imprescindible para el éxito del TR ABOi, sin embargo se asociaba a múltiples complicaciones (quirúrgicas e infecciosas), además de su irreversibilidad, lo que llevó a su sustitución por el RTX, a modo de “esplenectomía farmacológica”, a partir del año 2002.
El empleo del RTX en el acondicionamiento ABO es controvertido en varios aspectos, fundamentalmente en definir si es imprescindible, cuándo administrarlo, dosificación y complicaciones.
El RTX no es imprescindible para el éxito de TR ABOi; así, en un reciente metaanálisis con 4.810 pacientes, un 45% se sometió a esplenectomía, un 35% se trató con RTX y el resto con ninguna de ellas16. Algunos grupos han abandonado su empleo, con buenos resultados19,20. En general se acepta que el empleo de RTX en TR ABOi reduce el rebote de isoaglutininas en el postrasplante precoz y el riesgo de rechazo agudo mediado por anticuerpos. También se ha objetivado que reduce la aparición de anticuerpos anti-HLA específicos de donante de novo y el riesgo de rechazo crónico mediado por anticuerpos respecto a los no tratados con RTX21.
Respecto a la dosificación, la más extendida es una sola dosis de 375 mg/m2 (o una dosis fija de 500 mg), que se recomienda en los trastornos neoplásicos de células B. Con esta dosis, en receptores adultos de un TR, se induce una completa depleción de células B en sangre periférica e injerto renal, efecto que se mantiene hasta 2 años; el efecto también es duradero, pero más limitado, en bazo y ganglios linfáticos22. Otros autores recomiendan dosis inferiores, incluso tan bajas como 50 o 100 mg/m2, con resultados similares a las dosis estándar23. La vida media del RTX es de unos 12 días.
El efecto del RTX se aprecia muy rápidamente, al eliminar las células B de sangre periférica dentro de las 72 h siguientes a su administración. El efecto máximo se presenta tras un período de 3 semanas a 6 meses, por lo que su administración, en los esquemas de DS, suele hacerse 1 mes antes de la fecha prevista del trasplante, aunque hay grupos que lo administran más tardíamente, en los días previos al inicio de la DS. El RTX es extraíble por PFS, por lo que esta técnica se debe evitar durante al menos 3 días después de la administración del fármaco.
En general, el RTX es bien tolerado. Pueden producirse reacciones alérgicas, en ocasiones graves, durante o poco después de la administración, por lo que se recomienda premedicación con acetaminofén y antihistamínicos. También se asocia a neutropenia, hipogammaglobulinemia y reactivación de infecciones como citomegalovirus (CMV), tuberculosis, hepatitis B o virus JC. El aumento de otras infecciones, que no se encuentra siempre, es difícil de desligar del resto de la inmunosupresión utilizada24.
Inmunoglobulina intravenosa
La IgIV tiene múltiples efectos sobre la respuesta inmune, algunos de los cuales no están bien definidos. Se acepta que los más importantes son: el bloqueo del receptor Fc de la membrana leucocitaria, la inhibición de la activación del complemento y la inducción de anticuerpos antiidiotipo, que tienen un efecto neutralizante sobre los anticuerpos anti-HLA circulantes. Su papel en el trasplante de órgano sólido se ha revisado en los últimos años25,26. Varios estudios, incluido un ensayo clínico multicéntrico27, han demostrado la eficacia de la IgIV en DS HLA y en facilitar el acceso al trasplante de pacientes hiperinmunizados, pero también en el tratamiento del rechazo agudo mediado por anticuerpos25 o en el rechazo celular refractario28.
El papel de la IgIV en el trasplante ABOi está peor definido, aunque se ha analizado en varios estudios observacionales, en general asociada a otros tratamientos, en especial RTX. Hay evidencia de que el empleo profiláctico de IgIV reduce el rebote de anticuerpos en el posoperatorio, el riesgo de rechazo agudo y mejora la supervivencia del injerto25. Su efecto beneficioso sobre el riesgo infeccioso está por definir. El empleo rutinario de IgIV dentro de los esquemas de DS en TR ABOi no es universal y muchos grupos no la utilizan2,9 o la han abandonado con buenos resultados29.
Aunque algunos grupos utilizan dosis bajas de IgIV (100 mg/kg) después de cada procedimiento de aféresis, la dosis más habitual, al menos en Europa, es de 500 mg/kg de inmunoglobulina inespecífica, administrada la víspera del trasplante (día –1), aunque algún grupo30 prefiere dividir la dosis y administrarla los días –4 y –1 para evitar una sobrecarga de volumen o un ascenso de los títulos de isoaglutininas, esto último es especialmente frecuente con algunos tipos de preparaciones de IgIV que contienen concentraciones altas de isoaglutininas31, lo que también puede conllevar un mayor riesgo de anemia hemolítica autoinmune (test de Coombs positivo)32.
En general, los efectos adversos son ligeros: cefalea, náuseas, astenia, mialgias, artralgias, escalofríos y dolor lumbar. Se han descrito complicaciones graves como meningitis aséptica o eventos trombóticos, pero son muy infrecuentes y la causalidad no siempre está clara. Algunos casos de eventos trombóticos coronarios y también de daño renal agudo, por necrosis tubular aguda con presencia de vacuolización (nefropatía osmótica), se han observado en pacientes tratados con dosis altas de algunas preparaciones de IgIV que tienen un alto contenido de sucrosa y elevada osmolaridad33.
Métodos para cuantificar isoaglutininas
Las isoaglutininas son anticuerpos naturales, de tipo IgG e IgM y, en menor medida, de tipo IgA (sobre todo en pacientes grupo O). Los títulos de anticuerpos varían entre individuos, con la edad, en respuesta a eventos inmunizantes (vacunas, infecciones o embarazos) e incluso de forma estacional.
Conocer el nivel (títulos) y tipo de isoaglutininas es un aspecto fundamental para decidir la posibilidad real de DS y la modalidad de aféresis. El método de cuantificación ideal debería de ser: fácil, rápido, sencillo, económico y reproducible. Hay diversos métodos: hemaglutinación por centrifugación; hemaglutinación en microtarjeta de gel; ELISA; citometría de flujo; resonancia superficial de plasmones, etc. Los métodos convencionales basados en hemaglutinación (técnica de tubo) tienen grandes limitaciones debidas al tiempo de centrifugación, la temperatura, la concentración de eritrocitos y si estos son del donante o son células comerciales (pool), entre otras. El método de referencia sería la citometría de flujo34, pero no es practicable en la clínica diaria y menos durante el proceso de DS, en el que el flujo de información debe ser ágil; además tiene un coste elevado.
Dadas las limitaciones del método tradicional de hemaglutinación, las técnicas de microtarjeta de gel, para isoaglutininas de tipo IgG e IgM frente a eritrocitos del donante o células comerciales, son las más utilizadas en la actualidad, al aproximarse razonablemente al método ideal, y además reducen la variabilidad intraindividual e intercentros35.
Durante el proceso de DS, suelen monitorizarse los títulos de isoaglutininas antes de iniciarse los procedimientos de aféresis y posteriormente al finalizar cada sesión y antes de la siguiente, para ver el nivel de rebote. Siempre que sea posible se harán frente a hematíes del donante y de no ser así frente a células comerciales (los resultados pueden variar). En nuestro programa, hacemos el último control de isoaglutininas la víspera del trasplante (tras la última aféresis) y a veces la mañana de la cirugía (estos trasplantes se hacen por la tarde), para descartar rebote tras la administración de la IgIV en pacientes con títulos previos en el límite deseado.
Como se comentó previamente, el nivel de isoaglutininas más aceptado para trasplantar es < 1:8, con variaciones entre centros2. Los títulos basales de anticuerpos (pre-DS) y los títulos postrasplante tienen un bajo poder predictivo de desarrollo de rechazo mediado por anticuerpos (RMA)36.
Tras el alta hospitalaria, la monitorización rutinaria de isoaglutininas no es necesaria, salvo que existiese indicación clínica para ello.
Inmunosupresión
Normalmente es similar a la de un paciente estándar, basada en esteroides, tacrolimus y derivados del ácido micofenólico, tratamiento que se introduce en el momento de iniciar la DS. Las dosis y los niveles valle son los habituales. Ya se comentó el papel del RTX y la IgIV. En la mayoría de los programas utilizamos inducción con basiliximab (días 0 y +4), o bien timoglobulina en pacientes con criterios de alto riesgo inmunológico5.
Un aspecto controvertido es la retirada de esteroides. Se ha visto que la retirada precoz es razonablemente segura en pacientes seleccionados, aunque la incidencia de rechazo agudo es superior36. La información sobre la retirada tardía también es limitada. Un estudio reciente mostró que la retirada tardía se asociaba a una incidencia de rechazo agudo del 19%37. La realización de una biopsia previa a la retirada, para descartar rechazo subclínico, podría facilitar el abordaje de estos pacientes36. Los inhibidores de mTOR utilizados de novo se asociaron a una alta tasa de complicaciones quirúrgicas (40%), en general ligeras, y a una incidencia de rechazo celular del 12%; por el contrario, el riesgo de infección por CMV es menor (4%)38. No hay evidencia que permita recomendar cualquier esquema de minimización de inmunosupresión en receptores de un trasplante ABOi.
Aféresis postrasplante
Aunque, de nuevo, hay diferencias entre centros, la tendencia actual es que, en ausencia de sensibilización HLA, las aféresis rutinarias postrasplante no son necesarias, aun en pacientes con un rebote de isoaglutininas, y se reservan para pacientes que presenten alguna indicación clínica: injerto inicialmente no funcionante, sospecha de rechazo agudo, deterioro funcional sin causa evidente, etc.12,29,39. Nuestra propia experiencia indica que el empleo rutinario de aféresis postrasplante no añade beneficio clínico alguno.
Algunos grupos las mantienen de forma rutinaria durante la primera semana, 1 a 3 procedimientos; otros solo en pacientes con títulos basales altos de isoaglutininas (pre-DS) o en caso de rebote de anticuerpos durante el período posoperatorio, sin que exista acuerdo sobre el título a partir del cual estarían indicadas11,12.
Acomodación
En la década de los ochenta del pasado siglo, se publicaron algunos trabajos en los que se comunicaba que la reducción del nivel de isoaglutininas antes de un TR ABOi permitía prolongar la supervivencia del injerto a largo plazo40,41. También se objetivó que, a pesar de la detección de anticuerpos circulantes y de la persistencia de expresión antigénica a nivel del injerto, este no se rechazaba42. Basándose en estos y otros hallazgos, se razonó que era factible que el injerto desarrollase algún cambio que lo hacía refractario al daño humoral, y a esta condición se la denominó “acomodación”, y se supuso que tendría aplicación clínica, fundamentalmente en el campo del xenotrasplante43 y, posteriormente, en el trasplante de órgano sólido en general44. En la actualidad se acepta en que es un fenómeno especialmente frecuente en el TR ABOi11,12,45. Su papel en el trasplante HLA incompatible es más controvertido45,46.
La acomodación en trasplante ABOi se ha intentado definir por la presencia de una serie de criterios, como serían: isoaglutininas circulantes, histología renal normal, expresión de antígeno A o B en el injerto y una función renal normal47. En 2006, la American Society of Transplantation alcanzó un consenso para establecer que ocurría acomodación cuando se detectaba C4d en los capilares peritubulares (CPT), sin daño histológico, y en presencia de una función renal normal11. La acomodación es diferente de la tolerancia, es un estado de no respuesta inmune a antígenos extraños en ausencia de tratamiento inmunosupresor. La acomodación se mantiene si el injerto se trasplanta a un nuevo receptor, la tolerancia no.
Los mecanismos de la acomodación no están bien definidos pero, de forma simplificada, parece que se origina por un daño endotelial no letal, debido a un nivel bajo de anticuerpos o con poca afinidad y al bloqueo de la activación del complemento44-49, que llevan a que se produzcan cambios fenotípicos a nivel del endotelio que lo hacen refractario al daño mediado por anticuerpos37. Estos cambios se desarrollan dentro de las 2-3 primeras semanas del trasplante y explican, al menos en parte, que no sea necesario tratamiento alguno cuando se produce un rebote de isoaglutininas postrasplante en pacientes asintomáticos50. En el TR ABOi, la acomodación se ve facilitada por: reducción del nivel de isoaglutininas (aféresis), bloqueo de la activación del complemento (IgIV) e inmunosupresión (RTX, etc.). Hay evidencia de que las columnas de IA específicas (Glycosorb ABO) también bloquean la activación del complemento51. Por último, el eculizumab, un anticuerpo monoclonal frente al factor C5, podría facilitar el desarrollo de acomodación, pero también el que receptores de un TR ABOi pudieran trasplantarse con títulos altos de isoaglutininas (con o sin intento de DS), con el objetivo de evitar el riesgo de un rechazo agudo precoz mediado por anticuerpos y facilitar la viabilidad del injerto52. Eculizumab es eficaz como terapia de rescate del rechazo humoral grave y del rechazo refractario53,54.
Papel de la biopsia de protocolo
En ausencia de sensibilización HLA e indicación clínica, la utilidad de este tipo de biopsia no está clara, aunque en ocasiones puede aportar información relevante.
En un estudio publicado en 2006, en biopsias de protocolo o por indicación clínica, realizado en 24 receptores de un TR ABOi y 66 HLAi, se concluyó que la presencia de C4d en los CPT (biopsia de protocolo o indicación) se asoció con signos histológicos de RMA en los receptores de un TR HLAi, pero no en los de un ABOi. En este caso, la positividad del C4d alcanzó el 75% (en su mayoría eran biopsias de protocolo)55. En otro estudio retrospectivo, en el que se investigó la presencia de C4d en 89 biopsias de protocolo de 48 trasplantes ABOi, que fueron comparadas con 250 controles procedentes de 133 TR ABO compatibles (ABOc), el 94% de los injertos ABOi presentaba depósito de C4d en los CPT (difuso en un 66%). Este depósito no se asoció a signos histológicos de RMA. No se apreciaron diferencias en la incidencia de glomerulopatía de trasplante. Los autores concluyen que la presencia de C4d en un riñón ABOi, en una biopsia de protocolo por lo demás normal, no tiene relevancia diagnóstica o terapéutica56. En línea con esta observación, en un estudio basado en 33 receptores de un TR de donante vivo ABOi tras DS, a los que se les realizó una biopsia de protocolo a los 1 y/o 3 y 6 meses, a 28 de los cuales se les realizó además una biopsia a los 12 meses, se objetivó que la presencia de C4d en CPT, sin otros signos de rechazo, se asoció con menores índices de cronicidad: glomerulopatía de trasplante, fibrosis intersticial/atrofia tubular (FI/AT) y fibrosis intimal arterial57. La positividad del C4d en CPT es frecuente en biopsias tempranas postrasplante y tiende a decaer con el paso del tiempo58.
En un estudio basado en 10 TR ABOi, con biopsias de protocolo a los 0 y 7 días y 3, 6, 12 y 18 meses, se objetivó un rechazo agudo IIa de Banff en la biopsia del día 7 en 3 pacientes, y en 1 paciente en las biopsias de los 3 y 6 meses, respectivamente. Estos 5 episodios se resolvieron con tratamiento esteroideo. Aunque 7 pacientes presentaron viremia BK, en ningún paciente se objetivó nefropatía por poliomavirus (NPV)59. En un amplio estudio realizado con 327 pacientes que recibieron un TR de donante vivo tras DS basada es RTX y PFS, de los cuales 101 eran ABOi, que fueron biopsiados de forma protocolizada a los 3 y 12 meses, no se encontraron diferencias histológicas significativas entre ambos grupos (ABOi frente a ABOc); específicamente, la incidencia de rechazo agudo, FI/AT y NPV fueron similares60.
En resumen, en un TR ABOi, la presencia de C4d en los CPT, en ausencia de otros hallazgos histológicos, es un signo de acomodación y no tiene otra relevancia clínica. El valor diagnóstico de la presencia de C3d, con o sin C4d, está por definir29,55. El diagnóstico de RMA se basará en criterios morfológicos, inmunohistoquímicos y serológicos, según las recomendaciones del Consenso de Banff61.
Perfil de las complicaciones
• Complicaciones quirúrgicas. Con la excepción de la hemorragia, son las habituales de cualquier TR29. El incremento del riesgo de hemorragia se objetiva tanto es series individuales como en series basadas en registros, aunque no siempre alcanza significación estadística al compararlo con el riesgo en trasplantes compatibles62-66. Se aprecia tanto en pacientes tratados con PFS como con IA66, aunque un estudio señala que es más frecuente en pacientes tratados con IA específica67. Se han implicado diferentes factores: coagulopatía secundaria a aféresis64, trombopenia/trombopatía en relación con el número de procedimientos de aféresis67, heparinización durante el trasplante63, deficiencia adquirida de factor XIII (menor con IA que con PFS)68, etc.
La hemorragia es una complicación relevante. De Weerd et al, en una serie de 65 trasplantes ABOi, comunicaron un 29% de necesidad de transfusiones y 3 pacientes necesitaron reintervención; tras un análisis multivariante, asocian la hemorragia al número de sesiones de IA67. Zschiedrich et al reportan un 38% de revisiones quirúrgicas, un 21% por hemorragia, que atribuyen a la inyección de heparina durante la reperfusión del injerto tras la extracción65. En nuestra serie (48 TR ABOi), un 50% de los pacientes presentó hemorragia en el lecho quirúrgico, un 60% precisó transfusión y un 14,6%, reintervención. No se detectó ningún trastorno de coagulación, aunque el nivel de fibrinógeno fue inferior en los pacientes tratados con PFS frente a IA; por el contrario, el descenso plaquetario fue mayor en el grupo de pacientes con IA. No analizamos el factor XIII.
• Complicaciones infecciosas. De nuevo, los resultados son heterogéneos. Se ha descrito un incremento de infecciones de la herida quirúrgica y del tracto urinario5,12,16,64,66,69,70 por CMV, virus del herpes simple, virus de la varicela-zóster, virus BK y Pneumocystis jiroveci; sin embargo, otros estudios no encuentran diferencias respecto a los trasplantes compatibles62,71,72. En nuestra experiencia, la enfermedad por CMV (síndrome viral) fue la infección más frecuente (19%), y un 12% desarrolló viremia BK, aunque ninguno NPV.
Las diferencias entre centros se pueden deber a diferencias en la técnica de aféresis, empleo y dosis de RTX, administración de IgIV, pauta de inmunosupresión (inducción y mantenimiento) y tipo de profilaxis antiinfecciosa, etc. Las infecciones se asocian con un incremento en la mortalidad precoz5,16,64,66.
• Complicaciones tumorales. En este caso parece haber consenso en que, a pesar del incremento del nivel de inmunosupresión, el riesgo de neoplasia no está incrementado respecto a los receptores de un TR ABOc5,16,73,74. En nuestra serie, un paciente desarrolló un tumor renal de células claras en un riñón nativo, que se resolvió mediante nefrectomía.
• Complicaciones inmunológicas. El rechazo agudo mediado por anticuerpos es la primera causa de pérdida de injerto tras un TR ABOi11 y son fundamentalmente pérdidas precoces66,75. Tras un período silente de unas 48 h, el RMA suele ocurrir dentro de las primeras 3 semanas del trasplante, y es infrecuente después (en ausencia de sensibilización HLA), en presumible relación con el desarrollo de acomodación16,76. Los factores de riesgo más implicados en el desarrollo de RMA son el título de isoaglutininas en el momento del trasplante (no el basal previo a la DS) y la coexistencia de sensibilización HLA75,77.
La incidencia de RMA oscila entre un 10 y un 30%11. En un reciente metaanálisis, la incidencia de rechazo agudo comprobado por biopsia fue del 32,9%; de ellos un 34,6% fue RMA. Estos episodios fueron diagnosticados entre los días 0 y 12 postrasplante16. Un estudio unicéntrico, que comparó trasplantes ABOi (n = 101) frente a trasplantes ABOc (n = 226), no halló diferencias en la incidencia de rechazo agudo subclínico (p = 0,4) o rechazo agudo (celular o mediado por anticuerpos) (p = 0,8) entre ambos grupos60; mientras que en otro metaanálisis, publicado en 2018, basado en 26 estudios unicéntricos de pequeñas cohortes, que también comparó TR ABOi frente a TR ABOc, las incidencias de rechazo agudo confirmado por biopsia (riesgo relativo [RR]: 1,39; p < 0,01) y de RMA (RR: 3,86; p = 0,001) fueron superiores en los primeros. La incidencia de RMA parece especialmente baja en pacientes DS con columnas de IA, específicas o no8,9,30. En nuestra serie, con DS basada en PFS y/o IA específica y RTX, la incidencia de rechazo agudo fue del 8,7% al quinto año (n = 5); de ellos un rechazo mixto en una paciente con sensibilización HLA concomitante, que perdió el injerto por un rechazo refractario.
Supervivencia
• Supervivencia del paciente. En algunos estudios se admite que la supervivencia del paciente a corto plazo es inferior, fundamentalmente por un incremento de mortalidad de causa infecciosa5,66,78, mientras que la supervivencia a largo plazo es similar a la del trasplante ABOc2,3,5,16,60,66,76. En un metaanálisis publicado en 201616, la supervivencia del paciente al quinto año fue superior al 90% en las DS con aféresis, RTX e inmunosupresión estándar (esteroides, tacrolimus y micofenolato), hallazgos similares a los publicados en la literatura2-5. También se apreció una mejor supervivencia en los tratados con RTX frente a los que fueron esplenectomizados, y una tendencia a mejores resultados en los tratados con IA frente a los tratados con PFS (aunque ambas técnicas no se compararon directamente)16. En nuestra serie, la supervivencia del paciente al quinto año fue del 97%, concordante con lo publicado en la literatura más reciente66.
• Supervivencia del injerto. En línea con lo ya expuesto, la supervivencia a corto plazo suele ser inferior a la del TR ABOc, por causas inmunológicas (con frecuencia ligadas a sensibilización HLA) o técnicas5,66,75,77, aunque algunos estudios encuentran supervivencias del 100%9,18,59,78. En todo caso, la pérdida del injerto es un evento infrecuente tras un TR ABOi, como se demuestra en un reciente metaanálisis, con una cifra del 4,2% a 1 año (no censurada)66. Es importante destacar que, no siempre, los estudios muestran la supervivencia del injerto ABOi una vez censurada la muerte del paciente; en este sentido, un estudio muy reciente encuentra un descenso de la supervivencia renal censurada, aunque solo en pacientes mayores de 50 años79. En nuestra serie, la supervivencia del injerto al tercer año (muerte no censurada) es del 93%. Hay coincidencia en que la supervivencia a largo plazo es similar a la del trasplante de donante vivo compatible.
Como resumen, cabe señalar que la muerte del paciente o la pérdida del injerto postrasplante son eventos infrecuentes tras un TR ABOi, aunque más frecuentes que tras un TR compatible66,80.
Impacto económico
Es evidente que el proceso de DS tiene un coste económico, variable según el procedimiento de aféresis utilizado, el empleo de RTX o IgIV, y las complicaciones (hemorragia, rechazo, infecciones), pero puede ser coste efectivo comparado con la opción de mantener al paciente en diálisis81-83, y todo ello sin penalizar la supervivencia del paciente. El acuerdo no es universal84,85.
La alternativa al TR ABOi, la DRC, tiene sus limitaciones y es difícil de implementar en pacientes en situación de prediálisis. Sin embargo, la DRC y el TR ABOi pueden ser opciones complementarias1,86,87.
CONCLUSIONES
En conclusión, el TR ABOi es una buena opción para incrementar el número de trasplantes de donante vivo. Permite soluciones locales para parejas incompatibles, puede hacerse en situación de prediálisis (el 50% en nuestra serie), con las ventajas que ello conlleva, y es una opción alternativa (a veces única, a veces complementaria) a la DRC. El proceso de DS, al alcance de la mayoría de centros trasplantadores, debe hacerse de forma individualizada para reducir costes y efectos adversos. Los resultados de función y supervivencia, a largo plazo, son similares a los obtenidos con un TR ABOc, aunque la tasa de complicaciones precoces es mayor. La implementación de grandes programas nacionales o transnacionales de DRC podría reducir la necesidad de estos trasplantes incompatibles, pero no evitarlos.
Conflicto de intereses
El autor A. Alonso ha recibido honorarios por asesoría científica y conferencias de Astellas, Novartis y Chiesi, no relacionados con el trabajo publicado. El autor C. Fernández ha recibido honorarios por asesoría científica y conferencias de Alexion, Novartis y Chiesi, no relacionados con el trabajo publicado. El resto de los autores no presentan conflicto de intereses.
Conceptos clave
1. El TR de donante vivo ABOi es una buena opción, al alcance de cualquier programa, con buenos resultados y una tasa de complicaciones asumible.
2. El beneficio clínico supera al mayor coste respecto al trasplante compatible.
3. Es una opción complementaria a la donación renal cruzada.
Correspondencia:
Ángel Alonso Hernández
Servicio de Nefrología.
Complexo Hospitalario Universitario A Coruña. As Xubias, 84. 15006 A Coruña.
angel.alonso.hernandez@sergas.es
Revisión por expertos bajo la responsabilidad de la Sociedad Española de Nefrología.