La mortalidad de los pacientes en hemodiálisis es alta. Una tasa de ultrafiltración horaria ajustada por peso (UFR/W) elevada se ha asociado con episodios de hipotensión arterial y con mayor riesgo de muerte y/o eventos cardiovasculares.
Material y métodosHemos evaluado la asociación entre UFR/W y mortalidad en 215 pacientes en hemodiálisis prevalentes seguidos durante 28 ± 6,12 meses. Se estimaron características clínicas basales y UFR/W media a lo largo del seguimiento.
ResultadosLa UFR/W media fue 9,0 ± 2,4 y los terciles 7,1 y 10,1 mL/kg/h. Se categorizó a la población en función del tiempo que habían estado con UFR/W igual o superior a los puntos de corte descritos en la literatura como relacionados con mayor mortalidad (10,0 mL/kg/h y 13,0 mL/kg/h). Los pacientes con mayor UFR/W fueron más jóvenes, con mayor ganancia de peso interdiálisis y porcentaje de reducción de peso, pero con menor peso seco, inicial y final. Durante el seguimiento, fallecieron 46 (21,4%) personas de las cuales la mayoría eran > 70 años, diabéticas o con enfermedad cardiovascular. No hubo diferencias en la mortalidad entre los grupos de UFR/W ni en la UFR/W entre los fallecidos y no fallecidos. En comparación con estudios previos donde describieron la asociación entre UFR/W y mortalidad, en nuestra población había más prevalencia de medicación protectora cardiovascular y no se observaron UFR/W tan altas.
ConclusiónEn nuestro medio, la UFR/W más elevada se observó en pacientes más jóvenes y de menor peso y no se asoció con mayor mortalidad.
Mortality among hemodialysis patients remains high. An elevated ultrafiltration rate adjusted by weight (UFR/W) has been associated with hypotension and higher risk of death and/or cardiovascular events.
MethodsWe evaluated the association between UFR/W and mortality in 215 hemodialysis patients. The mean follow-up was 28 ± 6.12 months. We collected patientś baseline characteristics and mean UFR/W throughout the follow-up.
ResultsMean UFR/W was 9.0 ± 2,4 and tertiles 7.1 y 10.1 mL/kg/h. We divided our population according to the percentage of sessions with UFR/W above the limits described in the literature associated with increased mortality (10.0 mL/kg/h and 13.0 mL/kg/h). Patients with higher UFR/W were younger, with higher interdialytic weight gain and weight reduction percentage but lower dry, pre and post dialysis weight. Throughout the follow-up, 46 (21.4%) patients died, the majority over 70 years old, diabetic or with cardiovascular disease. There were neither differences regarding mortality between groups nor differences in UFR/W among patients who died and those who did not. Contrary to previous studies, we did not find an association between UFR/W and mortality, maybe due to a higher prevalence in the use of cardiovascular protection drugs and lower UFR/W.
ConclusionsThe highest UFR/W were observed in younger patients with lower weight and were not associated with an increased mortality.
La enfermedad renal crónica (ERC) es un problema de salud pública que en España afecta a más de 60.000 pacientes en tratamiento renal sustitutivo, incluyendo diálisis y trasplante renal1. La supervivencia de las personas con ERC, especialmente de aquellas en diálisis, es menor que la de la población general2,3. La causa principal de esto es el mayor riesgo de enfermedad cardiovascular4,5, que se debe tanto a la alta prevalencia de factores de riesgo cardiovasculares clásicos (enfermedad cardiovascular, hipertensión, diabetes mellitus)6, como a factores específicos de la uremia, conocidos como emergentes, entre los que se encuentran la anemia7, la enfermedad óseo-mineral y la pérdida de la función renal residual, además de complicaciones asociadas con factores de la propia técnica de diálisis, entre los que encontramos la ultrafiltración (UF) excesiva y la hipotensión intradiálisis8,9.
Los factores de riesgo cardiovascular relacionados con la propia técnica de hemodiálisis son potencialmente modificables. Aunque la cinética de la urea (KT/Vurea) constituye un marcador de diálisis adecuada, en algunos centros condiciona la duración de cada terapia10, lo que podría conducir a sesiones cortas basadas solo en este indicador. Este modelo es frecuente en EE. UU. donde se han generalizado sesiones de diálisis cortas, atendiendo a la KT/Vurea correcta, que incrementan el riesgo cardiovascular11. Entre otros motivos, las diálisis cortas obligan a hacer UF horarias altas que pueden aumentar el riesgo de hipotensión arterial12.
La UF constituye un parámetro modificable y se ha descrito una repercusión directa sobre la supervivencia del paciente13. Está determinada por la cantidad de líquido eliminado o ultrafiltrado, y depende de la ganancia de peso en el período interdiálisis (GID) y del tiempo durante el cual se extrae. Una tasa de ultrafiltración horaria ajustada por peso (UFR/W) elevada incrementa la hipotensión arterial y el riesgo de mortalidad cardiovascular en la hemodiálisis convencional14,15,16-18. Ya con ratio de ultrafiltración (UFR) horaria de 6 mL/kg/h se ha observado mayor mortalidad, siendo muy significativa a partir de 10 mL/kg/h19.
Los episodios de hipotensión intradiálisis se relacionan con mayor mortalidad cardiovascular20, arritmias y microinfartos de miocardio21, origen del «myocardial stunning» o «aturdimiento» miocárdico22, además de microinfartos cerebrales. La mayor susceptibilidad a la isquemia miocárdica se debe a la alta prevalencia de ateromatosis coronaria e hipertrofia ventricular en estos pacientes23, incluso en ausencia de lesión coronaria significativa24,25. La hipotensión arterial se asocia también con mayor riesgo de trombosis del acceso vascular26.
Desde hace unos años, se ajusta la UFR al peso del paciente, expresando los valores en mL/kg/h26 y diferentes estudios han establecido un umbral de UFR/W de 10 a 13 mL/kg/h como tasa máxima en la que basarse para modificar la duración de las sesiones de diálisis, ya que por encima de estos límites se ha descrito una asociación con un exceso de mortalidad19,27,28. Sin embargo, muchos de estos estudios provienen de países donde ni los estándares de asistencia sanitaria (pautas de diálisis, acceso a cuidados sanitarios y a medicación) ni las características de la población son comparables a los españoles. Por ello, hemos abordado la relación entre UFR/W y mortalidad en una unidad de diálisis española.
Materiales y métodosEstudio observacionalRealizamos un estudio observacional prospectivo de 215 pacientes prevalentes en hemodiálisis del Hospital Fundación Jiménez Díaz (FJD) y del centro de hemodiálisis Santa Engracia. Presentado en el comité ético de la FJD, cumple con el estudio de conformidad con la Declaración de Helsinki de principios éticos para investigación médica en seres humanos y la Directiva de ensayos clínicos de la Unión Europea (2001/20/CE). Los criterios de exclusión fueron un tiempo en diálisis menor a tres meses y dializarse con pautas de hemodiálisis incremental. Los datos fueron recogidos entre el primero de enero del 2017 y el 30 de junio del 2019. Al inicio del estudio, se recopiló la siguiente información de la historia clínica: a) demográficos: edad, sexo, hipertensión, diabetes mellitus, enfermedad vascular periférica, insuficiencia cardiaca y cardiopatía isquémica; b) medicación; c) datos analíticos: albúmina, proteínas totales, natremia, potasemia y troponina I; d) características propias de la diálisis al inicio del estudio y durante el tiempo de seguimiento recogidas mediante el programa Nefrosoft: duración de la sesión, duración total semanal, peso seco (calculado mediante clínica y bioimpedancia, que se repetía mensualmente), GID, volumen total de UF, UFR horaria (mL/h) y ajustada por peso seco (UFR/W, mL/kg/h), porcentaje de reducción de peso y tiempo total en diálisis. Con respecto a la pauta de hemodiálisis, ninguno de los pacientes incluidos en el estudio estaba en programa de diálisis incremental, el porcentaje de hemodiálisis online era del 50% y todos los individuos se trataban con dispositivos de alto flujo. Además, las tasas de UF fueron constantes durante toda la sesión, sin usar pautas de UF automáticas, manteniendo, por tanto, una UF constante. Los perfiles de UF fueron usados en muy contadas ocasiones, pues preferíamos un incremento de las sesiones o perfiles de sodio. También, se ha tenido en cuenta el tipo de acceso vascular, las características del baño de diálisis (calcio y potasio), la tensión arterial pre y post hemodiálisis, así como el porcentaje de reducción de tensión arterial intradiálisis y la fracción de eyección del ventrículo izquierdo (FEVI). Durante el tiempo de seguimiento, se registró la mortalidad y la causa de muerte. No se recogieron los datos de diuresis residual.
Hemos analizado la asociación entre mortalidad y la media de UFR/W de todas las sesiones de hemodiálisis durante el período de seguimiento del estudio, así como, si presentaban ≥ 25 o ≥ 50% de sesiones con UFR/W ≥ 10 y ≥ 13 mL/kg/h como se había descrito previamente, ya que son las UFR seguras máximas definidas ampliamente en la literatura19,27,28. En nuestra unidad, la tasa de UF trata de ser baja, especialmente en aquellos pacientes con peor tolerancia, que suelen ser los que presentan un mayor riesgo cardiovascular o son más frágiles. Así, aumentamos el tiempo o la frecuencia. Esta es una importante diferencia con países como EEUU en donde se dializa en tiempos cortos, para conseguir KT/Vurea suficientes, sin tener en cuenta otros factores. El tema económico es fundamental, por lo que posiblemente es más fácil que pacientes inestables tengan UF más altas. Este concepto de la individualización hace que la mortalidad sea menor.
Análisis de la literaturaA fin de comprender la divergencia de los resultados obtenidos en este estudio con los publicados, hemos comparado las características de la población estudiada con la de los dos trabajos más grandes realizados en población occidental y que son en los que están basados los puntos de corte generalmente usados en la literatura.
Análisis estadísticoLas variables cuantitativas fueron descritas mediante media y desviación típica o mediante mediana y rango intercuartílico. Las variables cualitativas fueron definidas mediante frecuencias absolutas y relativas. Para comparar los diferentes grupos en función de los rangos de UFR/W y la mortalidad, se utilizaron la prueba t de Student o la U de Mann-Whitney en las variables cuantitativas, y la prueba de X2 o la F de Fisher en las variables cualitativas. Con el fin de evaluar la capacidad de los valores de UFR/W para discriminar entre pacientes vivos y fallecidos, se obtuvo la curva receiver operating characteristic (ROC) y el área bajo la misma, junto con su intervalo de confianza al 95%.
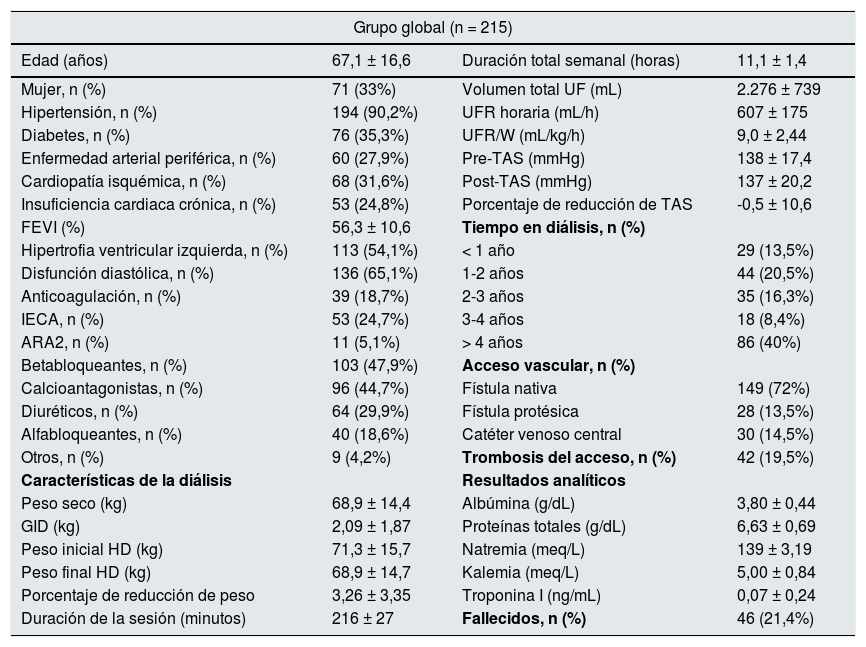
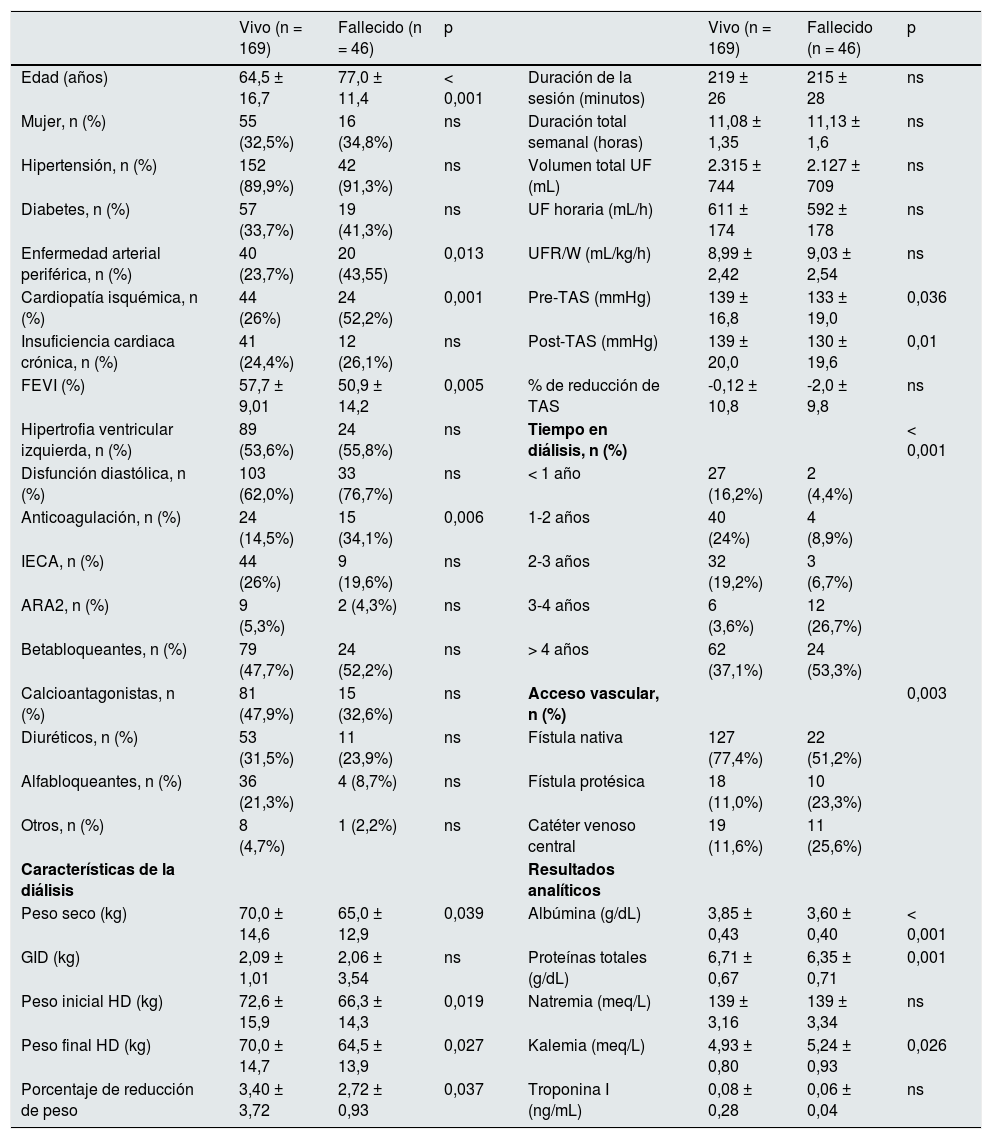
ResultadosDescripción de la población estudiadaLas características basales de los 215 pacientes analizados están representadas en la tabla 1. Se trata de una población con mayoría de varones, de edad similar a la media de la población en diálisis española, con frecuente comorbilidad y uso de diuréticos en casi el 30%. La UFR/W media fue 9,0 ± 2,4 mL/kg/h y los terciles 7,1 y 10,1 mL/kg/h.
Características basales de la población estudiada
| Grupo global (n = 215) | |||
|---|---|---|---|
| Edad (años) | 67,1 ± 16,6 | Duración total semanal (horas) | 11,1 ± 1,4 |
| Mujer, n (%) | 71 (33%) | Volumen total UF (mL) | 2.276 ± 739 |
| Hipertensión, n (%) | 194 (90,2%) | UFR horaria (mL/h) | 607 ± 175 |
| Diabetes, n (%) | 76 (35,3%) | UFR/W (mL/kg/h) | 9,0 ± 2,44 |
| Enfermedad arterial periférica, n (%) | 60 (27,9%) | Pre-TAS (mmHg) | 138 ± 17,4 |
| Cardiopatía isquémica, n (%) | 68 (31,6%) | Post-TAS (mmHg) | 137 ± 20,2 |
| Insuficiencia cardiaca crónica, n (%) | 53 (24,8%) | Porcentaje de reducción de TAS | -0,5 ± 10,6 |
| FEVI (%) | 56,3 ± 10,6 | Tiempo en diálisis, n (%) | |
| Hipertrofia ventricular izquierda, n (%) | 113 (54,1%) | < 1 año | 29 (13,5%) |
| Disfunción diastólica, n (%) | 136 (65,1%) | 1-2 años | 44 (20,5%) |
| Anticoagulación, n (%) | 39 (18,7%) | 2-3 años | 35 (16,3%) |
| IECA, n (%) | 53 (24,7%) | 3-4 años | 18 (8,4%) |
| ARA2, n (%) | 11 (5,1%) | > 4 años | 86 (40%) |
| Betabloqueantes, n (%) | 103 (47,9%) | Acceso vascular, n (%) | |
| Calcioantagonistas, n (%) | 96 (44,7%) | Fístula nativa | 149 (72%) |
| Diuréticos, n (%) | 64 (29,9%) | Fístula protésica | 28 (13,5%) |
| Alfabloqueantes, n (%) | 40 (18,6%) | Catéter venoso central | 30 (14,5%) |
| Otros, n (%) | 9 (4,2%) | Trombosis del acceso, n (%) | 42 (19,5%) |
| Características de la diálisis | Resultados analíticos | ||
| Peso seco (kg) | 68,9 ± 14,4 | Albúmina (g/dL) | 3,80 ± 0,44 |
| GID (kg) | 2,09 ± 1,87 | Proteínas totales (g/dL) | 6,63 ± 0,69 |
| Peso inicial HD (kg) | 71,3 ± 15,7 | Natremia (meq/L) | 139 ± 3,19 |
| Peso final HD (kg) | 68,9 ± 14,7 | Kalemia (meq/L) | 5,00 ± 0,84 |
| Porcentaje de reducción de peso | 3,26 ± 3,35 | Troponina I (ng/mL) | 0,07 ± 0,24 |
| Duración de la sesión (minutos) | 216 ± 27 | Fallecidos, n (%) | 46 (21,4%) |
ARA2: antagonistas del receptor de angiotensina 2; FEVI: fracción de eyección del ventrículo izquierdo; GID: ganancia de peso interdiálisis; IECA: inhibidor de la enzima convertidora de angiotensina; TAS: tensión arterial sistólica; Pre-TAS: TAS prediálisis; Post-TAS: TAS post-diálisis; UF: ultrafiltración; UFR: ratio de ultrafiltración horaria; UFR/W: ultrafiltración horaria ajustada por peso.
GID y UFR horaria media de todo el tiempo de seguimiento; HD: hemodiálisis.
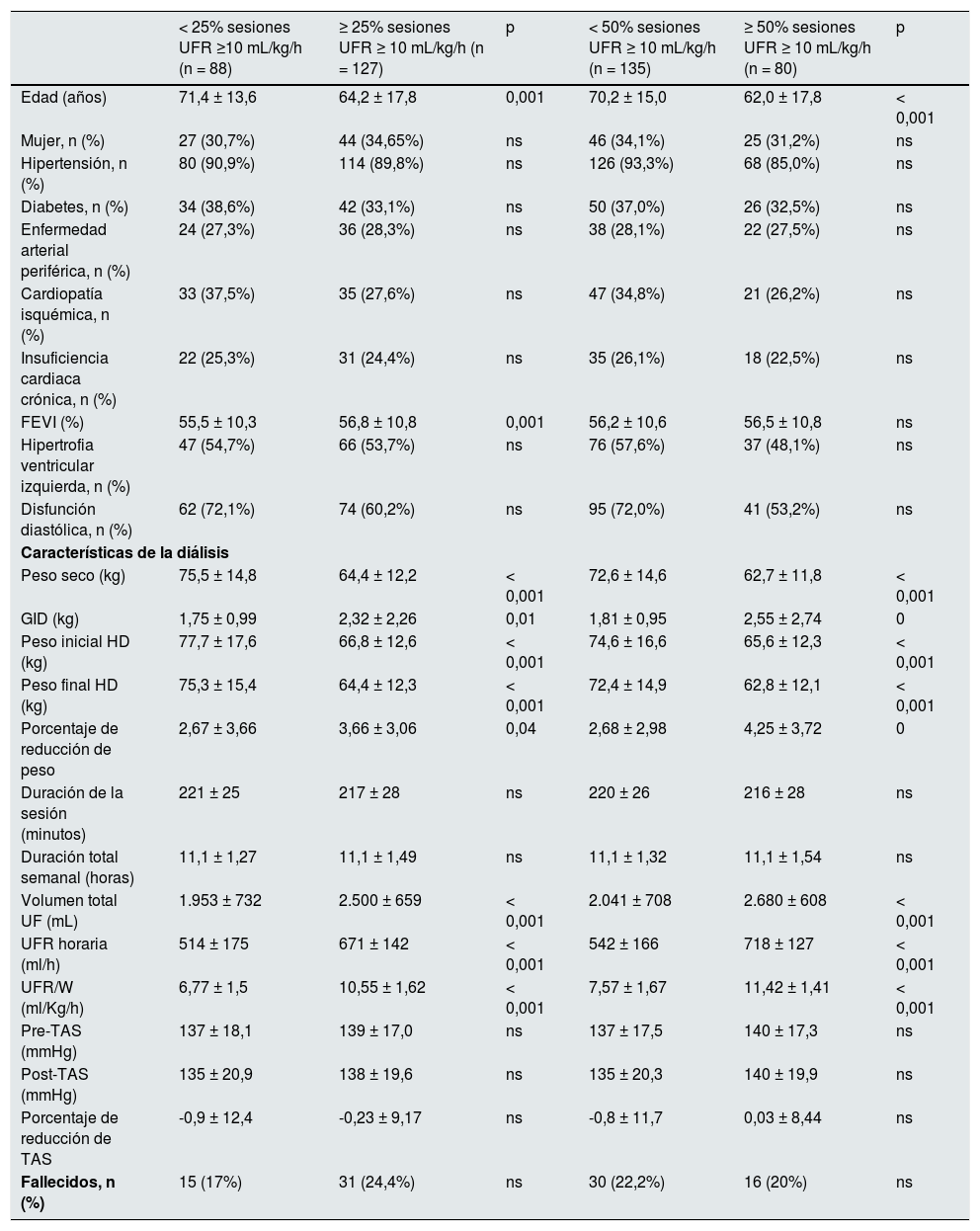
En las tablas 2 y 3 se muestran las características de los pacientes en distintos grupos de UFR/W, según diferentes porcentajes de sesiones con UFR/W mayor de 10 o de 13 mL/kg/h. Los individuos con mayor UFR/W fueron más jóvenes, con mayor GID, y mayor porcentaje de reducción de peso durante la diálisis, pero con menor peso seco, inicial y final. No hubo variaciones en la medicación antihipertensiva, el uso de anticoagulantes, el tiempo en diálisis, el tipo de acceso vascular o los parámetros analíticos. No se encontraron diferencias significativas en la mortalidad entre los grupos analizados.
Características basales de la población estudiada en función de la UFR/W usando el punto de corte de 10 mL/kg/h
| < 25% sesiones UFR ≥10 mL/kg/h (n = 88) | ≥ 25% sesiones UFR ≥ 10 mL/kg/h (n = 127) | p | < 50% sesiones UFR ≥ 10 mL/kg/h (n = 135) | ≥ 50% sesiones UFR ≥ 10 mL/kg/h (n = 80) | p | |
|---|---|---|---|---|---|---|
| Edad (años) | 71,4 ± 13,6 | 64,2 ± 17,8 | 0,001 | 70,2 ± 15,0 | 62,0 ± 17,8 | < 0,001 |
| Mujer, n (%) | 27 (30,7%) | 44 (34,65%) | ns | 46 (34,1%) | 25 (31,2%) | ns |
| Hipertensión, n (%) | 80 (90,9%) | 114 (89,8%) | ns | 126 (93,3%) | 68 (85,0%) | ns |
| Diabetes, n (%) | 34 (38,6%) | 42 (33,1%) | ns | 50 (37,0%) | 26 (32,5%) | ns |
| Enfermedad arterial periférica, n (%) | 24 (27,3%) | 36 (28,3%) | ns | 38 (28,1%) | 22 (27,5%) | ns |
| Cardiopatía isquémica, n (%) | 33 (37,5%) | 35 (27,6%) | ns | 47 (34,8%) | 21 (26,2%) | ns |
| Insuficiencia cardiaca crónica, n (%) | 22 (25,3%) | 31 (24,4%) | ns | 35 (26,1%) | 18 (22,5%) | ns |
| FEVI (%) | 55,5 ± 10,3 | 56,8 ± 10,8 | 0,001 | 56,2 ± 10,6 | 56,5 ± 10,8 | ns |
| Hipertrofia ventricular izquierda, n (%) | 47 (54,7%) | 66 (53,7%) | ns | 76 (57,6%) | 37 (48,1%) | ns |
| Disfunción diastólica, n (%) | 62 (72,1%) | 74 (60,2%) | ns | 95 (72,0%) | 41 (53,2%) | ns |
| Características de la diálisis | ||||||
| Peso seco (kg) | 75,5 ± 14,8 | 64,4 ± 12,2 | < 0,001 | 72,6 ± 14,6 | 62,7 ± 11,8 | < 0,001 |
| GID (kg) | 1,75 ± 0,99 | 2,32 ± 2,26 | 0,01 | 1,81 ± 0,95 | 2,55 ± 2,74 | 0 |
| Peso inicial HD (kg) | 77,7 ± 17,6 | 66,8 ± 12,6 | < 0,001 | 74,6 ± 16,6 | 65,6 ± 12,3 | < 0,001 |
| Peso final HD (kg) | 75,3 ± 15,4 | 64,4 ± 12,3 | < 0,001 | 72,4 ± 14,9 | 62,8 ± 12,1 | < 0,001 |
| Porcentaje de reducción de peso | 2,67 ± 3,66 | 3,66 ± 3,06 | 0,04 | 2,68 ± 2,98 | 4,25 ± 3,72 | 0 |
| Duración de la sesión (minutos) | 221 ± 25 | 217 ± 28 | ns | 220 ± 26 | 216 ± 28 | ns |
| Duración total semanal (horas) | 11,1 ± 1,27 | 11,1 ± 1,49 | ns | 11,1 ± 1,32 | 11,1 ± 1,54 | ns |
| Volumen total UF (mL) | 1.953 ± 732 | 2.500 ± 659 | < 0,001 | 2.041 ± 708 | 2.680 ± 608 | < 0,001 |
| UFR horaria (ml/h) | 514 ± 175 | 671 ± 142 | < 0,001 | 542 ± 166 | 718 ± 127 | < 0,001 |
| UFR/W (ml/Kg/h) | 6,77 ± 1,5 | 10,55 ± 1,62 | < 0,001 | 7,57 ± 1,67 | 11,42 ± 1,41 | < 0,001 |
| Pre-TAS (mmHg) | 137 ± 18,1 | 139 ± 17,0 | ns | 137 ± 17,5 | 140 ± 17,3 | ns |
| Post-TAS (mmHg) | 135 ± 20,9 | 138 ± 19,6 | ns | 135 ± 20,3 | 140 ± 19,9 | ns |
| Porcentaje de reducción de TAS | -0,9 ± 12,4 | -0,23 ± 9,17 | ns | -0,8 ± 11,7 | 0,03 ± 8,44 | ns |
| Fallecidos, n (%) | 15 (17%) | 31 (24,4%) | ns | 30 (22,2%) | 16 (20%) | ns |
FEVI: fracción de eyección del ventrículo izquierdo; GID: ganancia de peso interdiálisis; HD: hemodiálisis; ns: no significativo; TAS: tensión arterial sistólica; Pre-TAS: TAS prediálisis; Post-TAS: TAS post-diálisis; UF: ultrafiltración; UFR: ratio de ultrafiltración horaria; UFR/W: ultrafiltración horaria ajustada por peso.
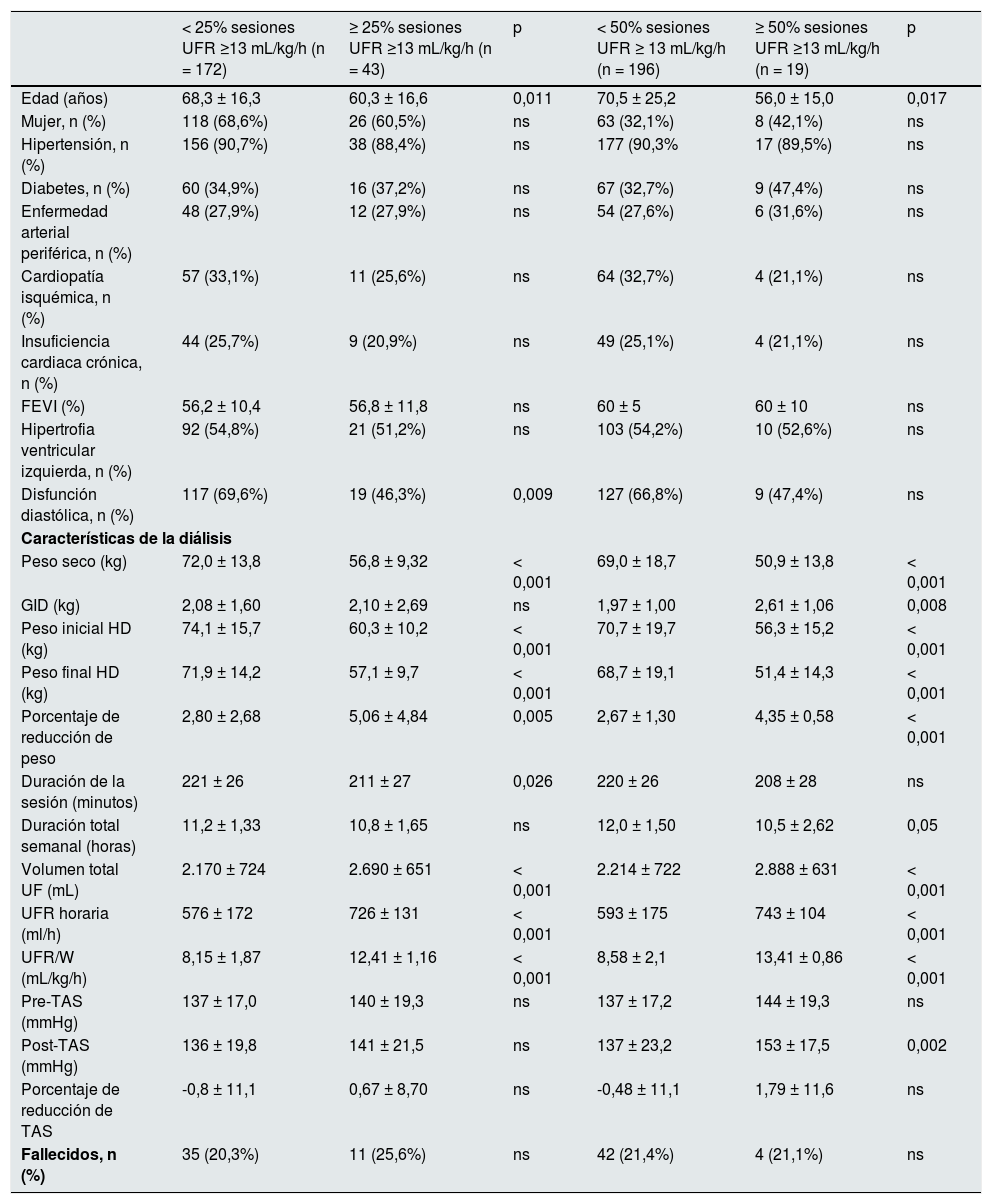
Características basales de la población estudiada en función de la UFR/W usando el punto de corte de 13 mL/kg/h
| < 25% sesiones UFR ≥13 mL/kg/h (n = 172) | ≥ 25% sesiones UFR ≥13 mL/kg/h (n = 43) | p | < 50% sesiones UFR ≥ 13 mL/kg/h (n = 196) | ≥ 50% sesiones UFR ≥13 mL/kg/h (n = 19) | p | |
|---|---|---|---|---|---|---|
| Edad (años) | 68,3 ± 16,3 | 60,3 ± 16,6 | 0,011 | 70,5 ± 25,2 | 56,0 ± 15,0 | 0,017 |
| Mujer, n (%) | 118 (68,6%) | 26 (60,5%) | ns | 63 (32,1%) | 8 (42,1%) | ns |
| Hipertensión, n (%) | 156 (90,7%) | 38 (88,4%) | ns | 177 (90,3% | 17 (89,5%) | ns |
| Diabetes, n (%) | 60 (34,9%) | 16 (37,2%) | ns | 67 (32,7%) | 9 (47,4%) | ns |
| Enfermedad arterial periférica, n (%) | 48 (27,9%) | 12 (27,9%) | ns | 54 (27,6%) | 6 (31,6%) | ns |
| Cardiopatía isquémica, n (%) | 57 (33,1%) | 11 (25,6%) | ns | 64 (32,7%) | 4 (21,1%) | ns |
| Insuficiencia cardiaca crónica, n (%) | 44 (25,7%) | 9 (20,9%) | ns | 49 (25,1%) | 4 (21,1%) | ns |
| FEVI (%) | 56,2 ± 10,4 | 56,8 ± 11,8 | ns | 60 ± 5 | 60 ± 10 | ns |
| Hipertrofia ventricular izquierda, n (%) | 92 (54,8%) | 21 (51,2%) | ns | 103 (54,2%) | 10 (52,6%) | ns |
| Disfunción diastólica, n (%) | 117 (69,6%) | 19 (46,3%) | 0,009 | 127 (66,8%) | 9 (47,4%) | ns |
| Características de la diálisis | ||||||
| Peso seco (kg) | 72,0 ± 13,8 | 56,8 ± 9,32 | < 0,001 | 69,0 ± 18,7 | 50,9 ± 13,8 | < 0,001 |
| GID (kg) | 2,08 ± 1,60 | 2,10 ± 2,69 | ns | 1,97 ± 1,00 | 2,61 ± 1,06 | 0,008 |
| Peso inicial HD (kg) | 74,1 ± 15,7 | 60,3 ± 10,2 | < 0,001 | 70,7 ± 19,7 | 56,3 ± 15,2 | < 0,001 |
| Peso final HD (kg) | 71,9 ± 14,2 | 57,1 ± 9,7 | < 0,001 | 68,7 ± 19,1 | 51,4 ± 14,3 | < 0,001 |
| Porcentaje de reducción de peso | 2,80 ± 2,68 | 5,06 ± 4,84 | 0,005 | 2,67 ± 1,30 | 4,35 ± 0,58 | < 0,001 |
| Duración de la sesión (minutos) | 221 ± 26 | 211 ± 27 | 0,026 | 220 ± 26 | 208 ± 28 | ns |
| Duración total semanal (horas) | 11,2 ± 1,33 | 10,8 ± 1,65 | ns | 12,0 ± 1,50 | 10,5 ± 2,62 | 0,05 |
| Volumen total UF (mL) | 2.170 ± 724 | 2.690 ± 651 | < 0,001 | 2.214 ± 722 | 2.888 ± 631 | < 0,001 |
| UFR horaria (ml/h) | 576 ± 172 | 726 ± 131 | < 0,001 | 593 ± 175 | 743 ± 104 | < 0,001 |
| UFR/W (mL/kg/h) | 8,15 ± 1,87 | 12,41 ± 1,16 | < 0,001 | 8,58 ± 2,1 | 13,41 ± 0,86 | < 0,001 |
| Pre-TAS (mmHg) | 137 ± 17,0 | 140 ± 19,3 | ns | 137 ± 17,2 | 144 ± 19,3 | ns |
| Post-TAS (mmHg) | 136 ± 19,8 | 141 ± 21,5 | ns | 137 ± 23,2 | 153 ± 17,5 | 0,002 |
| Porcentaje de reducción de TAS | -0,8 ± 11,1 | 0,67 ± 8,70 | ns | -0,48 ± 11,1 | 1,79 ± 11,6 | ns |
| Fallecidos, n (%) | 35 (20,3%) | 11 (25,6%) | ns | 42 (21,4%) | 4 (21,1%) | ns |
FEVI: fracción de eyección del ventrículo izquierdo; GID: ganancia de peso interdiálisis; HD: hemodiálisis; ns: no significativo; TAS: tensión arterial sistólica; Pre-TAS: TAS prediálisis; Post-TAS: TAS post-diálisis; UF: ultrafiltración; UFR: ratio de ultrafiltración horaria; UFR/W: ultrafiltración horaria ajustada por peso.
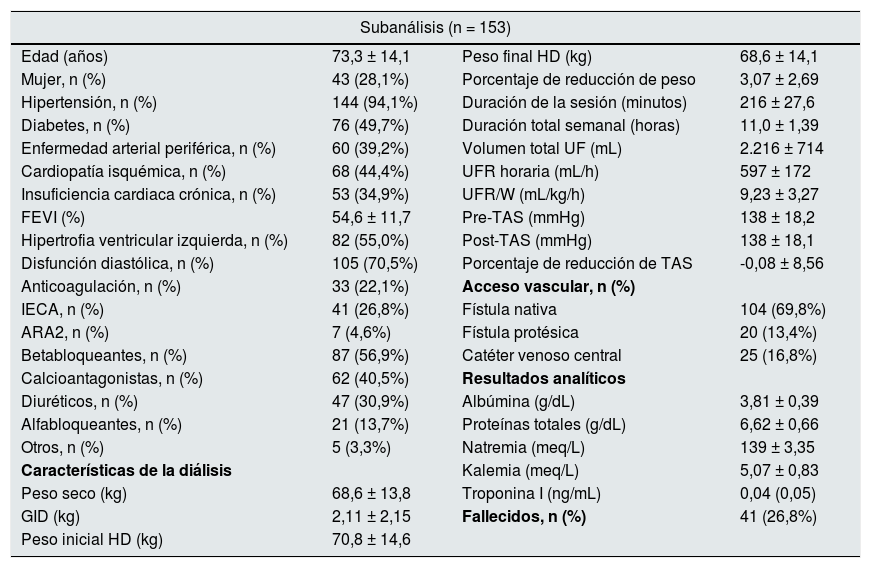
Durante los dos años y medio de seguimiento, fallecieron 46 de los 215 pacientes (21,4%). Las diferencias entre los vivos y fallecidos se muestran en la tabla 4. No hubo variaciones en la UFR/W entre ambos grupos. En un modelo de regresión logística, analizando la mortalidad con base en la edad y UFR/W fue estadísticamente significativa la asociación entre edad y mortalidad (OR 1,06 IC 95% 1,03 a 1,09 p < 0,001). Dado que la principal causa de mortalidad en los pacientes en hemodiálisis es cardiovascular, se realizó un subanálisis de los 153 individuos con alto riesgo basal al tener una o más de las siguientes características: edad > 70 años, diabetes o enfermedad cardiovascular (enfermedad vascular periférica, cardiopatía isquémica o insuficiencia cardiaca) (tabla 5). Entre estos pacientes, fallecieron 41 (26,8%), mientras que en el resto, la mortalidad fue del 8%.
Comparación entre los pacientes vivos y fallecidos
| Vivo (n = 169) | Fallecido (n = 46) | p | Vivo (n = 169) | Fallecido (n = 46) | p | ||
|---|---|---|---|---|---|---|---|
| Edad (años) | 64,5 ± 16,7 | 77,0 ± 11,4 | < 0,001 | Duración de la sesión (minutos) | 219 ± 26 | 215 ± 28 | ns |
| Mujer, n (%) | 55 (32,5%) | 16 (34,8%) | ns | Duración total semanal (horas) | 11,08 ± 1,35 | 11,13 ± 1,6 | ns |
| Hipertensión, n (%) | 152 (89,9%) | 42 (91,3%) | ns | Volumen total UF (mL) | 2.315 ± 744 | 2.127 ± 709 | ns |
| Diabetes, n (%) | 57 (33,7%) | 19 (41,3%) | ns | UF horaria (mL/h) | 611 ± 174 | 592 ± 178 | ns |
| Enfermedad arterial periférica, n (%) | 40 (23,7%) | 20 (43,55) | 0,013 | UFR/W (mL/kg/h) | 8,99 ± 2,42 | 9,03 ± 2,54 | ns |
| Cardiopatía isquémica, n (%) | 44 (26%) | 24 (52,2%) | 0,001 | Pre-TAS (mmHg) | 139 ± 16,8 | 133 ± 19,0 | 0,036 |
| Insuficiencia cardiaca crónica, n (%) | 41 (24,4%) | 12 (26,1%) | ns | Post-TAS (mmHg) | 139 ± 20,0 | 130 ± 19,6 | 0,01 |
| FEVI (%) | 57,7 ± 9,01 | 50,9 ± 14,2 | 0,005 | % de reducción de TAS | -0,12 ± 10,8 | -2,0 ± 9,8 | ns |
| Hipertrofia ventricular izquierda, n (%) | 89 (53,6%) | 24 (55,8%) | ns | Tiempo en diálisis, n (%) | < 0,001 | ||
| Disfunción diastólica, n (%) | 103 (62,0%) | 33 (76,7%) | ns | < 1 año | 27 (16,2%) | 2 (4,4%) | |
| Anticoagulación, n (%) | 24 (14,5%) | 15 (34,1%) | 0,006 | 1-2 años | 40 (24%) | 4 (8,9%) | |
| IECA, n (%) | 44 (26%) | 9 (19,6%) | ns | 2-3 años | 32 (19,2%) | 3 (6,7%) | |
| ARA2, n (%) | 9 (5,3%) | 2 (4,3%) | ns | 3-4 años | 6 (3,6%) | 12 (26,7%) | |
| Betabloqueantes, n (%) | 79 (47,7%) | 24 (52,2%) | ns | > 4 años | 62 (37,1%) | 24 (53,3%) | |
| Calcioantagonistas, n (%) | 81 (47,9%) | 15 (32,6%) | ns | Acceso vascular, n (%) | 0,003 | ||
| Diuréticos, n (%) | 53 (31,5%) | 11 (23,9%) | ns | Fístula nativa | 127 (77,4%) | 22 (51,2%) | |
| Alfabloqueantes, n (%) | 36 (21,3%) | 4 (8,7%) | ns | Fístula protésica | 18 (11,0%) | 10 (23,3%) | |
| Otros, n (%) | 8 (4,7%) | 1 (2,2%) | ns | Catéter venoso central | 19 (11,6%) | 11 (25,6%) | |
| Características de la diálisis | Resultados analíticos | ||||||
| Peso seco (kg) | 70,0 ± 14,6 | 65,0 ± 12,9 | 0,039 | Albúmina (g/dL) | 3,85 ± 0,43 | 3,60 ± 0,40 | < 0,001 |
| GID (kg) | 2,09 ± 1,01 | 2,06 ± 3,54 | ns | Proteínas totales (g/dL) | 6,71 ± 0,67 | 6,35 ± 0,71 | 0,001 |
| Peso inicial HD (kg) | 72,6 ± 15,9 | 66,3 ± 14,3 | 0,019 | Natremia (meq/L) | 139 ± 3,16 | 139 ± 3,34 | ns |
| Peso final HD (kg) | 70,0 ± 14,7 | 64,5 ± 13,9 | 0,027 | Kalemia (meq/L) | 4,93 ± 0,80 | 5,24 ± 0,93 | 0,026 |
| Porcentaje de reducción de peso | 3,40 ± 3,72 | 2,72 ± 0,93 | 0,037 | Troponina I (ng/mL) | 0,08 ± 0,28 | 0,06 ± 0,04 | ns |
ARA2: antagonistas del receptor de angiotensina 2; FEVI: fracción de eyección del ventrículo izquierdo; GID: ganancia de peso interdiálisis; HD: hemodiálisis; IECA: inhibidor de la enzima convertidora de angiotensina; ns: no significativo; TAS: tensión arterial sistólica; Pre-TAS: TAS prediálisis; Post-TAS: TAS post-diálisis; UF: ultrafiltración; UFR: ratio de ultrafiltración horaria; UFR/W: ultrafiltración horaria ajustada por peso.
Características del subgrupo de alto riesgo: pacientes con edad >70 años y/o diabetes mellitus tipo 2 y/o enfermedad cardiovascular (enfermedad vascular periférica, cardiopatía isquémica o insuficiencia cardiaca)
| Subanálisis (n = 153) | |||
|---|---|---|---|
| Edad (años) | 73,3 ± 14,1 | Peso final HD (kg) | 68,6 ± 14,1 |
| Mujer, n (%) | 43 (28,1%) | Porcentaje de reducción de peso | 3,07 ± 2,69 |
| Hipertensión, n (%) | 144 (94,1%) | Duración de la sesión (minutos) | 216 ± 27,6 |
| Diabetes, n (%) | 76 (49,7%) | Duración total semanal (horas) | 11,0 ± 1,39 |
| Enfermedad arterial periférica, n (%) | 60 (39,2%) | Volumen total UF (mL) | 2.216 ± 714 |
| Cardiopatía isquémica, n (%) | 68 (44,4%) | UFR horaria (mL/h) | 597 ± 172 |
| Insuficiencia cardiaca crónica, n (%) | 53 (34,9%) | UFR/W (mL/kg/h) | 9,23 ± 3,27 |
| FEVI (%) | 54,6 ± 11,7 | Pre-TAS (mmHg) | 138 ± 18,2 |
| Hipertrofia ventricular izquierda, n (%) | 82 (55,0%) | Post-TAS (mmHg) | 138 ± 18,1 |
| Disfunción diastólica, n (%) | 105 (70,5%) | Porcentaje de reducción de TAS | -0,08 ± 8,56 |
| Anticoagulación, n (%) | 33 (22,1%) | Acceso vascular, n (%) | |
| IECA, n (%) | 41 (26,8%) | Fístula nativa | 104 (69,8%) |
| ARA2, n (%) | 7 (4,6%) | Fístula protésica | 20 (13,4%) |
| Betabloqueantes, n (%) | 87 (56,9%) | Catéter venoso central | 25 (16,8%) |
| Calcioantagonistas, n (%) | 62 (40,5%) | Resultados analíticos | |
| Diuréticos, n (%) | 47 (30,9%) | Albúmina (g/dL) | 3,81 ± 0,39 |
| Alfabloqueantes, n (%) | 21 (13,7%) | Proteínas totales (g/dL) | 6,62 ± 0,66 |
| Otros, n (%) | 5 (3,3%) | Natremia (meq/L) | 139 ± 3,35 |
| Características de la diálisis | Kalemia (meq/L) | 5,07 ± 0,83 | |
| Peso seco (kg) | 68,6 ± 13,8 | Troponina I (ng/mL) | 0,04 (0,05) |
| GID (kg) | 2,11 ± 2,15 | Fallecidos, n (%) | 41 (26,8%) |
| Peso inicial HD (kg) | 70,8 ± 14,6 | ||
ARA2: antagonistas del receptor de angiotensina 2; FEVI: fracción de eyección del ventrículo izquierdo; GID: ganancia de peso interdiálisis; HD: hemodiálisis; IECA: inhibidor de la enzima convertidora de angiotensina; TAS: tensión arterial sistólica; Pre-TAS: TAS prediálisis; Post-TAS: TAS post-diálisis; UF: ultrafiltración; UFR: ratio de ultrafiltración horaria; UFR/W: ultrafiltración horaria ajustada por peso.
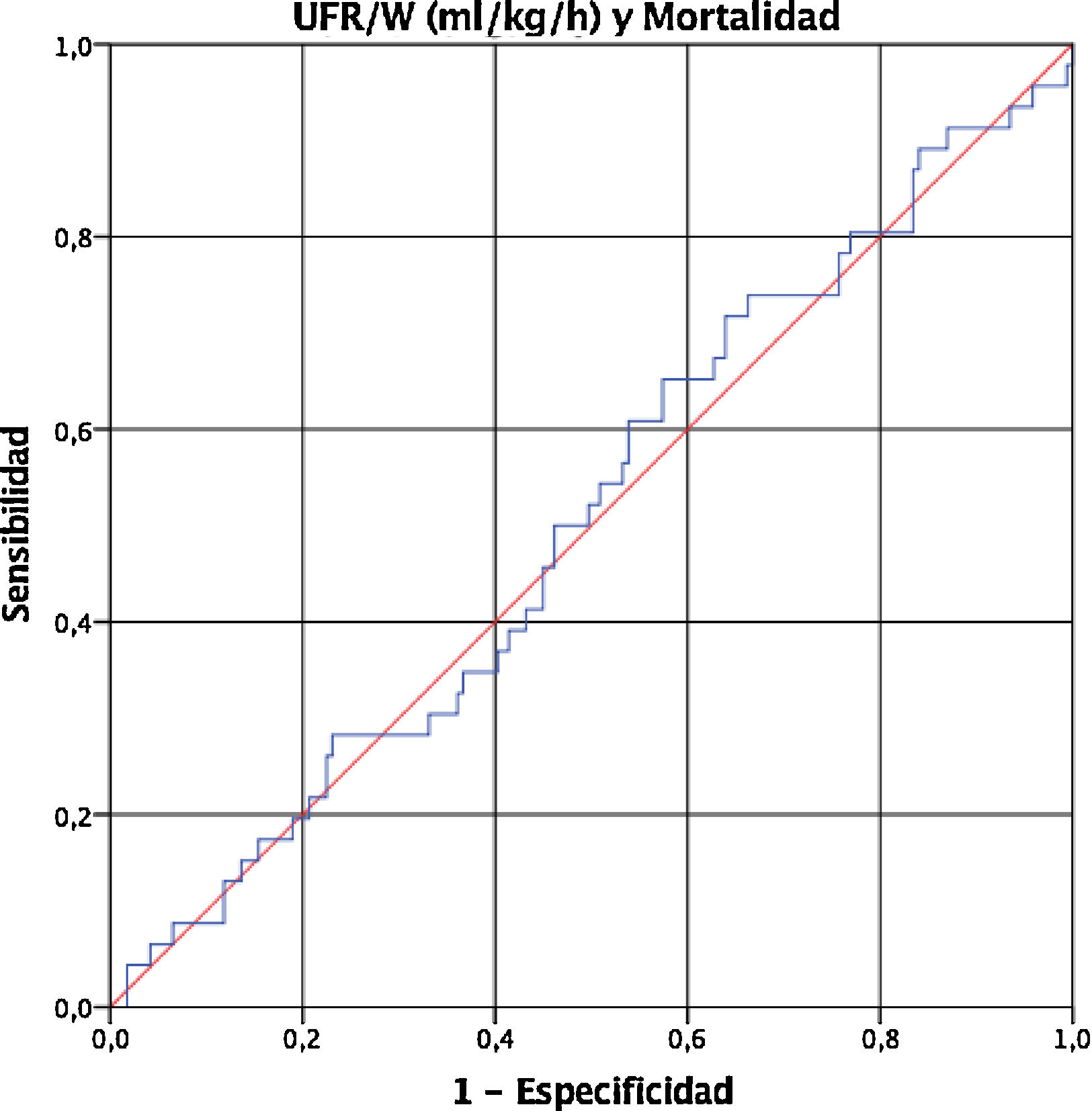
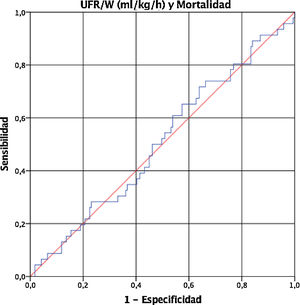
Finalmente, dado que la UFR/W es una variable continua, realizamos una curva ROC para determinar el punto de corte de UFR/W que se asocia con un incremento de la mortalidad en nuestra población. Sin embargo, la UFR/W no predijo la mortalidad (área bajo la curva 0,509, IC 95% 0,415 a 0,602) (fig. 1).
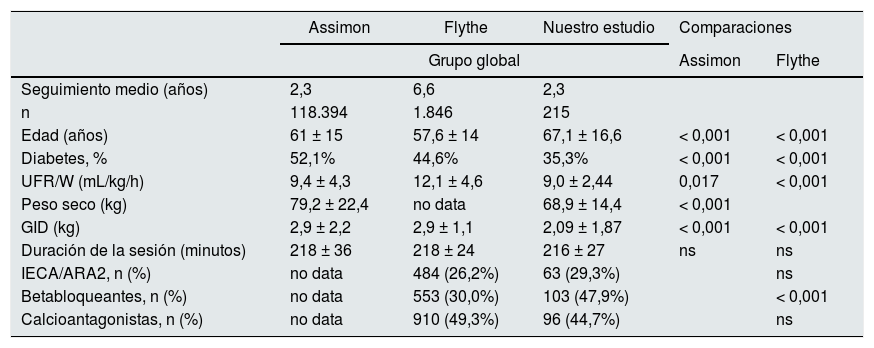
Comparación con estudios previosDado que los resultados obtenidos sobre la relación entre UFR/W y la mortalidad no concuerdan con la literatura, analizamos si existían diferencias entre las características de las distintas poblaciones estudiadas.
Assimon et al.19 concluyeron que un punto de corte de UFR/W > 13 mL/kg/h se asocia con mayor mortalidad, a pesar de que, como nosotros, observaron las UFR/W más altas en los pacientes más jóvenes y con menor peso. Sin embargo, comparando nuestros resultados con los de este trabajo, encontramos que nuestros pacientes con UFR >13 mL/kg/h en ≥ 50% de las sesiones tenían menor peso seco (50,9 vs. 73,5 kg; p < 0,001), menor GID (2,61 vs. 3,6 kg; p = 0,001) y una UFR media no tan elevada (13,41 mL/kg/h vs. 16,0 mL/kg/h; p < 0,001). Sin, no hubo diferencias en cuanto a la edad ni la duración de las sesiones (tabla 6).
Principales estudios sobre la asociación entre UFR/W y mortalidad en hemodiálisis
| Assimon | Flythe | Nuestro estudio | Comparaciones | ||
|---|---|---|---|---|---|
| Grupo global | Assimon | Flythe | |||
| Seguimiento medio (años) | 2,3 | 6,6 | 2,3 | ||
| n | 118.394 | 1.846 | 215 | ||
| Edad (años) | 61 ± 15 | 57,6 ± 14 | 67,1 ± 16,6 | < 0,001 | < 0,001 |
| Diabetes, % | 52,1% | 44,6% | 35,3% | < 0,001 | < 0,001 |
| UFR/W (mL/kg/h) | 9,4 ± 4,3 | 12,1 ± 4,6 | 9,0 ± 2,44 | 0,017 | < 0,001 |
| Peso seco (kg) | 79,2 ± 22,4 | no data | 68,9 ± 14,4 | < 0,001 | |
| GID (kg) | 2,9 ± 2,2 | 2,9 ± 1,1 | 2,09 ± 1,87 | < 0,001 | < 0,001 |
| Duración de la sesión (minutos) | 218 ± 36 | 218 ± 24 | 216 ± 27 | ns | ns |
| IECA/ARA2, n (%) | no data | 484 (26,2%) | 63 (29,3%) | ns | |
| Betabloqueantes, n (%) | no data | 553 (30,0%) | 103 (47,9%) | < 0,001 | |
| Calcioantagonistas, n (%) | no data | 910 (49,3%) | 96 (44,7%) | ns | |
| UFR/W 10-13 mL/kg/h | UFR/W 10-13 mL/kg/h | ≥ 50% sesiones | UFR/W >10 mL/kg/h | ||
|---|---|---|---|---|---|
| n | 26.794 (22,6%) | 517 (28,0%) | 80 (37,2%) | ||
| Edad (años) | 61 ± 15 | 57,9 ± 13,5 | 62 ± 17,8 | ns | ns |
| Diabetes, % | 54,0% | 46,8% | 0,325 | < 0,001 | 0,023 |
| UFR/W (mL/kg/h) | 11,4 ± 0,9 | 11,4 ± 8,6 | 11,42 ± 1,41 | ns | ns |
| Peso seco (kg) | 75,6 ± 18,3 | no data | 62,7 ± 11,8 | < 0,001 | |
| GID (kg) | 3,3 ± 2,0 | 3,0 ± 0,9 | 2,55 ± 2,74 | 0,004 | ns |
| Duración de la sesión (minutos) | 214 ± 28 | 220 ± 23 | 216 ± 28 | ns | ns |
| IECA/ARA2, n (%) | no data | 124 (24,0%) | 28 (35,0%) | 0,049 | |
| Betabloqueantes, n (%) | no data | 151 (29,2%) | 36 (45,0%) | 0,006 | |
| Calcioantagonistas, n (%) | no data | 247 (47,8%) | 41 (51,2%) | ns |
| UFR/W >13 mL/kg/h | UFR/W >13 mL/kg/h | ≥50% sesiones | UFR/W >13 mL/kg/h | ||
|---|---|---|---|---|---|
| n | 21.735 (18,4%) | 685 (37,1%) | 19 (8,8%) | ||
| Edad (años) | 58 ± 16 | 54,8 ± 14,7 | 56,0 ± 15,0 | ns | ns |
| Diabetes, % | 51,4% | 42,5% | 0,474 | ns | ns |
| UFR/W (mL/kg/h) | 16,0 ± 2,9 | 16,8 ± 3,6 | 13,41 ± 0,86 | < 0,001 | < 0,001 |
| Peso seco (kg) | 73,5 ± 6,5 | no data | 50,9 ± 13,8 | < 0,001 | |
| GID (kg) | 3,6 ± 2,2 | 3,6 ± 1 | 2,61 ± 1,06 | 0,001 | < 0,001 |
| Duración de la sesión (minutos) | 205 ± 28 | 209 ± 23 | 208 ± 28 | ns | ns |
| IECA/ARA2, n (%) | no data | 208 (30,4%) | 7 (36,8%) | ns | |
| Betabloqueantes, n (%) | no data | 222 (32,4%) | 9 (47,7%) | ns | |
| Calcioantagonistas, n (%) | no data | 371 (54,2%) | 12 (63,2%) | ns |
ARA2: antagonistas del receptor de angiotensina 2; GID: ganancia de peso interdiálisis; IECA: inhibidor de la enzima convertidora de angiotensina; ns: no significativo; UFR/W: ultrafiltración horaria ajustada por peso.
Comparamos también nuestros resultados con los de Flythe et. al29 y observamos que nuestros pacientes presentaron menor GID (2,6 vs. 3,6 kg; p < 0,001) y UFR más bajas respecto a las suyas (13,4 vs. 16,8 mL/kg/h; p < 0,001) (tabla 6).
En relación con el uso de fármacos, contrastamos nuestros resultados con los del estudio de Flythe29. Destaca que nuestros pacientes, globalmente, tienen mayor uso de betabloqueantes, pero esta diferencia significativa desaparece en el grupo con ≥ 50% sesiones con UFR >13 mL/kg/h, tal vez por nuestra n de 19 sujetos. No existen diferencias en el uso de inhibidor de la enzima convertidora de angiotensina/antagonistas de los receptores de angiotensina II (IECA/ARA2) ni de calcio-antagonistas (tabla 6). Nuestros pacientes tenían una mayor prevalencia de medicación cardioprotectora, en concreto betabloqueantes, que disminuyen la mortalidad en diálisis30, y un mejor control de la tensión arterial: nuestra tensión arterial sistólica (TAS) media fue de 144 ± 19,3 mmHg en el grupo de ≥ 50% de sesiones con UFR/W > 13 mL/kg/h, mientras que en los otros grupos de mayor UFR, un 49,1% tuvo TAS > 151 mmHg y un 40,9% tuvo TAS > 160 mmHg19,29.
DiscusiónEn el presente estudio, no encontramos diferencias estadísticamente significativas en la mortalidad en relación con las diferentes UFR/W. Como era previsible, observamos una asociación entre la mortalidad y la presencia de más comorbilidades de base, siendo la mortalidad más elevada en los pacientes con más edad, antecedentes de cardiopatía isquémica y enfermedad arterial periférica, uso de anticoagulantes, FEVI más baja, más tiempo de permanencia en hemodiálisis crónica, TAS pre y postdiálisis más baja, peor estado nutricional, menor peso, menor reducción porcentual de peso durante la diálisis y potasio más alto (tabla 4).
Las UFR altas muchas veces son consecuencia obligada de GID altas y sesiones de hemodiálisis cortas, existiendo relación entre la UFR alta y la mortalidad cardiovascular14-19. Aumentando la duración de las sesiones de hemodiálisis y disminuyendo la GID podrían conseguirse UFR más bajas. Actualmente, las estrategias basadas en largas sesiones de diálisis para el mejor control de la volemia han caído en desuso en determinados países, aunque no en el nuestro. Así, son destacables los resultados del estudio del grupo de Tassin en el que, con sesiones de hemodiálisis largas (ocho horas), consiguen efectos beneficiosos, logrando un estricto control de la volemia, con disminución de fármacos hipotensores y reducción gradual del peso corporal31,32. Con el incremento del tiempo o de la frecuencia de las sesiones de hemodiálisis (dosis de diálisis) se pretende reducir el riesgo de hipotensión arterial. El factor determinante más importante de la hipotensión intradiálisis es la disminución del volumen de plasma por debajo de un umbral crítico como resultado de un desequilibrio entre la UF y el refilling (relleno vascular con agua procedente del espacio extravascular).
Los factores que predisponen a la hipotensión intradiálisis incluyen disfunción diastólica, fibrilación auricular, disfunción barorreceptora, concentraciones bajas de sodio y calcio en el dializado, temperatura alta del dializado y los fármacos hipotensores, entre otros. La estrategia clásica para reducir el número de episodios de hipotensión intradiálisis consiste en ajustar o disminuir la UFR/W. Las tasas de UFR/W superiores a 10 mL/kg/h están asociadas con un mayor riesgo de hipotensión intradiálisis y mortalidad33. Algunos autores sugieren que usar UFR/W bajas (3 a 4 mL/kg/h) debería permitir una reducción segura del peso corporal y un buen control de la tensión arterial incluso sin fármacos34. La tasa de UFR/W ha sido definida de diferentes maneras, lo que hace que los resultados de los distintos trabajos no sean extrapolables. Con base en la literatura previa, se puede definir una alta tasa de UFR/W como la media durante un período o un porcentaje de sesiones con una UFR/W alta, habitualmente superior a 10 mL/kg/h, como exponemos a continuación.
Entre los principales trabajos que analizan la relación entre mortalidad y UF se encuentran cuatro estudios observacionales. En el Dialysis Outcomes and Practice Patterns Study (DOPPS), Saran et al.33 demostraron una asociación entre UFR/W > 10 mL/kg/h y mortalidad total (hazard ratio [HR] 1,09, p = 0,02) en 22.000 pacientes de hemodiálisis. En dicho estudio, se vincularon las sesiones más largas y los Kt/Vurea más altos con menor mortalidad, mientras que las UFR/W > 10 mL/kg/h se relacionaron con mayor mortalidad. Las sesiones de hemodiálisis de más de 240 minutos se asociaron significativamente con menor riesgo relativo (RR) de mortalidad (cada 30 minutos de la sesión de hemodiálisis disminuía un 7% el RR de mortalidad). Además, sugieren que las sesiones largas de hemodiálisis podrían reducir la morbilidad y mortalidad cardiovascular. Por otro lado, Movilli et al.9 realizaron un estudio prospectivo en 287 pacientes en hemodiálisis, describiendo que la supervivencia disminuye con tasas de UF altas, sobre todo con UFR/W superior a 12,4 mL/kg/h, por lo que recomiendan aumentar el tiempo o la frecuencia de las sesiones de hemodiálisis para evitar UFR/W altas y mejorar la supervivencia. En un análisis post hoc de 1.846 pacientes del estudio HEMO (Hemodialysis Study), Flythe et al.29 encontraron que UFR/W > 10 mL/kg/h se vincularon con un aumento de la mortalidad cardiovascular y por cualquier causa, si bien a partir de UFR/W > 13 mL/kg/h este resultó más marcado (mortalidad de cualquier causa HR 1,59, IC 95% 1,29 a 1,96; mortalidad cardiovascular HR 1,71, IC 95% 1,23 a 2,38). Por otro lado, hay que destacar el trabajo de Assimon et al.19, que analizó la UF en 118.394 pacientes en hemodiálisis en un estudio de cohortes retrospectivo, observando que la UFR/W > 13 mL/kg/h durante las sesiones de hemodiálisis de los primeros 30 días de seguimiento se vinculó con una mayor mortalidad, y que un aumento de la UFR/W de 1 mL/kg/h asociaba un aumento del riesgo de muerte del 3%.
En nuestro caso, estudiamos la media y el porcentaje de sesiones por encima de las cuales se alcanzaba una UF excesiva, definida como UFR/W > 10 mL/kg/h, durante los 30 meses del estudio. Nuestra media de UFR/W total fue de 9,0 mL/kg/h, pero un 59% (127) de los pacientes tuvo una UFR/W > 10 mL/kg/h en más del 25% de las sesiones y un 8,8% (19) tuvo una UFR/W > 13 mL/kg/h en ≥ 50% de las sesiones de diálisis (tablas 2 y 3). El análisis de estos datos nos lleva a concluir que podríamos haber aumentado la duración o la frecuencia de las sesiones de hemodiálisis para evitar altas tasas de UF y mejorar la supervivencia. Este dato permite estimar que, ajustando la UFR en cada sesión para cada paciente según su peso seco, GID y comorbilidades de base, se podría reducir el potencial riesgo individual que conllevan las UFR/W más exigentes. En nuestra muestra, los pacientes con mayor UFR/W resultaron ser más jóvenes, con menor peso seco, mayor GID, menor peso inicial y final, mayor volumen de UF y mayor porcentaje de reducción de peso en hemodiálisis. Las características de esta población con UFR/W más altas han podido influir en la baja mortalidad observada ya que, aún analizando separadamente el grupo de mayor riesgo cardiovascular y más edad, no notamos diferencias estadísticamente significativas. Sin embargo, no podemos descartar que puedan sufrir daños imperceptibles que incrementen la mortalidad en un seguimiento prolongado. Las UFR/W altas en los pacientes con menor peso seco se explican porque, en dichas personas, pequeñas GID en valores absolutos (kg) suponen incrementos importantes en la volemia respecto al peso y conllevan UFR/W más altas. Para evitar las UFR/W elevadas en los pacientes de peso seco más bajo habría que considerar aumentar el tiempo y/o la frecuencia de las sesiones de hemodiálisis.
Probablemente, el reducido tamaño muestral de nuestro estudio respecto al de Assimon (19 pacientes vs. 21.735 con UFR/W > 13 mL/kg/h) supone una limitación importante. Es posible que la mortalidad no tenga significación estadística en nuestro grupo con UFR/W más elevada porque, al ser personas con menos peso (peso seco 51,4 kg) y más jóvenes, tengan menor riesgo cardiovascular respecto a la población americana estudiada por Assimon, que tenía un peso seco 22,1 kg superior al nuestro. Nuestros pacientes con UFR/W más alta presentaron menor GID y, por tanto, menos UFR/W respecto al estudio de Assimon. A esto se une un probable menor riesgo cardiovascular por el hecho de tener menos peso y ser más jóvenes que los individuos del estudio de Assimon. Consideramos que esta puede ser la explicación de por qué este grupo, a pesar de tener UFR/W > 13 mL/kg/h en ≥ 50% de las sesiones de hemodiálisis, no se asoció con un aumento significativo de la mortalidad. Nuestra media de seguimiento fue de 2,3 años, al igual que en el estudio de Assimon, pero sería interesante analizar los datos relativos a la mortalidad a más largo plazo. Contrastando nuestros resultados con los de los estudios de Assimon y Flythe, encontramos que los individuos con UFR/W más elevadas son, en general, más jóvenes en los tres estudios. Sin embargo, incluso las UFR/W y GID medias más altas (13,41 mL/kg/h y 2,61 kg) en nuestros pacientes son inferiores a los de los otros dos, hecho que consideramos ha influido notablemente en los resultados de nuestro estudio, puesto que las personas con UFR/W más alta no presentaron un aumento significativo de la mortalidad durante el tiempo de seguimiento del estudio. Probablemente las diferencias relativas al peso y a la edad estén en relación con las características demográficas y socioeconómicas de las diferentes poblaciones, sobre todo el peso, dada la mayor prevalencia de obesidad en EEUU.
Una UFR/W elevada determina la aparición de hipotensión intradiálisis, pérdida de la función renal residual, daño isquémico y posible trombosis del acceso vascular. Por otro lado, la UFR/W alta contribuye a un buen mantenimiento de la euvolemia, lo que se asocia con resultados cardiovasculares favorables, que incluyen la mejoría de la hipertrofia del ventrículo izquierdo35 y la prevención de descompensaciones de insuficiencia cardiaca, con mejor supervivencia36–39. Por ello, es importante implementar estrategias individualizadas con el fin de garantizar una UFR/W específica para la situación hemodinámica y cardiovascular de cada paciente, sin exceder 13 mL/kg/h.
La evaluación de la ecocardiografía intradiálisis y de la troponina inducida por hipotensión arterial han demostrado que la isquemia cardiaca es un mediador potencial de la tasa de mortalidad relacionada con la UF40. Se debe evitar la UFR/W excesiva para permitir un refilling apropiado para cada paciente, para lo cual se proponen diferentes soluciones. Daugirdas ha analizado cómo podría optimizarse la UFR en hemodiálisis41 y sugiere que podría ser más apropiado escalar las tasas de UFR en relación con el área de superficie corporal en lugar de con el peso corporal. Otra alternativa sería calcular el peso seco «ideal» del paciente mediante bioimpedancia, de manera que se pueda efectuar un ajuste individualizado de la UFR42. Por otro lado, algunos autores están estudiando la realización de perfiles de UF para valorar intensificar la UFR al comienzo de la sesión de hemodiálisis43.
Como conclusión, en la población de nuestra unidad de diálisis, probablemente representativa de la realidad española, no se observó una relación entre UFR/W y mortalidad. Estos resultados difieren de los reportados en la literatura. Las diferencias podrían explicarse por la mejor situación basal de los pacientes con mayor UFR/W, así como en las variaciones en las características basales de la población y magnitud de la UFR/W con los estudios previos que sí asociaron UFR/W con mortalidad. Los obesos en hemodiálisis (HD) suelen tener mortalidad inferior por la epidemiología inversa, mientras que los más delgados pueden estar desnutridos. Este concepto hace que, posiblemente, los pesos extremos hayan de eliminarse, pues son factores que agravan o reducen la mortalidad. Los obesos tendrán menor tasa de UF por peso y además les protege de mortalidad. En EE. UU. el paciente obeso es frecuente y puede tener implicación sobre los resultados. Así, en una población con mejor protección farmacológica cardiovascular y en la que se evitan los extremos superiores de UFR/W, no objetivamos un impacto negativo de esta sobre la mortalidad. Otra posible explicación para no encontrar diferencias en esta entre los grupos, se explicaría porque existe un mayor cuidado de las personas vulnerables, a las que se trataría con diálisis más largas y menor tasa de UF/hora/peso, para mejorar la tolerancia. Esto intentaría aproximar su mortalidad a la del grupo más saludable. Dado que el tamaño muestral fue relativamente pequeño, sería interesante plantear un estudio multicéntrico español para establecer puntos de corte de UFR/W adaptados a la realidad española que marquen un aumento del riesgo de muerte.
FinanciaciónProyecto financiado por el fondo de investigación sanitaria ISC-III y cofinanciado con fondos FEDER PI16/01298.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.