INTRODUCCIÓN
El trasplante renal está considerado como la mejor forma de tratamiento de la insuficiencia renal crónica1a. El pronóstico depende de conseguir un equilibrio adecuado entre el tratamiento inmunosupresor y el estado inmune del paciente; un exceso de inmunosupresión provocaría infecciones y tumores y, al contrario, un defecto podría favorecer la presencia de rechazo.
En los últimos años se han comunicado nuevos esquemas de inmunosupresión en el trasplante, que guardan relación con el cambio en el perfil del paciente al que se debe realizar el trasplante y de su donante (criterio expandido, hipersensibilizados, donante fallecido de causa cardiovascular, ABO y HLA incompatibles, donante vivo, etc.). Además han aparecido nuevos perfiles en función de los riesgos de enfermedades infecciosas o tumorales que hacen que el gold standard de la inmunosupresión pueda variar en función de esos perfiles.
El término sobreinmunosupresión no está recogido en MeSH y los artículos indexados como tal lo hacen como immunosupression. Asimismo, el Diccionario de términos médicos de la Real Academia Nacional de Medicina1b tampoco dispone de una entrada para el término sobreinmunosupresión. En ambos casos se hace referencia a inmunosupresión como la disminución de la respuesta inmunitaria, ya sea por causas naturales, como consecuencia de una enfermedad congénita o adquirida, provocada artificialmente mediante irradiación o administración de productos químicos o biológicos para evitar el rechazo de los trasplantes, o por ambas causas a la vez, y que aumenta el riesgo de infecciones. En teoría, cabe distinguir entre inmunodepresión como disminución de la respuesta inmune e inmunosupresión como anulación de dicha respuesta. En la práctica, esta distinción se está perdiendo, posiblemente por la influencia del inglés supression, que indica disminución.
Si ya existe controversia en el término, la discrepancia surgida para tratar de monitorizar la inmunosupresión es mucho mayor, si bien se han realizado y se están realizando estudios que podrían complementar a los ya disponibles en la comprensión y abordaje de la respuesta inmune, no solo a nivel del uso de agentes inmunosupresores, sino también en cuanto a la respuesta en relación con enfermedades infecciosas asociadas con el trasplante. Un aspecto para tener en cuenta, muy mencionado en la actualidad, es el “estado neto de inmunosupresión”, que hace referencia a una serie de factores que cuando están presentes contribuyen a la aparición de infecciones.
En la actual revisión, pretendemos dar una definición más efectiva que literal del término de sobreinmunosupresión, además de actualizar los conocimientos, en función de estudios recientes, respecto a la monitorización de la respuesta inmune, no solo durante el trasplante, sino incluso antes de este (en lista de espera), con el objeto de conocer a los pacientes que están en riesgo de sufrir alguna enfermedad infecciosa. Se ha revisado el estado actual de biomarcadores, especialmente no invasivos, que ofrecerían una ayuda especial tanto en la prevención como en el tratamiento y monitorización de la sobreinmunosupresión.
Dado que la eficacia terapéutica en el tratamiento de las infecciones en el paciente trasplantado va a depender, en mayor o menor grado, de un diagnóstico eficaz y temprano de la enfermedad y del tratamiento más adecuado, se han revisado las publicaciones presentes en el momento actual sobre las novedades surgidas tanto en el diagnóstico como en el tratamiento de las enfermedades infecciosas más comunes en trasplante renal.
MÉTODOS
Se han revisado, tras una búsqueda en PubMed y Google Academic, los artículos relacionados con monitorización de la respuesta inmune, biomarcadores, diagnóstico y tratamiento de las infecciones oportunistas desde finales de los 2000 hasta 2017. Inicialmente se han seleccionado algo más de 104 artículos y revisado finalmente 71, contando las publicaciones recomendadas en las consideraciones finales realizadas durante el transcurso de la reunión Prometeo 2. Los artículos seleccionados se clasificaron según el grado de evidencia por el sistema Grade (alta, moderada, baja).
DEFINICIÓN DE SOBREINMUNOSUPRESIÓN
Una vez expuestas las dificultades para encontrar un término indexado y dado que no existe una definición clara y extensa para sobreinmunosupresión, por razones prácticas podemos definir este término como lo reflejan Budde et al2: la frecuencia y gravedad de infecciones oportunistas3 y de malignidad en pacientes que reciben tratamiento inmunosupresor. Esta definición está basada en que tanto las infecciones como la presencia de tumores se suelen considerar como “end points clínicos” en la mayoría de los estudios y suponen dos de las causas más importantes de fallecimiento en los pacientes trasplantados.
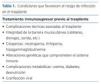
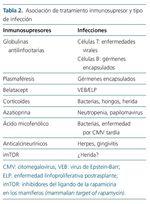
El riesgo de infección en un trasplante renal está asociado al tratamiento inmunosupresor, aunque depende también de una serie de factores que determinan el estatus neto de inmunosupresión (tabla 1). La clase de agente infeccioso implicado está asociada, de forma directa o indirecta, al tratamiento inmunosupresor utilizado, como refleja la tabla 2. Cabe reseñar respecto a esta tabla que son las dosis y los niveles elevados de imTOR (inhibidores del ligando de la rapamicina en los mamíferos [mammalian target of rapamycin]) los que están relacionados con la incidencia de estas infecciones. En la actualidad se emplean dosis y niveles más bajos y sin inducción, observándose una incidencia similar e incluso menor, si nos referimos a enfermedades virales, a las que presentan los pacientes tratados con derivados del ácido micofenólico4,5.
MONITORIZACIÓN DEL SISTEMA INMUNOLÓGICO
El éxito de un trasplante se basa en encontrar el equilibrio perfecto entre la presencia de rechazo, por un lado, y la aparición de infecciones y/o neoplasias, por otro. En la práctica clínica, es común monitorizar los niveles de agentes inmunosupresores y tratar de anticiparnos a las infecciones con análisis de PCR, fundamentalmente citomegalovirus (CMV) y bacilo de Koch (BK), aunque esto no represente conocer el estado de inmunosupresión del paciente. En los últimos años se han desarrollado métodos que tratan de identificar el verdadero estado de respuesta inmune del paciente. A continuación se revisan los aspectos más desarrollados en este campo:
• Valor predictivo ImmuKnow.
• Inmunidad celular (T: CD4, CD8, Treg).
• Natural killer (NK).
• Inmunidad humoral: inmunoglobulinas (Ig) y complemento.
• Biomarcadores de inmunosupresión.
ImmuKnow
El ImmuKnow es un marcador de producción de ATP en las células de la respuesta inmune. A pesar de que su nivel elevado se ha relacionado con la existencia de rechazo y su nivel bajo con la presencia de infecciones, no se considera un marcador de inmunosupresión, por sus resultados poco consistentes, la falta de un adecuado punto de corte, su variabilidad según el momento de la realización y que no discrimina el tipo de infecciones o rechazo.
PerezJacoiste et al6, tras un estudio prospectivo de cohortes realizado entre 2011 y 2013 en 100 pacientes, concluyen que este test al mes postrasplante predice el desarrollo de enfermedad por CMV entre el primer y el sexto meses postrasplante. No influye fuera de ese período ni con la presencia de otras infecciones. Evidencia baja.
Huskey et al7 analizan el valor predictivo de este test para diagnosticar infecciones oportunistas o rechazo, en un estudio retrospectivo observacional de 188 pacientes con infección oportunista y 94 con rechazo agudo. Concluyen que los niveles de ImmuKnow 90 días antes no predicen ni el desarrollo de infección oportunista ni el rechazo agudo. Evidencia baja.
Berglund et al8 analizan, en un estudio retrospectivo y observacional, la mortalidad de 362 pacientes trasplantados renales y encuentran una asociación de niveles de ImmuKnow < 175 ng/ml con una mayor mortalidad. Evidencia baja.
He et al9 estudian la influencia de la monitorización con ImmuKnow en un estudio retrospectivo observacional de 42 trasplantes renales y lo comparan con 25 controles sanos. Concluyen que la monitorización tiene mayor valor que determinaciones aisladas para detectar un cambio que se asocie con un evento (infección o rechazo). Evidencia baja.
Ling et al10 realizan un metaanálisis que demuestra una baja sensibilidad y especificidad para infección y menor aún para rechazo. Evidencia alta.
Inmunidad celular
El estudio de producción de citocinas (interferón gamma [IFNγ]) por las células que participan en la respuesta inmune tras ser estimuladas con distintos mitógenos proporciona información sobre la capacidad de respuesta de estas células y, por tanto, sobre la posibilidad de tener un rechazo. Por otra parte, el estudio de subpoblaciones linfocitarias aporta información sobre el riesgo de padecer infecciones oportunistas según el grado de depleción linfocitaria ocasionada por el tipo de inducción en el trasplante.
FernándezRuiz et al11 encuentran una predisposición a sufrir infecciones oportunistas en pacientes sin inducción con globulina antitimocítica (ATG) en aquellos con un nivel de CD8 al mes < 0,100 × 103 células/μl y en pacientes que reciben ATG con un nivel de CD4 al mes < 0,050 × 103 células/μl, que tienen mayor incidencia de enfermedad por CMV. Estos autores concluyen que la monitorización de las poblaciones linfocitarias puede ser útil para predecir infecciones oportunistas y ayudar a confeccionar una inmunosupresión adecuada al perfil de cada paciente. Evidencia moderada. Este mismo autor12 estudió las poblaciones linfocitarias NK en 396 pacientes, de los que 304 eran trasplantes renales y 92 trasplantes hepáticos, encontrando que un recuento de NK al mes < 50 células/μl tiene mayor riesgo de infecciones fúngicas, con una sensibilidad del 87,5% y una especificidad del 55,8%. Evidencia moderada.
Schachtner et al13, en un estudio prospectivo de casoscontrol de 97 pacientes que recibieron un injerto procedente de donante vivo (35 ABOi y 62 ABOc), detectaron más complicaciones infecciosas en los primeros meses postrasplante y una mayor disminución de las poblaciones linfocitarias (CD19, CD3, CD4, IFNγ, IL10). Evidencia baja.
San Segundo et al14, en un estudio de poblaciones linfocitarias en 18 trasplantes renales que fueron convertidos a imTOR, encontraron un aumento en el número absoluto de células Tregs, lo que facilitaría cierto grado de tolerancia inmunológica. Evidencia baja.
En sentido contrario, Hope et al15 realizaron un estudio observacional prospectivo en 56 receptores de trasplante renal con antecedentes o diagnóstico de cáncer y los compararon con 25 pacientes sin cáncer, y encontraron una respuesta aloinmune disminuida, así como células NK. Evidencia baja.
Hricik et al16, en un estudio sobre la valoración de la respuesta aloinmune mediante IFNγ ELISpot, concluyeron que este test puede asesorar sobre el riesgo inmunológico, si bien estos resultados están alterados en los pacientes que reciben ATG. Evidencia moderada. Crespo et al17 estudiaron a 60 pacientes con biopsias al sexto mes y encontraron que la monitorización mediante IFNγ ELISpot puede asesorar sobre la presencia de rechazo agudo subclínico y la presencia de anticuerpos HLA de novo. Evidencia moderada. Ambos estudios difieren en el tiempo de realización del test.
El problema reside en que, para realizar muchos de estos estudios, no se dispone de células del donante, la metodología empleada no está estandarizada y suele ser laboriosa, y los resultados tampoco están validados, por lo que, actualmente, es difícil poder extrapolar los resultados a la práctica clínica.
Inmunidad humoral
A diferencia de lo que ocurre con la monitorización de la respuesta celular, hay estudios que relacionan la hipogammaglobulinemia y la hipocomplementemia (C3) con la presencia de infecciones. Actualmente está en marcha un estudio multicéntrico español cuyo objetivo es dar validación a los estudios previos sobre estos parámetros.
FernándezRuiz et al18 evaluaron prospectivamente la incidencia de hipogammaglobulinemia en una serie de 226 trasplantes renales y encontraron que la presencia de hipogammaglobulinemia al mes es un factor de riesgo de infección bacteriana entre el primer mes y el sexto postrasplante. Evidencia moderada. Estos mismos autores19 publicaron 1 año más tarde los resultados de otro estudio prospectivo con 270 pacientes trasplantados renales sobre la monitorización de C3 y C4 tras el trasplante. En un análisis multivariado, la presencia de hipocomplementemia C3 al mes postrasplante emergió como factor de riesgo independiente para todas las infecciones en general y la infección bacteriana en particular. Evidencia moderada.
Florescu et al20 realizaron un metaanálisis que estudió 18 artículos sobre la hipogammaglobulinemia global y grave durante el primer año tras el trasplante y su impacto sobre la tasa de enfermedades oportunistas, y concluyeron que la aparición de hipogammaglobulinemia es frecuente durante el primer año postrasplante y que una hipogammaglobulinemia grave tiene un impacto negativo sobre la morbimortalidad asociada a infecciones oportunistas. Evidencia alta.
Tras estos resultados, y una vez validados con el estudio multicéntrico en marcha, el impacto de este hallazgo sobre la eficacia terapéutica futura deberá ser investigado.
Biomarcadores
El tratamiento inmunosupresor, en la mayoría de los pacientes trasplantados, no está seleccionado según las características individuales de alorreactividad, y la monitorización de los fármacos está en función de los efectos adversos que puedan presentar y analizando los niveles valle en sangre periférica. Esto puede conllevar que los pacientes presenten infrainmunosupresión, con el resultado de rechazo o, por el contrario, sobreinmunosupresión, con el resultado de infecciones o tumores21.
En los últimos años se han diseñado biomarcadores con el objeto de diagnosticar de manera incruenta la presencia de rechazo, individualizar el tratamiento inmunosupresor y anticipar un pronóstico de un evento futuro. El valor de un biomarcador es altamente dependiente de su uso clínico.
Anglicheau et al22 puntualizaron sobre los requisitos que deben cumplir estos test, como por ejemplo poseer unos elevados valores predictivos positivo y negativo en el caso de un test diagnóstico, como puede ser el de rechazo agudo. En ese mismo artículo se evaluaron los pasos que debe seguir el desarrollo de un biomarcador, que van desde la realización de estudios exploratorios, ensayos clínicos con su consiguiente validación, estudios retrospectivos longitudinales, estudios prospectivos y, finalmente, estudios controlados aleatorizados.
En la actualidad, del documento de consenso de Barcelona20, de la revisión crítica de biomarcadores22 y de otros estudios2,2327, hemos podido concluir que:
• La monitorización intracelular o del IFNγ y de la IL2, antes y después del trasplante, puede identificar a pacientes con alto riesgo de rechazo y ayudar a la minimización de la inmunosupresión. Evidencia moderada.
• CXCL9 y CXCL10 en orina asesoran sobre la inflamación del injerto renal, están validados y falta su implementación en la práctica clínica. Evidencia alta.
• La expresión genética de NFAT para la respuesta a anticalcineurínicos asesora sobre el riesgo de rechazo e infecciones. Evidencia moderada.
• El ADN derivado de las células del injerto (GcfDNA), conocido también como biopsia líquida, es un marcador de detección temprana del daño en el injerto, tanto el debido a rechazo subclínico como a infecciones o isquemia. Evidencia alta.
• El ajuste de la dosis de tacrolimus de liberación inmediata asesorado por el estudio del genotipo CYP3A5*1 mejora la dosis inicial en el trasplante renal. Estos datos no sirven para la ciclosporina A. Evidencia alta.
El problema de los biomarcadores está en la capacidad de poder desarrollar el test, ya que muchos laboratorios de histocompatibilidad no disponen de un banco con células del donante, en la realización de una validación interna y externa, en poder proceder a la estandarización de los resultados y establecer puntos de corte apropiados, en aportar calidad al programa y en la necesidad de revisar los resultados cada 35 años. En la actualidad están en marcha proyectos internacionales para adaptar y homogeneizar el estudio de los biomarcadores no invasivos que proporcionarán resultados en los próximos años.
CONSECUENCIAS INFECCIOSAS DE LA SOBREINMUNOSUPRESIÓN
Una de las consecuencias derivadas de la sobreinmunosupresión es la aparición de infecciones oportunistas, definidas como la aparición de infecciones por bacterias intracelulares (Listeria, Legionella, micobacterias y Nocardia) e infecciones asociadas a herpes virus (CMV, herpes varicela zóster, enfermedad linfoproliferativa asociada al virus de EpsteinBarr [VEB]), poliomavirus, hongos (cándida, Aspergillus, criptococo), Pneumocistis y parásitos3.
A continuación se revisan algunos aspectos que han surgido en los últimos años, especialmente en CMV, y que pueden tener consecuencias en el planteamiento de la inmunosupresión en estos pacientes.
Citomegalovirus
El CMV persiste como el patógeno más importante en trasplante renal, a pesar del uso de terapias específicas y efectivas. El reservorio del CMV latente está en los monocitos, lo que afecta a la respuesta inmune innata y favorece sobreinfecciones (Pneumocystis, Aspergillus), que producen replicación viral en órganos (nefritis, hepatitis, carditis, neumonitis, pancreatitis) y en vasos sanguíneos (fibroblastos, epitelios, endotelios), con las consecuencias clínicas derivadas de esta afectación4.
En los últimos años se han visto cambios en la incidencia de CMV, la profilaxis, el tratamiento y la monitorización inmune.
Incidencia de citomegalovirus
La incidencia de CMV es especialmente elevada, el 91,9% en los 3 primeros meses en pacientes de alto riesgo, especialmente receptores seronegativos que reciben un donante seropositivo sin profilaxis. La incidencia es también elevada en pacientes seropositivos (4060%) sin profilaxis. La incidencia de infección tardía (una vez finalizada la profilaxis) es de un 2540%. Asimismo, la incidencia se incrementa con la presencia de rechazo, coinfecciones por el virus herpes o uso de agentes policlonales4,28,29.
En los últimos años se han producido cambios en la incidencia de CMV. En poblaciones de trasplantes que utilizan protocolos de desensibilización y, por tanto, considerados de alto riesgo4, Toyoda et al30 estudian 372 pacientes sometidos a terapia de desensibilización (rituximab, inmunoglobulinas, plasmaféresis, alemtuzumab) y no encuentran mayor tasa de infecciones virales (CMV, VEB, BK) que en el grupo control, formado por 538 pacientes, en un estudio prospectivo casoscontrol. Evidencia moderada. Por el contrario, Puttarajappa et al31, tras un estudio observacional y retrospectivo en pacientes de alto riesgo (D+R– y que recibieron timoglobulina como inducción) y profilaxis con valganciclovir durante 6 meses, encontraron una incidencia del 40%, si bien hasta un 47% de los pacientes presentaba la infección cuando estaba recibiendo profilaxis. Estos autores recomiendan ajustar la dosis de valganciclovir a la función renal y asegurar el cumplimiento terapéutico. Evidencia baja.
Los pacientes que reciben imTOR de novo asociado a anticalcineurínicos sufren una incidencia menor de infecciones virales, especialmente CMV. En el estudio de Tedesco et al32, que comparó ciclosporina y everolimus con ciclosporina y micofenolato mofetil, la incidencia era del 00,7% frente al 5,9%. Evidencia alta. Más recientemente, Tedesco et al33 compararon 3 grupos de pacientes: el primero con inducción con ATG e inmunosuprimido con tacrolimus y everolimus; el segundo con inducción con basiliximab e inmunosuprimido con tacrolimus y everolimus, y el tercero con inducción con basiliximab e inmunosuprimido con tacrolimus y micofenolato sódico. Encontraron una disminución de incidencia en los grupos primero y segundo frente al grupo con micofenolato sódico (4,7, 10,8 y 37,6%, respectivamente). Evidencia moderada. Otros autores verifican esta disminución en la incidencia de CMV en pacientes tratados de novo con everolimus, con ciclosporina o tacrolimus frente a derivados del ácido micofenólico3438, entre ellos un estudio en trasplante renal ABO incompatible, un metaanálisis y un estudio en trasplante de pulmón. Evidencia moderada. Recientemente se han presentado en ESOT 2017 los resultados del estudio TRANSFORM39 y del estudio ATHENA40, que demuestran una considerable disminución de incidencia de CMV en el grupo tratado con everolimus frente al tratado con micofenolato mofetil (el 3,6 frente al 13,3% en el primero y el 6 frente al 21% en el segundo). Evidencia alta. Estos resultados también se confirman con sirolimus y tacrolimus de liberación retrasada41 frente a micofenolato mofetil —estudio RECORD— (el 1,3 frente al 9,33%). Evidencia alta.
Profilaxis de citomegalovirus
La profilaxis, en general, es preferible a la terapia anticipada, por reflejar mejores resultados tanto a nivel de supervivencia del injerto como en cuanto al pronóstico clínico, y se puede recomendar la estrategia anticipada a receptor + en riñón, hígado o corazón. Al no haber estudios en pulmón o intestino, no existe recomendación.
Se recomienda la profilaxis en pacientes de alto riesgo por otros motivos, como el empleo de rituximab, plasmaféresis y eculizumab, agentes deplecionantes de linfocitos comúnmente usados en terapias de desensibilización.
El valganciclovir es el agente antiviral preferido. Una alternativa en pacientes con un trasplante renal que presenta leucopenia es el aciclovir.
La dosis de valganciclovir debe ajustarse a la función renal y asegurarse un adecuado cumplimiento.
La profilaxis retardada (más de 10 días postrasplante) en D+R– puede prevenir la aparición de enfermedad tardía por CMV tras la retirada de la profilaxis.
Estas recomendaciones, y algunas otras, se reflejan en el documento de consenso sobre el tratamiento de CMV elaborado por TorreCisneros et al42. Evidencia alta.
Fehr43 et al realizaron un estudio aleatorizado en trasplantes renales43 y concluyeron que los diferentes tratamientos (profilaxis frente a anticipada) se deben adaptar al estado serológico, a la inmunosupresión y al centro trasplantador. Evidencia moderada.
Respecto al ajuste de dosis, Puttarajappa et al31 ecuentran una incidencia elevada de infección en los pacientes coincidiendo con la utilización de valganciclovir en profilaxis. Estos autores recomiendan ajustar las dosis de valganciclovir a la función renal y asegurar el cumplimiento terapéutico. Evidencia baja.
San Juan et al44 realizaron un estudio piloto con 44 receptores de trasplante de órgano sólido (corazón, hígado y riñón) D+R–, que comparó la incidencia y gravedad de la enfermedad por CMV en pacientes que recibieron profilaxis antes o después del 10 días postrasplante, y encontraron una menor incidencia de enfermedad tardía por CMV en los que recibieron profilaxis retardada y de menos gravedad. Evidencia baja.
Tratamiento de los citomegalovirus
La revisión sobre el abordaje del CMV en el documento de consenso publicado el pasado año42 y las revisiones de expertos mundiales como Fishman4, Kotton28 o Razonable y Humar29 ofrecen algunas novedades en el tratamiento del CMV.
Si bien hay conceptos bien definidos y con un nivel de evidencia elevado, existen otros que son motivo de debate, tanto en la bibliografía como en los foros internacionales y nacionales. Los nuevos agentes antivirales ofrecen resultados prometedores como alternativa al valganciclovir, especialmente en casos de resistencia, pero o bien tienen efectos adversos que complican su uso o todavía no están disponibles en nuestro país. Probablemente, a partir de los resultados obtenidos de los estudios TRANSFORM y ATHENA, se puedan diseñar otros estudios que aconsejen un cambio o modificación en la inmunosupresión de cara a evitar resistencias o efectos adversos indeseados.
El valganciclovir es el fármaco de elección, siempre ajustado a la función renal. Evidencia alta.
La duración del tratamiento debe ser al menos de 2 semanas y con 2 determinaciones consecutivas de ausencia de replicación viral. Evidencia alta.
Ante una falta de respuesta al tratamiento deben investigarse las mutaciones responsables de la resistencia al tratamiento (UL95, UL54). Evidencia alta.
En casos de resistencia a ganciclovir, las opciones van desde el aumento de dosis a 10 mg/k/12 h (evidencia alta), al uso de foscarnet (evidencia alta), cambio de inmunosupresor a imTOR (evidencia baja), o el empleo de nuevos antivirales: marimavir, leflunomida, artesunato, letermovir y brincidofovir (evidencia baja).
Marinavir, letermovir y brincidofovir no están disponibles en España.
En casos de infección grave, que comprometa la vida del paciente, se pueden usar inmunoglobulinas y, en algunos centros, inmunoterapia adoptiva. Evidencia baja.
Monitorización de la respuesta inmune en los citomegalovirus
El control de la infección por CMV por parte del sistema inmune (innata y adoptiva) es una pieza imprescindible para la resolución de la infección y la protección para nuevas infecciones. Diversas células del sistema inmune están implicadas, entre ellas CD8 y CD4, aunque otras células juegan un papel importante (Tregs, NK, γδ). El papel de la respuesta humoral está menos definido en la cuantificación de proteínas del CMV (glucoproteína, H o complejo pentamérico).
La capacidad de respuesta inmune frente a la infección viral se mide por la producción de IFNγ por parte de las células CD8 y CD4 cuando se estimulan utilizando partículas virales.
Actualmente existen 4 métodos, con sus ventajas e inconvenientes42, que se emplean en el estudio de la respuesta inmune frente al CMV: tinción de citocinas intracelulares, ELISpot, QuantiFERON y tinción de tetrámeros del MHC. Kumar et al45 estudiaron, mediante QuantiFERON, 108 trasplantes con alto riesgo de enfermedad por CMV y encontraron que la detección de la respuesta INFγ al final de la profilaxis se correlacionó con la protección frente al desarrollo de la enfermedad por CMV. Evidencia baja.
Kaminski et al46 estudiaron la expansión de células TVδ2– γδ y concluyeron que se produce una más rápida expansión en este tipo de células en los pacientes con enfermedad tardía que en los que la tienen temprana por CMV. Evidencia baja.
Higdon et al47 realizaron un estudio en 18 pacientes que analizó la respuesta a las células T, y encontraron que los receptores de trasplante serológicamente positivos para CMV, sin viremia o con viremia asintomática, tenían células respondedoras a CMV pretrasplante y que se incrementaron durante el primer año. Evidecia baja.
Lee et al48 investigaron el QuantiFERON CMV en receptores de trasplante de medula ósea y encontraron que la monitorización de la respuesta inmune a células T CMV específica predice la recurrencia de infección por CMV en el trasplante pediátrico. Evidencia baja.
Tarasewicz et al49 estudiaron el QuantiFERON en el trasplante renal y concluyeron que pacientes con niveles bajos de IFN podrían beneficiarse de una reducción de la inmunosupresión o mantener la profilaxis antiviral, ya que se incrementa el riesgo de infección. Permite estratificar el riesgo pretrasplante, al final de la profilaxis y durante el tratamiento. Evidencia baja.
Abate et al50 compararon ELISpot y QuantiFERON para ver la capacidad de ambos métodos para detectar la presencia de infección, y no encontraron diferencias en ambos test en sensibilidad, especificidad y correlación inversa con el desarrollo de viremia. Evidencia baja.
SanJuan et al51 estudiaron la presencia de células de inmunidad específica al CMV con la presencia de enfermedad por CMV en 95 pacientes, y encontraron que la respuesta de la inmunidad específica fue mayor en el trasplante hepático que en el renal y el cardíaco. La respuesta fue protectora frente a la enfermedad por CMV. Evidencia baja.
Sund et al52 realizaron un estudio prospectivo de la inmunidad específica a CMV en trasplantes seropositivos y encontraron que la monitorización de la reducción del IFN dependiente de CD4 frente al valor basal es predictivo de riesgo de enfermedad. Evidencia baja.
Banas et al53 realizaron un estudio T Track para identificar a pacientes en riesgo de enfermedad por CMV. Encontraron el T Track altamente sensible para identificar pacientes que desarrollan enfermedad por CMV. Evidencia baja.
Vacunas
La creación de una vacuna antiCMV viene siendo motivo de interés en los últimos años. Uno de los problemas que considerar en su uso es el tipo de respuesta inmune que queremos conseguir: producción de citocinas por parte de las células de respuesta celular o estimular la producción de anticuerpos dirigidos frente a partículas virales que actúen impidiendo la manifestación de la infección por CMV. Hasta el momento se han diseñado vacunas frente a glucoproteína B, glucoproteína B+ pp65IE1 fusión y glucoproteína B+ pp6554.
Los resultados de ensayos clínicos en fase 2 figuran en el documento de consenso42 y, según estos, en seropositivos no demuestran beneficios y los seronegativos tienen enfermedad menos grave pero la infección es similar, por lo que no permiten hacer ninguna consideración sobre su uso clínico. No obstante, está en marcha un nuevo estudio en fase 2 sobre una nueva vacuna, de la cual todavía no tenemos resultados.
Virus de Epstein-Barr/enfermedad linfoproliferativa postrasplante
El VEB es un gammaherpesvirus con una seroprevalencia que oscila entre el 5%, en la población pediátrica y localizada, hasta el 90%, en la población adulta mundial. La infección por VEB se caracteriza clínicamente por fiebre, linfadenopatía, hepatoesplenomegalia y hepatitis. Tras el trasplante, los pacientes seronegativos que sufren una infección por VEB tienen un alto riesgo de padecer enfermedad linfoproliferativa postrasplante (ELP)4.
La incidencia varía en función de la edad (pediátrica y adulta) y el tipo de trasplante; así, en niños la incidencia en trasplante renal oscila entre un 23% en riñón hasta un 1520% en pulmón o intestino y en adultos entre un 1,02,3% en riñón y un 20% en intestino55. En nuestro país, Franco et al56 reportan una incidencia en trasplante renal del 2,3% a los 21 años56.
Los factores de riesgo implicados son infección por VEB primaria, CMV D+R–, depleción de células T, edad joven en niños y mayor edad en adultos e intensidad de la inmunosupresión. El belatacept incrementa el riesgo de ELP, especialmente con afectación del sistema nervioso central (SNC) en pacientes seronegativos4,55. Existen datos contradictorios respecto a imTOR; por un lado, parece que hay una asociación de estos fármacos con la aparición de ELP y, por otro, dado su mecanismo de acción, serían beneficiosos en el tratamiento de la inmunosupresión en ELP55.
El tratamiento debe ser individualizado: combinación de disminución de la inmunosupresión (no está demostrado que el cambio a un imTOR cambie el pronóstico de la enfermedad, pero se ha descrito como estrategia para reducir la incidencia de rechazo si se suspenden anticalcineurínicos y/o micofenolato), tratamiento con antiCD20 (rituximab), CHOP (ciclofosfamida, hidroxidaunomicina, Oncovín® [vincristina] y prednisona, quimioterapia) y/o terapia adoptiva. En casos de afectación del SNC se debe aplicar irradiación. Resulta fundamental la estadificación histopatológica para definir la estrategia terapéutica que seguir4,55.
La monitorización de la carga viral se ha propuesto como parámetro de riesgo, aunque no existen datos con suficiente evidencia que lo corrobore. En trasplante cardíaco57 se ha relacionado la carga viral crónica con la aparición de ELP tras un estudio observacional retrospectivo. Evidencia baja. En cambio, en trasplante hepático no se encuentra dicha relación en un estudio observacional retrospectivo58. Evidencia baja. Todavía no se ha configurado una estrategia preventiva, aunque hace 2 años se publicó un estudio multicéntrico europeo basado en la realización de un cuestionario a 71 equipos de trasplante en 15 países59. En este estudio, se observó que la monitorización de la carga viral, a pesar de la falta de evidencia, sigue realizándose como medida de diagnóstico precoz en Europa y de control de reducción de la inmunosupresión. Otros parámetros observados son: que el 50,9% reducía la inmunosupresión, el 30,9 cambiaba a un imTOR, y el 60,9% realizaba una PET (tomografía por emisión de positrones). Evidencia baja. Una reciente revisión en Corea60 de 18 casos de ELP en su población en 20 años recomienda una monitorización de la infección por VEB para un mejor tratamiento de la ELP. Evidencia baja.
Se recomienda conocer el estatus del VEB entre donante y receptor4,55.
Pneumocystis jirovecii
Fishman4 realiza una revisión sobre la incidencia, etiopatogenia, diagnóstico y tratamiento de la neumonía por Pneumocistis (evindencia baja, dado que es una opinión de experto) y Martin y Fishman61 describen las recomendaciones adoptadas por la AST Infectios Diseases Community of Practice y, aunque el nivel de evidencia del artículo como tal es baja, existen recomendaciones con un nivel de evidencia mayor, moderada-alta.
Pneumocystis jirovecii es un organismo unicelular que en individuos con alteraciones en la inmunidad puede causar neumonía, cuyo pronóstico va desde una enfermedad menor a neumonía complicada y muerte. Su incidencia se ha modificado en los últimos años y se cree que es por la disminución de las dosis de esteroides y la profilaxis antibiótica, y varía según el órgano trasplantado desde un 5 a un 15%; esta incidencia es mayor en trasplante pulmonar o en cardiopulmonar. Se desconoce dónde se encuentra el reservorio de Pneumocystis; en infecciones tempranas se cree que puede ser una reactivación de una colonización previa o una infección latente, aunque se han comunicado brotes de infección por trasmisión persona a persona4,61,62.
Suele ocurrir entre el 1.o y el 6.o meses postrasplante, coincidiendo con un estado de mayor inmunosupresión y con un uso inadecuado de la profilaxis, aunque también puede ocurrir a lo largo de la vida del trasplante, especialmente relacionada con un exceso de inmunosupresión (tratamiento de rechazo agudo, coinfección por CMV).
Los factores predisponentes son infecciones respiratorias virales previas que impiden el aclaramiento ciliar y afectan a la función de los macrófagos, profilaxis inadecuada y no utilización de cotrimoxazol. Otros factores van ligados al tipo y dosis de inmunosupresión: uso de agentes policlonales, dosis elevadas de esteroides (un estudio estima una dosis por encima de 30 mg de prednisona al día) y uso de anticalcineurínicos. Se pensó, por estudios iniciales, que el micofenolato mofetilo podría ser protector frente a Pneumocystis, pero estudios posteriores no pudieron demostrarlo. Por último, algunos factores clínicos se han asociado a neumonía por Pneumocystis: infección por CMV, tratamiento antirrechazo, neutropenia, bajo recuento de linfocitos T y, fundamentalmente, baja exposición a la profilaxis61.
La clínica es inespecífica, con tos, disnea, fiebre, dolor torácico y alteraciones en la auscultación pulmonar, hipoxemia y elevación de LDH o de niveles de 13βDglucano. El estudio radiológico es inespecífico. El diagnóstico se establece con el estudio de esputo o secreciones bronquiales mediante tinciones para identificar quistes o trofozoitos (Gomori, Giemsa), aunque hay técnicas de biología molecular que son útiles en el diagnóstico4,61.
El tratamiento de elección es trimetoprimsulfametoxazol a dosis de 1520 mg/kg día (trimetoprim). Se recomienda una buena hidratación, uso de ácido fólico y monitorizar los efectos adversos, ya que la dosis puede resultar excesiva. Otras alternativas son la atovaquona, la clindamicina con primaquina o pirimetamina, o la pentamidina intravenosa. Parece recomendado el uso concomitante de un ciclo corto de esteroides y tratamiento frente a CMV4,61.
Infecciones fúngicas
Aspergillus
La aspergilosis invasiva suele ocurrir en pacientes debilitados e inmunosuprimidos. Su incidencia oscila entre un 1 y un 15% y varía según el órgano trasplantado: riñón, 0,74%; hígado, 19,2%; corazón, 114%. En pulmón, el grado de colonización es de un 20% y el de infección, de un 6%4.
La mortalidad asociada a Aspergillus en pacientes debilitados o inmunocomprometidos oscilaba históricamente entre un 65 y un 93%, y era la responsable de la causa de muerte en el primer año postrasplante del 9,316,9%63. Actualmente, la mortalidad oscila entre un 20 y > 50%. LópezMedrano et al64, en un estudio multinacional, encontraron un grado de supervivencia a las 12 semanas del 60,7%. Evidencia baja.
Los factores que contribuyen a su incidencia son los comunes a infecciones fúngicas y van unidos a la necesidad de reintervenciones, fracaso renal agudo que precisa hemodiálisis e infección por CMV y por virus de la hepatitis C4,62. Recientemente, LópezMedrano et al65 han comunicado la presencia de enfermedad pulmonar obstructiva crónica, el retraso en la función inicial del injerto renal, el posterior fracaso renal agudo y la presencia de bacteriemia en los 3 meses previos como factores de riesgo de aspergilosis invasiva en un estudio retrospectivo y multicéntrico desde 2000 a 2013, en 19 instituciones europeas. Evidencia baja.
El diagnóstico clínico se basa en la presencia de fiebre, tos, hemoptisis y probable afectación pleural y del SNC. Aspergillus fumigatus es la especie de Aspergillus aislada con mayor frecuencia y para su diagnóstico es fundamental el aislamiento del germen. El galactomanano en sangre es mucho menos sensible que el galactomanano en fluidos4. En el estudio multicéntrico de LópezMedrano et al64, la positividad del galactomanano en suero fue del 61,3% y en el lavado broncoalveolar, del 57,1%.
El tratamiento se basa en el uso de voriconazol y/o anfotericina B. El uso de voriconazol en el estudio multicéntrico de LópezMedrano et al64 se consideró como factor protector para mortalidad y la asociación de antifúngicos no tuvo relevancia en el pronóstico. Isavuconazol se ha posicionado como una alternativa al voriconazol66.
Candidiasis
Silveira et al67, en un estudio de revisión, definen la candidiasis como la infección fúngica invasiva más frecuente en trasplante, siendo algo más de la mitad de todas las infecciones fúngicas en esta población. La incidencia acumulada al año es del 1,9%, más elevada en el intestino, y siguiendo por orden descendente: páncreas, hígado, riñón corazón y pulmón. Evidencia baja.
Candida albicans es la especie de cándida más frecuente y Candida glabrata en la más frecuente del resto de las cándidas.
Fishman4 y Silveira et al67 comunican que suele ocurrir en los 3 primeros meses de trasplante como una infección nosocomial y está asociada con catéteres vasculares, drenajes, uso de antibióticos, alimentación enteral o parenteral, estancia en la unidad de cuidados intensivos, necesidad de diálisis, diabetes o ser portador de sonda vesical. En este último apartado, la presencia de candiduria se debe evaluar en ausencia de sonda vesical. En general, estos factores de riesgo son los mismos que en la población general. En trasplante debemos añadir el tipo de trasplante y el tipo de anastomosis quirúrgica, como por ejemplo el drenaje exocrino a vejiga en el trasplante renopancreático. Evidencia baja.
Silveira et al67 hacen una revisión sobre la sensibilidad y especificidad de las diferentes medidas diagnósticas. El diagnóstico se basa en el aislamiento de la cándida en cultivos estériles, si bien la sensibilidad de los nuevos cultivos es del 70%. Existen otras técnicas que ayudan al diagnóstico, como son la determinación del 13βDglucano y PCR. En un estudio de 55 pacientes, de los que el 20% eran receptores de trasplante, la sensibilidad y la especificidad del 13βDglucano y la PCR eran del 56 y el 73% para el primero y del 80 y el 70% para la PCR. La sensibilidad y especificidad de cultivos y 13βDglucano y PCR aumenta al 79 y al 93%, respectivamente. Evidencia baja.
Es fundamental identificar la especie de cándida para elegir el tratamiento más adecuado, ya que determinadas cepas se hacen resistentes a determinados azoles e incluso a equinocandinas. Evidencia baja.
Fishman4 y Silveira et al67 proponen el tratamiento de la candidiasis invasiva como no diferente en los pacientes trasplantados de la población general, solo que se deben tener en cuenta las interacciones de los azoles con los anticalcineurínicos, por lo que habrá que ajustar la dosis de estos últimos en función de los niveles plasmáticos. En general, la elección del agente terapéutico va a depender de la microbiología local y de sus respuestas a los distintos agentes. Evidencia baja.
Mucormicosis
A pesar de que la incidencia de infecciones fúngicas en general ha disminuido, otras infecciones fúngicas como la mucormicosis y las causadas por Scedosporium, Fusarium o Penicillium están siendo más frecuentes. La mucormicosis es la infección fúngica que ha ido emergiendo en los últimos años en relación con pacientes inmunocomprometidos, especialmente en diabéticos. Supone un 214% de las infecciones fúngicas en trasplante, y es la responsable de un 26% de las infecciones fúngicas invasivas4,68. Evidencia alta.
Recientemente, Song et al68 realizaron una revisión de 174 casos que revisaba la presentación clínica, el diagnóstico y el pronóstico. La forma clínica más frecuente fue la rinocerebral (33,3%), seguida de la pulmonar (25,9%).
El diagnóstico se realizó mediante el estudio histológico de la muestra y el cultivo.
La mortalidad de la mucormicosis diseminada es del 76% y la mortalidad de la mucormicosis del injerto renal es del 55,6%. Evidencia alta.
El tratamiento consiste en desbridamiento y antifúngicos (anfotericina liposomal y posaconazol). El pronóstico es mejor cuando se combina desbridamiento y antibióticos que antibióticos o cirugía solos (el 70,2 frente al 32,4 frente al 36,4%). Evidencia alta.
Isavuconazol se ha considerado como tratamiento alternativo en el reciente informe sobre posicionamiento terapéutico65.
Criptococo
Es la tercera forma más frecuente de infección fúngica en el trasplante de órgano sólido. Se estima que un 8% de todas las infecciones fúngicas en el trasplante de órgano sólido están causadas por criptococo y que su incidencia oscila entre un 0,2 y un 5%, y es más frecuente en trasplantados hepáticos4,6. Evidencia baja.
Es una infección tardía, entre 19 y 21 meses postrasplante, y la puerta de entrada suelen ser esporas inhaladas que provocan colonización, pero también se ha descrito la piel como puerta de entrada69,70. Evidencia baja.
Los factores de riesgo asociados a criptococo son los comunes a todas las infecciones fúngicas. En esta infección tiene especial relevancia el uso y las dosis de agentes deplecionantes de linfocitos (alemtuzumab, timoglobulina), así como el contacto con excrementos de pájaros y murciélagos.
La manifestación clínica suele ser una meningoencefalitis, pero otros órganos como el pulmón, el hígado o la próstata pueden estar afectados.
El diagnóstico se establece detectando el antígeno criptocócico en suero y en líquido espinal. El antígeno criptocócico tiene más sensibilidad que la tinción India, si bien la utilización de diversas tinciones ayuda a la identificación de la especie de criptococo4,69,70. Evidencia alta.
No existen estudios aleatorizados que sugieran un tratamiento u otro. Las guías americanas sobre enfermedades infecciosas recomiendan el uso de anfotericina B más flucitosina seguido de fluconazol durante un largo período (hasta 12 meses). Evidencia moderada.
Hay que reseñar que el tratamiento y la disminución de la inmunosupresión pueden dar lugar al síndrome de reconstitución inflamatoria inmune, que se caracteriza por un empeoramiento de la sintomatología neurológica, que puede llevar a una obstrucción ventricular y a la hidrocefalia4,69.
Parasitosis
En los últimos años ha aparecido un aumento en las publicaciones de enfermedades parasitarias en el trasplante de órganos; a pesar de ello, se considera que las enfermedades parasitarias son el capítulo de las enfermedades infecciosas en trasplante menos estudiadas y, salvo alguna actualización sobre Trypanosoma cruzi o Strongyloides, nada se ha estudiado y se han desarrollado pocos tratamientos; la mayor parte no están aprobados por la FDA.
Las infecciones parasitarias pueden afectar a receptores de un trasplante como recrudescencia de una infección latente, como consecuencia de una infección de novo o como transmisión por el órgano trasplantado.
La incidencia de enfermedad parasitaria en trasplantes de órgano sólido ha experimentado un crecimiento debido a programas de trasplante en áreas geográficas endémicas, pacientes que se trasplantan en zonas endémicas y regresan con infección transmitida en el órgano, inmigrantes a países occidentales desconocedores de su infección y turismo de trasplante71. Evidencia baja.
Un amplio y detallado resumen de estas infecciones puede encontrarse en Schwartz et al, en una revisión publicada en 201371.
CONCLUSIONES
Existe poca consistencia en la definición de sobreinmunosupresión y, por ello, se ha considerado una definición de índole práctica. La monitorización de la respuesta inmune trata de encontrar marcadores específicos de rechazo o, por el contrario, de sobreinmunosupresión, pero los trabajos publicados relacionados carecen de una evidencia científica lo suficientemente alta como para recomendar su uso en la práctica clínica, si bien algunos de ellos, como la hipogammaglobulinemia y la hipocomplementemia, parecen tener un impacto importante en la aparición de enfermedades infecciosas. La cuantificación de IFNγ procedente de células T estimuladas se está considerando un marcador de respuesta inmune celular. La aparición de biomarcadores ha suscitado un importante interés en la comunidad científica y, de hecho, existe un primer documento de consenso que recoge una serie de biomarcadores, tanto diagnósticos y terapéuticos como de monitorización del trasplante, aunque faltan estudios que confirmen los datos o que sean reproducibles en la mayoría de los centros, para que formen parte de la práctica clínica. Algunos de ellos (CXCL9, CXCL10) ya se han validado para su implementación. Finalmente, existen estudios clínicos que demuestran una disminución en la incidencia de infección por CMV con el uso de imTOR de novo y que la utilización de estos fármacos supone la posibilidad de realizar cambios en las distintas estrategias de profilaxis y de tratamiento. La respuesta de la inmunidad celular a la infección por CMV a través de QuantiFERON, ElisPOT y otros se está considerando como una estrategia tanto en la prevención como en la respuesta al tratamiento del CMV. Respecto a otras infecciones oportunistas, no se han realizado estudios con suficiente evidencia científica, a pesar de un aumento en su incidencia, especialmente en enfermedades parasitarias. Recientemente, ha habido un posicionamiento a nivel estatal en el uso de nuevos antifúngicos para el tratamiento de la aspergilosis invasiva y la mucormicosis.
Conflicto de intereses
El autor Constantino Fernández ha recibido honorarios por asesoría científica y por conferencias de Novartis, Alexion y Chiesi.
El autor Álex Gutiérrez ha recibido honorarios por asesoría científica y por ponencias de Chiesi y Novartis.
Los autores Marisa Agüera, Sheila Cabello, Sonia Cillero, Ana Fernández, Antonio Franco, Teresa García, Román Hernández, Inmaculada Lorenzo, Thais López, Alicia Mendiluce, Miguel Ángel Muñoz, Pilar Pascual, Ana Ramos e Isabel Sáez declaran que no tienen conflicto de intereses potencial relacionado con los contenidos de este artículo.
Correspondencia:
Constantino Fernández Rivera
Servicio Nefrología.
Complexo Hospitalario Universitario A Coruña.
As Xubias 84. PC 15006, A Coruña.
Constantino.fernandez.rivera@sergas.es
Revisión por expertos bajo la responsabilidad de la Sociedad Española de Nefrología.