El síndrome nefrótico en los pacientes con cáncer se puede asociar a su enfermedad de base o al tratamiento quimioterapéutico. El cáncer de órganos sólidos puede producir una glomerulonefritis membranosa que se manifiesta con síndrome nefrótico; otras presentaciones histológicas menos frecuentes son la glomeruloesclerosis focal y segmentaria y la enfermedad de cambios mínimos. Adicionalmente, los tratamientos quimioterapéuticos pueden causar toxicidad renal por afección de los pequeños vasos sanguíneos, los glomérulos, los túbulos y el intersticio. Los inhibidores de la tirosina quinasa como el sunitinib pueden causar daño endotelial y podocitario, produciendo una microangiopatía trombótica limitada a los riñones, que se manifiesta con proteinuria e hipertensión. Se presenta el caso de un hombre anciano con tumor del estroma gastrointestinal (GIST, por sus siglas en inglés) que fue tratado con sunitinib y como complicación presentó una microangiopatía trombótica manifestada con síndrome nefrótico e hipertensión de difícil control, que se controló al suspender este medicamento pero con desenlace fatal por su neoplasia maligna.
Nephrotic syndrome in patients with cancer may be related to the primary malignancy or chemotherapeutic therapy. Solid organ cancers may cause membranous glomerulonephritis manifesting with nephrotic syndrome; other less common histologic presentations include focal and segmental glomerulosclerosis and minimal change disease. In addition, chemotherapy agents can cause renal toxicity by affecting the small blood vessels, glomeruli, tubules, and interstitium. Tyrosine kinase inhibitors such as sunitinib may cause endothelial and podocyte damage leading to renal limited thrombotic microangiopathy, manifested by proteinuria and hypertension. We report a case of an elderly man with gastrointestinal stromal tumor (GIST) on treatment with sunitinib who had as a complication of a thrombotic microangiopathy manifested with nephrotic syndrome and difficult-to-control hypertension, which was controlled by stopping this drug but with a fatal outcome due to its malignant neoplasm.
El cáncer puede afectar el riñón secundario a lesiones glomerulares (glomerulopatías paraneoplásicas), o como consecuencia de los efectos tóxicos de la quimioterapia, radiación administrada por mieloablación y la afectación directa de la vasculatura renal por las células tumorales1,2. Entre los medicamentos relacionados con daño renal se encuentran los inhibidores del receptor de tirosina quinasa como el sunitinib3,4.
El sunitinib es un inhibidor multitarget de tirosina quinasa que bloquea la actividad de múltiples enzimas, entre ellas el factor de crecimiento endotelial vascular (VEGF), sistema de señalización implicado en la angiogénesis y el crecimiento tumoral2,5. Creciente evidencia reporta el riesgo de este medicamento en causar daño de los pequeños vasos sanguíneos y en los glomérulos renales, el cual clínicamente se manifiesta con hipertensión arterial, proteinuria, síndrome nefrótico y falla renal aguda6. Las lesiones renales observadas más frecuentes son glomeruloesclerosis focal y segmentaria, microangiopatía trombótica (MAT), y en ocasiones, necrosis tubular aguda y nefritis intersticial aguda1,3,5–10.
A continuación reportamos un caso raro de microangiopatía trombótica limitada al riñón secundaria a uso de sunitinib varios meses posteriores a su inicio, el cual fue documentado por biopsia renal y que derivó en enfermedad renal crónica con síndrome nefrótico e hipertensión de difícil control, que se controlaron al suspender el medicamento, pero con desenlace fatal por la neoplasia maligna.
Reporte de casoHombre de 74 años, con antecedentes de hipertensión arterial e hipotiroidismo, con función renal basal normal (creatinina 0,8mg/dl, sin proteinuria). En el año 2014 se le realizó diagnóstico de tumor GIST (gastrointestinal stromal tumor por sus siglas en inglés) en esófago distal con múltiples lesiones metastásicas a hígado; el paciente fue tratado inicialmente con 54 ciclos de imatinib (inhibidor de la tirosina quinasa [ITK]). En el 2018 se observó progresión tumoral de las lesiones de esófago e hígado, con evidencia de nuevas lesiones en pulmones por lo cual se hizo cambio por sunitinib (ITK más potente) el cual recibió durante el período desde agosto de 2018 hasta mayo de 2020; en total, el paciente recibió 6 ciclos consistentes en 50mg/día de sunitinib durante 4 semanas, seguidos de 2 semanas de descanso.
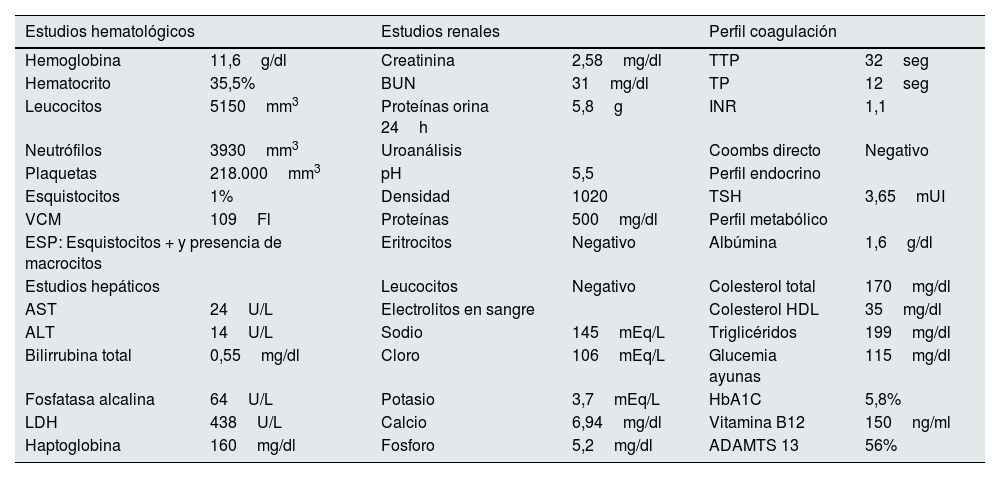
En abril de 2020 el paciente presentó deterioro progresivo de su función renal, con elevación de la creatinina sérica, proteinuria en rango nefrótico, edema marcado de miembros inferiores y palpebrales; asociado a disnea de esfuerzo, ortopnea, disnea paroxística nocturna y disminución de la diuresis. En análisis paraclínicos complementarios se documentó anemia macrocítica, LDH elevada, prueba de Coombs directa negativa; complemento sérico C3 y C4 en valores normales (C3: 112mg/dl y C4: 22mg/dl), ADAMTS 13 normal, sin trombocitopenia, sin reticulocitosis ni consumo de haptoglobina, crioglobulinas negativas y con presencia de esquistocitos 1% en el extendido de sangre periférica. No se encontró compromiso de otros órganos, con ecocardiograma normal; la macrocitosis se asoció a deficiencia de vitamina B12 (tabla 1).
Exámenes de laboratorio
| Estudios hematológicos | Estudios renales | Perfil coagulación | |||
|---|---|---|---|---|---|
| Hemoglobina | 11,6g/dl | Creatinina | 2,58mg/dl | TTP | 32seg |
| Hematocrito | 35,5% | BUN | 31mg/dl | TP | 12seg |
| Leucocitos | 5150mm3 | Proteínas orina 24h | 5,8g | INR | 1,1 |
| Neutrófilos | 3930mm3 | Uroanálisis | Coombs directo | Negativo | |
| Plaquetas | 218.000mm3 | pH | 5,5 | Perfil endocrino | |
| Esquistocitos | 1% | Densidad | 1020 | TSH | 3,65mUI |
| VCM | 109Fl | Proteínas | 500mg/dl | Perfil metabólico | |
| ESP: Esquistocitos + y presencia de macrocitos | Eritrocitos | Negativo | Albúmina | 1,6g/dl | |
| Estudios hepáticos | Leucocitos | Negativo | Colesterol total | 170mg/dl | |
| AST | 24U/L | Electrolitos en sangre | Colesterol HDL | 35mg/dl | |
| ALT | 14U/L | Sodio | 145mEq/L | Triglicéridos | 199mg/dl |
| Bilirrubina total | 0,55mg/dl | Cloro | 106mEq/L | Glucemia ayunas | 115mg/dl |
| Fosfatasa alcalina | 64U/L | Potasio | 3,7mEq/L | HbA1C | 5,8% |
| LDH | 438U/L | Calcio | 6,94mg/dl | Vitamina B12 | 150ng/ml |
| Haptoglobina | 160mg/dl | Fosforo | 5,2mg/dl | ADAMTS 13 | 56% |
ALT: alanina transaminasa; AST: aspartato transaminasa; BUN: nitrógeno ureico; HbA1C: hemoglobina glucosilada; LDH: lactato deshidrogenasa; TSH: hormona estimulante de la tiroides; VCM: volumen corpuscular medio..
Ante este escenario clínico se plantearon como posibilidades diagnósticas nefropatía membranosa secundaria a su patología oncológica de base o efecto adverso medicamentoso (sunitinib) tipo MAT.
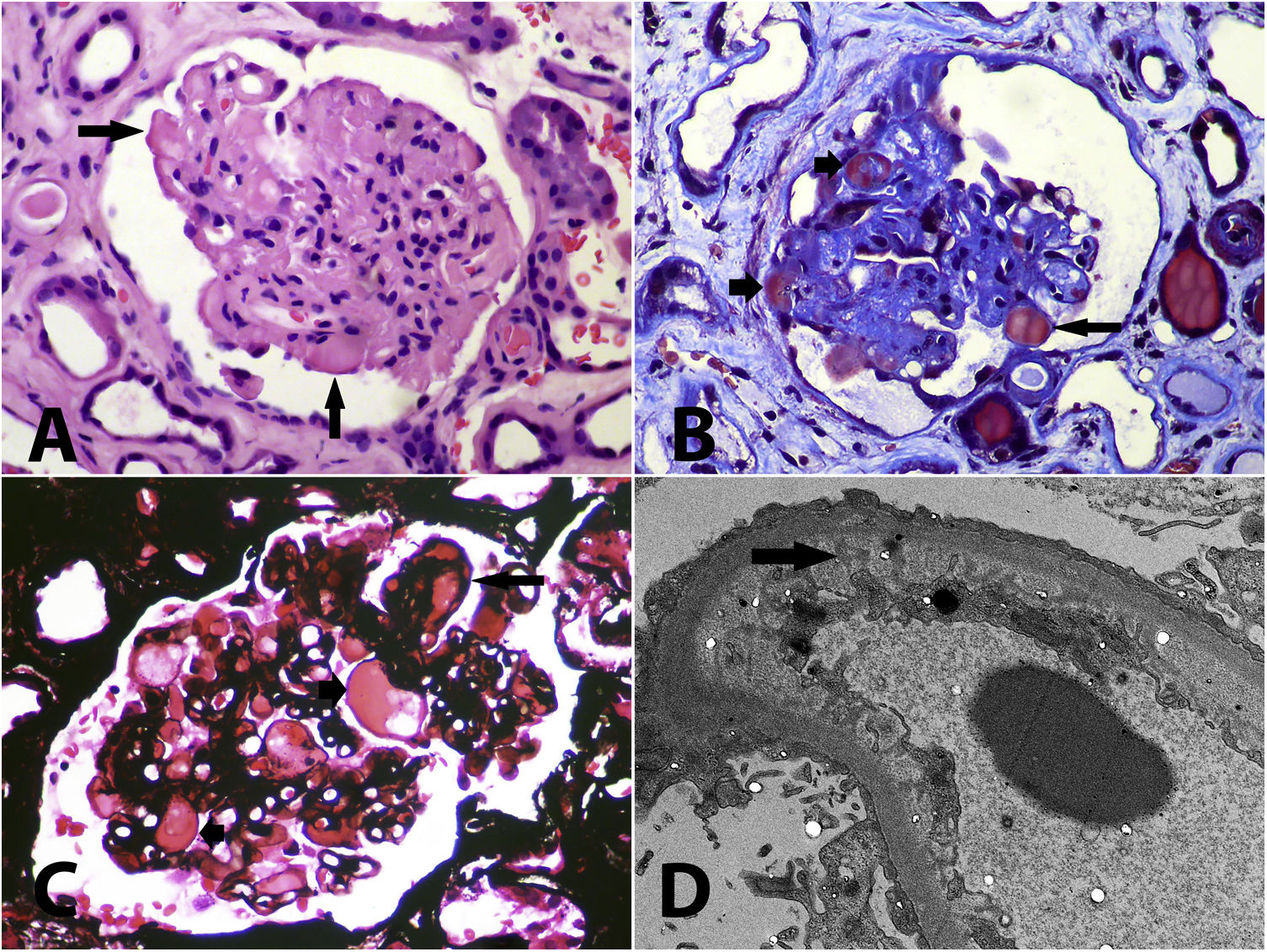
Inicialmente, se trató la hipertensión con amlodipina 10mg/día, metoprolol 100mg/día, furosemida 40mg/día, prazosina 6mg/día con control adecuado de las cifras de presión arterial y mejoría de su diuresis. Se realizó biopsia renal con hallazgos de microangiopatía trombótica crónica acompañada de glomeruloesclerosis focal y segmentaria secundaria (fig. 1), adicionalmente se reportó intersticio con edema, infiltrado inflamatorio mononuclear y daño epitelial agudo (nefritis tubulointersticial), con presencia en algunas arteriolas de trombos en vías de organización. Por los hallazgos de la biopsia en un paciente que por ningún motivo deseaba diálisis, se decidió en el mes de mayo de 2020 suspender sunitinib, presentando mejoría significativa de la función renal, resolución del síndrome nefrótico, control de sus cifras de presión arterial y sin signos de anemia hemolítica microangiopática; los resultados de los últimos análisis paraclínicos realizados en septiembre de 2020 fueron creatinina 1,26mg/dl, hemoglobina 11,7g/dl, plaquetas 523.000mm3, LDH 287U/L, extendido de sangre periférica sin presencia de esquistocitos, albúmina 3,5g/dl y proteinuria en orina de 24h de 120mg. Sin embargo, el paciente presentó progresión de las lesiones hepáticas tumorales sin posibilidad de manejo adicional, por lo cual se decidió tratamiento paliativo y el paciente murió debido a las lesiones tumorales malignas en octubre de 2020.
A: Glomérulo con aspecto solidificado, con pérdida o disminución de luces capilares, algunas paredes capilares se ven engrosadas y hay segmentos hialinos (flechas) que pueden corresponder a segmentos con daño irreversible y exudado de proteínas, o a trombos intracapilares (hematoxilina-eosina, X400). B: Glomérulo con retracción isquémica, compactación y segmentos hialinos (flechas cortas), y un trombo reciente intracapilar (flecha larga) (tricrómico de Masson, X400). C: Acúmulos intracapilares de material hialino o proteináceo (flechas cortas) que pueden corresponder a segmentos de hialinosis o a trombos en vía de organización; se reconoce un doble contorno (flecha larga) y las luces capilares se ven estrechas (plata-metenamina, X400). D: Daño podocitario difuso, con pérdida de pedicelos, marcado edema subendotelial, con pérdida de fenestraciones (flecha); en otros capilares se detectan dobles contornos, sin depósitos electrón-densos (microscopia electrónica de transmisión, aumento original, X2.100).
El sunitinib es un ITK que afecta las vías del VEGFR (vascular endothelial growth factor receptor según sus siglas en inglés) y del PDGFR (platelet-derived growth factor receptor según sus siglas en inglés). Su uso está cada vez más extendido en la oncología por sus propiedades antiangiogénicas, siendo indicado principalmente en carcinoma de células renales, GIST y tumores neuroendocrinos de páncreas7.
La toxicidad renal relacionada con los ITK se ha descrito con sunitinib5,10,11; en la literatura se describen pacientes con un síndrome similar a la preeclampsia con hipertensión y proteinuria, con mejoría después de suspender o disminuir la dosis de sunitinib7,11; en otro paciente con diagnóstico GIST se desarrolló una MAT, pero sin datos de biopsia renal12; posteriormente, han reportado diferentes casos de MAT histológicamente documentado en pacientes en tratamiento con sunitinib5,8,13–15 y de nefritis intersticial aguda secundaria a sunitinib16. Otras lesiones histopatológicas renales secundarias al tratamiento antiangiogénico incluyen nefropatía por IgA, glomerulonefritis membranoproliferativa y glomeruloesclerosis focal y segmentaria, con un sesgo en los reportes ya que la mayoría de los pacientes en este contexto de falla renal y cáncer en quimioterapia no son sometidos de biopsia de riñón6,14,17.
El VEGF se expresa constitutivamente por los podocitos, y los receptores de VEGF están presentes en las células endoteliales capilares glomerulares normales. La patogenia de la MAT en pacientes que reciben terapia anti-VEFG probablemente se relaciona con la perturbación de la señalización del eje VEGF podocito-endotelial18,19; en estudios en animales donde se administró anticuerpos anti-VEGF se observó desprendimiento de las células endoteliales glomerulares y disminución de la producción de nefrina5.
El mecanismo exacto por el cual la terapia anti-VEGF causa proteinuria no se conoce bien, pero se han propuesto varios mecanismos; uno de ellos parece ser una consecuencia directa de la inhibición de VEGF, ya que este se expresa en la nefrona normal, manteniendo la barrera de filtración y la integridad endotelial glomerular2,18. Adicionalmente, la inhibición de VEGF disminuye la biodisponibilidad de óxido nítrico y prostaglandina I2, lo cual puede contribuir tanto a una lesión isquémica como a una lesión por hiperfiltración en nefronas no isquémicas14,20. Otro posible mecanismo es el incremento en la producción de eritropoyetina, lo que aumenta la viscosidad sanguínea incrementando el riesgo de microtrombosis glomerular5
Una revisión de estudios publicados demostró una variedad de enfoques para el manejo de la TMA asociada a sunitinib, que van desde el uso de bloqueadores de los receptores de angiotensina13 hasta el intercambio de plasma urgente y la suspensión de la terapia12,21. El espectro clínico de gravedad es amplio, desde proteinuria aislada hasta hipertensión y déficit neurológicos. En el paciente presentado, la toxicidad renal por sunitinib se manifestó con falla renal progresiva, síndrome nefrótico e hipertensión arterial de difícil control asociados a MAT con compromiso limitado al riñón, con mejoría renal al suspender este medicamento.
La incidencia de toxicidad renal asociada con los ITK podría ser mayor debido a la falta de datos de biopsia renal y a la falta de detección sistémica de proteinuria de novo. Sugerimos monitorizar de cerca a los pacientes que reciben ITK, evaluando la función renal, lo cual incluye la presencia de proteínas en orina y el sedimento urinario, considerando la realización de biopsia renal en aquellos pacientes con disfunción renal dado que esta excluye otras etiologías y orientaría hacia la terapia adecuada.
ConclusiónEl abordaje del síndrome nefrótico en pacientes con cáncer requiere un enfoque integral para evaluar si está asociado a la enfermedad de base, al tratamiento quimioterapéutico o a otra causa. El sunitinib es un medicamento en auge para el tratamiento del cáncer por sus propiedades antiangiogénicas. Sin embargo, uno de sus efectos secundarios es la microangiopatía trombótica limitada al riñón que se puede manifestar con síndrome nefrótico e hipertensión. Se recomienda en los pacientes que reciben este medicamento realizar monitorización continua de la función renal, lo cual incluye la presencia de proteínas en orina y evaluación del sedimento urinario. En caso de deterioro de la función renal o desarrollo de hipertensión o proteinuria se debe considerar la suspensión del sunitinib.
Conflicto de interesesEl Dr. Nieto-Ríos ha dictado conferencias de microangiopatías trombóticas patrocinadas por Alexion Pharma. El resto de autores no declaran ningún conflicto de interés.