La combinación inmunosupresora más utilizada en trasplante renal de novo incluye un inhibidor de calcineurina (IC), tacrolimus, un derivado del ácido micofenólico y esteroides. La evidencia que sustenta esta práctica se basa en el ensayo clínico Symphony, de evolución controlada durante un año, en el que no existía ningún grupo comparador con IC asociado a un inhibidor de mTOR. Diversos ensayos clínicos de alta calidad sustentan la indicación del uso de everolimus como inmunosupresor básico asociado a una exposición reducida de un IC en pacientes que reciben un trasplante renal. Esta combinación podría mejorar las expectativas de resultados en salud.
Estas recomendaciones tratan de aportar la evidencia científica que apoya esta práctica, discuten las falsas creencias, mitos y realidades de la combinación y concretan pautas que permiten utilizarla con seguridad y evitar complicaciones.
The immunosuppressive combination most commonly used in de novo kidney transplantation comprises a calcineurin inhibitor (CI), tacrolimus, a mycophenolic acid derivative and steroids. The evidence which underlies this practice is based in the Symphony trial with controlled follow-up of one year, in which no comparator group included the combination CI-mTOR inhibitor. Different high-quality clinical trials support the use of everolimus as a standard immunosuppressive drug associated with reduced exposure of a CI in kidney transplantation. This combination could improve health related outcomes in kidney transplantation recipients.
The present recommendations constitute an attempt to summarise the scientific evidence supporting this practice, discuss false beliefs, myths and facts, and offer specific guidelines for safe use, avoiding complications.
La combinación inmunosupresora más utilizada en trasplante renal (TR) de novo está compuesta por un inhibidor de calcineurina (IC), tacrolimus, un derivado del ácido micofenólico (micofenolato sódico o micofenolato mofetil [MMF]) y esteroides1. Esta combinación ha disminuido la incidencia de rechazo agudo hasta alcanzar cifras del 12% a un año2. No obstante, la disminución del rechazo agudo no se ha reflejado en la misma medida en una mejoría de la supervivencia del injerto a largo plazo3. Además, sigue sin resolverse la alta incidencia de fracasos por muerte anticipada del paciente con injerto funcionante, cuya primera causa global es la enfermedad cardiovascular4, seguida muy de cerca por las neoplasias malignas, con impacto creciente5,6, y por las infecciones. La infección por citomegalovirus (CMV) constituye un factor significativo de morbimortalidad en el trasplante de órganos, y su prevención y tratamiento requiere de una adecuada coordinación y tiene un elevado coste.
La minimización o supresión de los IC con el apoyo de un inhibidor de mTOR (imTOR) como sirolimus o everolimus, con mecanismo de acción complementario al de los IC, consigue un efecto inmunosupresor sinérgico y no nefrotóxico que permite la reducción de los IC de forma temprana en el postrasplante. Una década después de la publicación de una revisión del uso de everolimus en sus diversas opciones terapéuticas7, y tras un prolongado desarrollo, un grupo de expertos hemos plasmado en el presente documento una serie de reflexiones y recomendaciones para el uso en TR de novo, que nos parece la mejor forma de aprovechar todo el potencial de este fármaco en el receptor de TR.
Los imTOR han demostrado su potencia inmunosupresora inhibiendo la acción de los linfocitos T por su efecto antiproliferativo y antimigratorio mediante el bloqueo del factor de crecimiento del endotelio vascular (VEGF), además disminuyen la aterosclerosis, lo que les confiere un perfil protector cardiovascular y antineoplásico7–11. Por tanto, además de sus propiedades inmunosupresoras, los imTOR presentan una serie de características que los hacen atractivos para su uso en el TR: a) capacidad para prevenir la disfunción del injerto renal por mecanismos mediados por la mTOR, como son la reducción de la hipertrofia glomerular, de citocinas proinflamatorias y profibróticas, o la inhibición de la transición de epitelio a mesénquima; b) reducción de la angiogénesis; c) reducción del crecimiento tumoral y aparición de neoplasias de novo; d) efectos cardioprotectores y e) reducción de las infecciones virales por el aumento de la capacidad específica de los linfocitos T CD8+ contra patógenos, como por ejemplo el CMV, en el postrasplante inmediato.
¿Qué resuelve la combinación IC-everolimus de novo?Aunque la conversión temprana o tardía a un imTOR ha mostrado beneficios sobre el filtrado glomerular (FG), el aumento de la tasa de rechazo agudo y la elevada incidencia de intolerancia a los imTOR por efectos secundarios10,11 hacen aconsejable la búsqueda de otra estrategia.
La utilización de un IC en minimización asociado a everolimus desde el mismo momento del trasplante es una combinación suficientemente potente para prevenir el rechazo, y su sinergia inmunosupresora permite disminuir dosis de fármacos y evitar efectos secundarios.
En estudios controlados, los resultados a corto plazo de everolimus asociado a dosis reducidas de IC son similares a la combinación clásica de IC con micofenolato, pero podría tener ventajas en diversos aspectos cruciales para la supervivencia del injerto y del paciente a medio y largo plazo. Por tanto, los responsables de algunos centros de trasplante a nivel nacional e internacional han incorporado a sus protocolos de inmunosupresión inicial en TR pautas que se basan en la combinación de IC a dosis y exposición reducidas con everolimus. Las potenciales ventajas son las desarrolladas a continuación.
Potencia inmunosupresora y propiedades inmunomoduladorasLa combinación everolimus-tacrolimus en minimización ha demostrado su eficacia en la prevención del rechazo agudo, similar a la observada con la rama de tacrolimus-MMF del ensayo Symphony2,7,9–18. De hecho, con la combinación imTOR-IC de novo se evita la mayor incidencia descrita de rechazo agudo observada en conversiones tempranas o tardías del IC al imTOR19. Más adelante se revisará la evidencia en detalle.
Además de su capacidad inmunosupresora, debe considerarse que los imTOR poseen un mecanismo de acción completamente diferente al de los IC. Los imTOR bloquean la progresión del ciclo celular del linfocito T tras su activación, promoviendo con ello un estado de anergia, incluso en presencia de coestimulación, con lo que inducen un estado de tolerancia operacional20. Debido a ello la incorporación de everolimus en el régimen inmunosupresor del paciente trasplantado renal podría favorecer mecanismos de tolerancia inmunológica que conducirían a una mejora de resultados a largo plazo.
Nefrotoxicidad y minimización del inhibidor de calcineurinaLa combinación de everolimus con dosis minimizada de IC obtiene FG entre 3 y 6ml/min mayor que con exposición estándar de IC7,9–18. Cuando se compara la asociación everolimus-ciclosporina con micofenólico-ciclosporina, el imTOR permite una reducción del IC del 60%, un mejor FG y menor proteinuria.
Un reciente metaanálisis reporta un mayor beneficio de la minimización de anticalcineurínicos cuando se realiza antes de los 6meses postrasplante, con mejor FG y con un menor riesgo de pérdida del injerto13.
Mejoría del perfil cardiovascularLa combinación everolimus-IC mejora el perfil cardiovascular por 2mecanismos: 1) permite una adecuada minimización del IC, con mejor control de la presión arterial y con reducción del número de antihipertensivos y 2) por el efecto directo de everolimus sobre la placa de ateroma, comprobado en modelos animales de trasplante y en trasplante cardiaco con la disminución de la vasculopatía del injerto, la enfermedad vascular periférica y la hipertrofia ventricular izquierda8,21–24.
Es importante comprender que la vasculopatía del injerto en trasplante cardiaco es una lesión trasladable al injerto renal, con importante prevalencia, y contemplada en la clasificación de Banff bajo el índice chronic vascular (cv). Se trata de una enfermedad de fibroproliferación acelerada del lecho vascular del injerto, que causa un engrosamiento intimal circunferencial. En su patogénesis participan factores inmunológicos y no inmunológicos que causan inflamación endotelial, lo cual desencadena la lesión final de daño endotelial y respuesta celular fibroproliferativa25. El hecho demostrado de que everolimus es capaz de reducir la vasculopatía del injerto en el trasplante cardiaco, especialmente cuando su uso es temprano postrasplante26,27, indica que un beneficio similar en TR pueda tener importantes consecuencias tanto sobre el paciente como sobre el injerto.
Mejoría del perfil de riesgo tumoralEn TR, el potencial beneficio de la combinación everolimus-IC se debería en parte a la minimización del IC, implicado en mecanismos de progresión neoplásica, pero también a su efecto antineoplásico directo, comprobado en cánceres frecuentes en trasplante como el carcinoma cutáneo espino y basocelular, síndromes linfoproliferativos postrasplante, sarcoma de Kaposi28,29 y también a nivel global, como demostró el estudio Convert6. Everolimus se emplea como agente antineoplásico desde hace años en las más diversas indicaciones en oncología30,31.
Infecciones por citomegalovirusLos imTOR reducen la incidencia, gravedad y recurrencia de la infección por CMV en el postrasplante32,33. Se ha descrito el aumento significativo del recuento de linfocitos T CD8+ específicos para CMV con everolimus en TR convertidos de ciclosporina a everolimus, así como el bloqueo de la vía de la fosfatidilinositol-3-cinasa, crucial en la replicación del CMV.
En un análisis combinado de 3ensayos clínicos aleatorizados de TR que compararon everolimus con exposición reducida a ciclosporina vs. MPA con dosis estándar de ciclosporina, se observó que la tasa de infección/enfermedad por CMV fue significativamente más baja con everolimus que con MPA, incluso en pacientes que recibían profilaxis frente a CMV34.
Tedesco-Silva et al., en un estudio prospectivo unicéntrico aleatorizado con 288 pacientes que no recibieron profilaxis farmacológica frente a CMV (ni siquiera en pacientes con alto riesgo de infección D+/R-), han mostrado que el uso de everolimus-tacrolimus en pacientes de bajo/moderado riesgo inmunológico e inducción con basiliximab o ATG a dosis reducidas (3mg/kg) se asoció a una menor incidencia de infección y enfermedad por CMV que el grupo de tratamiento estándar con TAC-MMF e inducción con basiliximab35.
Infección por virus BKHay evidencias de que everolimus con dosis reducidas de ciclosporina se asocia a una baja tasa de infección por BK comparado con el régimen estándar de IC-MPA16,17, posiblemente por una supresión de la replicación viral a través de la inhibición de la proteincinasa intracelular que se activa por la infección BK, además de por la permisividad de los imTOR al desarrollo de linfocitos CD8 específicos frente al virus36. También se han detectado beneficios en la conversión a everolimus37.
Indicación de everolimus en combinación con dosis bajas de inhibidor de calcineurina en trasplante renal de novoLa evidencia de la literatura sustenta la indicación del uso de everolimus como inmunosupresor básico asociado a una exposición reducida de un IC en pacientes que reciben un TR. Estas recomendaciones tratan de facilitar evidencia científica que apoye esta práctica, además de opiniones de expertos con experiencia en su uso, allí donde la evidencia publicada sea de menor grado.
Evidencias en el uso de novo de everolimus con inhibidor de calcineurina. Ventajas e inconvenientesSe han desarrollado 4estrategias en el uso de imTOR en TR: 1) el uso con dosis reducidas de IC en TR de novo; 2) la introducción preventiva con suspensión o reducción de IC en algún momento del TR sin que exista ningún imperativo clínico38,39; 3) la conversión de IC a everolimus en respuesta a determinadas circunstancias clínicas, estrategia de la que solo disponemos del análisis de series de pacientes y no de estudios aleatorizados y 4) el régimen con imTOR libre de IC desde el TR, de demostrada ineficacia por la elevada incidencia de episodios de rechazo agudo y función renal subóptima11.
Uno de los aspectos más atractivos del uso combinado de los imTOR con los IC es que se obtiene la misma eficacia inmunosupresora de cada agente por separado utilizando una dosis menor de ambos fármacos. En el caso del everolimus combinado con ciclosporina, se obtiene la misma eficacia con una dosis reducida en un 10-20% de la dosis de everolimus y un 20-40% de la dosis de ciclosporina40. Tanto con ciclosporina como con tacrolimus, una C0 ≥ 3ng/ml de everolimus se relaciona con una reducción de la aparición de episodios de rechazo agudo: el rango entre 3y 8ng/ml es el que ofrece mayor balance entre la reducción del riesgo de rechazo agudo y la tolerabilidad clínica del fármaco15.
Ensayos clínicos aleatorizados sobre el uso de everolimus y dosis reducidas de inhibidor de calcineurina en trasplante renal de novoDisponemos de los resultados de diversos ensayos clínicos aleatorizados con utilización de everolimus en combinación con dosis reducidas de IC en pacientes de bajo a moderado riesgo inmunológico, con un seguimiento de entre 6 y 24 meses11. Se utilizó inducción con esteroides y basiliximab en todos menos en el US92, en el que se permitió inducción con ATG como alternativa al basiliximab18. En 3 ensayos clínicos el IC utilizado fue tacrolimus14,15,18, el resto utilizó CsA16,17,41–44.
Incidencia de rechazo agudo y eficacia de la pauta inhibidor de calcineurina reducido/imTOREverolimus ya demostró en los estudios de registro europeos que permitía una mayor minimización del IC (en este caso ciclosporina) respecto a la combinación con micofenolato. El estudio A2309, de registro en EE. UU., confirmó estos resultados16. Este estudio de no inferioridad evaluó prospectivamente 2regímenes de everolimus en combinación con ciclosporina a dosis bajas versus micofenólico sódico en combinación con dosis estándar de ciclosporina en TR de novo. El endpoint primario fue un compuesto de eficacia que incluía rechazo comprobado por biopsia y tratado, pérdida del injerto, muerte del paciente y pérdida de seguimiento a los 12 meses. En uno de los grupos de everolimus los pacientes recibieron una dosis inicial de 0,75mg/12h con concentración sanguínea diana de 3-8ng/mL. En el otro, la dosis inicial fue de 1,5mg/12h, con diana de 6-12ng/mL. El tercer grupo de pacientes recibió una dosis fija de Myfortic® (720mg/12h) en combinación con dosis estándar de ciclosporina. Los niveles de ciclosporina al año fueron de 55ng/mL en el grupo everolimus 1,5mg/día y de 137ng/mL en el grupo de Myfortic®. La incidencia de rechazo fue similar en ambos grupos.
En el estudio ASSET, en TR de novo14, se utilizó la combinación de everolimus y tacrolimus a dosis bajas. Los niveles diana de tacrolimus fueron 4-7ng/mL durante los primeros 3meses y los niveles de everolimus de 3-8ng/mL durante todo el estudio (12 meses). A partir del mes 4 los pacientes fueron aleatorizados a mantener la misma exposición a tacrolimus (4-7ng/mL) o a minimizarla más (1,5-3ng/mL). Al año postrasplante los pacientes del brazo 4-7ng/mL tuvieron una concentración de tacrolimus de 5,5ng/mL mientras que los pacientes en el brazo de 1,5-3ng/mL tuvieron un nivel de 3,4ng/mL. En el brazo control (tacrolimus 4-7ng/mL durante todo el primer año) la incidencia de rechazo agudo fue de 7,7%. En el de minimización extrema de tacrolimus, la incidencia de rechazo fue de 18%, aunque, curiosamente, toda la diferencia se produjo durante el primer trimestre y antes de la aleatorización, cuando los niveles de tacrolimus en ambos grupos eran similares.
De estos datos concluimos que la incidencia de rechazo en la combinación everolimus y tacrolimus (con niveles entre 4 y 7ng/mL) durante el primer año se encuentra en rango comparable con el grupo de tacrolimus del estudio Symphony. En este momento está en desarrollo el estudio Transform que permitirá comparar en 2.037 TR de novo la pauta estándar de tacrolimus o ciclosporina y micofenólico frente a everolimus con dosis muy reducidas de IC45.
Resultados de los estudios según el riesgo inmunológico de los receptoresEn TR de bajo y moderado riesgo inmunológico los ensayos aleatorizados mostraron no inferioridad de everolimus con dosis reducidas de IC frente a la exposición estándar a IC. El ensayo clínico US92 es el único que incluye un pequeño porcentaje de pacientes de alto riesgo y disponemos de resultados en forma de abstract18. Los pacientes recibieron aleatorizadamente everolimus o micofenolato con exposición reducida o estándar de tacrolimus, respectivamente. La tasa de rechazo agudo confirmado por biopsia fue mayor en el grupo de everolimus y tacrolimus reducido, debido a que los niveles de tacrolimus y everolimus fueron excesivamente bajos y la proporción de pacientes de mayor riesgo inmunológico fue mayor en el grupo de tacrolimus reducido.
In vitro, everolimus es capaz de producir inhibición temprana y tardía de la proliferación de las células B y su diferenciación en células plasmáticas, a diferencia del MPA que actúa solo en las etapas tempranas de la respuesta inmune mediada por linfocitos B46,47. A pesar de ello, los ensayos clínicos aleatorizados que han comparado el uso de everolimus de novo con dosis reducidas de IC frente a pauta estándar han excluido a pacientes de alto riesgo inmunológico con base en diferentes criterios: tasa de anticuerpos reactivos frente al panel (panel reactive antibodies), tiempo de isquemia prolongado, infecciones crónicas, retrasplantes, donantes o receptores añosos, prueba cruzada positiva para células T o trasplante ABO incompatible9–18. Los estudios de conversión de que disponemos también han excluido a los de tasas elevadas de anticuerpos reactivos frente al panel o con rechazo agudo reciente18.
Hasta este momento no se ha publicado ningún ensayo clínico en el que el desarrollo de DSA de novo sea uno de los objetivos, y prácticamente no existe información comparativa en desarrollo de respuesta humoral en pautas basadas en IC-everolimus o las más estándares con micofenolato.
Resultados según la dosis de inhibidor de calcineurinaLa pauta everolimus e IC reducido ha resultado comparable a un régimen convencional de IC y MPA: ha mostrado una no inferioridad con respecto al objetivo primario combinado (rechazo tratado, fracaso del injerto, muerte o pérdida de seguimiento)16,17, incluso cuando el everolimus se utilizaba con niveles muy bajos de IC14.
Se ha observado además un mayor porcentaje de pacientes (20 vs. 12%) en el grupo de everolimus que, partiendo de una tasa de FG <60ml/min, alcanzaban cifras superiores a 60ml/min al año del trasplante. Incluso con exposición relativamente alta a everolimus (8-12ng/ml)42,44 y dosis muy reducidas de ciclosporina, la tasa de FG resultó significativamente mayor que en el régimen estándar de MPA+IC con una misma incidencia de rechazo agudo confirmado por biopsia44.
Importancia de los niveles de everolimus y de tacrolimusEverolimus es un imTOR derivado del sirolimus que presenta mayor biodisponibilidad oral y menor vida media que este, lo que permite que sea suficiente la monitorización a los 4 días desde su inicio para determinar el ajuste de dosis, a diferencia de los 5-7 días que se necesitan en el caso del sirolimus48. La exposición a everolimus está influida por la elección del IC concomitante debido a sus diferentes interacciones farmacocinéticas. De hecho, la administración de ciclosporina incrementa la exposición a everolimus de 2 a 3 veces49, debido a que ambos fármacos se metabolizan por el CYP3A4 del P450 y son sustratos del trasportador de fármacos glicoproteína P. Por el contrario, tacrolimus no presenta una interacción de esa importancia con everolimus, de tal modo que aunque el imTOR reduce la biodisponibilidad de tacrolimus de modo dosis-dependiente50, la AUC de everolimus no se modifica en función de las diferentes dosis de tacrolimus administradas51. La monitorización farmacocinética es fundamental en el manejo del paciente para prevenir los efectos adversos, detectar la interacción de fármacos y su potencial toxicidad49. Múltiples estudios han revelado que tanto la inmunosupresión como los efectos secundarios son dependientes de la dosis y de la concentración52.
Everolimus presenta una buena correlación entre la C0 y la AUC, que permite que la C0 sea una buena medida de la exposición al fármaco y un buen indicador de la evolución clínica (mayor eficacia y menor toxicidad)53.
La exposición adecuada al tratamiento con everolimus se ha fijado por encima de 3ng/mL54. Para conseguirlo, la dosis inicial recomendada de everolimus en caso de que se administre junto a tacrolimus es de 1,5mg/12h, a diferencia de lo que sucede en el caso de ciclosporina, en el que se recomienda 0,75mg/12h50,51. En el ensayo US92, una inadecuada dosis inicial de everolimus de 0,75mg cada 12 h (basada en los ensayos clínicos previos utilizando ciclosporina como IC) a partir del día 5 postrasplante, resultó ser demasiado baja y tardía y condujo a unos niveles medios de everolimus el día 7 postrasplante inferiores a 3ng/mL. Esta fue la principal causa de la mayor incidencia de rechazo agudo en el brazo de everolimus/tacrolimus (19,1 frente a 11,2% en el brazo con MPA)18.
Consideramos que una dosis de 1,5mg cada 12 h desde el día 1 postrasplante es recomendable en combinación con tacrolimus para conseguir niveles de everolimus de 3a 8ng/mL ya en la primera fase del trasplante55. En muchos pacientes, tras una primera determinación de nivel en sangre al 3.er-4.° día postrasplante, debe aumentarse la dosis un 50% para alcanzar el rango.
No existe hasta este momento ningún ensayo clínico que haya comparado dosis reducidas de CsA con everolimus frente a dosis reducidas de tacrolimus con everolimus, aunque el estudio Transform incluye a pacientes estratificados en ambos grupos que podrían analizarse en el futuro45. La elección de uno u otro debería considerarse teniendo en cuenta el perfil de riesgo de la pareja/receptor frente a comorbilidades como la diabetes, o las restricciones económicas del medio en que se vaya a utilizar, dado que la combinación con CsA supone un ahorro en la dosis de everolimus.
Importancia de la inducciónCon el fin de poder minimizar adecuadamente el IC y prevenir eficazmente en rechazo agudo, se recomienda la utilización de inducción con anticuerpos en el TR de novo con esta pauta. La mayoría de los ensayos clínicos han utilizado inducción con basiliximab, aunque también puede utilizarse inducción con ATG18,35,45.
Falsas creencias, mitos y realidades del uso de everolimus de novo en trasplante renalA pesar de que los imTOR han demostrado efectos beneficiosos en cuanto a estabilidad cardiovascular23–26, disminución de infecciones33–35 y descenso en la incidencia de neoplasias28,29, su uso más habitual viene siendo en régimen de conversión, por el fracaso o efecto adverso de los IC o de los derivados del ácido micofenólico, o por la aparición de una neoplasia. La realidad es que el empleo de everolimus de novo es escaso. En nuestra opinión, la causa fundamental para no utilizar una pauta de inmunosupresión basada en IC minimizado y everolimus es un conjunto de mitos y creencias, quizá debido a la experiencia previa con sirolimus con dosis de carga, niveles desproporcionadamente elevados y asociado a MMF en lugar de a IC. Otra poderosa razón es el estudio Symphony, que concluyó que el mejor régimen inmunosupresor en TR estaba constituido por tacrolimus, MMF y esteroides, sin incluir ninguna rama de tratamiento que combinara IC e imTOR2. También contribuye la pretendida falta de eficacia en la prevención del rechazo agudo, el posible aumento de la necrosis tubular aguda, los problemas de la cicatrización y el temor a los efectos adversos y su manejo (tablas 1 y 2).
Incidencia de rechazo agudo en pacientes tratados con inhibidor de calcineurina combinado con everolimus vs. MMF
| Estudio | Ciclosporina-everolimus | Ciclosporina-MMF | Tacrolimus-everolimus | Tacrolimus- MMF |
|---|---|---|---|---|
| A230916,17 | 16,2 | 17 | ||
| A120258 | 4,9 | 8,2 | ||
| US0915 | 14 | |||
| ASSET14 | 7,7a | |||
| Symphony2,56 | 15,4 | |||
| ABOi59 | 12 | |||
| TR pediátrico60 | 6 | 13 |
Datos en porcentaje.
MMF: micofenolato mofetil.
Principales complicaciones que se consideran una barrera para la utilización de un imTOR de novo y su incidencia en los diversos ensayos clínicos
| A2309 (CsA) EVE vs. MS16,17 | US09 (tacrolimus)15 | ASSET (tacrolimus)14 | Symphony2,56 | |||||
|---|---|---|---|---|---|---|---|---|
| EVE (1,5mg/d) | MS | EVE (1,5mg/d)+tacrolimus minimizado | EVE (1,5mg/d)+tacrolimus normal | EVE (1,5mg/d)+tacrolimus muy minimizado | EVE (1,5mg/d)+tacrolimus minimizado | Tacrolimus-MMF | Sirolimus-MMF | |
| Función retardada del injerto | 10,2 | 9,2 | 0 | 2 | ND | ND | 35,7 | 21,1 |
| Linfocele | 6,6 | 5,1 | 4,1 | 2,3 | 7,3 | 10,9 | 4 | 11,6 |
| Herida quirúrgica | 1,8 | 1,1 | 4,1 | 2,3 | 18,3 | 14,3 | 2,5 | 2,4 |
| Hernia incisional | 1,5 | 1,5 | 2 | 4,7 | 3,7 | 1,7 | ND | ND |
| Rechazo agudo | 16,2 | 17 | 14 | 14 | 18,7 | 7,7 | 15,4 | 39 |
Datos en porcentaje.
EVE: everolimus; MMF: micofenolato mofetil; MS: ácido micofenólico con recubrimiento entérico; ND: no disponible.
Deriva fundamentalmente del estudio Symphony, en el que la incidencia de rechazo agudo a los 36 meses era de un 39% en el grupo de minimización sirolimus/MMF sin IC frente a un 15,4% en el grupo de tacrolimus/MMF2,56. Cuando se ha utilizado sirolimus en combinación con tacrolimus, la tasa de rechazo ha sido del 12,2%, similar a la obtenida con tacrolimus/MMF en el Symphony57. Como ya se ha detallado en la sección previa, los estudios realizados con la administración conjunta de everolimus con ciclosporina o tacrolimus de novo demuestran que la incidencia de rechazo es similar o incluso inferior al estudio Symphony2,14–18,56,58–60 (tabla 1). Por tanto, la creencia de que una pauta de minimización de IC con everolimus se asocia a más rechazo que la clásica con MMF no se sostiene con la evidencia disponible.
Función retrasada del injertoEn cuanto a la hipotética mayor incidencia en la función retrasada del injerto (DGF), los estudios iniciales con sirolimus no mostraban mayor frecuencia de DGF: incluso en el estudio Symphony, el grupo de sirolimus era el que menor DGF tenía (21,1 vs. 35,7% en grupo tacrolimus/MMF)2,56. Ningún ensayo clínico de comparación entre IC-everolimus e IC-micofenólico ha mostrado diferencias en el desarrollo de DGF (tabla 2).
Problemas de cicatrización y linfocelesLa inhibición de la vía mTOR limita la proliferación celular y la angiogénesis de células endoteliales y fibroblastos y puede retrasar, por tanto, el componente fibrótico necesario para la cicatrización de las heridas y la recanalización de vasos linfáticos. Pero como demuestra el estudio de Azzola et al.61, aunque la inhibición de la proliferación de fibroblastos es mayor con everolimus que con tacrolimus, ciclosporina, azatioprina y esteroides, lo es todavía más con MMF.
La relación de los imTOR con complicaciones de la herida quirúrgica se basa en hallazgos de las etapas iniciales en las que se utilizaban altas dosis de imTOR. No existe evidencia de que las concentraciones de imTOR utilizadas en la actualidad, sin dosis de carga, acompañados de dosis reducidas de IC, incrementen el riesgo de eventos a ese nivel con relación a la pauta de IC a dosis plenas y MMF62 (tabla 2).
Un estudio que comparó la incidencia de linfoceles en pacientes con MMF frente a azatioprina63, observó un 19% en el grupo de MMF frente al 10% en azatioprina. En el análisis multivariante el empleo de MMF se asoció a 2,6 veces mayor riesgo de linfocele frente a azatioprina.
La eliminación de las dosis de carga y niveles muy elevados de sirolimus, la modificación de la técnica quirúrgica y la exclusión de pacientes con índice de masa corporal >32kg/m2, disminuyeron considerablemente la incidencia de complicaciones de la herida y de linfoceles64.
Los ensayos clínicos de IC-everolimus, tanto con ciclosporina16,17,62,65 como con tacrolimus14,15, ponen de manifiesto la incidencia similar de complicaciones de la herida y linfoceles en pacientes tratados con IC asociada a everolimus que asociada a MMF.
En la práctica habitual de los centros de los autores de estas recomendaciones, y coincidiendo con revisiones recientes de expertos66, no se observa ninguna diferencia en la incidencia de función retardada del injerto ni en la duración de la hospitalización inicial entre utilizar IC-micofenolato y utilizar IC-everolimus a las dosis y niveles bajos actuales (tabla 2). No es necesario aplicar medidas especiales en el cuidado de la herida quirúrgica del implante renal, que debe revisarse como en cualquier TR diariamente durante el primer ingreso hospitalario y después en las sucesivas revisiones, aconsejándose retirada de sutura a partir de las 3 semanas.
La excepción sería el caso de pacientes obesos, que ya de por sí presentan un riesgo elevado de problemas de la herida quirúrgica, en los que sería adecuado evitar el uso de everolimus o sirolimus. No hay evidencia de que se deban usar con precaución en ancianos o diabéticos, que tienen mayor tendencia a presentar complicaciones de la herida quirúrgica9–11,66.
Edema periféricoLa aparición de edema palpebral y en miembros inferiores ha sido asociada al uso tanto de sirolimus como de everolimus, si bien algunos estudios que compararon la incidencia de aparición de edemas con ambos fármacos indican que su aparición es menor con everolimus67.
Como en los efectos secundarios comunicados anteriormente, la aparición de edema está relacionada con dosis y niveles elevados de imTOR68,69. El mecanismo responsable del edema estaría relacionado con un aumento de la permeabilidad vascular asociada a un aumento de prostaciclina y a una disminución de VEGF. Los estudios actuales asociando everolimus a ciclosporina muestran entre un 2,616,17 y un 32%58 (tabla 3). El primer estudio se refiere a edema moderado-severo y el segundo a edema leve-moderado, que en ningún caso supuso la suspensión del fármaco. Asociando everolimus a tacrolimus, la incidencia de edema es del 10%, similar a la comunicada en el Symphony14,15. En nuestra experiencia de práctica clínica habitual, el uso de novo no se asocia a edema relevante en frecuencia e intensidad mayor que la observada con otras pautas. Tras descartar otras causas de edema, se recomienda el ajuste de dosis del imTOR y, en caso de combinación de CsA con everolimus, ajustar la dosis de CsA a la baja ya que la CsA aumenta la exposición a los tejidos del everolimus.
Incidencia de los principales eventos adversos relacionados clásicamente con los imTOR
| A2309 (CsA) Eve vs. MS16,17 | US09 (tacrolimus)15 | ASSET (tacrolimus)14 | Symphony2,56 | |||||
|---|---|---|---|---|---|---|---|---|
| EVE (1,5mg/d) | MS | EVE (1,5mg/d)+tacrolimus minimizado | EVE (1,5mg/d)+tacrolimus normal | EVE (1,5mg/d)+tacrolimus muy minimizado | EVE (1,5mg/d)+tacrolimus minimizado | Tacrolimus-MMF | Sirolimus-MMF | |
| Edemas (%) | 2,6 | 1,4 | 9,3 | 10,2 | 9,2 | 10,9 | 12 | 32 |
| Hiperlipidemia (%) | 21 | 16 | 10,2 | 9,3 | 26 | 21 | 9,9 | 15,8 |
| Proteinuria [>0,5g/24h (%)] | 9,1 | 7,3 | 0 | 2,3 | 7 | 11 | 5,3 | 5 |
| Diabetes (%) | 14 | 16 | 24 | 38 | 15,1 | 12,8 | 10,6 | 7,8 |
EVE: everolimus; MMF: micofenolato mofetil; MS: ácido micofenólico con recubrimiento entérico.
La hipercolesterolemia e hipertrigliceridemia son efectos adversos comúnmente relacionados con el TR que se hacen más evidentes cuando se emplean imTOR, ya que estos fármacos disminuyen el catabolismo de la APO B 100 y disminuyen la actividad de la lipoproteinlipasa. La incidencia es mayor cuando se asocia a ciclosporina (hasta un 45 vs. 16% grupo control)16,17,58,65 y algo menor cuando se asocia a tacrolimus (9,3-21%)14,15 (tabla 3). En nuestros grupos la incidencia de hipercolesterolemia fue del 40-50% al 6.° mes, con un uso de estatinas de alrededor del 70% (datos no publicados).
En pautas con everolimus, la incidencia de DMPT oscila entre un 11,5 y un 14% asociado a ciclosporina16,17,53 o 12,8-24% asociado a tacrolimus14,15, similar a la observada en el estudio Symphony2,56 (tabla 3). No existe ninguna evidencia de que el uso de una pauta de IC minimizado con everolimus se asocie a una DMPT más frecuente o grave que el uso de pautas de IC-micofenólico.
Aftas bucalesLas aftas orales parece que están producidas por un mecanismo tóxico directo del imTOR sobre las membranas de la mucosa oral y nasal70. Aparecen habitualmente al inicio de la terapia, aproximadamente una semana después del inicio de la exposición, y suelen ser dependientes de la dosis. En la experiencia personal de los autores, la incidencia es mucho menor cuando el fármaco se utiliza de novo que cuando se utiliza en conversión. Suelen evolucionar hacia la curación tras el ajuste de dosis del imTOR o el tratamiento con corticoides tópicos.
Efectos hematológicosEl uso de estos fármacos se ha asociado a un incremento del riesgo de leucocitopenia y trombocitopenia comparados con los IC71, efecto que se ha señalado que puede que no sea dosis dependiente. En la toxicidad hematológica hay factores dificiles de distinguir en caso de conversiones de IC a imTOR, como el aumento de dosis de MMF. En este sentido hay experiencias en que la conversión a imTOR se asocia a mayor leucocitopenia y trombocitopenia, aunque otros estudios, como el A2309, muestran un mayor recuento de leucocitos y plaquetas en everolimus de novo e IC reducidas que en pauta estándar con MPA16. El uso de imTOR además puede afectar al riesgo de anemia, pero una baja hemoglobina no suele ser criterio de exclusión para su uso. En opinión de los autores de esta revisión no suele ser un problema relevante con las dosis reducidas que se utilizan en la combinación con IC, por lo que siempre en este contexto es fundamental descartar otras causas de depresión medular.
Desarrollo de proteinuriaEl mecanismo por el que los imTOR son capaces de producir proteinuria en el receptor de TR no es bien conocido72. Parece que los imTOR pueden producir proteinuria por inhibición de VEGF, que altera la función endotelial y podocitaria. Aunque la proteinuria asociada a imTOR más conocida es la que aparece tras conversión de un IC a imTOR70, también se ha visto que puede producirse con sirolimus de novo73. En los estudios de everolimus de novo la incidencia de proteinuria es baja o similar al grupo control (tabla 3). De hecho, en los ensayos A2306 y A2307 de everolimus con ciclosporina de novo, menos del 5% de los pacientes presentaron proteinuria en determinación de muestra de orina aislada9,74. En el A2309 no se observaron diferencias entre las ramas de micofenolato y dosis bajas de everolimus con nivel entre 3 y 8ng/ml75. La incidencia de proteinuria comunicada en el Symphony es 12 vs. 8% en el grupo de tacrolimus-MMF.
NeumonitisEl efecto adverso potencialmente más grave asociado a los imTOR es la neumonitis intersticial. Con una etiopatogenia inmunomediada, la incidencia inicial asociada a sirolimus era de un 5-15% en trasplante de órgano sólido76, algo mayor que la descrita por grupos españoles en TR (4-7%)77,78. Se ha observado que el hábito tabáquico o la enfermedad pulmonar preexistente predisponen a la neumonitis. Asimismo, se ha relacionado una mayor exposición al fármaco con una mayor toxicidad pulmonar. Aunque la presentación clínica varía desde mínimos síntomas hasta fallo respiratorio grave, en general los casos reportados hablan de síntomas y signos leves-moderados que remiten tras la suspensión del fármaco.
Recientemente, se ha publicado la serie de casos con mayor número de neumonitis intersticiales asociadas a everolimus hasta la fecha79. Se trata de un estudio caso-control en el que presentan 13 pacientes trasplantados (12,7% de la cohorte) que desarrollaron la enfermedad tras la conversión a los 6 meses del TR desde ciclosporina-micofenolico-prednisona a everolimus-prednisona. La mediana de tiempo de exposición a everolimus hasta la neumonitis fue de 5,5 meses. Aunque los autores no encontraron factores predisponentes, existía más enfermedad pulmonar previa en los que desarrollaron neumonitis (31 vs. 17%). Aunque los niveles sanguíneos de everolimus de los que desarrollaron la complicación no fue superior a los que no la desarrollaron, dicha exposición fue alta en todos los casos (niveles valle de alrededor de 10ng/ml en ambos grupos). Sin embargo, la descripción de este evento parece mucho más excepcional en el uso de novo de everolimus en combinación con dosis reducidas de IC. De hecho, en una revisión retrospectiva del ensayo A2309, solo pudo identificarse un paciente con desarrollo de neumonitis sobre un total de 556 pacientes expuestos a everolimus80.
Aparición de anticuerpos anti-HLA de novoLa escasa evidencia sobre el potencial desarrollo de DSA en pacientes tratados con imTOR se limita a estudios de conversión a un imTOR tras 3 a 4,5 meses de terapia con IC-micofenólico. En la experiencia de un centro de trasplante de Berlín, la conversión de una pauta basada en ciclosporina-micofenólico a otra basada en everolimus-micofenólico pareció asociarse a un aumento en la aparición de novo de DSA y rechazo agudo humoral81. En el referido estudio resultó llamativo el sesgo de selección y la infrainmunosupresión de los pacientes convertidos a everolimus, en particular, la suspensión concomitante de los esteroides82. Otros estudios similares no han mostrado los mismos resultados83–85.
En TR ABO incompatible tratados con everolimus y ciclosporina, 4 de 25 pacientes desarrollaron DSA, 3con relación a TR anteriores59. En TR pediátrico se observó un 11,4% de DSA en pacientes tratados con everolimus frente a un 17,9% grupo control bajo tacrolimus-MMF60. No existen datos de ensayos clínicos controlados que describan la posible aparición de DSA en TR de novo con pautas basadas en IC minimizado y everolimus.
Seguridad en el manejo. Recomendaciones para evitar complicacionesContraindicaciones relativas al uso de everolimus de novo en trasplante renalLa mejor forma de evitar efectos adversos graves asociados al fármaco es no utilizarlo en algunos pacientes con especial riesgo de presentarlos (tabla 4). Se recomienda evitar el uso de everolimus de novo en el TR en pacientes con hipersensibilidad al fármaco o a los excipientes, hiperlipidemia grave no controlable con tratamiento habitual, con antecedentes de enfermedad pulmonar intersticial o enfermedad pulmonar obstructiva crónica grave, obesos con índice de masa corporal superior a 35, casos de glomerulosclerosis focal y segmentaria primaria o síndrome hemolítico-urémico atípico, y en aquellos en los que se deba practicar una cirugía vascular compleja para el implante renal. Finalmente, y aunque existen experiencias no publicadas positivas de utilización, en aquellos pacientes en los que se considere la necesidad de utilización de dosis altas y niveles elevados de IC, como por ejemplo, los pacientes de muy alto riesgo inmunológico, debe aplicarse esta pauta con precaución.
Contraindicaciones relativas en el uso de everolimus en TR de novo y los motivos para desaconsejarlo
| Contraindicación relativa | Motivo |
|---|---|
| Enfermedad pulmonar intersticial u obstructiva crónica severa | Evitar la exposición al fármaco de receptores susceptibles de padecer neumonitis asociada a inhibidor de mTOR |
| Obesidad con índice de masa corporal superior a 35 kg/m2 | Evitar la exposición al fármaco de sujetos con mayor propensión a padecer problemas de herida quirúrgica y linfoceles por su obesidad |
| Glomerulosclerosis focal y segmentaria primaria como nefropatía de base | Potencial del fármaco para producir proteinuria mediante daño podocitario y desarrollo de esclerosis focal y segmentaria |
| Síndrome hemolítico-urémico atípico | Dado que no está descrita la asociación etiopatogénica de micofenolato con problemas de microangiopatía trombótica, se considera más aconsejable su asociación al IC en trasplante renal de novo |
| Cirugías complejas vasculares (por ejemplo: anastomosis arterial renal a una prótesis ilíaca de Goretex®) | Evitar alto riesgo de dehiscencia de suturas |
| Necesidad de utilización de dosis altas y niveles elevados de IC, como por ejemplo, aquellos de muy alto riesgo inmunológico | Evitar nefrotoxicidad en la maximización del IC |
IC: inhibidor de calcineurina.
La experiencia inicial con sirolimus de novo nos enseñó que la dosis inicial de imTOR desde el primer día postrasplante debe ser baja. Los niveles de everolimus deseados cuando se utiliza en combinación con un IC están entre 3 y 8ng/mL55. Al aplicarse en combinación con un IC, deben vigilarse posibles interacciones farmacólogicas entre ambos; la dosis de everolimus de 1,5mg/12 h indicada en combinación con tacrolimus precisa con mucha frecuencia un aumento para alcanzar nivel adecuado: se necesita una media de 2,5mg/12 h al primer mes y 2mg/12 h al cabo de 12 meses51. Este aumento suele ser innecesario o en todo caso es mucho menor cuando el IC utilizado es ciclosporina.
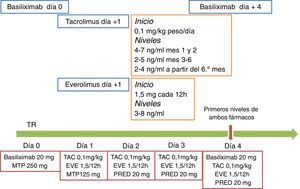
Como se recoge en la figura 1, y dentro de esta ventana terapéutica de nivel de everolimus en sangre de 3-8ng/ml, mantendremos niveles en torno a 4ng/mL durante las 3 primeras semanas para favorecer la cicatrización de la herida quirúrgica y no contribuir a la formación de linfoceles.
Propuesta de pauta de inicio de inmunosupresión con IC a dosis reducidas y everolimus de novo. La práctica totalidad de los estudios publicados de la combinación utilizan anticuerpos monoclonales anti-IL2r (basiliximab), por lo que se recomienda aplicar esta inducción. Aunque la experiencia es limitada, también puede aplicarse inducción con globulina antitimocítica según pauta habitual o minimizada. No se ha demostrado que el inicio de everolimus días o semanas después de la cirugía del trasplante aporte ningún beneficio, por lo que se recomienda el inicio durante el primer día después del trasplante. La dosis de inicio de everolimus es de 1,5mg cada 12h si el IC es tacrolimus y de 0,75 cada 12h si el IC es ciclosporina. Debe realizarse determinación de nivel en sangre al 3.er o 4.° día, y aumentar la dosis un 50% si se detecta menos de 3ng/ml. El rango terapéutico es 3-8ng/ml, y se aconseja mantenerse más próximos a 3ng/ml durante las primeras 3 semanas para posteriormente mantener una cifra ideal de 5-7ng/ml durante el primer trimestre. Se recomienda iniciar el IC el día del trasplante o en las primeras 24 h, manteniendo un nivel de tacrolimus de 4-7 los primeros 2meses, 2-5 posteriormente, e incluso 2-4ng/ml a partir del 6.° mes. Una regla sencilla que puede aplicarse es estar siempre con suma=10 entre los niveles de tacrolimus y everolimus, priorizando tacrolimus el primer mes y everolimus a partir de ese momento. La pauta esquematizada en la figura es el protocolo aplicado actualmente en el Hospital del Mar.
ATG: globulina antitimocítica; EVE: everolimus; IC: inhibidor de calcineurina; MTP: metilprednisolona; PRED: prednisona; TAC: tacrolimus.
Los niveles de tacrolimus con uso concomitante de everolimus deben ir enfocados a reducir la exposición del IC, para evitar así tanto los efectos adversos en términos de infecciones y neoplasias asociados a los IC como la nefrotoxicidad inherente a ellos. Sin embargo, y de la misma forma que se comentaba respecto al everolimus pero en sentido inverso, los niveles de tacrolimus durante las 3 primeras semanas postrasplante los mantendremos en torno a 7ng/mL, bajando dosis posteriormente para optimizar la protección frente al rechazo agudo. Una regla sencilla que puede aplicarse, en general, es estar siempre con suma alrededor de 10 entre los niveles de tacrolimus y everolimus, priorizando tacrolimus el primer mes y everolimus a partir de ese momento.
No es necesario aplicar medidas especiales en el cuidado de la herida quirúrgica del implante renal, que debe revisarse como en cualquier TR diariamente durante el primer ingreso hospitalario y después en las sucesivas revisiones, aconsejándose retirada de sutura a partir de las 3 semanas.
Manejo de complicaciones: ¿cuándo bajar dosis y cuándo retirar el fármaco?La praxis correcta cuando estamos delante de un efecto adverso grave que pueda comprometer la seguridad del paciente es la suspensión del fármaco con el que se relaciona el efecto adverso. Sin embargo, en multitud de ocasiones nos enfrentamos con efectos adversos leves o moderados, cuestiones de tolerancia que empeoran la calidad de vida del paciente y prolongan la consulta médica y que nos hacen desistir a la hora de continuar con un fármaco (fig. 2).
Manejo de los efectos adversos y situaciones clínicas asociadas al uso de everolimus. En cada una de estas situaciones, deben siempre descartarse causas no relacionadas con everolimus, antes de retirar el fármaco sin un buen motivo.
IMC: índice de masa corporal; iSRAA: inhibidores del sistema renina-angiotensina-aldosterona; RTU: resección transuretral.
Saber cuándo disminuir dosis o cuando retirar el fármaco depende de la experiencia del médico y de la tolerancia que tanto este como el propio enfermo puedan desarrollar ante una situación determinada. El balance efecto adverso/potencial beneficio debe aplicarse, igual que con cualquier otro fármaco inmunosupresor. Curiosamente, la tasa de reducciones de dosis y abandonos en las unidades de trasplante de los autores no son diferentes en pautas basadas en everolimus y en aquellas basadas en micofenolato, como acompañantes del IC.
Lo fácil ante cualquier situación que potencialmente puede estar asociada a everolimus es su retirada, incluso cuando el efecto observado no esté en relación con el fármaco o cuando no es esperable ningún beneficio tras su suspensión. Por lo tanto, es necesario discernir entre la necesidad del simple ajuste de dosis y niveles y la retirada completa del fármaco, lo cual no está indicado en muchas ocasiones (fig. 2).
ConclusionesLos mitos asociados al uso imTOR no se corresponden con la realidad actual en que se emplean dosis para obtener niveles entre 3 y 8ng/ml junto a dosis y niveles bajos de IC. Esta combinación, en pacientes de bajo a moderado riesgo inmunológico:
- -
Permite la reducción de la exposición a los IC en las primeras semanas postrasplante sin un incremento del riesgo de rechazo agudo y con una potencial mejoría de la función renal a medio-largo plazo.
- -
No se ha utilizado de una manera sistemática en pacientes de alto riesgo inmunológico, y la información acerca de su relación con el desarrollo de DSA hasta este momento es controvertida.
- -
Se asocia a una reducción del riesgo de infecciones virales en el postrasplante inmediato: en pacientes de riesgo moderado de infección por CMV, incluso en ausencia de la administración de profilaxis frentea él, o por BK.
- -
No se ha asociado a un incremento de complicaciones de la herida quirúrgica, aunque no es recomendable su uso en pacientes con un riesgo incrementado, como son los pacientes con índice de masa corporal >35kg/m2.
- -
La dislipidemia incontrolable con tratamientos habituales es una contraindicación relativa al uso de un imTOR.
- -
La enfermedad pulmonar moderada-grave, si no contraindica el trasplante, sí supone una contraindicación relativa al uso de everolimus, por el posible aumento en la incidencia de neumonitis.
- -
No se ha asociado a un incremento del riesgo de proteinuria con respecto a pautas estándar, aunque no se recomienda su uso en pacientes con glomeruloesclerosis focal y segmentaria.
- -
La ausencia de interacción farmacológica relevante con el everolimus unido a su mayor eficacia inmunosupresora haría recomendable el uso de tacrolimus combinado con everolimus frente al uso de ciclosporina.
- -
A pesar de que tanto las complicaciones cardiovasculares como neoplásicas son problemas multifactoriales, el efecto antiproliferativo y antitumoral de los imTor podrían suponer una ventaja en la supervivencia del paciente a largo plazo.
- -
Otros problemas relacionados con el uso de IC a dosis elevadas como es la neurotoxicidad podrían mejorar, con el uso combinado de IC y everolimus, al permitir la reducción de las dosis y niveles del IC.
El presente documento de recomendaciones es producto del trabajo conjunto de sus autores y de un convenio de colaboración entre Novartis Farma y la Sociedad Española de Nefrología, que le da su aval. Novartis no ha tenido acceso a su contenido ni ha influido en ninguna fase de su elaboración.