La microangiopatía trombótica (MAT) se caracteriza por daño endotelial, anemia hemolítica microangiopática, trombocitopenia y daño orgánico, especialmente renal. En oncología, la MAT puede ser secundaria al propio cáncer o estar relacionada con los tratamientos oncológicos. La MAT asociada a gemcitabina tiene un pronóstico desfavorable, con alta mortalidad, y la activación del complemento tiene un papel central en su fisiopatología. Mientras que eculizumab ha demostrado su eficacia y mejorado el pronóstico en esta enfermedad, la evidencia en cuanto al uso de ravulizumab es escasa. Presentamos el caso de una mujer de 81 años con hipertensión arterial, cáncer de mama izquierda tratada con cirugía y radioterapia y con angiosarcoma de mama izquierda en estadio iv en la actualidad, tratado con gemcitabina tras progresión con paclitaxel. Desarrolló una emergencia hipertensiva, con anemia (Hb 6,9g/dL), trombocitopenia (68.000 plaquetas), deterioro de la función renal (creatinina 1,64mg/dL) y aumento de LDH (1.126 U/L). Ante la sospecha de MAT inducida por gemcitabina, se suspendió dicho tratamiento y se inició ravulizumab, con rápida respuesta renal y hematológica. Se reintrodujo el tratamiento oncológico con pazopanib, con reaparición de la MAT. Se suspendió dicho tratamiento y se administró otra dosis de ravulizumab, con buena respuesta. La MAT es una causa importante de morbimortalidad en los pacientes con cáncer, que contribuye a la progresión a enfermedad renal crónica y a la suspensión del tratamiento oncológico. Este caso destaca el papel de ravulizumab en la MAT asociada a gemcitabina, que ofrece ventajas en pacientes frágiles, dados su alargada vida media, menor frecuencia de administración y buenos resultados.
Thrombotic microangiopathy (TMA) is characterized by endotelial damage, microangiopathic hemolytic anemia, thrombocytopenia and organ damage, particularly renal. In oncology, TMA can be secondary to the cancer itself or related to oncological treatments. TMA associated with gemcitabine has a poor prognosis, with high mortality and complement activation plays a central role in its pathophisiology. While eculizumab has shown efficacy and improved outcomes in this condition, evidence regarding the use of ravulizumab remains scarce. We present the case of an 81-year-old woman with arterial hypertension and a history of left breast cancer treated with surgery and radiotherapy, currently diagnosed with stage iv left breast angiosarcoma treated with gemcitabine after progression on paclitaxel. She developed a hypertensive emergency, anemia (Hb 6.9g/dL), thrombocytopenia (68,000 platelets), impaired renal function (creatinine 1.64mg/dL) and elevated LDH (1,126 U/L). Suspecting gemcitabine-induced TMA, the treatment was discontinued and ravulizumab was initiated, resulting in rapid renal and hematological response. Oncological treatment with pazopanib was reintroduced, leading to recurrence of TMA. That treatment was suspended and another dose of ravulizumab was administered, with good response. TMA is a significant cause of morbidity and mortality in cancer patients, contributing to progression to chronic kidney disease and the discontinuation of oncological treatment. This case highlights the role of ravulizumab in gemcitabine-associated TMA, offering advantages in frail patients due to its longer half-life, reduced administration frequency and favorable outcomes.
La microangiopatía trombótica (MAT) se caracteriza por daño endotelial y oclusión vascular por trombos, que da lugar a anemia hemolítica microangiopática, trombocitopenia por consumo y lesión de órgano diana, lo que afecta típicamente a los riñones y al sistema nervioso central1.
En oncología, la MAT puede ser secundaria al propio cáncer o estar relacionada con los tratamientos oncológicos2. La MAT inducida por fármacos tiene una incidencia superior al 15% y se clasifica en: tipo i (asociada a quimioterapia) y tipo ii (asociada a tratamientos anti-VEGF o inhibidores de tirosina cinasa)3. Característicamente la tipo i tiene lugar durante los primeros 6-12 meses de tratamiento, es dependiente de la dosis y, generalmente, es reversible. Sus manifestaciones principales son hematológicas, con altas tasas de recurrencia y elevado riesgo de enfermedad renal crónica (ERC) y mortalidad. La MAT asociada a gemcitabina, al ser una MAT tipo i, tiene un pronóstico desfavorable, con fracaso renal o mortalidad en el 70-75% de los casos4.
La desregulación e hiperactivación del complemento juegan un papel fundamental en la MAT secundaria, al actuar como un «segundo episodio» que amplifica el daño endotelial desencadenado por un factor inicial y perpetúa la MAT. Los inhibidores del complemento como eculizumab se han usado en MAT secundarias con buenos resultados5. Recientemente, una serie de casos ha demostrado el beneficio de eculizumab en la recuperación del daño renal en pacientes con MAT por gemcitabina6.
Ravulizumab, un nuevo fármaco derivado del eculizumab, puede considerarse como una alternativa. Ofrece ventajas en cuanto a su mayor vida media (unos 52 días vs. ∼11 días) y, por ello, permite espaciar las administraciones (8 semanas vs. 2 semanas). Sin embargo, actualmente no hay estudios que evalúen el uso de ravulizumab en MAT por gemcitabina.
Presentación del casoMujer de 81 años, con antecedentes de hipertensión arterial, hipotiroidismo autoimmune, cáncer de mama izquierda tratado con cirugía y radioterapia en 2007 y angiosarcoma de mama izquierda estadio iv con afectación ósea diagnosticada en diciembre de 2021. Comenzó tratamiento con paclitaxel, cambiando a gemcitabina tras 2meses por progresión ósea; presentó respuesta parcial.
Durante el tratamiento con gemcitabina, acudió al servicio de urgencias con una urgencia hipertensiva (presión arterial 200/110mmHg), anemia (Hb 6,9g/dL), trombocitopenia (68.000 plaquetas), deterioro de la función renal (creatinina 1,42mg/dL, pico 1,64mg/dL) y aumento de LDH (1.126 U/L). En el urianálisis presentaba proteinuria (600mg/dL por tira reactiva), un cociente albúmina/creatinina de 2.038mg/g, un cociente proteína/creatinina de 3.767mg/g, piuria (>100 leucocitos/campo) y microhematuria (5-10 hematíes/campo).
Dada la presentación clínica y analítica, se sospechó MAT inducida por gemcitabina. Los análisis revelaron un valor de haptoglobina indetectable, actividad de ADAMTS-13 normal y frecuentes esquistocitos en el frotis de sangre periférica. Se consideró hacer una biopsia renal, que no se pudo llevarse a cabo por limitación funcional de la paciente. Dada la sospecha clínica, se suspendió la gemcitabina y se inició ravulizumab basándose en la fragilidad de la paciente, las dificultades logísticas y la experiencia de nuestro centro con dicho fármaco. Se administraron las vacunas obligatorias antes del tratamiento.
Dos días tras la administración del fármaco, mejoraron tanto la situación clínica como los datos de laboratorio. Fue dada de alta al sexto día, con Hb 8,2g/dL, 129.000 plaquetas, creatinina 1,31mg/dL, LDH 803 U/L, proteinuria 100mg/dL (por tira reactiva) y microhematuria (1-5 hematíes/campo).
Se administró una segunda dosis de ravulizumab a los 13 días, como se recomienda, y la función renal permaneció estable (creatinina 1,3mg/dL, FGe 40mL/min), Hb 9,1g/dL, 158.000 plaquetas, LDH 495 U/L.
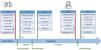
Un mes tras la última administración del fármaco, los oncólogos decidieron reiniciar el tratamiento oncológico con pazopanib. Tras 9semanas de tratamiento, reapareció la anemia (Hb 9,6g/dl), con disminución de haptoglobina y moderada elevación de LDH (427 U/L). Es conocido que los inhibidores de la tirosina cinasa se relacionan con MAT tipo ii, por lo que, sospechando una recurrencia de la MAT, se suspendió pazopanib y se administró otra dosis de ravulizumab. La función renal se mantuvo estable (creatinina 1,2-1,4mg/dL), sin signos de hemólisis (fig. 1). Se inició ciclofosfamida posteriormente, con lo que la paciente se ha mantenido estable durante los siguientes 5meses.
Discusión y conclusionesLa ERC estadios iii-v afecta al 12-25% de los pacientes con cáncer7 y aumenta significativamente la mortalidad relacionada con el cáncer así como la mortalidad por todas las causas. Los tratamientos oncológicos son una causa importante de nefrotoxicidad, por lo que resaltamos la importancia de entender los mecanismos de daño renal y de llevar a cabo un tratamiento multidisciplinar.
Un estudio español demostró que la MAT es el quinto diagnóstico más frecuente en los pacientes con cáncer a quienes se les hace una biopsia renal8. Dada la importante morbimortalidad de la MAT, diagnosticarla y tratarla en estadios tempranos es vital para prevenir tanto la mortalidad como la progresión a ERC. Además, recuperar la función renal es crucial para continuar con el tratamiento oncológico, que, en última instancia, es lo que determina el pronóstico de los pacientes. Por ello, siempre que sea posible, se deben evitar como segunda línea de tratamiento aquellos fármacos oncológicos con evidencia de causar MAT.
En nuestro caso, destacamos los beneficios de ravulizumab en una paciente con MAT inducida por gemcitabina, que presentó una recurrencia tras la administración de pazopanib. Ravulizumab es especialmente beneficioso en pacientes frágiles y con dificultad para los traslados, gracias a su esquema terapéutico, ya que ofrece ventajas tanto clínicas como en calidad de vida.
A pesar de que la evidencia del uso de ravulizumab en MAT asociado a quimioterapia es escasa y se limita a un único caso clínico publicado en un paciente joven con cáncer de páncreas9, el caso que se presenta refuerza la idea de que puede ser una opción viable y efectiva para estos pacientes.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial ni entidades sin ánimo de lucro.
Clara García Carro ha recibido soporte económico para asistencia a congresos y reuniones científicas por parte de Alexion y ha recibido remuneración económica por colaboraciones en forma de conferencias y redacción de material científico para Alexion.
Conflicto de interesesLos autores de este manuscrito declaran no tener conflictos de interés.