Las escalas de predicción del riesgo cardiovascular (RCV) suelen infraestimar el riesgo, al no estar validadas en población con enfermedad renal crónica (ERC). Dos de las más empleadas son la clásica escala de Framingham (FRS-CVD) y la contemporánea ASCVD (AHA/ACC 2013). El objetivo del estudio es evaluar la capacidad predictiva de sufrir un evento cardiovascular (ECV) mediante estas 2escalas en población con ERC.
Material y métodosEstudio observacional prospectivo de 400 pacientes prevalentes con ERC (estadios 4 y 5 según KDOQI, no en diálisis). Se calculó el RCV según las 2escalas y se analizó su poder predictivo de ECV ateroscleróticos (infarto agudo de miocardio, evento cerebro vascular isquémico y hemorrágico, enfermedad vascular periférica) y no ateroscleróticos (insuficiencia cardíaca).
ResultadosCon una media de seguimiento de 40,3±6,6 meses se registraron 49 ECV ateroscleróticos. Ambas escalas clasificaron a la mayoría de los pacientes en el grupo de alto RCV (59% según FRS-CVD y 75% según ASCVD). Todos los ECV sucedieron en el grupo de alto RCV, y ambas escalas (FRS-CVD log rank: 12,2; p<0,001; HR 3,1 [IC 95%: 1,3-7,1]; p: 0,006 y ASCVD log rank: 8,5 p<0,001; HR 3,2 [IC 95% 1,1-9,4] p: 0,03) fueron predictores independientes ajustados a función renal, albuminuria y antecedente de ECV.
ConclusionesLas escalas de predicción de RCV (FRS-CVD y ASCVD [AHA/ACC 2013]) pueden estimar la probabilidad de sufrir ECV ateroscleróticos en pacientes con ERC independientemente de la función renal, albuminuria y antecedente de ECV.
Scores underestimate the prediction of cardiovascular risk (CVR) as they are not validated in patients with chronic kidney disease (CKD). Two of the most commonly used scores are the Framingham Risk Score (FRS-CVD) and the ASCVD (AHA/ACC 2013). The aim of this study is to evaluate the predictive ability of experiencing a cardiovascular event (CVE) via these 2scores in the CKD population.
Material and methodsProspective, observational study of 400 prevalent patients with CKD (stages 4 and 5 according the KDOQI; not on dialysis). Cardiovascular risk was calculated according to the 2scores and the predictive capacity of cardiovascular events (atherosclerotic events: myocardial infarction, ischaemic and haemorrhagic stroke, peripheral vascular disease; and non-atherosclerotic events: heart failure) was analysed.
ResultsForty-nine atherosclerotic cardiovascular events occurred in 40.3±6.6 months of follow-up. Most of the patients were classified as high CVR by both scores (59% by the FRS-CVD and 75% by the ASCVD). All cardiovascular events occurred in the high CVR patients and both scores (FRS-CVD log-rank 12.2, P<.001, HR 3.1 [95% CI: 1.3–7.1] P: 0.006 and ASCVD log-rank 8.5 P<.001, HR 3.2 [95% CI: 1.1–9.4] P: 0.03) were independent predictors adjusted to renal function, albuminuria and previous cardiovascular events.
ConclusionThe cardiovascular risk scores (FRS-CVD and ASCVD [AHA/ACC 2013]) can estimate the probability of atherosclerotic cardiovascular events in patients with CKD regardless of renal function, albuminuria and previous cardiovascular events.
Existen distintas escalas de predicción de riesgo cardiovascular (RCV) diseñadas para predecir la probabilidad de sufrir un evento cardiovascular (ECV) a 10 años1–3. Una de ellas es la clásica escala de Framingham, inicialmente validada en 1998 para predecir ECV: muerte de causa cardíaca, infarto agudo de miocardio no fatal, angina estable e inestable4,5. Posteriormente revisada en 2002 por el Third Adult Treatment Panel (ATP III)6 y por última vez en 20087, desde entonces ha sido validada para predecir ECV ateroscleróticos (infarto agudo de miocardio fatal y no fatal, angina o insuficiencia coronaria, evento cerebrovascular isquémico/hemorrágico fatal y no fatal, accidente isquémico transitorio, claudicación intermitente) y no ateroscleróticos (insuficiencia cardíaca)7. La ecuación de Framingham está basada en una población homogénea, geográficamente limitada, con un predominio de la raza blanca, de ahí que su uso en cohortes modernas haya sido ampliamente cuestionado8,9. Recientemente la American College of Cardiology (ACC) y la American Heart Association (AHA)» desarrollaron el nuevo Atherosclerotic Cardiovascular Disease (ASCVD)10. Este nuevo instrumento está validado en una muestra multirracial (Multi-Ethnic Study of Atherosclerosis, MESA) y está diseñado para predecir ECV ateroscleróticos: infarto agudo de miocardio fatal y no fatal, evento cerebrovascular fatal y no fatal, además de estar validado para la población afroamericana10–13.
La enfermedad renal crónica (ERC) constituye un potente predictor de ECV14,15. Esto se explica por la alta prevalencia de factores de riesgo tradicionales así como por aquellos intrínsecamente relacionados con la ERC (no tradicionales)16–18.
Las escalas de predicción de RCV no suelen incluir dentro de sus variables aquellos factores propios de la ERC7,10. Sin embargo, en diversos estudios no se ha logrado demostrar que el añadir estas variables propias de la ERC implique un incremento significativo en términos predictivos19.
Una de las grandes críticas a las escalas de predicción de RCV es su capacidad para «sobrestimar» el riesgo8, y su escaso poder de discriminación en población con ERC20. Sin embargo, a día de hoy no existe una ecuación lo suficientemente precisa a la hora de estimar el RCV tanto en población general como en pacientes con ERC8,20,21.
El objetivo del presente estudio consiste en evaluar la capacidad predictiva de presentar un ECV mediante 2 escalas: Framingham Risk Score Cardiovascular Disease (FRS-CVD) y ASVCD (ACC/AHA 2013) en pacientes con ERC y analizar la influencia de la función renal en términos predictivos.
Material y métodosSe realizó un estudio observacional prospectivo para evaluar la capacidad predictiva de presentar un ECV mediante escalas de predicción de RCV: FRS-CVD y ASCVD (ACC/AHA 2013) en pacientes con ERC. Se estudia una cohorte de 400 pacientes consecutivos valorados en consultas externas de Nefrología con ERC. Los criterios de inclusión fueron tener una edad comprendida entre 40 y 79 años y estar en uno de los estadios 1 a 4 de la ERC (no en diálisis) según las guías KDOQI22. Los criterios de exclusión fueron la hospitalización reciente (4 meses previos) y negarse a participar en el estudio.
Los datos basales recogidos fueron: edad, sexo, etiología de la ERC (identificada por los hallazgos clínicos y confirmada principalmente mediante biopsia), antecedentes de ECV (insuficiencia cardíaca determinada mediante ecocardiografía en los 3 meses previos, infarto de miocardio, enfermedad vascular periférica, enfermedad cerebrovascular), factores de RCV clásicos tales como dislipidemia (definida según criterios de las guías ATP III o acordes, si el paciente recibía tratamiento con estatinas)6, diabetes mellitus y hábito tabáquico.
La función renal se valoró de forma basal (filtrado glomerular estimado mediante la ecuación MDRD-4, cistatina C sérica e índice albúmina/creatinina). Los parámetros nutricionales e inflamatorios que se recogieron fueron colesterol de baja densidad (LDL), colesterol de alta densidad (HDL), colesterol total y proteína C reactiva de alta sensibilidad (PCR). La medición de los parámetros de laboratorio se hizo mediante métodos estandarizados usando autoanalizadores. La PCR sérica se midió con inmunoanálisis turbidométrico basado en látex mediante analizador Hitachi (Sigma Chemical Co., St. Louis, Missouri, EE. UU.). La excreción urinaria de albúmina se midió usando método por inmunonefelometría. La tensión arterial se midió con un esfigmomanómetro electrónico automático (Omron MX3, Omron Life Science, Kyoto, Japón).
Los pacientes fueron seguidos durante 40,3±6,6 meses y se recogieron datos sobre los ECV. Los ECV se definieron: infarto agudo de miocardio (diagnosticado mediante elevación en los marcadores cardíacos y alteraciones en el ECG y confirmado mediante cateterismo cardíaco), insuficiencia cardíaca (diagnosticada mediante criterios clínicos (Framingham) o fracción de eyección de ventrículo izquierdo <45%), evento cerebrovascular (diagnosticado mediante tomografía computarizada), enfermedad vascular periférica (diagnóstico basado en estenosis de arterias primarias o de extremidades inferiores confirmada mediante arteriografía o con necesidad de amputación, y otras condiciones isquémicas tales como isquemia mesentérica o neuritis óptica). Hemos analizado las escalas como factores predictores de estos eventos según el RCV estimado. Los ECV se dividieron como ateroscleróticos (infarto agudo de miocardio fatal y no fatal, evento cerebrovascular fatal y no fatal, enfermedad vascular periférica fatal y no fatal) y no ateroscleróticos (insuficiencia cardíaca).
Basalmente se calcularon las 2 escalas: FRS-CVD y ASCVD (ACC/AHA 2013) para estimar el RCV. El RCV según FRS-CVD se definió como bajo (<10%), intermedio (10-20%) y alto (>20%)7. Según ASCVD (AHA/ACC 2013), el RCV se definió como bajo (<5%), intermedio (5-7,5%) y alto (>7,5%)10.
Análisis estadísticoLos valores se expresaron como media (desviación estándar) o mediana (rango intercuartílico) dependiendo de su distribución, lo cual fue valorado mediante el test de Kolmogorov–Smirnov. Los pacientes se estratificaron en 2grupos según cada una de las escalas: alto RCV (>20% utilizando la FRS-CVD y >7,5% con la ASCVD) y no alto RCV que correspondería a riesgo bajo/intermedio (<20% utilizando la FRS-CVD y <7,5% con la ASCVD). Se analizó la capacidad predictiva de cada una de las escalas mediante un análisis de supervivencia entre estos 2subgrupos (alto RCV vs. no alto RCV). Mediante el área bajo la curva se definió la sensibilidad y especificidad para el punto de corte definido como de alto RCV para estimar ECV ateroscleróticos. Se analizó la capacidad predictiva independiente de cada una de las escalas (FRS-CVD, ASCVD [AHA/ACC 2013]) en un análisis multivariante que se ajustó para función renal (FGe según MDRD-4, cistatina C sérica) y antecedente de ECV mediante un test de regresión de Cox. Se verificó la concordancia que tenían ambas escalas a la hora de estratificar el RCV mediante un coeficiente de correlación intraclase. El nivel de p para considerarlo estadísticamente significativo fue<0,05.
El análisis estadístico se realizó con el paquete de análisis estadístico SPSS versión 20.
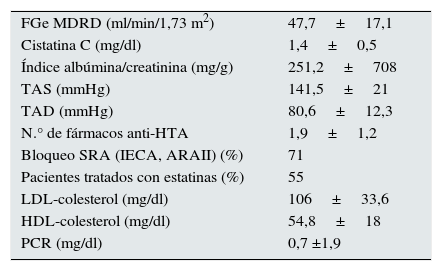
ResultadosCaracterísticas basalesLa media de seguimiento del estudio fue de 40,3±6,6 meses. La edad media de la muestra fue de 64,7±10,3 años, con un predominio de varones (62%), 8,5% eran fumadores activos, 23% tenía antecedentes de diabetes mellitus y un 15%, de enfermedad cardiovascular. El resto de las características basales se describen en la tabla 1.
Características basales
| FGe MDRD (ml/min/1,73 m2) | 47,7±17,1 |
| Cistatina C (mg/dl) | 1,4±0,5 |
| Índice albúmina/creatinina (mg/g) | 251,2±708 |
| TAS (mmHg) | 141,5±21 |
| TAD (mmHg) | 80,6±12,3 |
| N.° de fármacos anti-HTA | 1,9±1,2 |
| Bloqueo SRA (IECA, ARAII) (%) | 71 |
| Pacientes tratados con estatinas (%) | 55 |
| LDL-colesterol (mg/dl) | 106±33,6 |
| HDL-colesterol (mg/dl) | 54,8±18 |
| PCR (mg/dl) | 0,7 ±1,9 |
anti-HTA: antihipertensivos; ARAII: antagonistas del receptor de angiotensina II; FGe MDRD: filtrado glomerular estimado por la ecuación MDRD; HDL: lipoproteínas de alta densidad; IECA: inhibidores de la enzima convertidora de angiotensina; LDL: lipoproteínas de baja densidad; N.°: número; PCR: proteína C reactiva; SRA: sistema renina angiotensina; TAD tensión arterial diastólica; TAS tensión arterial sistólica.
La etiología más frecuente de la ERC fue la nefropatía diabética (18%), seguida de glomerular (16%), vascular (14%), no filiada (14%), túbulo-intersticial crónica (7%) y otras (31%).
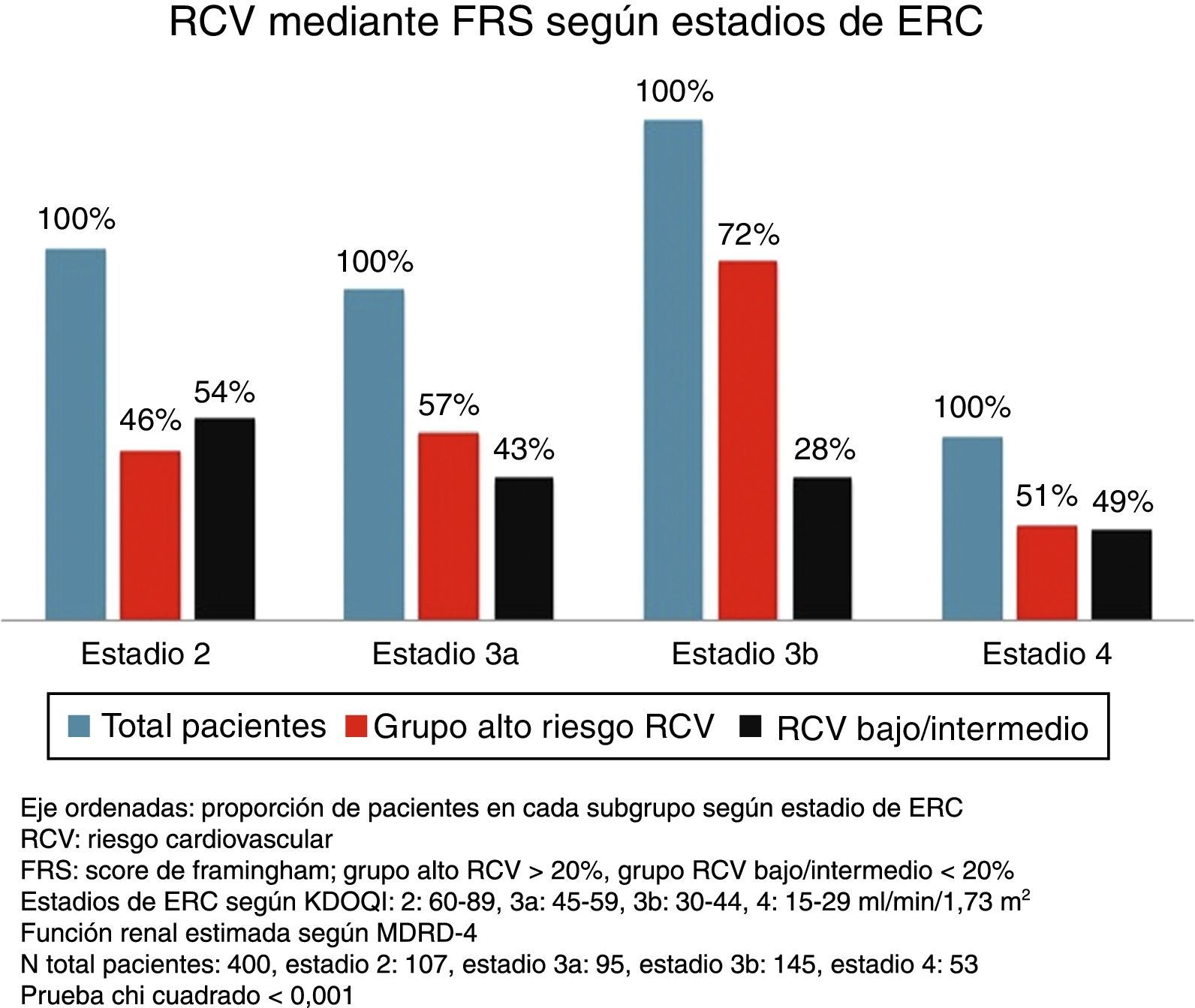
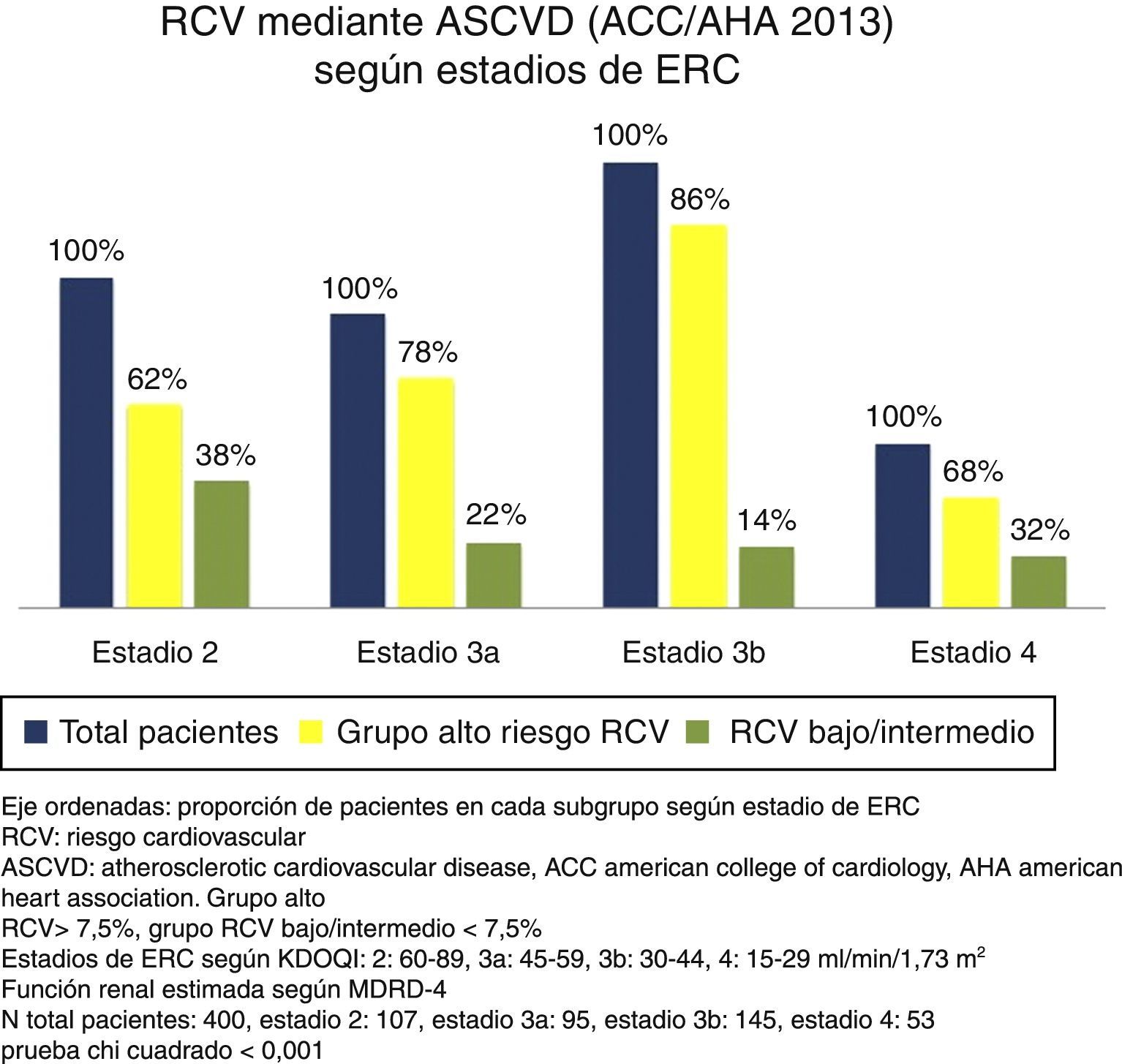
Riesgo cardiovascular globalLa media del RCV según FRS-CVD fue 27 ± 17,7% y según la ASCVD (ACC/AHA 2013) de 22±17,5%. Sin considerar los diferentes estadios de la ERC, el 59% de la muestra se agrupó como de alto RCV según FRS-CVD frente a un 15% de riesgo bajo. Mediante el área bajo la curva para el punto de corte definido como de alto RCV la sensibilidad y especificidad para predecir ECV ateroscleróticos fue del 81 y del 45%, respectivamente.
La ASCVD (ACC/AHA 2013) estratificó al 75% de los pacientes como de alto RCV. Mediante el área bajo la curva para el punto de corte definido como de alto RCV la sensibilidad y especificidad para predecir ECV ateroscleróticos fue del 91 y del 32%, respectivamente.
La concordancia para agrupar a los pacientes como de alto RCV mediante ambas escalas fue excelente, con un coeficiente de correlación intraclase (IC 95%) de 0,89 (0,87-0,91).
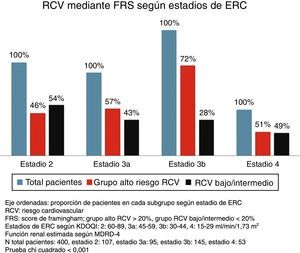
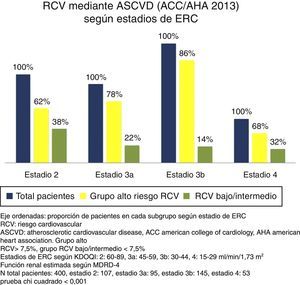
Riesgo cardiovascular según estadios de enfermedad renal crónicaSe encontraron diferencias significativas entre los diversos estadios de la ERC para el RCV estimado por ambas escalas (p < 0,001 prueba de chi cuadrado). A estadios más avanzados de ERC, una mayor proporción de sujetos se agrupaban como de alto RCV frente a un riesgo bajo/intermedio. Si bien esto ocurrió con ambas escalas, es de notar que con ASCVD se agrupaban un mayor número de pacientes como de alto riesgo frente a riesgo bajo/intermedio que con FRS-CVD (figs. 1 y 2).
Eventos cardiovascularesCon una media de seguimiento de 40,3±6,6 meses, el 83% de los pacientes no presentaron ningún ECV. Se registraron 79 ECV, de los cuales 49 correspondían a eventos ateroscleróticos (27 episodios de cardiopatía isquémica, 10 a eventos cerebrovasculares, 12 a enfermedad vascular periférica) y 30 eran no ateroscleróticos, todos ellos episodios de insuficiencia cardíaca.
Predicción de eventos cardiovascularesLas escalas de RCV solo predijeron ECV ateroscleróticos: no fueron predictivos de episodios de insuficiencia cardíaca (FRS-CVD log rank: 2,7; p: 0,09 y ASCVD [AHA/ACC 2013] log rank: 2,1; p: 0,1).
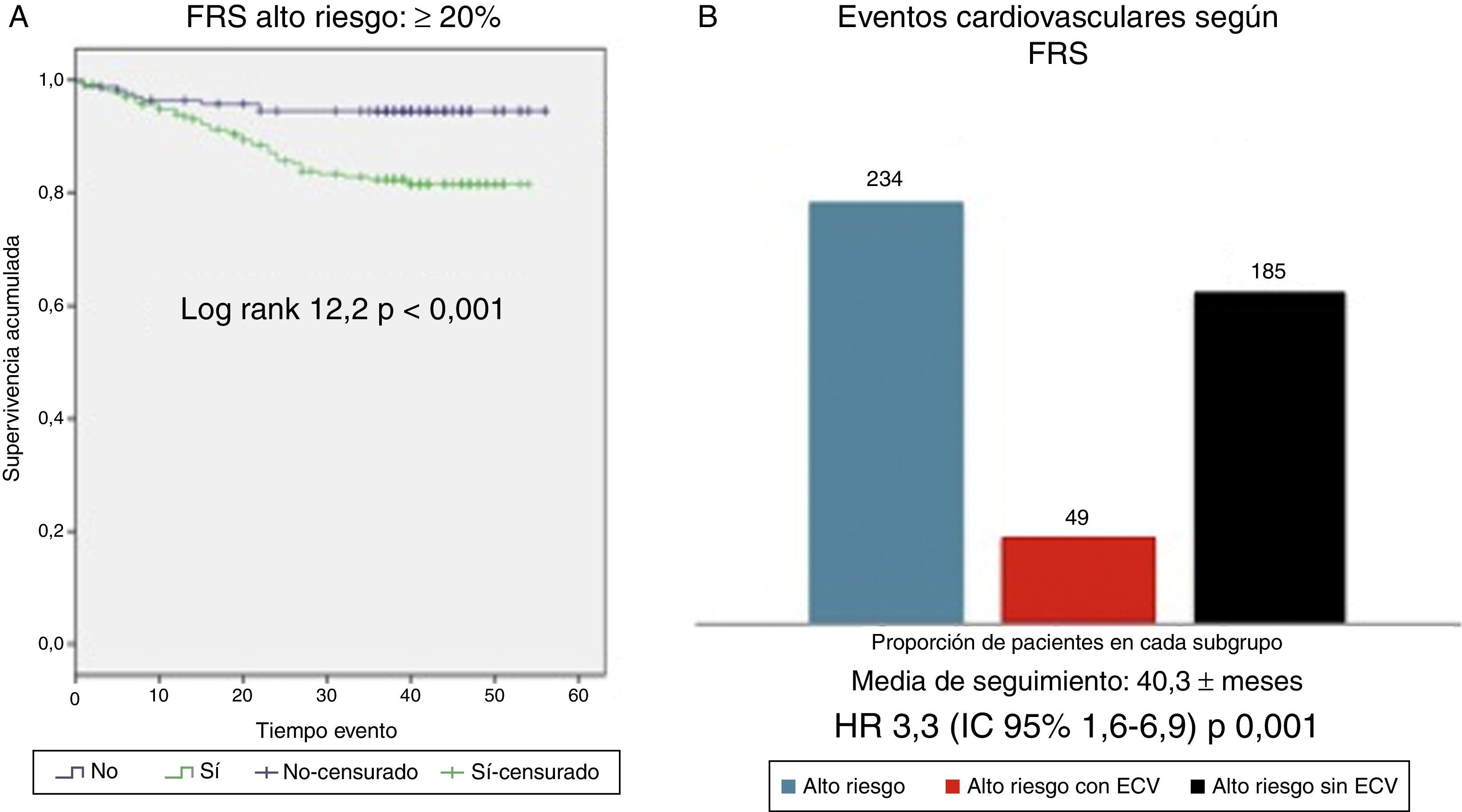
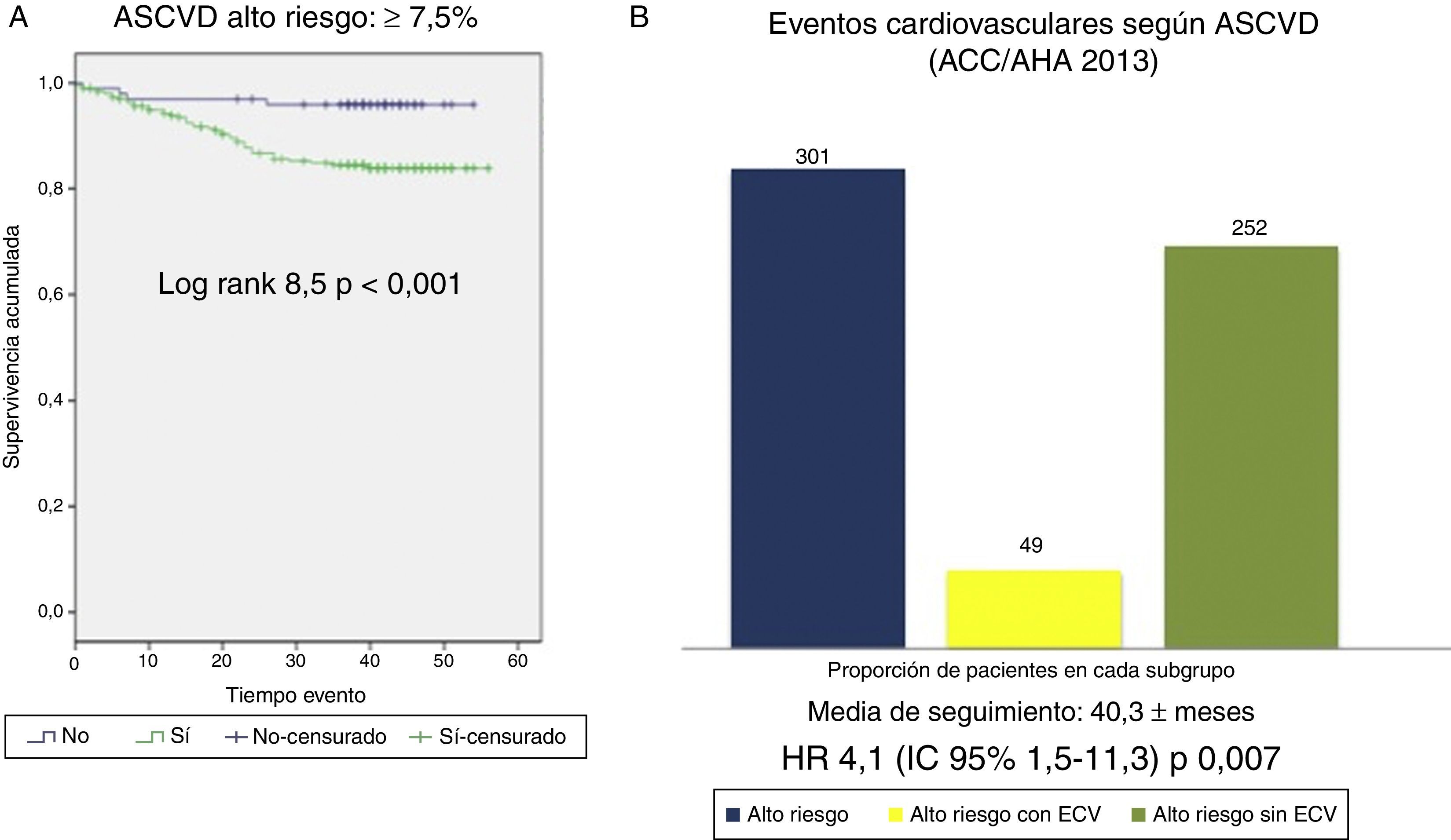
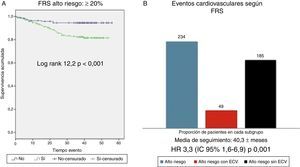
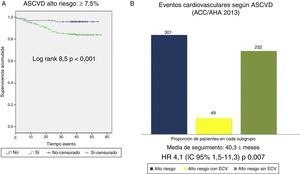
Supervivencia cardiovascular según FRS-CVD y ASCVD (AHA/ACC 2013)Los pacientes clasificados como de alto RCV según FRS-CVD tuvieron una peor supervivencia cardiovascular (log rank 12,2; p<0,001, fig. 3). De los 234 pacientes clasificados como de alto RCV, 40 presentaron un ECV aterosclerótico (HR 3,3; IC 95%: 1,6-6,9; p: 0,001). Igualmente la supervivencia cardiovascular fue peor en los pacientes de alto RCV según ASCVD (AHA/ACC 2013) (log rank 8,5; p<0,001, fig. 4). De los 301 pacientes, 42 presentaron un ECV aterosclerótico (HR 4,1; IC 95%: 1,5-11,3; p: 0,007). Por lo tanto, la mayoría de los ECV ateroscleróticos sucedieron en el grupo de alto RCV estimado por ambas escalas (40/49 según FRS-CVD y 47/49 según ASCVD).
A) Supervivencia cardiovascular según la escala de Framingham ≥20% vs < 20%. FRS: Framingham risk score. B) Eventos cardiovasculares observados en grupo de alto riesgo cardiovascular (FRS ≥20%); totalidad de pacientes del grupo de alto riesgo cardiovascular según score de Framingham (barra azul, n= 234), pacientes dentro de este grupo que sufren evento cardiovascular (barra roja, n=49), pacientes dentro de este grupo que no sufren eventos cardiovascular (n=185).
A) Supervivencia cardiovascular según la escala ASCVD (ACC/AHA 2013) ≥7,5% vs < 7,5%. B) Eventos cardiovasculares observados en grupo de alto riesgo cardiovascular (ASCVD ≥7,5%); totalidad de pacientes del grupo alto riesgo cardiovascular según ASCVD (barra azul, n=301), pacientes dentro de este grupo que sufren evento cardiovascular (barra amarilla, n=49), pacientes dentro de este grupo que no sufren eventos cardiovasculares (barra verde, n=252).
La predicción de los ECV ateroscleróticos con cada una de las escalas (FRS y ASCVD [AHA/ACC 2013]) resultó significativa e independiente en un modelo ajustado a función renal (FGe según MDRD y cistatina C sérica), albuminuria (índice albúmina/creatinina) y antecedente de enfermedad cardiovascular de origen aterosclerótico (tablas 2 y 3).
Predicción de riesgo cadiovascular según escala de Framingham. Modelo de regresión multivariable de Cox ajustado para función renal, albuminuria y antecedente de evento cardiovascular ateroesclerótico
| Factor predictor | Riesgo | P |
|---|---|---|
| FRS alto riesgo | HR 3,1 (IC95% 1,3-7,1) | 0,006 |
| Cistatina C | HR 3,8 (IC95% 1,9-7,6) | < 0,001 |
| FGe (MDRD) | HR 1,02 (IC95% 0,9-1,0) | 0,08 |
| Albuminuria (índice albúmina/creatinina) | HR 1,0 (IC95% 1,0-1,0) | 0,7 |
| Antecedente de ECV ateroscierótica | HR 4,7 (IC95% 2,5-8,8) | < 0,001 |
Regresión multivariante de Cox, modelo 1
Predicción de riesgo cardiovascular según escala de ASCVD. Modelo de regresión multivariable de Cox ajustado para función renal, albuminuria y antecedente de evento cardiovascular aterosclerótico
| Factor predictor | Riesgo | P |
|---|---|---|
| ASCVD (ACC/AHA 2013) riesgo | HR 3,2 (IC95% 1,1-9,4) | 0,03 |
| Cistatina C | HR 4,1 (IC95% 2,0-8,1) | < 0,001 |
| FGe (MDRD) | HR 1,02 (IC95% 0,9-1,1) | 0,09 |
| Albuminuria (índice albúmina/creatinina) | HR 1,0 (IC95% 1,0-1,0) | 0,5 |
| Antecedente de ECV aterosclerótica | HR 4,8 (IC95% 2,5-9,0) | < 0,001 |
Regresión multivariante de Cox, modelo 2
Durante el seguimiento de 40,3±6,6 meses ocurrieron 17 fallecimientos, de los cuales 10 eran secundarios a ECV ateroscleróticos. Ninguna de las 2 escalas (FRS-CVD p: 0,15; ASCVD [AHA/ACC 2013] p: 0,11) logró predecir la mortalidad. Solo los niveles séricos de cistatina C (HR 3,1; [IC 95% 1,2-8,0]; p: 0,01) predijeron ECV mortales independientemente del antecedente de enfermedad cardiovascular y de las escalas.
DiscusiónUno de los pilares de una buena práctica clínica lo constituye el pronóstico. El pronóstico en medicina es factible gracias a los modelos de predicción. Un buen modelo de predicción debe cumplir 4 características: 1) validez interna, 2) validez externa, 3) discriminación y 4) calibración. Además, debe tener la suficiente capacidad de discriminar entre aquellos sujetos de riesgo que pueden presentar un evento frente a aquellos que no lo van a desarrollar1,2.
En este estudio prospectivo de pacientes con ERC, ambas escalas de RCV (FRS-CVD y ASCVD [AHA/ACC 2013]) fueron predictoras independientes de ECV ateroscleróticos.
La prevalencia de alto RCV estimado en nuestra muestra fue del 59% (FRS-CVD) y del 75% (ASCVD [AHA/ACC 2013]), lo cual es consistente con los hallazgos de otros estudios de predicción de RCV mediante escalas20,23,24. Ambas escalas guardan una excelente concordancia a la hora de agrupar a la muestra en el subgrupo de alto RCV; no obstante, un mayor número de sujetos se agrupan como de alto RCV según ASCVD (AHA/ACC 2013) frente a FRS-CVD.
La ERC constituye un potente predictor de ECV. Esto se explica por la alta prevalencia de los factores de RCV clásicos (edad, sexo, diabetes mellitus, tensión arterial, dislipidemia) y no tradicionales (propios de la ERC, tales como el filtrado glomerular, albuminuria, anemia, metabolismo fosfocálcico, inflamación, entre otros)14–18. La influencia sobre el RCV de estos 2 grupos de factores de riesgo guarda una relación dicotómica: predominio de los tradicionales en etapas incipientes y de los no tradicionales en estadios más avanzados de la ERC. En nuestra muestra, la ERC constituyó un potente predictor de ECV y, así mismo, estadios peores de ERC condicionaban que una mayor proporción de sujetos se agruparan en la subpoblación de alto RCV.
Las distintas ecuaciones de predicción del RCV usualmente incluyen dentro de sus variables los factores de riesgo clásicos y muy pocas incluyen la ERC. Pese a ello, en distintos estudios se ha comprobado que el efecto de añadir a una escala clásica, como la de Framingham, estas variables propias de la ERC (filtrado glomerular, proteinuria, albuminuria, cistatina C sérica) consigue un escaso incremento en términos de poder predictivo19.
Las escalas de predicción de RCV han sido ampliamente criticadas en la literatura por su capacidad para sobrestimar el RCV en población general8,21. En los estudios que incluyen población con ERC se demuestra poca capacidad discriminativa con la escala de Framingham20, sin embargo, existe evidencia a favor de que FRS-CVD puede predecir ECV en la población de alto RCV23. A día de hoy, la escala ASCVD está generando mucho debate, no solo por su capacidad de sobrestimar el RCV21, sino también porque, el estratificar a una gran proporción de sujetos como de alto RCV (>7,5%) implica un mayor uso de estatinas en sujetos aparentemente sanos21; sin embargo, existe muy poca información acerca de su uso en población con ERC.
En nuestro estudio con un seguimiento de 40,3±6,6 meses, observamos 79 ECV, de los cuales 30 correspondían a episodios de insuficiencia cardíaca. Ninguno de los 2 instrumentos logró predecir estos eventos no ateroscleróticos, si bien el FRS-CVD está diseñado para poder predecir insuficiencia cardíaca7, el ASCVD (ACC/AHA 2013) no incluye dentro de su perfil predictivo eventos no ateroscleróticos tales como la insuficiencia cardíaca10. Al contrario, los eventos ateroscleróticos (49 en el seguimiento) sí fueron pronosticados con ambas escalas (FRS-CVD, ASCVD [ACC/AHA 2013]) en la población definida como de alto RCV de forma independiente en el modelo ajustado a función renal y antecedente de ECV aterosclerótica.
La sensibilidad para predecir estos ECV ateroscleróticos con cada una de las escalas para el punto de corte definido como de alto RCV (>20% utilizando FRS-CVD y >7,5% según ASCVD [AHA/ACC 2013]) fue similar (81% para FRS-CVD y 91% para ASCVD [AHA/ACC 2013]). Sin embargo, ambas poseen baja especificidad (45% FRS-CVD y 32% ASCVD [AHA/ACC 2013]) lo que aumenta considerablemente la tasa de falsos positivos y disminuye su capacidad discriminativa. Considerando que una gran proporción de la muestra se clasificó como de alto RCV vs. bajo/intermedio RCV, es vital el lograr distinguir qué sujetos van a desarrollar un evento frente a los que no van a presentarlo. Esto último, su poca capacidad discriminativa, es una de las grandes críticas que se hace a todas las ecuaciones de predicción del RCV8,20,21.
Durante el seguimiento se registró una baja tasa de mortalidad: 17 fallecimientos, de los que solo 10 corresponderían a ECV mortales: ninguna de las escalas logró predecir estos eventos. Recientemente se ha descrito el poder predictivo de ECV y de mortalidad de causa cardiovascular de la cistatina C sérica25. En nuestro estudio solo la cistatina C sérica fue capaz de predecir mortalidad, independientemente de cada una de las escalas y del antecedente de enfermedad cardiovascular.
Las escalas de predicción estiman la probabilidad de sufrir un ECV en los próximos 10 años, por lo que probablemente el tiempo de seguimiento de nuestro estudio de 40,3±6,6 meses no sea suficiente para valorar su poder predictivo en este grupo poblacional. De ahí, la baja tasa de ECV registrados a lo largo del seguimiento. En otros trabajos, con una media de seguimiento incluso menor, se ha reportado una tasa mayor de ECV23. Es de esperar que con un tiempo mayor de seguimiento la tasa de eventos «observados» se acerque más a los eventos «esperables».
Diversos trabajos previos realizados en población sin ERC han demostrado una sobrestimación del riesgo, de tal manera que los eventos que se predicen con las escalas son mayores de los que realmente ocurren8. Esto implica una discriminación pobre en la población general. Al contrario, estudios realizados con la escala de Framingham encuentran una infraestimación del RCV, con lo cual los eventos que se predicen con ella son menos que los que realmente ocurren20. A día de hoy no existe una ecuación lo suficientemente precisa para predecir RCV tanto en población general como con ERC8,10,20,21.
La aplicabilidad de las escalas de predicción de RCV en pacientes con ERC ha sido ampliamente discutida ya que, al tratarse de una población de alto RCV, la estimación puede ser poco precisa20,21. Existen diversos factores que hacen especialmente difícil la predicción de RCV en esta población: factores de RCV no tradicionales, la epidemiología inversa, la importancia de la sobrecarga de volumen y, por ende, la menor prevalencia de eventos ateroscleróticos en estadios más avanzados de la ERC16–18. En este sentido, recientemente se ha diseñado una escala de predicción de RCV para pacientes con ERC terminal en diálisis, sin embargo, aún está por definirse su validez externa y la generalización de resultados26. Al contrario, para pacientes con ERC que no están en diálisis, a día de hoy únicamente disponemos de las clásicas escalas de predicción de RCV, muchas de las cuales no incluyen variables propias de la ERC dentro de su diseño19.
El estudio no carece de limitaciones. La principal, como hemos señalado previamente, es el corto tiempo de seguimiento. Además, probablemente el tamaño muestral no es suficiente, al incluir diferentes estadios de ERC. Este hecho, junto al tiempo de seguimiento, han podido influir en la baja tasa de ECV registrados. Es probable que en situaciones más avanzadas de la ERC la influencia de los factores no tradicionales juegue un papel predominante y aumente exponencialmente el RCV, que se podría traducir en un mayor número de ECV. En esta última situación hipotética, estimar el RCV mediante las ecuaciones convencionales podría resultar impreciso.
La clásica escala de Framingham ha sido evaluada en población con ERC con resultados dispares20,23; sin embargo, la contemporánea ASCVD (AHA/ACC 2013)10 no ha sido aún evaluada en esta población. Hasta la fecha, es el único estudio que analiza el valor predictivo de estos 2instrumentos: uno más clásico y otro más contemporáneo en población renal. Según nuestros datos, ambos estiman el RCV de forma similar (agrupando a una gran proporción de pacientes como de alto riesgo) y son capaces de predecir los ECV ateroscleróticos, sin embargo, las implicaciones y la utilidad de estas herramientas a largo plazo aún están por definir.
En conclusión, las escalas de predicción de RCV (FRS-CVD y ASCVD [AHA/ACC 2013]), aun con sus limitaciones, pueden estimar la probabilidad de presentar ECV ateroscleróticos en pacientes con ERC de forma independiente.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.