La nefropatía asociada al virus de la inmunodeficiencia humana (VIH) es la principal causa de enfermedad renal crónica en los pacientes infectados por el VIH; sin embargo, en los últimos años la prevalencia de otras glomerulopatías asociadas a inmunocomplejos ha ido en aumento. Presentamos el caso clínico de un paciente de 43 años con VIH sin confección por el virus de la hepatitis C (VHC) que presentó deterioro de la función renal con proterinuria, y, al realizar la biopsia renal, en la microscopia electrónica se evidenciaron depósitos de fibrillas orientadas al azar con diámetro aproximado de 18-20 nm, y se diagnosticó de glomerulonefritis fibrilar, la cual se ha asociado a pacientes con VIH coinfectados por el VHC. Su patogenia es desconocida y el tratamiento no está definido.
INTRODUCCIÓN
Las glomerulopatías con depósitos organizados son una rara entidad. La incidencia en biopsias renales de riñones nativos oscila entre el 0,8 y el 1,5%. La mayoría de los casos son idiopáticos, aunque un porcentaje se ha asociado a procesos neoplásicos o autoinmunes. Se producen más frecuentemente entre la 5.ª y la 6.ª décadas de la vida, sobre todo en la raza caucásica1. Clínicamente se manifiestan en forma de proteinuria, pudiendo aumentar hasta rango nefrótico, microhematuria, hipertensión arterial e insuficiencia renal. Progresan lentamente pese al uso de esteroides o fármacos citotóxicos, desarrollando insuficiencia renal crónica a los 2-4 años en el 50% de los casos. No tienen un tratamiento claramente establecido.
CASO CLÍNICO
Presentamos el caso de un varón de 43 años, sin antecedentes personales de interés. Ingresa en el servicio de digestivo por cuadro de diarrea, vómitos y fiebre de 38,5º de 2 días de evolución, con heces amarillas, orinas colúricas y astenia de 2 meses de evolución. Reconocía consumo de batidos hiperproteicos, anabolizantes y concentrados multivitamínicos. En la analítica de urgencias destacaban: creatinina, 2,9 mg/dl; GPT (glutamato piruvato transaminasa), 3.116 U/l; GOT (glutamato oxalacetato transaminasa), 1.489 U/l; GGT (gammaglutamiltranspeptidasa), 354 U/l; BT (bilirrubina total), 5,25 mg/dl; BD (bilirrubina directa), 4,4 mg/dl. Orina con patrón prerrenal: CrO (creatinina en orina), 235 mg/dl; sodio, 20 mEq/l. Sistemático de orina: proteína, 500 mg/dl; hematíes, 25 mg/dl. Se le realizó ecografía de abdomen, que mostraba riñones de tamaño normal, esplenomegalia de 12 cm, porta aumentada de tamaño y lesiones sospechosas en el hígado. Por este motivo se realizó colangiorresonancia, que mostró un hígado de tamaño normal y lesiones hiperintensas en segmentos VII, IV y VI, no caracterizables en este estudio, por lo que se realizó resonancia y TC (tomografía computarizada) hepáticas, que señalaron que las lesiones focales del hígado correspondían a angiomas.
Tras hidratación, la función renal se mantuvo alterada, por lo que se solicitó analítica completa, con las inmunoglobulinas y los complementos normales; ANA (anticuerpos antinucleares), anticuerpos antimembrana basal y ANCA (anticuerpos citoplasmáticos antineutrófilos), negativos; crioglobulinas, negativas; perfil lipídico, normal. En el proteinograma no se observó pico monoclonal. Cadenas ligeras en sangre y orina, normales. Albúmina, 3 g/dl. Serología con VHB (virus de la hepatitis B) y VHC (virus de la hepatitis C), negativa; VIH (virus de la inmunodeficiencia humana), positivo, con carga viral de 22.159 copias/ml; citomegalovirus (CMV) IgG, positivo; PCR CMV, negativo; VEB (virus de Epstein-Barr) IgG, positivo; herpesvirus, negativo. Serología para Toxoplasma gondii, negativa. Orina con la relación albúmina/creatinina de 2,8 g/g, por lo que se decidió la realización de biopsia renal, que mostró:
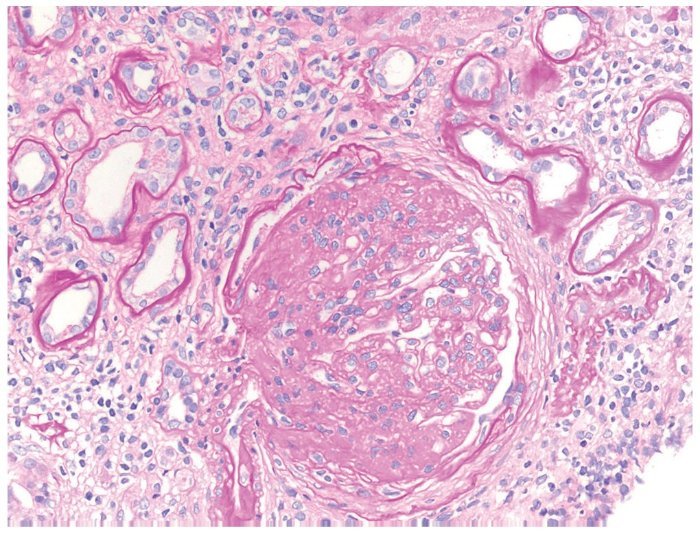
• Microscopia óptica: 11 glomérulos, 2 globalmente esclerosados, otros 2 con retracción del ovillo capilar, con plegamiento de las asas capilares y fibrosis pericapsular. Los restantes mostraron una prominente expansión de la matriz mesangial y de las paredes capilares por un material amorfo PAS (ácido peryódico de Schiff) positivo. Plata metenamina, negativo. Intersticio con moderada fibrosis intersticial, atrofia tubular acompañada de un infiltrado inflamatorio mono-nuclear restringido a dichas áreas (fig. 1).
Figura 1. Microscopio óptico: hematoxilina-eosina.
• Inmunofluorescencia (IF): positividad granular mesangial y parietal IgG (3+), C3 (2+), kappa (2+), lambda (2+), IgA (+), IgM (+). Negatividad fibrinógeno.
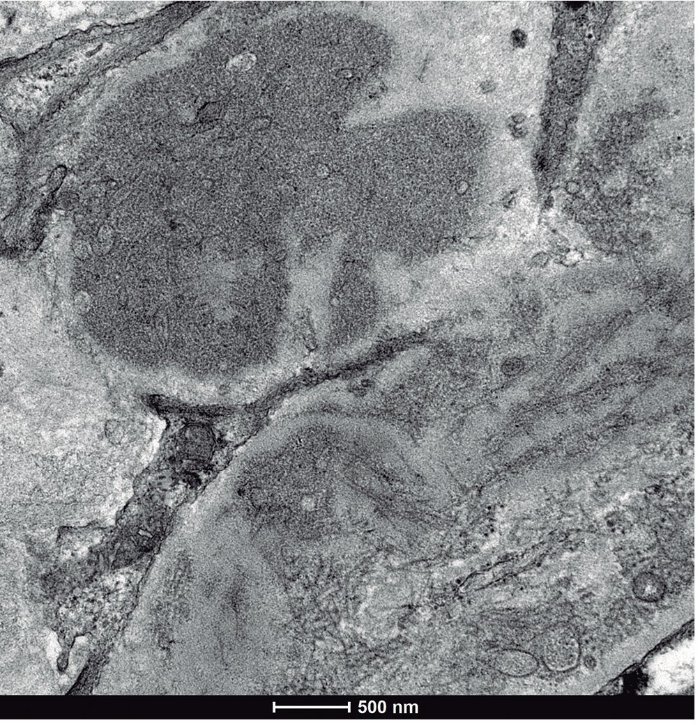
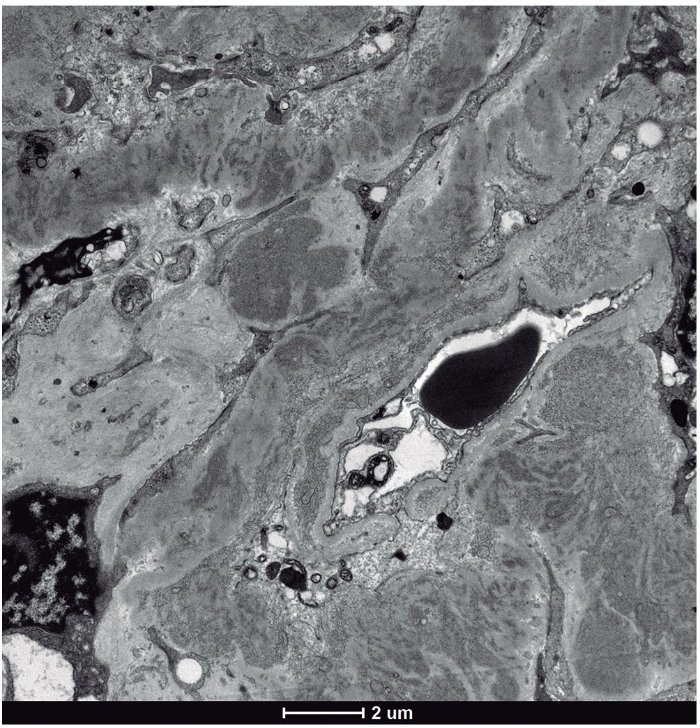
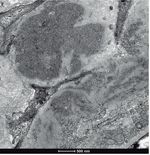
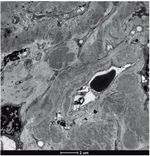
• Microscopia electrónica: un glomérulo con distorsión general de la arquitectura con engrosamiento de las paredes capilares y expansión mesangial por la presencia de abundantes depósitos de fibrillas localizadas tanto en el mesangio como en las paredes capilares, que se distribuían aleatoriamente, y que eran de mayor tamaño que las de amiloide, con un grosor medio que oscilaba entre 20-25 nm (figs. 2 y 3). Ante los hallazgos de las fibrillas se solicitó rojo Congo, que fue negativo, por lo que se descartó la amiloidosis.
Figura 2. Microscopio electrónico: depósito de fibrillas.
Figura 3. Microscopio electrónico: depósito de fibrillas.
Se diagnosticó de hepatitis aguda por virus A. Inició tratamiento antirretroviral ajustado a la función renal. Treponema pallidum fue positivo, por lo que se pautó tratamiento antibiótico y, ante la sospecha de neurolúes, se realizó punción lumbar, que fue negativa.
Debido a los hallazgos de la biopsia, se inició con doble bloqueo del sistema renina-angiotensina; la función renal se mantiene estable, con creatinina de 2,5 mg/dl y proteinuria de rango no nefrótico, en espera de valorar el tratamiento inmunosupresor cuando se resuelvan los problemas infecciosos.
DISCUSIÓN
La glomerulonefritis fibrilar (GNF) es una rara enfermedad glomerular primaria descrita por primera vez por Rosenmann y Eliakim en 19772. Más tarde, en 1983, Duffy et al describieron 8 pacientes con hipertensión, hematuria y proteinuria, en cuyas biopsias se observaron depósitos de fibrillas dispuestas al azar en el mesangio y transmembranosas; utilizaron el término fibrilar para designar la ultraestructura de dichos depósitos. En 1987, Alpers et al comunicaron 7 casos de lesiones renales que presentaron a nivel ultraestructural los depósitos extracelulares de fibrillas orientadas al azar y de un diámetro superior al del amiloide (10 a 20 nm), y acuñaron el término de glomerulonefritis (GN) fibrilar (GNF)3. Las fibrillas se depositan en el mesangio, en las membranas basales glomerulares o en ambos. En la IF, los depósitos tiñen típicamente para IgG policlonal y complemento, lo que indica depósito de complejos inmunes. Las características microscópicas de la luz son heterogéneas. La mayoría de los casos presentan expansión mesangial/hipercelularidad con o sin duplicación de la membrana basal glomerular. Los patrones morfológicos menos conocidos incluyen glomerulonefritis proliferativa endocapilar y glomerulonefritis crescéntica. Por definición, los depósitos glomerulares en GNF son rojo Congo negativo, lo que los distingue de amiloide. La GNF se encuentra entre el 0,5 y el 1% de las biopsias nativas4.
La patogenia es desconocida. La mayoría de los casos son idiopáticos, aunque se han descrito numerosas asociaciones con otras enfermedades, como procesos linfoproliferativos, mieloma, síndrome de Sjögren, vasculitis leucocitoclástica y crioglobulinemia. Asimismo se ha descrito en pacientes con infección por el VHC5 y se han comunicado también 2 casos de coinfección por el VIH y el VHC6. La GNF es vista raramente en pacientes VIH excepto que estén coinfectados por el VHC.
Tanto la presentación clínica como la gravedad de esta glomerulopatía son variables. La forma de presentación es la proteinuria, que en un alto porcentaje de los casos es en rango nefrótico. La insuficiencia renal, la hematuria o la hipertensión son otras de las formas de presentación descritas con mayor frecuencia en la literatura7.
No tiene tratamiento claramente establecido. La estrategia terapéutica para la GNF está pobremente definida. Podría argumentarse que el tratamiento con bloqueo del sistema renina-angiotensina está basado en los beneficios en otras glomerulopatías. La remisión puede ocurrir con tratamiento sintomático solo, aunque en la mayoría de los pacientes se requiere tratamiento adicional. Se han probado varios regímenes inmunosupresores, que han encontrado resultados heterogéneos y una amplia variedad de opciones de inmunosupresión, y sus resultados son inconsistentes y limitados8.
El pronóstico es malo, y cerca de la mitad de los pacientes progresan a insuficiencia renal terminal dentro de unos pocos años después del diagnóstico3. Además, la GNF puede recurrir hasta en el 36% en el trasplante renal, y es mayor en presencia de gammapatía monoclonal subyacente.
CONCLUSIÓN
En conclusión, presentamos el caso de un paciente con VIH sin coinfección por el VHC que se diagnosticó de GNF8. La GNF es una enfermedad de baja incidencia y con amplia variabilidad de presentación, probablemente infradiagnosticada, y es imprescindible la microscopia electrónica para el diagnóstico preciso. Aún quedan por esclarecer las bases de la patogenia y el tratamiento de la GNF. Por todo ello, es necesario realizar más estudios.
Conflicto de intereses
Los autores declaran que no tienen conflicto de intereses potencial relacionado con los contenidos de este artículo.
Correspondencia:
Patricia García-Frías
Servicio de Nefrología.
Hospital Regional Universitario Virgen de la Victoria.
Campus de Teatinos, s/n. 29011 Málaga.
pgfrias@hotmail.com
Revisión por expertos bajo la responsabilidad de la Sociedad Española de Nefrología.