Las complicaciones renales se encuentran entre las más frecuentes de la enfermedad falciforme (EF), aparecen tempranamente desde la infancia, y constituyen uno de los principales factores relacionados con la mortalidad en estos pacientes. La vasooclusión y la hemólisis son los principales mecanismos patogénicos subyacentes. La médula renal reúne condiciones ideales para la falciformación de los hematíes debido a su baja presión parcial de oxígeno, elevada osmolaridad y pH ácido. Inicialmente, la falciformación en los vasa recta de la médula renal es la causa de hipostenuria, que es universal, y aparece en la infancia temprana. Existe también hematuria, microscópica y macroscópica, en parte relacionada con la necrosis papilar renal cuando los infartos son extensos. La liberación en la médula renal de prostaglandinas debido a la isquemia se relaciona con el aumento del filtrado glomerular (FG). De forma adaptativa, aumenta la reabsorción de sodio en el túbulo proximal, que se acompaña de un aumento de la secreción de creatinina. Por ello, el FG estimado a partir de la creatinina puede estar sobreestimado. La glomeruloesclerosis focal y segmentaria es la glomerulopatía más común. La albuminuria es muy frecuente, y se ha observado reducción en el 72,8% de los sujetos tratados con IECA o ARA-II. Recientes evidencias sugieren que la hemoglobina libre tiene efectos nocivos sobre los podocitos, pudiendo ser un mecanismo implicado en la alteración de la función renal que presentan estos enfermos. Estos efectos han de ser mejor estudiados en la EF, ya que podrían constituir una alternativa terapéutica en la nefropatía falciforme.
Kidney problems are among the most common complications in sickle cell disease (SCD). They occur early in childhood and are one of the main factors related to mortality in these patients. The main underlying pathogenic mechanisms are vaso-occlusion and haemolysis. The renal medulla has ideal conditions for the sickling of red cells due to its low partial pressure of oxygen, high osmolarity and acidic pH. Initially, sickle-cell formation in the vasa recta of the renal medulla causes hyposthenuria. This is universal and appears in early childhood. Microscopic and macroscopic haematuria also occur, in part related to renal papillary necrosis when the infarcts are extensive. Release of prostaglandins in the renal medulla due to ischaemia leads to an increase in the glomerular filtration rate (GFR). Adaptively, sodium reabsorption in the proximal tubule increases, accompanied by increased creatinine secretion. Therefore, the GFR estimated from creatinine may be overestimated. Focal segmental glomerulosclerosis is the most common glomerular disease. Albuminuria is very common and reduction has been found in 72.8% of subjects treated with ACE inhibitors or ARB. Recent evidence suggests that free haemoglobin has harmful effects on podocytes, and may be a mechanism involved in impaired kidney function in these patients. These effects need to be better studied in SCD, as they could provide a therapeutic alternative in sickle cell nephropathy.
- •
Las complicaciones renales son frecuentes en pacientes con enfermedad falciforme (EF).
- •
La vasooclusión y la hemólisis son los principales mecanismos patogénicos de la nefropatía falciforme.
- •
Se presenta a menudo en forma de hipostenuria, hematuria, albuminuria, aumento del filtrado glomerular y de la función tubular proximal, fracaso renal agudo o enfermedad renal crónica.
- •
El tratamiento con IECA o ARA-II reduce la albuminuria en la mayoría de los sujetos.
- •
La hemoglobina libre tiene efectos nocivos en los podocitos, aunque no hay estudios que hayan validado esta observación en pacientes con EF.
- •
A pesar de los avances realizados en los últimos años, es necesario seguir estudiando la fisiopatología de la EF y su relación con el daño renal, ya que no hay tratamientos farmacológicos efectivos que eviten el daño renal y su progresión.
La nefropatía falciforme es el término empleado para referirse al conjunto de manifestaciones de la enfermedad falciforme (EF) en el riñón. Las complicaciones renales son unas de las más frecuentes y graves en la EF. A menudo están presentes desde la infancia, y son una de las principales causas de muerte en los adultos1.
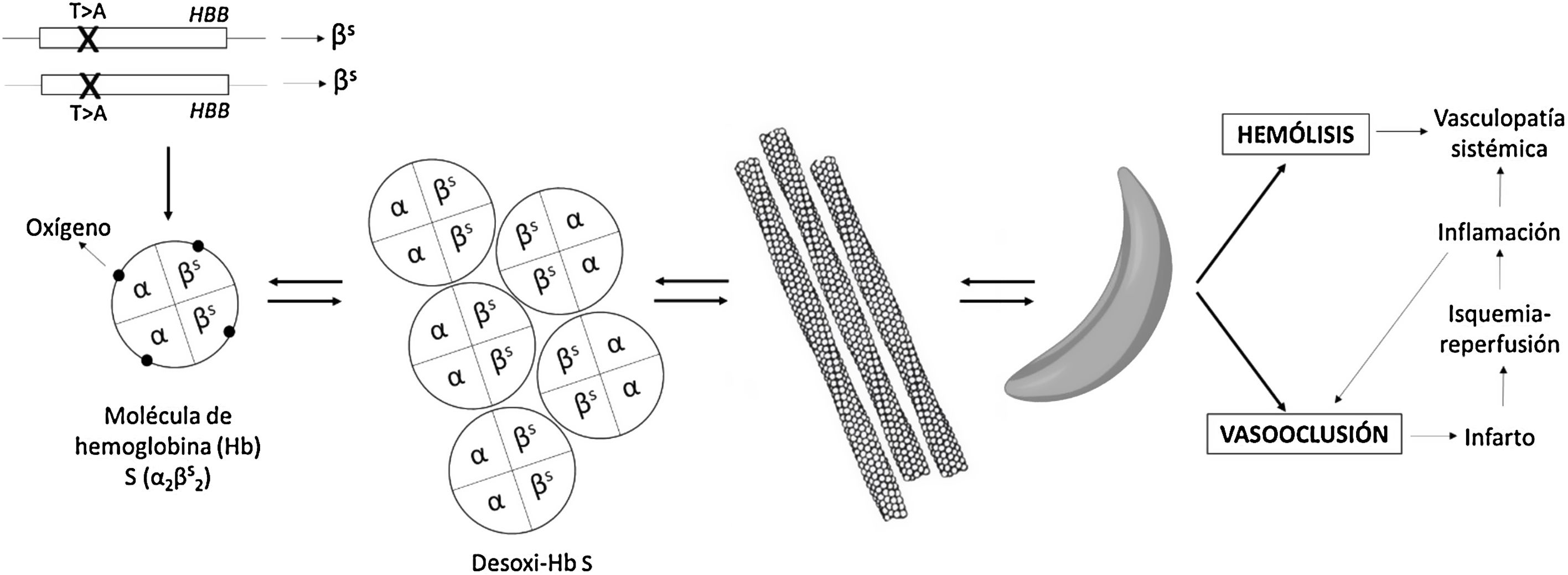
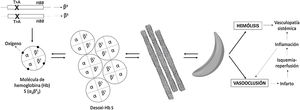
La EF (o drepanocitosis) engloba el conjunto de fenotipos resultantes de la combinación de la mutación responsable de la hemoglobinopatía S, en uno de los alelos del gen de la globina beta (HBB), con otra mutación en el otro alelo. De esta forma, las variantes más graves son el estado homocigoto (S/S), al que se refiere la expresión «anemia falciforme», y la combinación con una mutación que origina un alelo silente (S/β0-talasemia). Otras formas son las dobles heterocigocias S/C o S/β+-talasemia. Cuando la mutación que origina la hemoglobinopatía S coexiste con un alelo normal, es decir, el estado de portador, se habla de rasgo falciforme, que no es una enfermedad y no se incluye en la definición de EF. En el rasgo falciforme, en torno al 40% de la hemoglobina (Hb) es Hb S. Dado que la Hb es un tetrámero constituido por 2 globinas alfa y 2 de tipo beta, las alteraciones del gen de la globina beta pueden coexistir con mutaciones que reduzcan la producción de globina alfa (α-talasemias)2.
La Hb S es poco soluble cuando se desoxigena y da lugar a polímeros con forma de bastón que otorgan al hematíe la característica forma de hoz (en latín, falx, falcis) o media luna (fig. 1). Esto ocasiona hemólisis y vasooclusión, fenómenos patogénicos principales de la EF, y conduce a disfunción endotelial y vasculopatía, daño por isquemia/reperfusión, estrés oxidativo, hipercoagulabilidad, déficit de óxido nítrico (la Hb libre resultado de la hemólisis intravascular se une a él y lo secuestra), activación plaquetaria y aumento de la adhesividad de los neutrófilos. Todo ello da lugar a manifestaciones agudas y crónicas que pueden afectar potencialmente a cualquier órgano. Las más frecuentes son la anemia crónica y las crisis dolorosas óseas. Otras manifestaciones son asplenia/hipoasplenia funcional, sepsis, infartos cerebrales silentes e ictus, retinopatía, hipertensión pulmonar, fibrosis pulmonar, síndrome torácico agudo, necrosis avascular de cadera u hombro, úlceras en extremidades inferiores, priapismo o la propia nefropatía falciforme2,3.
El rasgo falciforme confiere protección parcial frente a la malaria, lo que justifica que la EF afecte predominantemente a personas de origen africano, aunque también es prevalente en individuos de Oriente Próximo, India y América del Sur y Central4. En el África subsahariana, la prevalencia del rasgo falciforme oscila entre el 10 y el 30%, y la enfermedad llega a afectar al 2% de la población en algunos países5. El aumento del flujo migratorio desde zonas endémicas, la instauración de programas de cribado neonatal universal en las comunidades autónomas y la mejora en la supervivencia son responsables del aumento del número de pacientes en seguimiento en nuestro país. Sin embargo, aún no existen datos sobre la prevalencia real de la enfermedad en España. Según datos publicados a inicios de 20196, 826 pacientes con EF estaban incluidos en el Registro Español de Hemoglobinopatías (REHem), un registro no poblacional auspiciado por la Sociedad Española de Pediatría (SEHOP) y con participación de algunos centros. La mayor parte de los individuos incluidos se concentraban en la Comunidad de Madrid, Cataluña y, en menor medida, la Comunidad Valenciana. La mayor parte de los niños (63,3%) habían nacido en España, la mayoría de los cuales (51,4%) fue diagnosticada a través del cribado neonatal. En Madrid, la incidencia de EF es de 0,16 por cada 1.000 nacimientos6.
La EF se ha de sospechar ante la presencia de anemia hemolítica u otras manifestaciones clínicas propias de la enfermedad, y un origen étnico de riesgo. Las manifestaciones clínicas no aparecerán, incluso en las formas más graves, hasta unos meses tras el nacimiento, conforme la Hb fetal (Hb F) vaya disminuyendo a lo largo del primer año de vida.
El origen étnico no es siempre un marcador. La anemia y los rasgos de hemólisis pueden estar ausentes en algunos casos en determinados genotipos. Generalmente observaremos hematíes falciformes en el frotis de sangre periférica, aunque son raros en la forma Hb S/C, en la que predominan los dianocitos. El volumen corpuscular medio (VCM) puede disminuir (microcitosis) en la forma Hb S/C o en las formas asociadas a β-talasemia (Hb S/β0-talasemia o Hb S/β+-talasemia) o a α-talasemia. Generalmente, el diagnóstico se completará con un estudio de las variantes de Hb mediante cromatografía líquida de alta eficacia o high performance liquid chromatography (HPLC) y electroforesis capilar. En determinados casos será útil el estudio genético de confirmación7,8.
El trasplante de progenitores hematopoyéticos (TPH) alogénico es el único tratamiento curativo disponible. Sin embargo, su aplicación en nuestro medio está limitada por la falta de donantes adecuados, y la morbilidad asociada, sobre todo cuando se realiza más allá de la adolescencia. En EE. UU., menos de un 15% de los pacientes disponen de un donante familiar HLA-idéntico9. Los tratamientos basados en edición génica están en estudio, aunque los resultados son prometedores. La hidroxiurea es todavía el único medicamento para tratar la enfermedad aprobado en Europa. Este fármaco induce la producción de Hb F, lo que inhibe la polimerización de la Hb S y, por tanto, la falciformación. No obstante, los niveles de Hb F que se obtienen con la dosis máxima tolerada se sitúan habitualmente entre el 20 y el 30%, por lo que la Hb S sigue representando la Hb predominante10. El beneficio de la hidroxiurea es, por tanto, parcial. Además, es insuficiente la evidencia sobre su beneficio en pacientes con genotipos no Hb S/S o Hb S/β0-talasemia o en relación a la prevención de las complicaciones crónicas11. Por otro lado, todavía es incierto el efecto de distintos fármacos ya aprobados por la FDA, como la L-glutamina, el crizanlizumab y el voxelotor, sobre las complicaciones crónicas de la EF. De este modo, la esperanza de vida de los pacientes con EF en los países desarrollados sigue estando reducida en 20 o 30 años9. En este contexto, esta revisión pretende constituir una herramienta para la asistencia a pacientes con nefropatía falciforme.
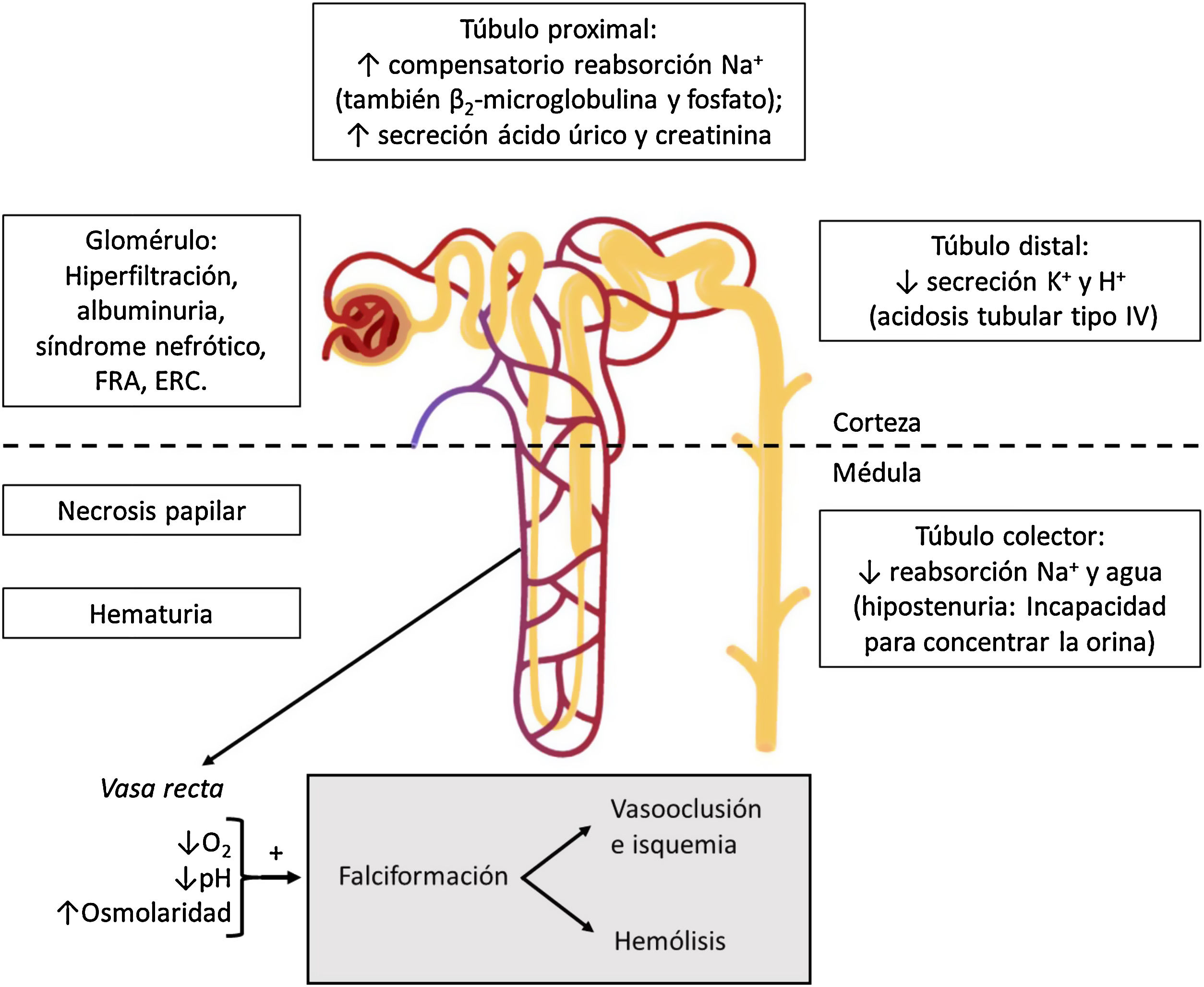
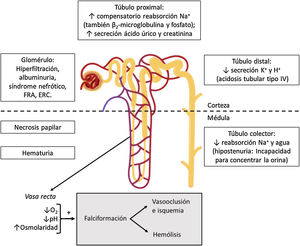
Manifestaciones clínicasHipostenuriaLa hipostenuria se define como la incapacidad para concentrar la orina más de 450mOsm/kg en condiciones de deprivación hídrica, y es un hallazgo universal en la EF12. Aparece en la infancia temprana y es irreversible hacia los 15 años de edad en individuos con genotipo S/S o S/β0-talasemia13. Se presenta en torno a los 10 años en individuos con rasgo falciforme14.
El ambiente de la médula renal, crítico para la reabsorción de agua y solutos, es ideal también para la falciformación (fig. 2). Su presión parcial de oxígeno de 35-40mmHg está por debajo del umbral de falciformación (45mmHg); su elevada osmolaridad deshidrata los hematíes y concentra la Hb S; y su pH ácido disminuye la afinidad de la Hb por el oxígeno (efecto Bohr)15. Por ello, la falciformación se produce inicialmente en los vasa recta medulares, cuya obliteración hace que el sodio reabsorbido del tubo colector no pueda ser lavado por la circulación, impidiendo la reabsorción de agua libre y conduciendo a la congestión medular. Con el tiempo, ciclos repetidos de isquemia e infarto dan lugar a la destrucción de los vasa recta, formación de colaterales, y pérdida de las asas de Henle más largas que descienden en la médula interna y en la papila y que derivan de las nefronas yuxtamedulares. Sin embargo, la capacidad de dilución urinaria se mantiene intacta, ya que depende esencialmente de las nefronas corticales, que tienen asas de Henle más cortas que no llegan más allá de la médula externa y que están irrigadas por los capilares peritubulares13,15.
La hipostenuria a menudo se manifiesta en forma de enuresis nocturna, poliuria, y aumento del riesgo de deshidratación en caso de ingesta hídrica insuficiente o incremento de las pérdidas extrarrenales, favoreciendo la aparición de crisis vasooclusivas. Por ello, se recomienda una ingesta líquida de 3-4l/día en los pacientes con enfermedad falciforme7. El grado de hipostenuria es proporcional a la concentración de Hb S y, en niños pequeños, el tratamiento con hidroxiurea durante 24 meses se asoció con una mayor capacidad de concentración urinaria frente al tratamiento con placebo16.
Acidosis tubularEn pacientes con EF puede existir un defecto en la secreción distal de hidrogeniones y potasio, dando lugar a una acidosis tubular renal tipo IV (acidosis tubular renal distal con hiperpotasemia) incompleta, que acompaña a la hipostenuria. Aunque se desconoce el mecanismo etiopatogénico exacto, puede deberse a una reducción en el gradiente electroquímico en los túbulos colectores, debido a la alteración del flujo sanguíneo medular y la hipoxia secundaria. Como el daño principal ocurre en el segmento más profundo del asa de Henle, es muy raro que exista un defecto severo de la acidificación urinaria y por ello la acidosis es incompleta. La hiperpotasemia es rara y leve, a no ser que concurran otras circunstancias que afecten a los mecanismos compensatorios renales, como la administración de fármacos bloqueantes del sistema renina-angiotensina-aldosterona (inhibidores de la enzima convertidora de angiotensina [IECA] o antagonistas de la angiotensina II [ARA-II]), diuréticos ahorradores de potasio, o beta-bloqueantes, aporte excesivo de potasio, rabdomiólisis o insuficiencia renal15.
Hematuria y necrosis papilar renalLa hematuria es común en pacientes con EF, y su prevalencia podría ser aproximadamente el doble en personas con rasgo falciforme17. Puede presentarse a cualquier edad. Puede ser microscópica o, más a menudo, macroscópica y autolimitada. Se debe a eventos vasooclusivos y microinfartos que afectan a las papilas renales. Frecuentemente es unilateral y procede del riñón izquierdo, presumiblemente por motivos anatómicos: la vena renal izquierda es más larga y queda comprimida entre la aorta y la arteria mesentérica superior (fenómeno del cascanueces), de manera que está sometida a una mayor presión venosa que aumenta la hipoxia relativa en la médula renal, lo que favorece la falciformación12,15. Ocasionalmente, estos infartos pueden ser extensos, causando necrosis papilar renal (NPR), cuya prevalencia se estima en el 30-40% de los pacientes homocigotos (Hb S/S). Su presentación clínica varía desde hematuria macroscópica asintomática (no siempre presente) hasta un cuadro agudo acompañado de dolor, fiebre e incluso fracaso renal agudo obstructivo con hidronefrosis15.
La NPR puede diagnosticarse mediante ecografía renal, aunque la urografía por tomografía computarizada (TC) es más sensible y puede ser necesaria para confirmar el diagnóstico7, siempre utilizando medidas profilácticas frente a la nefrotoxicidad por contrastes yodados, fundamentalmente expansión de volumen. En la ecografía, el hallazgo más precoz de la NPR es una ecogenicidad aumentada de las pirámides medulares (la zona medular más interna), lo que en ausencia de hipercalciuria en un paciente con EF y hematuria sugiere NPR. Posteriormente, puede objetivarse la calcificación de las pirámides medulares con un patrón típico de sombra «en guirnalda» que rodea la pelvis renal, o defecto de ecogenicidad en alguna pirámide por desprendimiento de la papila15.
En casos de hematuria macroscópica, puede ser aconsejable mantener una diuresis forzada a 4l/1,73m2 mediante hidratación, preferiblemente con sueros hipotónicos, y el uso de diuréticos tiazídicos o del asa. Esta medida disminuirá la osmolaridad medular y podría aminorar la falciformación en los vasa recta, así como ayudar a eliminar los coágulos de la vía urinaria. Se debe evitar la expansión de volumen con suero fisiológico, ya que sería inefectiva para disminuir la osmolaridad plasmática. La alcalinización de la orina podría resultar potencialmente útil para aumentar la afinidad de la Hb por el O2 y reducir la falciformación, además de disminuir la toxicidad tubular de la hemoglobinuria. El reposo en cama también puede ser apropiado para evitar el desprendimiento de los microtrombos15.
Como en otras complicaciones graves, o que no responden a otros tratamientos, puede utilizarse la transfusión de hematíes, simple o en forma de recambio eritrocitario, ya que disminuye de forma rápida la proporción de Hb S. Esta opción debe ser valorada cuidadosamente, pues no está exenta de riesgos. La transfusión simple también puede estar indicada si la hemorragia ha sido importante. La desmopresina ha sido utilizada con éxito en algunos pacientes con hematuria grave o refractaria. Esta molécula podría actuar a varios niveles: 1) disminuyendo la osmolaridad plasmática, aumentando así la hidratación de los hematíes y disminuyendo la concentración de Hb S y su falciformación o 2) promoviendo la coagulación por medio del aumento de los niveles de factor VIII y factor de von Willebrand hasta niveles suprafisiológicos18. En esta línea, cuando otras medidas han fracasado, también se ha descrito el uso de agentes antifibrinolíticos, como el ácido tranexámico o el ácido ɛ-aminocaproico, a una dosis baja y con precaución por el riesgo de trombosis19.En casos aislados podría requerirse la embolización selectiva del segmento renal afectado20. No es recomendable la nefrectomía unilateral, por el riesgo de recurrencia en el otro riñón. En casos de hematuria persistente puede ser necesaria la reposición de hierro.
HiperfiltraciónLa hiperfiltración o aumento del filtrado glomerular (FG) (>130ml/min/1,73m2 en mujeres y >140ml/min/1,73m2 en varones) típicamente precede a la albuminuria en pacientes con EF, y puede estar presente desde la infancia temprana. En un estudio en pacientes adultos homocigotos, aproximadamente la mitad de los sujetos menores de 40 años presentaba hiperfiltración, en la mitad de los cuales se asociaba con albuminuria21.
El flujo plasmático renal está aumentado, incluso más que el FG, por lo que la fracción de filtración está disminuida en los pacientes con EF respecto a sujetos sanos. Este hecho podría reflejar la pérdida selectiva de nefronas yuxtamedulares, que presentan una fracción de filtración más elevada que las nefronas corticales. La hiperperfusión renal no se explica por el aumento en el flujo cardíaco debido a la anemia, ya que no se revierte mediante transfusiones repetidas de hematíes. Además, otras condiciones que asocian anemia crónica no producen habitualmente hiperperfusión renal. Probablemente se relaciona con la liberación en la médula renal, como resultado de la isquemia, de sustancias vasodilatadoras, como las prostaglandinas, que reducen la resistencia vascular renal y aumentan el flujo renal. La inhibición de la síntesis de prostaglandinas con indometacina se ha asociado a una reducción en el FG. De este modo, el riñón ejemplifica, en un único órgano, la «paradoja de la perfusión» que ocurre en la EF: la hipoperfusión es endémica en los lechos microvasculares debido a la vasooclusión por la Hb S, mientras que la hiperperfusión caracteriza la circulación sistémica y algunos circuitos regionales. No se conoce el papel del óxido nítrico (ON) en este proceso. Sin embargo, como resultado de la hemólisis intravascular se libera a la circulación Hb y grupo hemo, los cuales son quelantes del ON, lo que explicaría el defecto o resistencia al ON que caracteriza la EF. En la EF, se ha observado un aumento de la expresión renal de la enzima hemo oxigenasa-1 (HO-1). La HO-1 cataboliza al grupo hemo que se acumula en el riñón como consecuencia de la hemólisis intravascular, disminuyendo el estrés oxidativo y liberando monóxido de carbono (CO), el cual tiene propiedades vasodilatadoras y podría contrarrestar la vasoconstricción inducida por el grupo hemo13,22.
Por último, es importante señalar que la hiperfiltración en la EF no solo se asocia con cambios hemodinámicos, sino que también aumenta el coeficiente de filtración glomerular (Kf). El Kf es el producto de la superficie total de filtrado y la permeabilidad hidráulica de la pared capilar glomerular. Por tanto, su aumento podría reflejar al menos un aumento en la superficie de filtración debido a la hipertrofia glomerular, que es un rasgo de la EF y que, en modelos de la enfermedad, acompaña al aumento del flujo plasmático glomerular y de la presión intraglomerular13.
Función tubular proximal aumentadaEl aumento del FG se relaciona con un aumento adaptativo de la función tubular proximal, aumentando la reabsorción de sodio. También se ha descrito un aumento de la reabsorción de β2-microglobulina y fosfato (puede existir hiperfosfatemia, sobre todo si se produce una sobrecarga de fosfato, como sucede en la hemólisis), así como una mayor secreción de ácido úrico y creatinina, y un aumento del transporte máximo de ácido para-amino hipúrico13. A su vez, el aumento de la reabsorción de sodio aumenta el consumo de oxígeno, lo que predispone al daño tubular debido a un mayor estrés oxidativo. Además, el mayor consumo de oxígeno exacerbará la hipoxia y favorecerá la falciformación, agravando la lesión renal13.
ProteinuriaLos cambios hemodinámicos previamente descritos pueden dañar el endotelio glomerular y a los podocitos, causando así proteinuria14,23, que produce subsecuentemente daño en el compartimento tubulointersticial13. El daño en los podocitos da lugar a adhesiones focales al epitelio parietal24. Estas adhesiones causan glomeruloesclerosis focal y segmentaria, que es la glomerulopatía más frecuente en la EF, referida hasta en un 39% de las biopsias renales realizadas a pacientes con EF y proteinuria y/o insuficiencia renal. Otros patrones histológicos como la glomerulonefritis membranoproliferativa y la microangiopatía trombótica son menos frecuentes. La hipertrofia de los glomérulos y los depósitos de hemosiderina en las células tubulares son hallazgos casi universales25.
La albuminuria está presente hasta en el 27% de los pacientes en las 3 primeras décadas de vida, y hasta en el 68% de los pacientes mayores26. Sin embargo, la presencia de proteinuria en rango nefrótico es rara y se presenta solo en el 4% de los pacientes con EF27. La albuminuria >500mg/g de creatinina se asoció con progresión a enfermedad renal crónica (ERC) en un estudio llevado a cabo durante 5 años en 98 pacientes28.
El tratamiento con IECA o ARA-II se recomienda iniciarlo en niños y adultos con EF y albuminuria >100mg/mmol (884mg/g)12. En un ensayo clínico aleatorizado con 22 pacientes y 7 estudios observacionales con 114 pacientes en total, se observó una reducción en la albuminuria en el 72,8% de los sujetos tratados; la mayoría de los sujetos presentaba albuminuria grave. Sin embargo, no está claro el efecto de estos fármacos en la prevención de ERC. La dosis debe ajustarse si el FG es <45ml/min/1,73m2. Dado que los enfermos con EF tienen un riesgo aumentado de desarrollar hipercaliemia, se debe controlar el FG y el potasio sérico a la semana de tratamiento y antes de aumentar la dosis, debiendo suspenderse durante procesos agudos o antes de intervenciones quirúrgicas, administración de radiocontrastes o preparaciones para endoscopias29. Como muchos pacientes tienen una presión arterial baja o normal, pueden producir hipotensión postural, por lo que puede resultar beneficioso su toma a la hora de dormir12.
Reducción de la tensión arterialEn 2014, un metaanálisis concluyó que los individuos con genotipo Hb S/S tienen una tensión arterial diastólica, sistólica y media significativamente más baja que controles sanos de la misma edad y sexo (−8,37, −2,32 y −8,41mmHg, respectivamente)29. Este hecho podría estar relacionado con el defecto de concentración urinaria, y en pacientes con anemia falciforme la albuminuria ≥300mg/g creatinina y la insuficiencia renal parecen asociarse a resistencia a desarrollar hipertensión arterial (HTA)30. Un estudio con 163 pacientes sugiere que una tensión arterial sistólica (TAS) entre 120 y 139mmHg o una diastólica (TAD) entre 70 y 89mmHg definen una categoría de HTA relativa en EF, que se asocia con un riesgo aumentado de hipertensión pulmonar (HP) y disfunción renal31. En base a los beneficios en la población general, se recomienda mantener la TA≤130/80mmHg29.
Fracaso renal agudoEl fracaso renal agudo ocurre entre el 4-10% de los pacientes con EF ingresados, siendo más frecuente en aquellos pacientes con síndrome torácico agudo (13,6% si es grave y asociado a con hipertensión pulmonar, lo que sugiere un papel de la congestión venosa) que en pacientes con crisis dolorosas óseas (2,3%)32,33. Durante las crisis de dolor vasooclusivo se ha observado una reducción reversible del 15% en el aclaramiento de creatinina34. La depleción de volumen, la rabdomiólisis, las infecciones o el uso de analgésicos no esteroideos, predisponen al fracaso renal agudo13. Asimismo, en la EF a menudo se produce sobrecarga de hierro y se requiere de tratamiento con quelantes; el agente más utilizado es el deferasirox. Este fármaco puede producir un aumento reversible en la creatinina sérica de forma dosis-dependiente, por lo que ante pequeños aumentos de creatinina debe valorarse disminuir la dosis.
Enfermedad renal crónicaEn un estudio llevado a cabo en 410 pacientes de entre 2 y 21 años con EF, el 26,5% presentaban ERC; estadio 1: 14,5% y estadio 2: 11,6%)35. En otro estudio, el 10,5% de las muertes en pacientes adultos con EF se debió a ERC36. En pacientes homocigotos mayores de 60 años, la ERC fue el principal factor contribuyente a la mortalidad en el 43% de los casos37.
La hidroxiurea, el único fármaco aprobado en nuestro país para la EF, se metaboliza en el riñón, por lo que la dosis debe ajustarse a la función renal. También, se elimina mediante hemodiálisis, por lo que debe tomarse tras dicho procedimiento. Cuando la ERC progresa, los abordajes terapéuticos clásicos presentan algunas peculiaridades que se comentan a continuación:
Análogos de la eritropoyetinaA medida que el FG cae, disminuye la producción de eritropoyetina y empeora la anemia. En estos casos, aunque con escasa evidencia, se recomienda el uso de análogos de la eritropoyetina en asociación con hidroxiurea12,29. Estos pacientes, a menudo requieren dosis superiores a las generalmente utilizadas. La cifra de Hb no debe exceder los 10g/dl debido al riesgo de promover crisis vasooclusivas y otros fenómenos trombóticos por hiperviscosidad, aunque raramente se consigue alcanzar estas cifras de Hb, y la mayoría de pacientes requiere de transfusiones periódicas cuando progresan a enfermedad renal terminal12.
DiálisisUn estudio que incluyó 397 pacientes con nefropatía falciforme en diálisis reveló que la edad media de inicio era mucho menor en los pacientes con EF (40 frente a 60 años), y que la EF era un factor de riesgo independiente de muerte, mayor que la diabetes, pero que dejaba de serlo tras el trasplante renal38.
La hemodiálisis presenta la ventaja de ofrecer una vía para las transfusiones en los pacientes que las requieren, aspecto a considerar a la hora de elegir la técnica de diálisis, puesto que los pacientes con EF tienen a menudo malos accesos periféricos. Tanto la EF como la hemodiálisis son factores de riesgo para la HP, por lo que se recomienda una valoración previa. En muchos casos, la diálisis peritoneal suele ser la técnica de elección porque permite una mejor tolerancia de la ultrafiltración.
Trasplante renalEn pacientes con EF, la supervivencia media a los 6 años postrasplante es del 70%39, y debe considerarse en todos los pacientes con enfermedad renal terminal29. El tratamiento mediante recambios eritrocitarios regulares debería considerarse una vez que el paciente ha sido incluido en lista de espera (o bien unos meses antes del trasplante de donante vivo) y continuarse durante la vida del injerto. La complicación grave más frecuente del trasplante es la sepsis, cuyo riesgo está aumentado por la hipoasplenia o asplenia funcional, por lo que algunos autores postulan evitar el uso de globulina antitimocito para el tratamiento del rechazo del injerto12.
Consideraciones diagnósticasNo existe consenso acerca de las determinaciones que deben solicitarse para el cribado de nefropatía falciforme ni sobre la periodicidad de las mismas. Sin embargo, se recomienda evaluar la función renal al menos anualmente desde los 10 años de edad8,29, aunque podría resultar útil hacerlo más tempranamente29. En cuanto a las determinaciones, sería recomendable examinar la orina de la primera micción de la mañana mediante tira urinaria y determinar, tanto en sangre como en orina, sodio, potasio, creatinina, osmolalidad, albúmina y proteínas totales, incluyendo el cálculo de los índices urinarios proteína/creatinina y albúmina/creatinina, así como cistatina C y bicarbonato en sangre (venosa). La albuminuria debe confirmarse en la orina de primera hora o bien en dos muestras consecutivas a cualquier hora29.
El FG estimado a partir de la creatinina mediante la ecuación CKD-EPI en adultos o mediante la fórmula de Schwartz en niños, puede estar sobreestimado debido a la hiperfiltración y el aumento de la secreción de creatinina en el túbulo proximal40. Por ello, deben considerarse más bien los cambios en la creatinina sérica o en el FG estimado que sus valores absolutos8. La cistatina C sérica, que es filtrada libremente en el glomérulo y no es secretada por los túbulos renales, ha demostrado ser un marcador de la función renal más preciso que la creatinina y podría detectar un defecto en el FG más precozmente, pero su uso rutinario no ha sido validado. Además, las personas con EF tienden a tener menor masa magra, y la cistatina C parece no asociarse, o al menos mucho menos que la creatinina, a la masa muscular41.
La utilidad de la β2-microglobulina como marcador de disfunción tubular proximal en EF no ha sido bien estudiada y, en un estudio longitudinal retrospectivo, sus niveles no difirieron significativamente en 120 niños con y sin albuminuria42.
Un abordaje planteado consiste en derivar a Nefrología a los pacientes que presenten una ratio proteína-creatinina >50mg/mmol (442mg/g), hematuria microscópica persistente, una caída anual >10% en el FG estimado, o un FG estimado <60ml/min/1,73m212. Es necesario que el especialista en Nefrología esté familiarizado con las manifestaciones de la EF, y en este sentido puede ser recomendable que un único especialista aglutine los casos en cada centro. Otras causas de proteinuria o hematuria deben ser valoradas. La utilidad de la biopsia renal no ha sido evaluada, y la decisión debe ser individualizada, aunque debería realizarse en los casos de síndrome nefrótico12.
Modificadores genéticos de la nefropatía falciformeComo en otras manifestaciones de la EF, el genotipo es un importante modificador de la prevalencia y la gravedad de la nefropatía falciforme. Así, la nefropatía falciforme es más grave en las formas que asocian una mayor cantidad de Hb S y hemólisis (Hb S/S y Hb S/β0-talasemia), mientras que es más leve en las formas heterocigotas compuestas Hb S/C y Hb S/β+-talasemia)13,43. La coexistencia de deleciones que afectan a los genes de globina α (rasgo α-talasémico) se asocia en el rasgo falciforme con niveles más bajos de Hb S, y protege de la hipostenuria44; en la anemia falciforme, disminuye la prevalencia de macroalbuminuria45.
Tal y como se comentó anteriormente, la Hb F interfiere con la polimerización de la Hb S. En ausencia de tratamiento con hidroxiurea, los niveles de Hb F difieren entre el 5 y el 20% según los haplotipos ligados a la Hb S y con relación a determinados polimorfismos14. Así, algunos polimorfismos en el gen de la miosina 9 (MYH9), apolipoproteína L1 (APOL1), receptor de proteína morfogenética ósea tipo 1B (BMPR1B) o en la hemo oxigenasa-1 (HMOX1) se han asociado a un mayor riesgo de albuminuria, disminución del FG o progresión a ERC14.
Alteraciones renales en el rasgo falciformeLos individuos con rasgo falciforme son portadores de un único alelo afecto por la mutación de la hemoglobinopatía S, mientras que el otro alelo es normal. Según se ha observado mediante microangiografía renal, presentan distorsión y destrucción de los vasa recta, aunque considerablemente menos que los pacientes con EF46. Sin embargo, de acuerdo con un metaanálisis publicado en 2018, la hematuria es 2 veces más frecuente que en la EF17. Este hecho podría ser debido a la mayor prevalencia del rasgo falciforme, y al mayor hematocrito de estos individuos portadores respecto a los enfermos. En este mismo estudio también se observó un mayor riesgo de presentar proteinuria y ERC en los individuos portadores respecto a la población general. Por ello, resulta razonable estudiar la función renal en individuos con rasgo falciforme si presentan otros factores de riesgo de ERC, como diabetes o hipertensión17. Finalmente, es importante señalar que el carcinoma medular renal se ha descrito casi exclusivamente en personas con rasgo falciforme, aunque también puede ocurrir en individuos con EF. El carcinoma medular renal es una entidad rara, de muy mal pronóstico y que suele presentarse en la edad adulta temprana, en forma de hematuria macroscópica, dolor en flanco y pérdida de peso. En la ecografía puede observarse como un quiste, y este hallazgo debe valorarse mediante TC con contraste o resonancia magnética47.
Nuevos mecanismos implicados en el daño renalLa hemólisis que acontece en pacientes con EF provoca la liberación masiva de Hb y grupo hemo, los cuales atraviesan la barrera de filtración glomerular y se acumulan en las células tubulares proximales, principalmente. En estas células, tanto la Hb como el grupo hemo promueven varios efectos adversos, como daño mitocondrial, inflamación, fibrosis, estrés oxidativo y apoptosis48. El grupo hemo y la Hb dan lugar a especies reactivas de oxígeno que generan peroxidación lipídica, daño al ADN e inflamación49. En este sentido, se ha descrito que el grupo hemo es capaz de inducir de forma directa la respuesta inflamatoria en ratones con EF a través de su unión al receptor tipo-Toll 4, presente en células endoteliales, mesangiales, tubulares, y en podocitos, y posterior activación del factor de transcripción NF-kB50. Además, como se ha comentado, el grupo hemo actúa como potente agente vasoconstrictor, ya que se une al óxido nítrico e impide su acción vasodilatadora, tanto a nivel sistémico como renal51.
La Hb y el grupo hemo son transportados al hígado por la haptoglobina y hemopexina, respectivamente, donde son degradados por la hemo oxigenasa-1. En la EF existe un déficit adquirido de haptoglobina y hemopexina debido a la hemólisis crónica52. Sin embargo, el grupo hemo también es eliminado a través de la barrera glomerular unido a la α-1-microglobulina (A1M). Tanto en humanos como en ratones con EF se ha descrito recientemente un aumento compensatorio en A1M de hasta 10 veces en la ratio A1M-hemopexina, asociado a marcadores de hemólisis y de daño tubular (KIM-1, de Kidney Injury Molecule-1 y NGAL, neutrophil gelatinase-associated lipocalin)53. La administración de hemopexina y haptoglobina disminuye el daño renal en modelos experimentales de EF52,53.
Aunque las células tubulares se han considerado tradicionalmente como las únicas dianas celulares de los efectos adversos de la Hb en el riñón, datos obtenidos por nuestro grupo muestran que los podocitos pueden capturar la Hb, lo que altera su viabilidad y funcionalidad. En los podocitos, la Hb aumenta la producción de especies reactivas de oxígeno e induce apoptosis, tanto in vitro como en modelos experimentales de hemólisis intravascular y según se ha observado a partir de biopsias de pacientes con otros desórdenes que cursan con hemólisis intravascular (síndrome hemolítico urémico atípico y hemoglobinuria paroxística nocturna)54. Sin embargo, se desconoce si este mecanismo de daño también está presente en pacientes con EF. Por otro lado, los efectos nocivos mediados por Hb sobre podocitos o células tubulares se redujeron activando Nrf2 (Nuclear erythroid 2-related factor 2), un factor de transcripción que incrementa la respuesta antioxidante y antiinflamatoria54,55. Diversos inductores de Nrf2 han demostrado eficacia en diferentes modelos de enfermedad renal debido a su capacidad para reducir el estrés oxidativo y la inflamación56. Por lo tanto, sería interesante analizar su efecto en pacientes con EF ya que podría ofrecer una alternativa terapéutica en nefropatía falciforme.
Perspectiva futuraLa creciente presencia de la EF en nuestro país exige un mayor conocimiento de la misma por parte de los profesionales sanitarios. Las manifestaciones renales se sitúan entre las más frecuentes y graves en la enfermedad falciforme, y se extienden al rasgo falciforme. Es necesario profundizar en el conocimiento de su fisiopatología para poder desarrollar opciones terapéuticas específicas que se adecúen a la heterogeneidad de la afectación renal y a las relaciones entre los diferentes procesos que en ella coexisten. Se requiere disponer de biomarcadores que permitan estratificar a los pacientes en función del riesgo de progresar a ERC y llevar a cabo intervenciones terapéuticas tempranas y más eficaces. Aunque en los últimos años se han desarrollado nuevos tratamientos para paliar la enfermedad a nivel sistémico, es necesario analizar el efecto que tendrán sobre la afectación renal.
FinanciaciónEste trabajo ha sido financiado por el Instituto de Salud Carlos III (ISCIII)/FEDER (PI17/00130, PI17/01495, PI20/00375, PI20/00487 y SAF2015-63696-R), Ministerio de Economía y competitividad (RTI2018-098788-B-100, DTS17/00203, DTS19/00093 y RYC-2017-22369), Sociedad Española de Nefrología (SEN), Centro de Investigación Biomédica en Red de Diabetes y Enfermedades Metabólicas Asociadas (CIBERDEM) y Cardiovasculares (CIBERCV).
Conflictos de interesesLos autores declaran no tener ningún conflicto de intereses.