INTRODUCCIÓN
En trasplante renal (TR), la importancia de los anticuerpos antiantígenos leucocitarios humanos (anti-HLA por sus siglas en inglés, anti-human leukocyte antigen) dirigidos frente al donante quedó patente hace casi 50 años, cuando Patel y Terasaki mostraron las consecuencias de trasplantarse con una prueba cruzada positiva1. El impacto de los anticuerpos donante específicos (ADE) pretrasplante en la supervivencia del injerto ha sido bien descrito en la literatura y caracterizar a los pacientes en función de su riesgo inmunológico, cuyo mayor peso recae en la presencia de anticuerpos anti-HLA circulantes, ha sido la práctica habitual de las unidades de trasplante.
Sin embargo, a pesar de que desde los años ochenta se sugiere la importancia de los anticuerpos formados postrasplante2 y desde los noventa varios estudios demuestran una sólida relación entre la detección precoz de ADE y la existencia de una forma de rechazo agudo especialmente severa3-5, su monitorización a medio y largo plazo no está extendida ni protocolizada. Esto puede deberse a tres ra-zones fundamentalmente: el peso del rechazo agudo celular en las primeras épocas, la falta de técnicas sensibles, específicas y coste-efectivas para su determinación, y la ausencia de tratamientos específicos contra el daño humoral crónico clínico, patología con la que se asocian con frecuencia estos anticuerpos circulantes.
Con el desarrollo de las técnicas de fase sólida para la determinación de anticuerpos en suero, en los últimos años hemos asistido a una importante expansión de la investigación en este campo: desde la descripción de la simple existencia de estos anticuerpos de novo y su potencial impacto en el injerto renal, hasta las tendencias más actuales que intentan determinar cuáles de estos anticuerpos son real-mente determinantes en la disfunción renal.
Otras técnicas para monitorizar la respuesta inmunológica postrasplante han sido investigadas o están en desarrollo, aunque su uso está incluso menos extendido.
El objetivo de este documento de consenso es dilucidar si la monitorización inmunológica postrasplante renal tiene impacto clínico, cuestión difícil de resolver teniendo en cuenta que se desconocen las medidas terapéuticas eficaces que pueden aplicarse como consecuencia de esta monitorización.
MONITORIZACIÓN DE ANTICUERPOS HLA Y NO HLA
Definición, frecuencia, momento de aparición e impacto en la supervivencia del injerto de los anticuerpos anti-HLA
Los ADE dirigidos frente a antígenos del donante más estudiados son los anticuerpos anti-HLA, que pueden estar presentes pretrasplante o aparecer de novo en cualquier momento tras el TR. Para que estos ADE puedan considerarse de novo es importante un estudio pretrasplante adecuado, con técnicas suficientemente sensibles. En la era de la detección de anticuerpos mediante técnicas basadas en la citotoxicidad, probablemente pasaban desapercibidos ADE presentes en el momento del trasplante. Desde la generalización del uso de técnicas de fase sólida para la detección de los anticuerpos anti-HLA, varios trabajos han documentado la incidencia de aparición de estos anticuerpos de novo postrasplante6-17 (tabla 1). La variabilidad en la incidencia de los ADE de novo (del 2% hasta casi el 20% en el primer año postrasplante) depende de diversos factores, como el riesgo inmunológico del paciente, el tipo de inmunosupresión recibida, la frecuencia de monitorización pretrasplante, la técnica de detección (análisis de inmunoabsorción ligada a enzimas [ELISA por sus siglas en inglés, enzyme linked immunosorbent assay], prácticamente abandonada, o Luminex), las variaciones de la técnica (diversos kits comerciales, procedimientos diferentes entre laboratorios), el punto de corte en la intensidad media de fluorescencia (MFI por sus siglas en inglés, median fluorescence intensity) escogido para definirlo como ADE, el tipo de valor empleado para su valoración (MFI cruda o normalizada) o los antígenos conocidos del donante (tipajes C, DQ-B, DQ-A y DP incluidos) (nivel de evidencia alto). Si se define como ADE pretrasplante el que se presenta en estudio de antígeno aislado con un título de MFI superior a
1.000, por ejemplo, la aparición del ADE de novo puede ser muy precoz debido a una respuesta de células B de memoria ante un antígeno conocido al haber infravalorado anticuerpos con MFI bajos9,10,12,14. Sin embargo, si se definen los ADE pretrasplante con MFI bajos, como 500, la aparición de ADE de novo será menos frecuente y más tardía11. En pacientes de bajo riesgo inmunológico y con terapia inmunosupresora consistente en tacrolimus, ácido micofenólico y esteroides, la incidencia de aparición de ADE de novo es del 2-10% al año. Aunque la cinética de aparición es variable, pueden detectarse desde el primer año postrasplante y los más frecuentes son de clase II, particularmente anti-DQ10.
En cuanto a factores asociados a la aparición de ADE de novo, tres estudios encontraron relación directa entre el número de disidentidades HLA entre donante y receptor (especialmente en clase II) y la aparición de anticuerpos tras el TR11,12,18. Otros factores, como los episodios de rechazo agudo19,20, los eventos inflamatorios21,22, el retrasplante13, la no adherencia al tratamiento11, la edad joven y el sexo femenino11,12,18,20, se asocian también al desarrollo de ADE de novo (nivel de evidencia alto). Episodios inflamatorios como un rechazo agudo celular (clínico o subclínico) modifican la expresión de antígenos HLA por parte de las células endoteliales (barrera de protección del injerto; de hecho, un endotelio quiesciente no expresa antígenos HLA de clase II) y potencialmente la consecuente activación T-dependiente de las células B para la producción de anticuerpos. Sin embargo, también es posible que la secuencia temporal sea la inversa, y con la aparición de los ADE de novo se produzca el daño histológico (fundamentalmente inflamación microvascular) y la alteración de la función renal14 (nivel de evidencia bajo).
Las consecuencias de la aparición de ADE de novo no están claramente establecidas. Se ha descrito una mayor incidencia de rechazo agudo (anterior y posterior a la aparición de los anticuerpos) y peor supervivencia del injerto renal en pacientes que desarrollan anticuerpos tras el trasplante9-13,23 (nivel de evidencia alto), siendo este fenómeno más frecuente con anticuerpos frente a antígenos HLA de clase II y en concreto con anti-DQ donante específicos de aparición tardía9-11 (nivel de evidencia moderado). El impacto en la supervivencia del injerto es controvertido y mientras que diversos estudios sugieren que es independiente del rechazo agudo11-13, otros no han podido desvincular el impacto de la presencia del anticuerpo en el suero del propio rechazo, de manera que la influencia de los anticuerpos desaparece en aquellos pacientes que no habían tenido un rechazo7,10. Asimismo, una MFI inicial elevada, el aumento de esta durante los primeros 24 meses postrasplante y la persistencia frente a la desaparición de los ADE de novo también se han asociado a peor función renal15,17,24 (tabla 1) (nivel de evidencia moderado).
Aunque los anticuerpos anti-HLA no donante específicos podrían tener un papel específico en la supervivencia del injerto6, trabajos recientes no confirman estos datos13.
Tipos de anticuerpos anti-HLA
El gran avance que ha supuesto el desarrollo de las técnicas de fase sólida para mejorar la determinación y la caracterización de los anticuerpos anti-HLA tanto pre como postrasplante, está dando paso a estudios cuyo objetivo es determinar cuáles son los anticuerpos con capacidad patogénica.
Diversos estudios han analizado la capacidad de los anticuerpos anti-HLA de fijar complemento en la plataforma Luminex®, tanto pre como postrasplante, para relacionarla con los resultados del TR (rechazo, supervivencia, etc.). Se han utilizado para ello diversas técnicas: el test de fijación del componente C4d en muestras pretrasplante25, el test del componente C1q13 y el test del componente C3d26. En líneas generales, la capacidad de fijar complemento de los anticuerpos anti-HLA de novo postrasplante se asocia a mayor capacidad patogénica de los mismos (nivel de evidencia moderado). El estudio más importante describe una cohorte de más de 1.000 pacientes con TR; los que desarrollaron ADE al año del trasplante presentaron una supervivencia del injerto inferior en comparación con aquellos que no lo hicieron (el 54 frente al 93% a 5 años)13. Sin embargo, este hecho solo se confirmaba si los ADE eran capaces de fijar complemento (C1q), con un riesgo casi cinco veces superior de pérdida del injerto en el análisis multivariante. Es decir, la afinidad por C1q de los anticuerpos se asocia a una peor supervivencia del injerto (nivel de evidencia moderado). Dos hechos relevantes más se extraen de este estudio. Por un lado, los pacientes que presentaban peor supervivencia del injerto son aquellos con ADE C1q negativos en el pretrasplante que se convierten en C1q positivos en el postrasplante y, además, los anticuerpos con las MFI más elevadas son los que presentaban mayor capacidad de fijar complemento (nivel de evidencia moderado). Además de asociarse a peor supervivencia del injerto, la presencia de ADE C1q positivos se relacionó con una mayor incidencia de rechazo agudo, inflamación microvascular y depósito de C4d13. Otros trabajos han reproducido estos hallazgos en cohortes de pacientes más limitadas27-29.
Otro test que mide la capacidad de fijar complemento de los ADE es el test de C3d. La afinidad por C3d de los anticuerpos parece asociarse a peor pronóstico en la supervivencia del injerto, bien en pacientes con rechazo mediado por anticuerpos26, bien en receptores pediátricos no sensibilizados previamente30(nivel de evidencia bajo).
Finalmente, otra característica asociada a la capacidad de fijar complemento y, por tanto, determinante de la patogenicidad de los anticuerpos es el subtipo de inmunoglobulina. Existen cuatro subclases de inmunoglobulina G (IgG), con distintas capacidades de activar complemento: la IgG1 y la IgG3 son más potentes que la IgG2 y la IgG4. Los ADE de novo IgG1 y 3 se han asociado a una peor supervivencia del injerto renal28,31,32 (nivel de evidencia bajo), aunque también existen otros trabajos que han relacionado los ADE isotipo IgM31 o subclase IgG433 con rechazo mediado por anticuerpos y fracaso del injerto. En el mejor de estos estudios, el tipo de ADE IgG3, el nivel de la MFI y la capacidad de fijar C1q se asociaron en un modelo multivariante a pérdida del injerto32.
Inmunosupresión y anticuerpos
Los estudios que analizan la incidencia de aparición de ADE de novo tras el TR presentan una variabilidad importante en cuanto a la inmunosupresión utilizada, tanto de inducción como de mantenimiento. Por consiguiente, establecer qué pauta de inmunosupresión se asocia con la menor incidencia de ADE de novo es difícil, al menos desde un punto de vista empírico.
Los inhibidores de la calcineurina (ICN) redujeron de forma muy significativa la incidencia de rechazo agudo y mejoraron la supervivencia del injerto a corto plazo, superior al 90% en el primer año. Sin embargo, los beneficios a más largo plazo de los ICN se han cuestionado clásicamente debido a su toxicidad. El debate actual se centra en la dicotomía entre la necesidad de una potente inmunosupresión basada en los ICN como la mejor forma potencial de evitar el desarrollo de ADE postrasplante y el rechazo humoral, y el hecho cierto de que la primera causa de pérdida del injerto renal es el fallecimiento del paciente con injerto funcionante, con la necesidad ineludible de reducir el riesgo cardiovascular, las infecciones graves y las neoplasias malignas, favorecidas asimismo por los ICN.
Los inhibidores de la vía de la diana de la rapamicina en mamíferos (m-TOR por sus siglas en inglés, mammalian target of rapamycin), im-TOR, plantean una combinación diferente a la clásica ICN-ácido micofenólico-esteroides. Con estrategias de conversión de los ICN a los im-TOR o con combinaciones ICN + im-TOR, se pretende, por un lado, reducir la toxicidad de los ICN a largo plazo y mejorar el perfil de riesgo cardiovascular, de infecciones y de neoplasias, por otro. La tabla 2 muestra los principales resultados en cuanto al desarrollo de ADE de los estudios de conversión precoz y tardía de los ICN a los im-TOR18,34-38. En cuanto a la conversión precoz a los im-TOR sin ICN (durante el primer año postrasplante, usualmente entre el tercer y cuarto mes), esta se asocia a una mayor aparición de ADE de novo en algunos estudios (nivel de evidencia bajo), siendo solo estadísticamente significativa en el trabajo de Liefeldt et al18. Este estudio presenta sesgos considerables, el más importante de los cuales es que la mayoría de los pacientes convertidos también suspendieron el tratamiento con corticoides39. En cuanto a los estudios de conversión tardía, la aparición de ADE también es más frecuente en los pacientes que se convierten de ICN a im-TOR, nuevamente con tan solo un estudio con significación estadística y todos ellos de diseño retrospectivo. Los ADE pueden no ser de novo, presentándose especialmente en aquellos pacientes con anticuerpos preconversión38 (nivel de evidencia bajo). Por tanto, la conversión a una pauta libre de ICN debería realizarse en pacientes de bajo riesgo inmunológico, sin anticuerpos pretrasplante y con monitorización estrecha de los mismos tras la conversión (nivel de evidencia bajo).
Por otro lado, y aunque con un solo ensayo clínico publicado y prematuramente interrumpido por la tasa de rechazo agudo y desarrollo de ADE de novo en el brazo sin ICN, parece claro que la retirada precoz de ICN (dentro de los 6 primeros meses pos-TR) sin introducción de im-TOR (quedando en régimen ácido micofenólico-esteroides) se asocia a mayor aparición de ADE de novo40(nivel de evidencia moderado-alto).
Anticuerpos no anti-HLA
El impacto de los anticuerpos dirigidos frente a antígenos no HLA en la función y supervivencia del injerto renal no está bien establecido. El hecho de que los gemelos univitelinos HLA idénticos requieran inmunosupresión y la existencia de rechazos agudos de histología compatible con daño mediado por anticuerpos, sin hallazgo en suero de ADE anti-HLA, apoyan la existencia de antígenos no HLA que podrían activar la inmunidad celular y, en consecuencia, la producción de anticuerpos no anti-HLA en el receptor dirigidos contra ellos. No obstante, la falta de técnicas de detección validadas, el posible factor de confusión de la presencia factible de anticuerpos anti-HLA no detectados y la falta de especificidad documentada contra el donante han limitado el avance en esta área.
Los anticuerpos no HLA son llamados en términos generales «anticuerpos anticélulas endoteliales» (AECA por sus siglas en inglés, antiendothelial cell antibodies), ya que el endotelio es la barrera primaria de defensa del trasplante. Estos antígenos pueden ser polimórficos y capaces de provocar alorrespuesta, como las proteínas A y B relacionadas con el complejo mayor de histocompatibilidad I (MICA y MICB) o con limitado polimorfismo (autoanticuerpos) como el receptor 1 de la angiotensina II y muchos otros.
Existen trabajos que relacionan la presencia de anticuerpos anti no HLA con resultados del trasplante como el rechazo agudo y la supervivencia del injerto41-44, mientras que otros no han encontrado asociación independiente45,46. Parece que los pacientes que presentan anticuerpos anti-HLA y no HLA (ambos) muestran peor supervivencia del injerto47(nivel de evidencia bajo). Identificar qué antígenos de las células endoteliales inducen la producción de anticuerpos clínicamente significativos48 o determinar especificidades contra el donante de anticuerpos anti-MIC (complejo mayor de histocompatibilidad I) en pacientes de riesgo49 constituyen objetivos recientes de investigación.
Sin embargo, no existe evidencia suficiente que apoye la monitorización sistemática de anticuerpos anti no HLA postrasplante. Ante el hallazgo histológico de un rechazo mediado por anticuerpos en ausencia de anticuerpos anti-HLA detectables en suero, se debería considerar la búsqueda de anticuerpos no HLA (nivel de evidencia bajo).
Recomendaciones
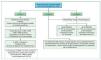
¿Cómo tengo que monitorizar a los pacientes? (figura 1)
Figura 1. ADE: anticuerpo donante específico; HLA: antígenos leucocitarios humanos; IS: inmunosupresión. RMA: rechazo mediado por anticuerpos.
Se recomienda realizar el cribado de los anticuerpos anti-HLA postrasplante mediante una técnica de fase sólida en la plataforma Luminex (nivel de evidencia alto) y si este cribado resulta positivo, se realizará la determinación de antígeno aislado.
En cuanto al punto de corte considerado para la positividad del anticuerpo, cualquier valor de la MFI puede ser positivo respecto al control negativo interno de cada laboratorio, aunque este sea de 450, 600 o 13.000. El punto de corte con impacto clínico no está definido, por lo que es necesario consensuarlo con el Servicio de Inmunología de cada hospital. De modo general, se considerará positivo un anticuerpo si la MFI es mayor a 1.000-1.500, siendo el significado dudoso si la MFI se encuentra entre 500 y 1.000 (nivel de evidencia bajo).
Ante el hallazgo de un ADE postrasplante, se sugiere realizar una técnica complementaria de fijación de complemento (mediante el test de C1q o de C3d) si está disponible en el hospital, ya que podría ayudar a la toma de decisiones clínicas (nivel de evidencia bajo).
Ante el hallazgo de un ADE de novo, se valorará la realización de una biopsia renal, aunque este no se acompañe de deterioro de la función renal o proteinuria (nivel de evidencia bajo).
Ante la presencia de lesiones histológicas sugestivas en gran medida de ser mediadas por anticuerpos, pero con anticuerpos anti-HLA circulantes no detectables por técnicas de fase sólida, se valorará la búsqueda de anticuerpos no HLA como anticuerpos antiendotelio (MICA, MICB, anticuerpos anti-AT1R) (nivel de evidencia bajo).
¿Cuándo y a quién debo monitorizar? (figura 1)
Durante el estudio pretrasplante debe estratificarse el riesgo inmunológico de los pacientes en lista de espera y realizarse monitorización de los anticuerpos anti-HLA postrasplante de acuerdo con este riesgo:
– En pacientes de bajo riesgo inmunológico (primer TR sin anticuerpos anti-HLA pretrasplante) se recomiendan dos evaluaciones, durante los primeros 6 meses y a los 12-18 meses postrasplante.
– En pacientes de alto riesgo inmunológico (retrasplante o presencia de anticuerpos anti-HLA pretrasplante) se recomienda aumentar la frecuencia de determinación de los ADE.
Asimismo, se recomienda la determinación de anticuerpos anti-HLA o el aumento en la frecuencia de determinación de los mismos ante las siguientes situaciones:
– Complicaciones inmunológicas del injerto: disfunción del injerto, rechazo agudo –antes y después del tratamiento–.
– Cambios o inestabilidad en la inmunosupresión: planteamiento de cambio de inmunosupresión –incluyendo retirada de esteroides, determinando anticuerpos antes y después–, niveles erráticos de inmunosupresión o sospecha de no adherencia.
– Realización de una biopsia del injerto de «protocolo».
La necesidad de una monitorización estrecha del desarrollo de anti-HLA de novo debe relativizarse teniendo en cuenta la ausencia de una actitud terapéutica eficaz que pueda revertir o controlar su impacto a posteriori.
MONITORIZACIÓN DE LA RESPUESTA T
Con la introducción de los ICN, y más aún combinados con potentes antiproliferativos, el rechazo agudo mediado por células T ha experimentado un descenso del 40% al 10-15% durante el primer año postrasplante50. Las pérdidas inmunológicas de los injertos se deben fundamentalmente a un daño crónico mediado por anticuerpos, bien preformados o bien desarrollados postrasplante, en el que el peso de la célula T parece, al menos hasta ahora, menor51.
Sin embargo, siendo la célula T el principal mediador del rechazo agudo y considerando la baja incidencia actual del mismo, la monitorización de su alorreactividad postrasplante podría abrir la puerta del control sobre un exceso o un defecto de la inmunosupresión que aplicamos a nuestros pacientes y conducirnos hasta la deseada inmunosupresión «a la carta». Entre las técnicas disponibles para determinar esta alorreactividad, las más ampliamente utilizadas son la caracterización fenotípica de las subpoblaciones linfocitarias T mediante la citometría de flujo y la determinación de la liberación de trifosfato de adenosina (ATP por sus siglas en inglés, adenosine triphosphate), con el método Immuknow, o la secreción de citocinas (con un inmunospot ligado a enzimas [ELISpot por su denominación en inglés, enzyme-linked immunospot]) por parte del linfocito T52.
Immuknow
El Immuknow® (Cylex Ltd., Estados Unidos) es un test aprobado en 2002 por la United States Food and Drug Administration (FDA) que fue desarrollado como biomarcador de dosis de inmunosupresión. Se trata de un test que mide la liberación de ATP por parte del linfocito T cuando este se expone a un estímulo no específico53. En teoría, los valores de ATP medido serán más altos si el linfocito T está poco inhibido por la inmunosupresión y serán más bajos en el contexto de sobreinmunosupresión. Numerosos estudios, la mayoría de naturaleza retrospectiva, han asociado valores altos de ATP con rechazo agudo y valores bajos con infecciones oportunistas en el paciente trasplantado54-57 (nivel de evidencia bajo). No obstante, el estudio con mayor número de pacientes publicado hasta la fecha58 y un metaanálisis sobre todos los estudios publicados59 no encontraron asociación entre el Immuknow y la capacidad predictiva de rechazo agudo (infrainmunosupresión) o infecciones (sobreinmunosupresión), por lo que no se recomienda la monitorización sistemática de la respuesta de la célula T postrasplante mediante este test.
ELISpot T
El ELISpot de interferón gamma (IFN-γ) o ELISpot T es una técnica validada, con un valor predictivo negativo alto, que permite identificar frecuencias de células T circulantes de memoria reactivas frente a antígenos del donante60-65 (nivel de evidencia alto). Los linfocitos presentes en la sangre periférica del receptor son incubados y enfrentados durante 18-24 horas a antígenos de células del donante, de modo que se permite que se produzca el alorreconocimiento y la consecuente liberación de citocinas, que es lo que finalmente mide el test63. En el postrasplante, existen varios estudios que han correlacionado el ELISpot T con el rechazo agudo y la función del injerto62,64,65.
No obstante, a falta de estudios prospectivos aleatorizados, no existe suficiente evidencia para recomendar realizar sistemáticamente un ELISpot T a los pacientes trasplantados para monitorizar la respuesta alogénica celular.
MONITORIZACIÓN DE LA RESPUESTA B
Si la monitorización de la respuesta celular T se encuentra en una fase preliminar que dificulta tomar decisiones diagnóstico-terapéuticas basadas en ella, aún más experimental es el estudio de la respuesta celular B66. Existen diferentes técnicas que permiten tanto la identificación de subpoblaciones linfocitarias B (citometría de flujo), como la evaluación de la funcionalidad de las células B (ELIS-pot B), que han mostrado interesantes asociaciones con un mayor riesgo de rechazo67(nivel de evidencia bajo).
No obstante, estas técnicas se encuentran en fase de experimentación o validación, por lo que no existe evidencia suficiente que apoye su utilización actualmente en la práctica clínica.
MICROARRAYS
Se ha relacionado la determinación de la expresión de distintos genes en sangre periférica con la posibilidad de predecir la aparición de rechazo agudo o tolerancia inmunológica y, aunque los resultados preliminares de un conjunto de transcriptos concretos (test de respuesta de órganos sólidos [kSORT por sus siglas en inglés, kidney solid organ response test]) utilizados mediante un algoritmo estadístico específico (kSAS, por sus siglas en inglés kSORT analysis suite) tienen una buena correlación con rechazo agudo, son necesarios estudios prospectivos aleatorizados68-71 (nivel de evidencia bajo-moderado).
OTROS
Se han descrito otros biomarcadores serológicos72,73 y en orina74-76 con capacidad predictiva de rechazo agudo. No obstante, no disponemos de evidencia suficiente que apoye la determinación de ninguno de ellos para la monitorización inmunológica postrasplante (nivel de evidencia bajo).
Conflicto de intereses
Los autores declaran que no tienen conflictos de intereses potenciales relacionados con los contenidos de este artículo.
Correspondencia:
M.a José Pérez Sáez
Servicio de Nefrología. Hospital del Mar, Barcelona.
mperezsaez@parcdesalutmar.cat