La valoración del riesgo de fractura del paciente con enfermedad renal crónica (ERC) ha sido incluida en el complejo Chronic Kidney Disease-Mineral and Bone Disorders (CKD-MBD) en guías nefrológicas internacionales y nacionales, sugiriéndose por primera vez la evaluación de la densidad mineral ósea (DMO) si los resultados pueden condicionar la toma de decisiones terapéuticas. Sin embargo, existe muy poca información en práctica clínica real en esta población. El objetivo principal del estudio ERC-Osteoporosis (ERCOS) es describir el perfil de los pacientes con ERC G3-5D con osteoporosis (OP) y/o fracturas por fragilidad atendidos en consultas especializadas de nefrología, reumatología y medicina interna en España. Participaron 15 centros y se incluyeron 162 pacientes (siendo en su mayoría mujeres [71,2%] posmenopáusicas [98,3%]) con una mediana de edad de 77 años. La mediana del filtrado glomerular estimado (FGe) fue de 36ml/min/1,73m2 y el 38% de pacientes incluidos estaban en diálisis. Destacamos la elevada frecuencia de fracturas por fragilidad prevalentes ([37,7%), principalmente vertebrales [52,5%] y de cadera 24,6%]), el antecedente desproporcionado de pacientes con enfermedad glomerular en comparación con series puramente nefrológicas (corticoides) y el infratratamiento para la prevención de fracturas, fundamentalmente en consultas nefrológicas. Este estudio supone una inmediata llamada a la acción con la difusión de las nuevas guías clínicas, más proactivas, y subraya la necesidad de homogeneizar el enfoque asistencial/terapéutico multidisciplinar coordinado de estos pacientes de un modo eficiente para evitar las actuales discrepancias y el nihilismo terapéutico.
Fracture risk assessment in patients with chronic kidney disease (CKD) has been included in the Chronic Kidney Disease-Mineral and Bone Disorders (CKD-MBD) complex in international and national nephrology guidelines, suggesting for the first time the assessment of bone mineral density (BMD) if the results will impact treatment decisions. However, there is very little information on actual clinical practice in this population. The main objective of the ERC-Osteoporosis (ERCOS) study is to describe the profile of patients with CKD G3-5D with osteoporosis (OP) and/or fragility fractures treated in specialized nephrology, rheumatology and internal medicine clinics in Spain. Fifteen centers participated and 162 patients (mostly women [71.2%] postmenopausal [98.3%]) with a median age of 77 years were included. Mean estimated glomerular filtration rate (eGFR) was 36ml/min/1.73m2 and 38% of the included patients were on dialysis. We highlight the high frequency of prevalent fragility fractures ([37.7%], mainly vertebral [52.5%] and hip [24.6%]), the disproportionate history of patients with glomerular disease compared to purely nephrological series (corticosteroids) and undertreatment for fracture prevention, especially in nephrology consultations. This study is an immediate call to action with the dissemination of the new, more proactive, clinical guidelines, and underlines the need to standardize a coordinated and efficient multidisciplinary care/therapeutic approach to these patients to avoid current discrepancies and therapeutic nihilism.
Ya es bien conocido, no solo en el mundo nefrológico, que la organización internacional Kidney Disease Initiative Global Outcomes (KDIGO) define la enfermedad renal crónica (ERC) por la presencia de alteraciones de la estructura o función renal, durante un periodo superior a 3 meses, con consecuencias para la salud1–4. Entre sus complicaciones, una de las que tiene mayor impacto es la salud ósea; por ello en las guías KDIGO del año 2009 aparece el término complejo Chronic Kidney Disease-Mineral and Bone Disorder (CKD-MBD) para describir una entidad sistémica que integra todas las alteraciones bioquímicas, esqueléticas y extraesqueléticas que ocurren como consecuencia de los trastornos del metabolismo mineral de la ERC, y que se asocian a un aumento de enfermedad cardiovascular y mortalidad4–6.
Sin embargo, es mucho menos conocido tanto en el ámbito nefrológico, como general, que dentro de las enfermedades recientemente consideradas en el complejo CKD-MBD se encuentra la osteoporosis (OP), que se define como una pérdida de la resistencia mecánica global del hueso que predispone a un riesgo aumentado de presentar fracturas7–9. Estas fracturas comportan una alta morbimortalidad para los pacientes, además de un elevado coste socioeconómico10,11. Aunque existe muy poca información sobre la OP en el contexto de la ERC y sus diferentes estadios (G), se ha descrito en pacientes con ERC un riesgo aumentado en la incidencia de fracturas por fragilidad respecto a la población general, además de un incremento de la mortalidad12,13.
Para el diagnóstico de la OP es de utilidad comprobar la existencia de una reducción de la densidad mineral ósea (DMO) mediante Dual-energy X-ray Absortiometry (DXA). Sin embargo, en el ámbito nefrológico no se había contemplado nunca la medición de la DMO de forma rutinaria en pacientes con ERC porque se creía que no predecía el riesgo de fractura como en la población general, argumentándose que la disminución de la DMO podía ser consecuencia de las alteraciones del metabolismo calcio-fósforo asociados a la ERC14. Sin embargo, varios estudios confirmaron no solo que existe una relación directa entre el grado de ERC y la pérdida de DMO15–19, sino también una clara asociación entre una DMO disminuida y el incremento del riesgo de fractura también en esta población20. De hecho, la medición de la DMO por DXA es útil para la predicción de fractura a lo largo de todo el espectro de la ERC G3a-5D21–24. Toda esta evidencia quedó reflejada en la actualización de las guías KDIGO del año 20174, donde se sugirió por primera vez la evaluación de la DMO en los pacientes con ERC G3-5D con evidencia de CKD-MBD y/o factores de riesgo (FR) de fractura si sus resultados pudieran impactar en decisiones terapéuticas. Esta sugerencia ha sido también adaptada en las recientes recomendaciones de la Sociedad Española de Nefrología (S.E.N.) para el manejo de las alteraciones del metabolismo óseo-mineral en los pacientes con ERC 2021 (S.E.N.-MM)6,14. Adicionalmente, la Sociedad Española de Reumatología (SER) ha reforzado esta posición destacando a los pacientes con ERC como candidatos a DXA por presentar riesgo elevado de OP y fracturas por fragilidad25.
Sin embargo, la ambigüedad presente en las guías genera todavía notables discrepancias sobre cuándo realizar una DXA en los pacientes con ERC. Además, es probable que la DXA subestime el riesgo de fractura en estos pacientes, ya que proporciona información principalmente de la «cantidad», pero no de la «calidad» del hueso, que en esta población suele estar deteriorada, debido a las alteraciones en el remodelado, mineralización y volumen óseo21,26.
De lo que no hay duda es que la realización de una DXA en los pacientes con ERC podría ayudar a mejorar la brecha asistencial en la prevención de las fracturas todavía presente en estos pacientes, especialmente teniendo en cuenta la creciente experiencia que demuestra que los tratamientos para la OP son también efectivos en pacientes con ERC27. Probablemente este cambio de paradigma podría contribuir a reducir la incidencia de fracturas y su morbimortalidad asociada (prevención primaria y secundaria), que hasta ahora no eran consideradas en las guías a pesar de la gran carga asistencial y económica que conllevan3,28–30.
Por todo ello, el estudio Enfermedad Renal Crónica y Osteoporosis (ERCOS) se diseñó con el objetivo de definir el perfil de los pacientes con ERC G3-5D y objetivo principal (OP), así como conocer los FR de fractura asociados, y las estrategias diagnósticas y terapéuticas (objetivos secundarios). Los resultados de este estudio nos ayudarán a profundizar en el conocimiento de la relación entre la ERC y la OP, y a mejorar la atención clínica de estos pacientes.
MetodologíaDiseñoERCOS es un estudio epidemiológico descriptivo, observacional, transversal y multicéntrico de ámbito nacional en el que se han recogido durante 9 meses, de forma consecutiva, los datos de pacientes con ERC G3-5D diagnosticados de OP, en práctica clínica habitual. El estudio fue realizado en servicios de nefrología, reumatología y medicina interna de un total de 15 centros hospitalarios distribuidos por toda España.
PoblaciónSe incluyeron de forma consecutiva pacientes adultos (>18 años) con diagnóstico de ERC G3-5D, con un filtrado glomerular estimado (FGe)<60ml/min/1,73m2 (incluyendo pacientes en diálisis), que además hubieran sido diagnosticados de OP mediante DXA (T-score≤−2,5 en columna lumbar, cuello de fémur o cadera total) y/o con historia de al menos una fractura por fragilidad (las que se producen por un traumatismo de bajo impacto, como la caída desde la propia altura, principalmente las de vértebra, cadera, húmero proximal y radio distal) aparecida después de los 50 años.
Recogida de datosEn una única visita, después de obtener el consentimiento informado del paciente, se recogieron datos demográficos, comorbilidades, FR de fractura, fracturas previas, valores de DMO, parámetros del metabolismo mineral y tratamientos recibidos para la OP (tipo y prescriptor del mismo).
Análisis estadísticoSe analizaron los datos registrados en el cuaderno de recogida de datos (CRD) electrónico del estudio mediante un análisis descriptivo. Se obtuvo la media y desviación estándar o mediana y rango intercuartílico según fuera apropiado en función de la normalidad de las variables cuantitativas. Para las variables cualitativas se obtuvo la frecuencia y el porcentaje sobre la N válida.
Para describir y comparar las variables por estadio renal, se categorizó a los pacientes en base al FGe o la necesidad de diálisis. La comparación de las variables del estudio por estadio renal se realizó mediante la prueba de la χ2 de Pearson para las variables cualitativas y el análisis de la varianza (ANOVA) de un factor para las variables cuantitativas. En caso de diferencias estadísticamente significativas en las comparaciones globales, se realizaron comparaciones post-hoc dos a dos mediante el test de Bonferroni.
Para la comparación de DMO se evaluó si el cambio era significativamente diferente de cero mediante la prueba de la t de Student. Para la comparación de la prescripción de los tratamientos para la OP según especialidad médica se compararon variables mediante la prueba de la χ2 de Pearson para las variables cualitativas y el ANOVA de un factor para las variables cuantitativas. Todas las pruebas estadísticas fueron bilaterales estableciendo el nivel de significación α al 5%.
Consideraciones éticasSe obtuvo la aprobación del Comité Ético de Investigación con medicamentos (CEIm) del Complejo Hospitalario Universitario de Canarias y adicionalmente también fue evaluado y valorado positivamente por los CEIm locales de cada hospital participante. Se respetaron las normas de buena práctica clínica y los principios éticos establecidos para la investigación en seres humanos en la Declaración de Helsinki y sus revisiones posteriores. Todos los participantes en el estudio fueron informados sobre el estudio y aceptaron voluntariamente participar mediante firma del consentimiento informado.
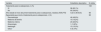
ResultadosSe incluyeron 162 pacientes (115 mujeres), 65 con ERC G3, 35 con ERC G4-5 y 62 con ERC G5D. El perfil más frecuente del paciente con ERC y OP en esta población era mujer (71,2%) posmenopáusica (98,3%) de edad avanzada (77 años de mediana), con un IMC de 26,4kg/m2, una creatinina sérica de 1,48mg/dl (1,20-2,01) y un FGe de 36ml/min/1,73m2 (26-43). En la tabla 1 se recogen las características sociodemográficas por estadio de enfermedad renal. Un 38% de pacientes se encontraba en programa de diálisis, con una mediana de tiempo en diálisis de 2,6 años (1,3-4,3 años). La etiología más frecuente de la ERC fue la hipertensión arterial (47,5%), seguida de las enfermedades glomerulares (26,5%) y la diabetes mellitus (19,8%). En un 14,2% de los casos la causa no se conocía. El 21% de los pacientes recibieron tratamiento con corticoides (10,8; 20,6 y 32,3% de pacientes con ERC G3, G4-5 y G5D, respectivamente) y el 71% de estos los estaban recibiendo en el momento de la inclusión.
Características sociodemográficas y prevalencia de fracturas por fragilidad según el estadio de la enfermedad renal crónica (ERC)
| Variable | ERC 3 | ERC 4-5 | ERC 5D | Valor de p* |
|---|---|---|---|---|
| N=65 | N=35 | N=62 | ||
| Edad (años), media (DE) | 78,2 (9,76) | 74,1 (12,4) | 70,9 (12,4) | 0,002a |
| Sexo, n (%): | 0,200 | |||
| Varón | 16 (24,6%) | 8 (22,9%) | 23 (37,1%) | |
| Mujer | 49 (75,4%) | 27 (77,1%) | 39 (62,9%) | |
| Estado menopáusico, n (%): | 0,167 | |||
| Posmenopáusica | 49 (100%) | 27 (100%) | 37 (94,9%) | |
| Premenopáusica | 0 (0,00%) | 0 (0,00%) | 2 (5,13%) | |
| Fractura por fragilidad tras el diagnóstico de ERC, n (%): | 0,553 | |||
| Sí | 27 (41,5%) | 13 (38,2%) | 20 (32,3%) | |
| No | 38 (58,5%) | 21 (61,8%) | 42 (67,7%) | |
DE: desviación estándar; ERC: enfermedad renal crónica.
La hipertensión arterial, la diabetes mellitus, la enfermedad cardiovascular (incluyendo insuficiencia cardíaca y cardiopatía isquémica) fueron las comorbilidades más frecuentes (87,1, 35,6, 29,4 y 13,5%, respectivamente). Cuando se analizó la prevalencia de los FR de fractura se identificó la diabetes mellitus en más del 30% de pacientes, hipogonadismo o menopausia precoz (9,4%), hepatopatía (9,4%) y fractura de cadera en padre y/o madre (8%). La diabetes mellitus, el hipogonadismo o menopausia precoz y la hepatopatía fueron significativamente más frecuentes en pacientes en diálisis en comparación con pacientes con ERC G3 y ERC G4-5 (p=0,013 y p=0,021, respectivamente).
En el estudio se observó una prevalencia de fracturas por fragilidad del 37,7%. Un 19,1% de los pacientes habían presentado al menos una fractura vertebral y un 9,3% una fractura de cadera.
Las localizaciones más frecuentes de las fracturas fueron: vertebral (50,8%), cadera (24,6%), muñeca (21,3%), húmero (16,4%) y pelvis (13,1%). El 19,4% de pacientes con ERC sufrió alguna fractura por fragilidad a pesar de estar recibiendo tratamiento para la OP.
Respecto a los parámetros bioquímicos del metabolismo óseo, los pacientes en diálisis presentaban niveles séricos significativamente más bajos de calcio, proteínas totales, albúmina y 25-hidroxivitamina D, y niveles significativamente más elevados de fósforo, hormona paratiroidea y fosfatasa alcalina, respecto a los pacientes con ERC sin diálisis (ERC G3-5) (tabla 2).
Datos bioquímicos del metabolismo fosfo-cálcico según el estadio de la ERC
| Variable | ERC 3 | ERC 4-5 | ERC 5D | Valor de p* |
|---|---|---|---|---|
| N=65 | N=35 | N=62 | ||
| Calcio (mg/dl), media (DE) | 9,62 (0,50) | 9,45 (0,52) | 8,80 (0,64) | <0,001a,b |
| Fósforo (mg/dl), media (DE) | 3,45 (0,61) | 3,71 (0,90) | 4,44 (1,24) | <0,001a,b |
| Proteínas (g/dl), media (DE) | 6,89 (0,63) | 6,73 (0,57) | 6,46 (0,54) | <0,001a |
| Albúmina (g/dl), media (DE) | 4,32 (0,82) | 4,26 (0,76) | 3,80 (0,41) | <0,001a,b |
| PTH (pg/ml), media (DE) | 102 (76,3) | 168 (180) | 317 (276) | <0,001a,b |
| 25-hidroxivitamina D (ng/ml), media (DE) | 32,6 (13,8) | 36,0 (20,1) | 23,9 (13,6) | <0,001a,b |
| Fosfatasa alcalina total (UI/l), media (DE) | 77,0 (28,0) | 88,8 (40,0) | 116 (61,9) | <0,001a,b |
| GGT (UI/l), media (DE) | 34,9 (49,7) | 42,7 (47,7) | 37,4 (40,2) | 0,755 |
| Magnesio (mg/dl), media (DE) | 2,02 (0,37) | 2,13 (0,73) | 2,15 (0,43) | 0,442 |
DE: desviación estándar; ERC: enfermedad renal crónica; GGT: gamma glutamil transpeptidasa; PTH: hormona paratiroidea.
El 46% de los pacientes estaban recibiendo suplementos de calcio y el 84,7% tratamiento con vitamina D (calcidiol 58%; colecalciferol 45,7%), sin diferencias significativas entre los distintos estadios de la ERC. El 23,9% de los pacientes recibían tratamiento con paricalcitol (especialmente en ERC G4-5D) y el 8% con calcitriol. El 16% de pacientes estaba con calcimiméticos, y el 35,8% recibían captores de fosfato (31,4% de pacientes con ERC G4-5 y el 77% de pacientes G5D; p˂0,001). El 37,9% de estos captores de fosfato eran captores cálcicos, especialmente carbonato de calcio (50%), y el 82,8% eran no cálcicos, siendo el más frecuente el carbonato de sevelámero en el 62,5% de pacientes. El 20,7% de pacientes, todos ellos menos uno en diálisis, recibían ambos tipos de captores.
Para el diagnóstico de la OP se realizó una DXA a 157 pacientes (97%), con una mediana de tiempo de 2,7 años antes de la inclusión en el estudio (tabla 3). La DXA diagnóstica se realizó mucho antes en los pacientes con ERC G3 que en los que estaban en otros estadios (tiempo transcurrido desde el diagnóstico de la ERC y la realización de la DXA en pacientes con ERC G3 vs. ERC G4-5 y ERC5D fue de 7,5±11,4 vs. 3,4±3,1 y 1,8±1,9 años, respectivamente; p˂0,001). El valor medio de T-score estaba en el rango de OP en la columna lumbar, y en el rango de osteopenia en cadera y cuello femoral. La DMO en radio, sugerida en algunas guías para el diagnóstico en pacientes con ERC, se midió solo en el 16% de los pacientes.
Densitometría ósea en el momento del diagnóstico de osteoporosis/osteopenia
| Variable | Estadístico descriptivo | N válida |
|---|---|---|
| T-score columna lumbar, mediana (P25,P75) | −2,55 (−3,27,−1,83) | 146 |
| T-score cadera, mediana (P25,P75) | −2,30 (−2,70,−1,70) | 143 |
| T-score cuello femoral, mediana (P25,P75) | −2,30 (−2,80,−1,70) | 142 |
| T-score radio ultradistal, mediana (P25,P75) | −1,70 (−2,70,−0,30) | 25 |
Un 60,1% de los pacientes habían iniciado tratamiento específico para la OP desde hacía una mediana de 4 años (P25, P75: 1,7-6,5). Iniciaron este tratamiento el 86,2% de pacientes con ERC G3, el 65,7% de los pacientes con ERC G4-5 y el 30,6% de los pacientes en diálisis (p˂0,001), 6,3±5,4, 4,9±4,3 y 2,3±2,5 años, respectivamente antes de la inclusión en el estudio (p=0,008). La mediana del FGe al iniciar el tratamiento para la OP fue de 44ml/min/1,73m2 (35-54) en los pacientes que no estaban en programa de diálisis (ERC G3-5).
Cuando se analizó el médico prescriptor según la especialidad se observó que el 46,9% eran reumatólogos, el 23,5% médicos internistas, el 10,2% médicos de familia y el 13,3% nefrólogos (tabla 4). En pacientes con ERC G5D la prescripción fue mayoritariamente por nefrólogos (36,8%) y reumatólogos (31,6%) y en menor medida por médicos de familia (10%), médicos internistas (15,8%), entre otros.
Tratamiento para la osteoporosis y médico prescriptor según la especialidad
| Variable | Estadístico descriptivo | N válida |
|---|---|---|
| Tratamiento para la osteoporosis, n (%) | 163 | |
| Sí | 98 (60,1%) | |
| No | 65 (39,9%) | |
| Años desde el inicio del primer tratamiento para la osteoporosis, mediana (P25,P75) | 4,02 (1,66-6,54) | 98 |
| Especialista que inició el tratamiento para la osteoporosis, n (%) | 98 | |
| Reumatología | 46 (46,9%) | |
| Medicina de familia | 10 (10,2%) | |
| Medicina interna | 23 (23,5%) | |
| Ginecología | 1 (1,02%) | |
| Nefrología | 13 (13,3%) | |
| Otrosa | 5 (5,10%) |
Por estadios de ERC, estos fármacos para la OP fueron prescritos fundamentalmente por reumatólogos (51,8%) e internistas (30,4%) en la ERC G3 (82,2% en conjunto) y por nefrólogos y reumatólogos en ERC G5D (36,8 y 31,6%, respectivamente). Por otra parte, el inicio de tratamiento por parte de nefrólogos es nominalmente inferior (2,0±2,0 vs. 5,2±5,0 —reumatólogos e internistas— vs. 7,8±4,9 años —otras especialidades— [p=0,006]).
El tratamiento antirresortivo más empleado fueron los bisfosfonatos (45,9% de pacientes), que en un 82,2% de los casos eran orales, más utilizados en pacientes con ERC G3 (51,8%) (p=0,053) (tabla 5). Los bisfosfonatos orales más utilizados fueron el alendronato (45,9%) y el risedronato (45,9%). Un 17,8% de los pacientes recibieron ácido zoledrónico (7 pacientes con ERC G3 y uno con ERC G4-5). Se observó una menor tendencia a recibir bisfosfonatos en pacientes en diálisis (21,1% de los tratamientos para la OP en este estadio), pero no en pacientes con ERC G4-5 (52,2%) en comparación con el estadio G3 (51,8%) (p=0,053). El 45,9% de los pacientes que iniciaron tratamiento para la OP recibieron denosumab, de los cuales un 42,9% de los pacientes presentaban ERC G3, un 34,8% ERC G4-5 y un 68,4% ERC G5D (p=0,073).
Primer tratamiento antiosteoporótico según el estadio de la ERC
| Variable | ERC 3 | ERC 4-5 | ERC 5D | Valor de p |
|---|---|---|---|---|
| N=56 | N=23 | N=19 | ||
| Tratamiento con bisfosfonatos, n (%) | 29 (51,8%) | 12 (52,2%) | 4 (21,1%) | 0,053 |
| Orales | 22 (75,9%) | 11 (91,7%) | 4 (100%) | 0,385 |
| Intravenosos (ácido zoledrónico) | 7 (24,1%) | 1 (8,33%) | 0 (0,00%) | |
| Bisfosfonatos orales, n (%) | >0,999 | |||
| Alendronato | 10 (45,5%) | 5 (45,5%) | 2 (50,0%) | |
| Risedronato | 10 (45,5%) | 5 (45,5%) | 2 (50,0%) | |
| Ibandronato | 2 (9,09%) | 1 (9,09%) | 0 (0,00%) | |
| Tratamiento con denosumab, n (%): | 24 (42,9%) | 8 (34,8%) | 13 (68,4%) | 0,073 |
| Tratamiento con teriparatida, n (%): | 2 (3,57%) | 1 (4,35%) | 2 (10,5%) | 0,382 |
| Tratamiento con SERM, n (%): | 1 (1,79%) | 2 (8,70%) | 0 (0,00%) | 0,232 |
ERC: enfermedad renal crónica; SERM: selective estrogen receptor modulator.
Dos pacientes con ERC G3, un paciente con G4-5 y 2 pacientes en G5D habían recibido teriparatida como primer tratamiento para la OP, en todos los casos prescrita por reumatólogos o internistas. Tan solo un paciente con ERC G3 y 2 pacientes en G4-5 habían recibido como primer tratamiento un fármaco modulador selectivo de los receptores estrogénicos (SERM).
Ningún paciente había recibido romosozumab (no comercializado en España en el momento de la recogida de datos).
La duración media del primer tratamiento para la osteoporosis fue de 3 (1-5) años para los bisfosfonatos, 3 (1-4) años para el denosumab, un (1-1) año para la teriparatida y 4,5 (3,7-5,2) años para los SERM.
De los pacientes que recibieron un primer tratamiento para la OP, un 25,5% recibió un segundo tratamiento (denosumab 64%, bisfosfonatos 32% y teriparatida 4%). Las causas más frecuentes del cambio de tratamiento fueron: pérdida de DMO (32%), nueva fractura por fragilidad (20%) y efectos adversos (8%). En 2 pacientes con ERC G3 el motivo fue la discontinuación de denosumab, iniciándose ácido zoledrónico.
DiscusiónEl estudio ERCOS muestra el perfil de pacientes con ERC y OP en España. Mayoritariamente son mujeres, posmenopáusicas, de edad avanzada, con grados variables de la enfermedad renal, incluyendo muchos casos de pacientes en diálisis.
La ERC y la OP son altamente prevalentes especialmente en pacientes de mayor edad. Datos de estudios recientes españoles indican que hasta el 37% de los pacientes ≥65 años pueden padecer ERC y que 1/3 mujeres y 1/5 varones padecerán una fractura por fragilidad como complicación de la osteoporosis29,31. Sin embargo, no disponíamos de datos que informaran de las características de los pacientes en los que coexisten estas 2 enfermedades, lo que supone un factor diferencial con otros estudios. De hecho, al tratarse de un estudio descriptivo en condiciones de práctica clínica, ERCOS podría no reflejar datos poblacionales en pacientes con ERC. En este sentido, analizando los factores de riesgo de fractura en nuestra cohorte, la prevalencia de diabetes sería muy similar a la prevalencia descrita por Lee WC et al.32 en pacientes con ERC G3-5, pero superior al 13,1% descrito por Naylor KL et al.22 en pacientes con FGe˂60ml/min/1,73m2 (su único criterio de inclusión). Como sería de esperar, en esta última comparación entre sus pacientes con FGe˃ o ˂ a 60ml/min/1,73m2, la prevalencia de diabetes e HTA era superior en los pacientes con FGe disminuido (6,6 vs. 13,1% y 32,3 vs. 58,1%, respectivamente)22. Es obvio que la inclusión de un mayor número de pacientes con ERC avanzada (incluyendo un número importante de pacientes con ERC G5D) en nuestra cohorte, explicaría fácilmente nuestra mayor prevalencia de HTA, DM e incluso de hepatopatía, así como la mayor prevalencia de fracturas por fragilidad que, además y por definición, era un potencial criterio de inclusión en ERCOS. Destacamos asimismo la baja prevalencia descrita en nuestra cohorte de hipogonadismo (9,4%), incluyendo la menopausia precoz, que está muy por debajo de la elevada prevalencia de menopausia precoz descrita en mujeres con ERC (26%)33. Independientemente de que nuestra cohorte incluye un 29% de varones, es probable que el hipogonadismo también sea infraregistrado en las historias clínicas nefrológicas, lo que también sirve como llamada de atención a un factor relevante poco considerado hasta ahora y con el fin de otorgar potencialmente preferencias diagnóstico-terapéuticas a estos pacientes.
Teniendo en cuenta estas consideraciones sobre nuestros criterios de inclusión (ERC y OP) y que el diagnóstico de una fractura por fragilidad ya tiene per se implicaciones diagnósticas (OP) y terapéuticas (prevención secundaria), no es de extrañar que la prevalencia de fracturas en el momento del diagnóstico de la OP en nuestra cohorte fue de casi el 40%, superior a la cohorte de Naylor et al. en pacientes con FGe˂60ml/min/1,73m2 (25,3 vs. 17,1% en pacientes con FGe˃60ml/min/1,73m2)22 lo que traduce que el diagnóstico de la enfermedad ósea se hace demasiado tarde en muchos pacientes. Como se ha mencionado con anterioridad, aunque existe poca información y dispersa sobre la OP en el contexto de la ERC y sus diferentes estadios, se ha descrito un riesgo aumentado y progresivo en la incidencia de fracturas por fragilidad respecto a la población general12,13,22,34. El hecho de que la mayor parte de las fracturas observadas en estos pacientes sean vertebrales y de cadera, hace que la situación sea todavía más preocupante, puesto que son las fracturas asociadas con una mayor morbimortalidad, que a su vez se incrementa adicionalmente en los pacientes con ERC, que ya de por sí presentan más comorbilidades, mayor riesgo cardiovascular y menor esperanza de vida4,13.
Es bien conocido que entre las múltiples complicaciones de la ERC la afectación ósea es una de las que tiene mayor impacto, por lo que el complejo CKD-MBD se ha confirmado como una entidad sistémica también asociada a fracturas4,35. En este sentido, cabe destacar el importante cambio de paradigma de las últimas guías nacionales e internacionales en las que ahora se sugiere medir la DMO en pacientes con ERC G3a-G5D con evidencia de CKD-MBD y/o FR de OP6,14. Se trata de un reconocimiento nefrológico de que la fragilidad ósea asociada a la ERC no solo es secundaria al diagnóstico clásico de «osteodistrofia renal» y que hasta ahora había sido solo tratada con fármacos específicos como captores de fosfato, vitamina D nativa y/o derivados activos de la vitamina D y/o calcimiméticos. Nuevas evidencias de que la medición por DXA de la DMO sí predice el riesgo de fractura en la ERC y que los fármacos dirigidos al tratamiento de la OP en la población general mejoran también la DMO en estos pacientes, han condicionado estos importantes cambios4. De este modo, además de la necesidad de reconocer la ERC «oculta» y valorar los FR asociados a la OP clásica (senil, postmenopáusica), su diagnóstico y potencial tratamiento con agentes antiosteoporóticos se han convertido en un nuevo reto ineludible13,29. En este sentido, la tendencia actual es la toma de actitudes proactivas3,13, incluso en ausencia de las biopsias óseas recomendadas previamente antes del uso de estos fármacos4,6, siendo precisa la participación activa del paciente en la toma de decisiones dado el probable balance riesgo-beneficio positivo, aunque se debe reconocer la ausencia de evidencias absolutas4,6,28. En consecuencia, el conocimiento del perfil más frecuente a partir de los resultados del estudio permitiría realizar inicialmente cribados más eficientes.
Es necesario subrayar de nuevo que la presencia de una o varias fracturas por fragilidad es sinónimo de diagnóstico de OP25. Además, no solo el riesgo de fractura de cadera y de fracturas no vertebrales es más elevado en la ERC36, sino que también se ha descrito una gradación entre el riesgo de fractura y el grado de función renal, y aunque son pocos los estudios que valoran las fracturas vertebrales en ERC no parecen desdeñables en esta población36–38.
En nuestro estudio, el 37,7% de los pacientes habían sufrido alguna fractura por fragilidad, siendo la vertebral la más frecuente, probablemente, como se mencionó con anterioridad, por la proporción elevada de enfermedad glomerular y su tratamiento con glucocorticoides. Independientemente de la localización, el antecedente de fractura implica un mayor riesgo de nuevas fracturas a lo largo de la vida, siendo este riesgo especialmente alto durante los 2 años posteriores a la fractura39. Por este motivo, parecería importante resaltar la importancia de la identificación de fracturas (sobre todo vertebrales, frecuentemente asintomáticas) en la evaluación del paciente con ERC y, especialmente, en aquellos pacientes con las características mencionadas. El diagnóstico de fractura por fragilidad clasifica al paciente como alto o muy alto riesgo de fractura y, por lo tanto, se trataría de pacientes candidatos a recibir un tratamiento para la OP en prevención secundaria29.
En condiciones de práctica clínica habitual se ha observado un evidente infratratamiento de los pacientes con ERC y diagnosticados de OP. Según los datos de nuestro estudio permanecen sin tratamiento casi el 40% de los pacientes. Además, es importante destacar que se han observado diferencias significativas en relación con la prescripción por especialidad clínica. La mayoría de los tratamientos para la OP fueron iniciados por reumatólogos, subyaciendo un infratratamiento por parte de nefrología. Curiosamente, este infratratamiento es más evidente en estadios tempranos de la ERC, donde la indicación de su uso no estaría limitada por la presencia de un FG disminuido. Por otra parte, es posible que pacientes con estadios tempranos de ERC fueran visitados por parte de reumatólogos e internistas, con una actitud más proactiva en el tratamiento de estos pacientes con fármacos antiosteoporóticos.
La selección y prescripción de estos fármacos en el estudio ERCOS se adecúa a las recomendaciones de tratamiento de las principales guías de práctica clínica de referencia actuales. Los bisfosfonatos orales son agentes antirresortivos recomendados en primera línea para la prevención de fracturas40,41. Respecto a la seguridad, alendronato y risedronato están contraindicados, según ficha técnica, en pacientes con aclaramientos de creatinina <30-35ml/min, aunque algunos estudios post-hoc con pocos pacientes han mostrado que también pueden ser eficaces y seguros en los estadios más avanzados de ERC. Sin embargo, publicaciones recientes a partir de una base de datos electrónica del Reino Unido y Cataluña reportan un leve incremento del riesgo de progresión de la enfermedad en pacientes con ERC G3b-5 tratados con bisfosfonatos orales29,42–44, aunque los datos de la base de Reino Unido mostraron un aumento de supervivencia en los pacientes tratados. Es de destacar que la definición de deterioro/progresión de la función renal en este estudio fue definido por el impreciso concepto de cambio de estadio44. Asimismo, destacamos que, a pesar de la presencia de ERC, 17,8% de los pacientes en nuestra cohorte recibieron ácido zoledrónico anual (la gran mayoría con ERC G3).
Con relación a denosumab, aunque no requiere ajuste de dosis en pacientes con ERC, en estadios G4-G5D se recomienda precaución por el mayor riesgo de hipocalcemia y aumento secundario de la PTH29. Por otro lado, es especialmente importante la adherencia al tratamiento con denosumab, ya que su discontinuación produce un efecto rebote del remodelado óseo, con pérdida acelerada de la DMO y un aumento del riesgo de fracturas vertebrales, en ocasiones múltiples. En este sentido, en nuestra cohorte se observó una mayor adherencia con denosumab que con bisfosfonatos (un 84% de los pacientes seguían tratamiento con denosumab, mientras que tan solo lo hacía un 42% de los pacientes tratados con bisfosfonatos).
A pesar de haber iniciado tratamiento para la osteoporosis el 19,4% de los pacientes con ERC sufrió alguna fractura por fragilidad. Hay que recordar que los tratamientos para la osteoporosis disminuyen el riesgo de fractura entre un 20-70% según el fármaco y la localización de la fractura45, pero no evitan todas. Por otro lado, es probable que los pacientes a los que se les inició tratamiento presentaran un alto o muy alto riesgo de fractura, y podrían haber presentado más fracturas de no haber recibido tratamiento.
Aunque el estudio pone de manifiesto el infratratamiento de los pacientes con ERC y FR de fractura, una de las limitaciones principales a destacar es el pequeño tamaño muestral. Se debe tener en consideración que el trabajo de campo se inició en plena pandemia de COVID-19 por lo que inicialmente se estableció una aleatorización previa a la inclusión de los pacientes pero que al reducirse las restricciones sobre la sanidad pública y la realización de las visitas en consulta se realizaban con normalidad se decidió añadir la opción de reclutamiento consecutivo. Por otra parte, es necesario resaltar que nuestros resultados no se pueden extrapolar a toda la población con ERC puesto que en nuestra cohorte se incluyeron pacientes con diagnóstico de OP densitométrica y/o fracturas por fragilidad, por lo que la prevalencia de fracturas en nuestra cohorte es superior a la que podríamos observar en la población global de pacientes con ERC22. Otra limitación es el corto tiempo de tratamiento de los pacientes, que obliga a tomar con cautela los datos relacionados con el mismo. Finalmente, existe un sesgo de inclusión de pacientes en diálisis, justificado por el interés de conocer la actitud diagnóstico-terapéutica en estos pacientes. En este sentido, analizar las características de los pacientes en los que coexisten estas 2 enfermedades tan prevalentes, como criterio de inclusión, nos ha permitido describir no solo el gran infratratamiento detectado sino también la escasa sensibilidad por parte de los nefrólogos a la hora de tratar la OP, a pesar de los importantes cambios recientes en nuestras guías4,6. Así, como se ha mencionado, en los pacientes con ERC G3a-5D con evidencia y/o FR de OP, ahora sí se sugiere realizar densitometrías (si los resultados impactarán decisiones terapéuticas, evidencia 2B). Además, que los pacientes con ERC G1-2 con OP o alto riesgo de fractura ahora se recomienda (evidencia 1A) el mismo tratamiento que en la población general y que en los pacientes con ERC G3a-3b, con OP o alto riesgo de fractura (y PTH controlada) se sugiere (evidencia 2B) también el mismo tratamiento que en la población general4,6. Diversos algoritmos de actuación han sido publicados por diversas sociedades y autores, incluyendo ERC G4-5D28,29,46, y en los que se resalta especialmente la importancia de la prevención secundaria (además de la primaria) y la necesidad del estudio de la enfermedad metabólica ósea en pacientes con ERC, así como la de realizar un estudio de la función renal y enfermedad metabólica ósea en pacientes que han sufrido una fractura por fragilidad, para la cual puede incluso sugerirse una búsqueda activa.
ConclusiónDescribimos, en condiciones de práctica clínica habitual, una elevada prevalencia de fracturas y un preocupante infratratamiento en los pacientes con ERC y OP, que es especialmente notorio en el ámbito nefrológico a pesar de la existencia de un sesgo positivo determinado por la participación en este estudio de centros y especialistas especialmente interesados en esta enfermedad.
Definir el escasamente conocido perfil de estos pacientes y el enfoque clínico utilizado en una muestra nacional transversal multidisciplinar no solo ha permitido detectar heterogeneidad de actuaciones sino también subrayar la importancia de determinados subgrupos de pacientes, resaltar nuevas necesidades clínicas y disponer de datos basales sobre los que en el futuro se pueda valorar el impacto de las nuevas guías, especialmente en el campo nefrológico.
Considerando el cambio de paradigma de las guías nefrológicas recientes, en las que se sugiere por primera vez la evaluación de la DMO en los pacientes con ERC G3-5D, parece necesaria una llamada a la acción, en especial entre nefrólogos y probablemente también extensible al ámbito de la atención primaria13. En este sentido, consideramos necesario ampliar la difusión de estas guías4,6,28,29,46, más proactivas en el diagnóstico y tratamiento de la OP en la ERC, así como homogeneizar el enfoque asistencial y terapéutico multidisciplinar coordinado de estos pacientes para evitar las actuales discrepancias y nihilismo terapéutico.
FinanciaciónEste estudio fue financiado por Laboratorios Rubió.
Conflicto de interesesEl Dr. Jordi Bover Sanjuán declara que ha recibido honorarios por conferencias, consultorías y/o becas de viaje de Abbvie, Amgen, AstraZeneca, Bayer, CSL-Vifor, GSK, Rubió y Sanofi.
El Dr. Carlos Gómez declara haber recibido honorarios por conferencias y consultorías de Amgen, Italfármaco, FAES, Gedeon-Richter, Rubió, UCB y Sanofi.
El Dr. Enrique Casado declara haber recibido honorarios por conferencias y consultorías de Eli Lilly, Amgen, UCB, Theramex, Italfármaco, Gedeon-Richter, STADA, Bayer, GP-Pharma y Rubió.
La Dra. Minerva Rodríguez García declara que ha recibido honorarios por conferencias, consultorías o asistencia a cursos y congresos de Gedeon-Richter, Rubió, Sanofi, Kyowa-Kirin, Alexion, Takeda, Amgen y Gebro Pharma.
La Dra. María Jesús Lloret Cora ha recibido ha recibido honorarios por conferencias y/o consultorías de Abbvie, CSL-Vifor, Rubió y Sanofi.
La Dra. Cristina Castro declara que ha recibido honorarios por conferencias y/o becas de viajes y asistencia de congresos por Amgen, Novo Nordisk y Boehringer-Lilly.
El Dr. Fernando Henríquez-Palop indica que ha recibido honorarios como docente de AstraZeneca y Vifor Pharma.
La Dra. Laia Gifre declara haber recibido honorarios por conferencias o asistencia a cursos y congresos de Amgen, UCB, Rubió y STADA.
La Dra. Virginia López de la Manzanara declara haber recibido honorarios por conferencias y consultorías de Amgen, Abbott y Fresenius Kabi.
La Dra. Ana Laiz declara haber recibido honorarios por conferencias y consultorías de Amgen, UCB, Lilly, Abbvie, Pfizer, Novartis, Janssen y MSD.
La Dra. Àngels Martinez-Ferrer declara que ha recibido honorarios por conferencias y/o becas de viaje de Eli Lilly, Amgen, UCB, Theramex, Novartis, GEdeon Richter y STADA.
El Dr. Vicenç Torregrosa declara no tener ningún conflicto de intereses.
El Dr. Secundino Cigarrán Guldrís declara que ha recibido honorarios por conferencias de Baxter, AstraZeneca, Novo Nordisk, Boeringher, Chiesi y Bayer.
El Dr. Jose Luis Górriz declara haber recibido honorarios por conferencias de Vifor SCL.
El Dr. Marco Montomoli declara haber recibido honorarios por conferencias y consultorías de AstraZeneca, Bayer, Baxter y Novonorksik.
La Dra. Nayara Panizo declara no tener ningún conflicto de intereses.
La Dra. Águeda Prior-Español ha recibido honorarios por conferencias y/o becas de viaje de Eli Lilly, Amgen, UCB, Teames y GP-Pharma.
La Dra. Ester Costa Moya indica que ha recibido financiación de congresos por parte de Rubió, Amgen y Kyowa Kirin.
El Dr. Daniel Martínez-Laguna declara haber recibido honorarios por conferencias, consultorías o asistencia a cursos y congresos de Amgen, Italfármaco, Pierre Fabre, Rubió, Gedeon Ritcher, STADA, Grünenthal, Theramex y UCB.
El Dr. Mariano Rodríguez declara haber recibido honorarios por conferencias de Amgen, Kyowa, Vifor Pharma, GSK y Rubió.
El Dr. Juan Navarro declara haber recibido honorarios por conferencias y consultorías de Abbvie, Amgen, Vifor Pharma, Rubió y Sanofi.
Los autores agradecen a GOC Health Consulting por el apoyo en el desarrollo del estudio y el soporte en la redacción médica, y a Laboratorios Rubió por la financiación del estudio.