El conocimiento de la mejor evidencia disponible es un elemento indispensable para la práctica de una medicina basada en la evidencia. Para ello, además del recurso a las pautas o guías de práctica clínica basadas en la evidencia y a la lectura de la literatura secundaria filtrada con los mismos criterios, el clínico puede aprender a encontrar y juzgar por sí mismo la mejor evidencia clínica externa posible. Para ello, debe saber formular preguntas clínicas (teniendo en cuenta 4 elementos: el paciente, la intervención, la comparación y el desenlace), buscar la mejor evidencia disponible para contestar esas preguntas, evaluar críticamente la validez e importancia de la evidencia encontrada, aplicar esa evidencia a la práctica clínica y evaluar el rendimiento de todo el proceso. En la evaluación crítica de la literatura médica hay elementos comunes para todos los tipos de diseños (la especificidad, la relevancia y la novedad de la pregunta, el cumplimiento estricto del protocolo de investigación y el manejo adecuado de los conflictos de intereses) y otros específicos para cada tipo de diseño. El clínico debe dominar los criterios específicos de lectura crítica de ensayos controlados y aleatorizados, revisiones sistemáticas, estudios de exactitud de las pruebas diagnósticas, estudios pronósticos y estudios de efectos adversos, con el objetivo de mejorar su competencia clínica. Ese proceso requiere práctica y tiempo. El dominio de las habilidades de lectura crítica necesita tanto un esfuerzo individual como un apoyo y un estímulo colectivo de los servicios.
LA LECTURA CRÍTICA DE LITERATURA ES PARTE DE LA PRÁCTICA DE LA MEDICINA BASADA EN LA EVIDENCIA
El movimiento de la medicina basada en la evidencia —como se ha señalado reiteradamente, es discutible el uso en español del término “evidencia” para traducir el sustantivo inglés evidence, cuya traducción mejor sería “pruebas”, de modo que evidence-based medicine debería traducirse mejor como “medicina basada en pruebas”; sin embargo, el uso extendido de “evidencia” en la literatura nos lleva a emplear ese término— ha revolucionado la teoría y la práctica de la medicina en las 3 últimas décadas. En 1992 se publicó el documento fundacional que definía las características básicas del movimiento1. Sus autores proclamaban que la medicina basada en la evidencia suponía un paradigma nuevo en la enseñanza y en la práctica de la medicina al relegar a un segundo plano la intuición, la experiencia clínica no sistematizada, el razonamiento fisiopatológico y los argumentos de autoridad, dominantes hasta entonces, y destacar, por el contrario, la adquisición de nuevas habilidades, como la formulación de preguntas, la búsqueda y recuperación de la mejor evidencia disponible y la lectura crítica de los métodos de los estudios para poder juzgar si son válidos o no1,2.
La medicina basada en la evidencia se puede definir como el empleo consciente, explícito y juicioso de la mejor evidencia disponible para tomar decisiones en el cuidado de los pacientes individuales3. La mejor evidencia disponible, junto con la pericia clínica individual y las preferencias y valores de los pacientes, es uno de los componentes básicos de la práctica de la medicina basada en la evidencia4. En comparación con patrones previos, lo característico de la práctica de la medicina basada en la evidencia es el énfasis que concede a los componentes de la mejor evidencia clínica disponible y de las preferencias y valores del paciente. La importancia de las preferencias y valores del paciente trasciende el campo de la medicina basada en la evidencia y tiene que ver con el declive progresivo de la medicina paternalista que se practicó en el pasado y su sustitución progresiva por otra medicina respetuosa con los derechos y preferencias de los pacientes. El componente de la mejor evidencia clínica disponible es el componente más propio de la medicina basada en la evidencia.
El conocimiento de la mejor evidencia clínica disponible se puede efectuar de 3 modos, con grados crecientes de dificultad. El modo más sencillo es la aceptación y aplicación de las pautas o protocolos de práctica clínica basada en la evidencia que han elaborado otros. Esto supone, por ejemplo, adoptar las guías de práctica clínica basadas en la evidencia, como las guías que elabora la Kidney Disease Improving Global Outcomes (KDIGO)5.
Un segundo modo, algo más laborioso, es la búsqueda y aplicación de los resúmenes de medicina basada en la evidencia producidos por otros. En lugar de recurrir a la información suministrada por los representantes de los laboratorios —claramente sesgada siempre— o la contenida en los libros o en los artículos de revisión narrativa —que no se rigen por criterios objetivos y rigurosos de síntesis de la evidencia científica—, los clínicos que buscan la mejor evidencia clínica disponible pueden recurrir a 2 fuentes de información. Por un lado, revistas de literatura médica secundaria, que incluyen resúmenes estructurados con comentarios clínicos de artículos originales publicados en revistas científicas. Aunque en este terreno el grado de rigor en los métodos de evaluación de los artículos originales es variable, tenemos desde la revista ACP Journal Club6 (suplemento del Annals of Internal Medicine —del American College of Physicians— dirigido a médicos internistas o de especialidades de medicina interna que contiene numerosas evaluaciones de artículos de interés para el nefrólogo) y la revista Evidence Based Medicine7 (revista hermana de ACP Journal Club —fruto de la colaboración del American College of Physicians y el BMJ Medical Journal Publishing Group—, que se orienta a médicos de atención primaria al incluir también artículos publicados en revistas de atención primaria, ginecología y obstetricia, pediatría y otros campos) hasta los resúmenes estructurados que antes se publicaban en Nefrología Basada en la Evidencia8 y ahora en NefroPlus. En estos resúmenes, conviene destacar también las alertas por correo electrónico que envía McMaster Plus™ y Dynamed Plus®9 —que evalúa los artículos según los criterios de calidad, novedad y relevancia— y NDT-Educational Literature Review —en donde son los evaluadores los que plantean sus propios criterios—10. BMJ Clinical Evidence11 es un recurso que ofrece un repertorio de la efectividad de múltiples intervenciones tras un proceso de evaluación basado en la evidencia. Es de pago, únicamente por medio de suscripciones institucionales. La Cochrane Library12 es un repertorio de revisiones sistemáticas que resumen la evidencia de múltiples procedimientos terapéuticos y diagnósticos. Hay una versión en castellano, la Biblioteca Cochrane Plus, con acceso universal gratuito en territorio español gracias a la suscripción efectuada por el Ministerio de Sanidad, Servicios Sociales e Igualdad13. La Colaboración Cochrane ha contribuido a relegar las revisiones narrativas y los artículos individuales a un papel menor en comparación con las revisiones sistemáticas del conjunto de la literatura. Un ejemplo reciente es la revisión sistemática de las dianas del control de la hipertensión arterial en pacientes con hipertensión y enfermedad cardiovascular14. Sus resultados, a diferencia del ensayo SPRINT, no apoyan un beneficio en la mortalidad global de buscar una diana terapéutica más baja15.
Por último, el método más laborioso es el aprendizaje por parte del clínico de cómo encontrar y juzgar la mejor evidencia clínica externa posible, sin recurrir al trabajo previamente hecho por otros. Este método es el mejor, pues proporciona al clínico los mejores instrumentos para que pueda juzgar por sí mismo la calidad y pertinencia de la evidencia, sin personas interpuestas. El aprendizaje de estas habilidades contribuye a mejorar la competencia clínica. Y contribuye a generar una saludable actitud de escepticismo ante la verdadera efectividad de lo que otros proclaman como beneficioso. El prestigio de la medicina basada en la evidencia ha conducido a que múltiples actores reivindiquen la etiqueta de “basado en la evidencia” para apoyar cualquier intervención. En concreto, en la medida en que gran parte de la investigación en nuevas intervenciones terapéuticas está promovida por la industria farmacéutica, muchos ensayos controlados y aleatorizados y muchas revisiones sistemáticas basadas en ensayos adolecen de múltiples sesgos inducidos para favorecer sus productos2,16. En este sentido, algunos defensores de la medicina basada en la evidencia han dado una llamada de atención sobre los riesgos que la amenazan actualmente17,18.
El proceso de la práctica de la medicina basada en la evidencia pasa por 5 fases sucesivas: primera, la formulación de preguntas clínicas; segunda, la búsqueda de la mejor evidencia disponible para contestar esas preguntas; tercera, la evaluación crítica de la validez e importancia de la evidencia encontrada; cuarta, la aplicación de esa evidencia a la práctica clínica, y, por último, la evaluación del rendimiento de esa aplicación. En este proceso, la lectura de la literatura médica debe surgir fundamentalmente de la necesidad de contestar a preguntas clínicas formuladas a partir de los problemas encontrados en la propia práctica clínica. Es decir, no intervienen aquí otros motivos para la lectura de la literatura médica también importantes pero aplicables a otras situaciones, como la necesidad de profundizar en un tema objeto de un proyecto de investigación o la necesidad de mantenerse al día y avanzar en el desarrollo profesional de cada clínico. En conjunto, la lectura crítica de la literatura médica se puede definir como el proceso de examinar cuidadosa y sistemáticamente la investigación con objeto de juzgar su validez, así como su valor y relevancia en un contexto determinado. La lectura crítica de la literatura permite, además, afrontar con éxito la sobrecarga de información médica a que estamos sometidos, al permitirnos “separar el trigo de la paja” y poder encontrar la información que nos sea más valiosa y útil.
PROCESO DE FORMULACIÓN DE PREGUNTAS CLÍNICAS
La formulación de preguntas clínicas constituye la primera fase de este proceso. Consiste en el desglose de la pregunta en los componentes definidos por las siglas PICOtt (por sus palabras en inglés: paciente [P], intervención [I], comparación [C] y desenlace —outcome— [O], junto con el tipo de pregunta [t] —de tratamiento, diagnóstico, pronóstico, efectos adversos, etc.— y el tipo de estudio correspondiente [t] —revisión sistemática, ensayo controlado y aleatorizado, estudio de exactitud de las pruebas diagnósticas, estudio de cohortes, estudio de casos y controles, etc.—). Este desglose, que permite definir con claridad y precisión la pregunta, es la base tanto para hacer una búsqueda de la mejor evidencia disponible que vaya a poder contestarla como para evaluar si los artículos encontrados la abordan adecuadamente.
El proceso de formular preguntas clínicas no es nada sencillo. En realidad surge de la existencia de las lagunas del conocimiento con que todos los clínicos se topan prácticamente a diario. El planteamiento de las preguntas y la búsqueda de las respuestas es la reacción positiva al hallazgo negativo del desfase de los conocimientos que, en la medida en que estos se van desarrollando, es inherente al trabajo del clínico. Las preguntas clínicas surgen de cualquiera de las tareas del trabajo clínico: la interpretación de los hallazgos clínicos, la etiología de las enfermedades o de las complicaciones, el diagnóstico diferencial, la selección e interpretación de las pruebas diagnósticas, el pronóstico, el tratamiento, la prevención y, por último, la autosuperación del clínico (cómo mantenerse al día, mejorar su destreza clínica y llevar a cabo una práctica clínica mejor y más eficaz)19,20.
Todas las preguntas posibles, para cualquier tipo de pregunta o de estudio, se pueden expresar en los 4 grupos del formato PICO. Con frecuencia, surgen múltiples preguntas que hay que jerarquizar por razones de importancia, de urgencia para las necesidades del paciente, de viabilidad para encontrar una respuesta rápida o de la frecuencia con que aparece en la práctica clínica. El proceso de construir y ordenar buenas preguntas exige un cierto entrenamiento, una voluntad decidida de aprendizaje y, ante todo, mucha práctica. Con la práctica, el proceso de formulación de preguntas se convierte en una segunda naturaleza19,21.
BÚSQUEDA DE LA MEJOR EVIDENCIA DISPONIBLE
En cuanto a la búsqueda de la mejor evidencia posible, debe condicionarse al tipo de pregunta planteado. Si es una pregunta de tratamiento, la primera búsqueda debe hacerse en repertorios de revisiones sistemáticas, como la Biblioteca Cochrane, y de ensayos controlados y aleatorizados, como la base de datos Cochrane Central Register of Controlled Trials (CENTRAL), también de la Biblioteca Cochrane22,23. Aunque los formatos de búsqueda de la Biblioteca Cochrane no son tan elaborados como los del PubMed, sí permiten encontrar sin dificultad los ensayos y las revisiones sistemáticas.
Para el resto de preguntas, el repertorio primario debería ser el MEDLINE, a través del PubMed. Aunque las búsquedas no son complicadas, requieren cierta formación y cierta experiencia para poderlas hacer de un modo eficiente24-27. Para ello, la ayuda de un bibliotecario, al menos en los primeros pasos, puede ser incalculable.
Un recurso muy útil en las búsquedas en PubMed es el uso de los interrogantes clínicos (clinical queries). Cuando ante una búsqueda se piden los interrogantes clínicos, además de referencias relacionadas con revisiones sistemáticas y con genética médica, aparecen 5 categorías de estudios clínicos: de etiología, diagnóstico, tratamiento, pronóstico y guías de predicción clínica. Los resultados de las búsquedas se pueden limitar a las referencias más enfocadas al objeto de la búsqueda (búsquedas estrechas —narrow—) o pueden abarcar cualquier tema que remotamente se relacione con él (búsquedas amplias —broad—)28.
GUÍAS DE LECTURA CRÍTICA EN LOS DISTINTOS TIPOS DE ESTUDIOS
En el proceso de lectura crítica de literatura, cada tipo de estudio (de tratamiento, diagnóstico, pronóstico, daño, etc.) requiere un enfoque distinto según las características propias de cada diseño.
Sin embargo, todos ellos se pueden clasificar en 3 grupos de preguntas comunes que, tras modificar los criterios de otros autores, son los siguientes: preguntas relacionadas con el objeto de la investigación, es decir, la definición y relevancia de la pregunta de investigación; preguntas de validez, relacionadas con la validez interna del estudio y la naturaleza, interpretación y aplicación de los resultados, así como la validez externa y novedad del estudio, y preguntas relativas a la integridad científica del estudio en lo que respecta al cumplimiento del protocolo original y a la existencia de conflicto de intereses (tabla 1).
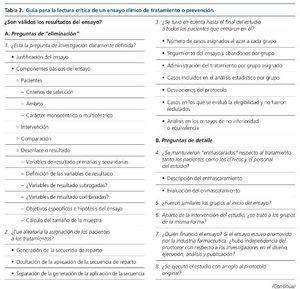
Lo que diferencia a los distintos tipos de estudios específicos son las preguntas de validez, las relacionadas con la validez interna del estudio, la naturaleza de sus resultados, su validez externa, su novedad y su aplicación. Cada tipo de estudio requiere un conocimiento específico de sus particularidades para poder llevar a cabo una lectura crítica adecuada. Por ejemplo, en el caso de los ensayos controlados y aleatorizados, los elementos decisivos son la elección de una variable de resultado con significación clínica indudable (lo que hace que la elección de una variable subrogada —intermedia— pueda ser cuestionable si, como sucede con frecuencia, su relación con las variables clínicas es incierta —es el caso de los ensayos con quelantes del fósforo—) y la evaluación del riesgo de sesgos: el sesgo de selección (la generación de la secuencia del reparto aleatorio y la ocultación de la aleatorización al investigador), el sesgo de ejecución (si no hay suficiente enmascaramiento de los participantes y del personal de investigación con respecto al conocimiento de qué intervención se recibe), el sesgo de detección (si quien evalúa la variable de resultado no está suficientemente enmascarado con respecto al grupo de asignación de los participantes), el sesgo de pérdida (si el análisis estadístico no se puede efectuar por tratamiento asignado —también llamado por intención de tratar—, sea por pérdidas en el seguimiento o por otros motivos), el sesgo de descripción de los resultados y otros sesgos29. La tabla 2 indica los criterios para evaluar un ensayo clínico de tratamiento o prevención, aunque también es aplicable a ensayos controlados aleatorizados de pruebas diagnósticas30.
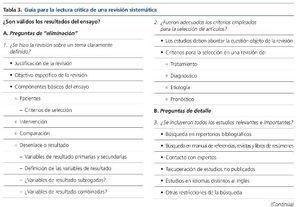
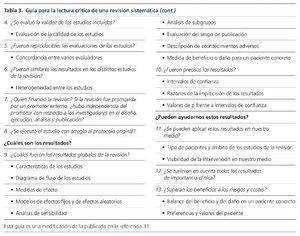
En los estudios de revisión, que deben ser revisiones sistemáticas, no revisiones narrativas, los criterios decisivos son: una exposición clara de la cuestión clínica objeto de la revisión, una descripción clara de las fuentes y los métodos para la identificación exhaustiva de los artículos que componen la revisión, una especificación de los criterios de inclusión y exclusión para la selección de los artículos, la evaluación de los criterios de calidad de los estudios individuales, un análisis estadístico adecuado y un análisis de sensibilidad de los resultados según determinadas consideraciones. En la tabla 3 se muestra una guía de lectura crítica de revisiones sistemáticas31.
En los estudios de exactitud de las pruebas diagnósticas (para distinguirlos de los ensayos controlados y aleatorizados para evaluar pruebas diagnósticas), los criterios más importantes son: la inclusión de un espectro clínico amplio de pacientes con la enfermedad, la evaluación de un patrón de referencia del diagnóstico (el “patrón de oro”) o los criterios estándares aceptados, que cada participante haya recibido tanto la prueba diagnóstica en estudio como la prueba de referencia, las interpretaciones de la prueba diagnóstica y de la prueba de referencia enmascaradas con respecto al resultado de la otra prueba, la reproducibilidad (fiabilidad) de la prueba tanto intraobservador como interobservadores, y la descripción de las sensibilidades, especificidades e intervalos de confianza de las pruebas. En la tabla 4 se muestra un esquema más amplio de una guía de lectura de un estudio de exactitud de las pruebas diagnósticas, modificado de otros autores32,33.
En los estudios pronósticos, los criterios decisivos son: que haya una cohorte de inicio con sujetos sin la enfermedad o el desenlace que se quiere estudiar, que se efectúe una medición adecuada de la exposición o del diagnóstico tanto en el grupo expuesto como en el grupo control, que haya un seguimiento completo de toda la cohorte hasta el desarrollo del desenlace o hasta el final del estudio, y que haya un control adecuado de los factores de confusión. En la tabla 5 se exponen los criterios para la lectura de un estudio pronóstico34.
En los estudios de efectos adversos o nocivos, o de daño, los criterios más importantes son: la recogida prospectiva de datos con grupos claramente identificables (según el tipo de diseño, ensayos controlados y aleatorizados, estudio de cohortes, de casos y controles o series de casos), el enmascaramiento de los evaluadores del desenlace con respecto a la exposición y de los evaluadores de la exposición con respecto al desenlace, y un ajuste suficiente de la confusión en el análisis estadístico. En la tabla 6 se muestra una guía para la lectura crítica de un artículo sobre efectos nocivos35.
En la revista JAMA se publicó una serie de artículos para orientar sobre la lectura crítica de la literatura médica36-57. Además de los tipos de estudios ya comentados, que son los más frecuentes, la serie aborda una gama muy amplia de estudios, desde las guías de práctica clínica hasta la investigación cualitativa. También hay un libro muy completo con múltiples guías58. El programa de habilidades de lectura crítca Critical Appraisal Skill Programme, con origen en Oxford, Inglaterra,59 pero con aplicación también en España60, es un recurso docente muy útil.
Una vez evaluado críticamente un artículo, el evaluador debería redactar un resumen del tema valorado críticamente, para emplearlo en futuras ocasiones, para que sirva de registro de su trabajo, para poder actualizarlo cuando sea necesario y para compartirlo con sus colegas. El Centre for Evidence-Based Medicine de la Universidad de Oxford ofrece un recurso para elaborar esos temas valorados críticamente (critical appraisal topics, CATs), el CATMaker, en los tipos de artículos más frecuentes61.
LA LECTURA CRÍTICA DE LA LITERATURA MÉDICA DESPUÉS DEL GRADE
Algunos de los promotores del movimiento de la medicina basada en la evidencia, junto con otros autores, han propuesto el sistema GRADE (Grading of Recommendations Assessment, Development and Evaluation) para juzgar la calidad de la evidencia y la fuerza de las recomendaciones en las revisiones sistemáticas y en las guías de práctica clínica62,63. Las principales virtudes del sistema GRADE son, por una parte, la combinación de distintos elementos relevantes para juzgar la calidad de la evidencia de una intervención (las limitaciones o sesgos de los estudios implicados, la inconsistencia de los resultados, la ausencia de evidencia directa, los resultados imprecisos, el sesgo de publicación, la fuerza de la asociación, la presencia de un gradiente dosis-respuesta y el efecto de los factores de confusión potenciales)64, tanto en ensayos controlados y aleatorizados como en estudios observacionales, y, por otra parte, la combinación de todos los desenlaces posibles de una intervención para juzgar la fuerza de una recomendación64.
Las ventajas que aporta el sistema GRADE suponen una transformación en el modo de lectura crítica de literatura médica.
Después del GRADE, la evaluación crítica de las intervenciones que pretendan responder a las preguntas clínicas de tratamiento, diagnóstico y prevención debe comenzar con la búsqueda de revisiones sistemáticas y, preferiblemente, de guías de práctica clínica que incorporen el sistema GRADE, pues son las que pueden sintetizar mejor la calidad de la evidencia y la fuerza de las recomendaciones. En nefrología, Gordon Guyatt, uno de los autores del GRADE, ha contribuido recientemente a varias de las guías de práctica clínica de KDIGO. Eso no significa, sin embargo, que las guías elaboradas con el sistema GRADE constituyan una verdad revelada. La ventaja del sistema GRADE es que, en teoría, es transparente y permite evaluar los motivos del juicio de la calidad de evidencia y las razones para la fuerza de la recomendación. Pero las guías de práctica clínica no están libres de sesgos, incluso con el sistema GRADE. Lamentablemente, las guías KDIGO apenas aportan información metodológica acerca de las decisiones tomadas que permitan juzgarlas adecuadamente.
APLICACIÓN DE LA EVIDENCIA A LA PRÁCTICA CLÍNICA
Una vez evaluada críticamente la evidencia, la recomendación de actuación que se desprende de esa evaluación crítica debe aplicarse al paciente concreto que ha suscitado la pregunta clínica. Aquí se plantean varios problemas. Por una parte, la cuestión de hasta qué punto los resultados de otros estudios son aplicables a nuestros pacientes, es decir, la validez externa o generalidad de esos estudios. Por ejemplo, muchos de nuestros pacientes no habrían podido participar en los ensayos clínicos que evaluamos críticamente, debido a que suelen tener otras comorbilidades que les habrían excluido. En esos casos, la pregunta que debemos plantearnos es la de hasta qué punto nuestros pacientes son tan distintos de los que formaron parte del ensayo como para que sus resultados no fueran aplicables45.
Otro aspecto importante para evaluar la aplicación de los resultados a nuestro paciente es la consideración de todos los desenlaces posibles, que incluye los efectos adversos de la intervención, así como consideraciones de costes, si hubiera lugar. La cuestión de los efectos adversos de las intervenciones es una cuestión importante, pues los ensayos controlados y aleatorizados no constituyen un buen diseño para evaluar efectos adversos relativamente infrecuentes o que aparezcan a medio o a largo plazo. Sin entrar en los efectos adversos ocasionados por la interacción entre distintos medicamentos. Además, la descripción de los efectos adversos en las publicaciones de los ensayos controlados y aleatorizados puede ser incompleta. Esto significa que la mera lectura de un ensayo clínico puede relegar a un segundo plano efectos adversos reales que queden desapercibidos.
Diversos estudios han tratado de analizar la aplicación a pacientes concretos de los resultados de estudios efectuados en grupos. Glasziou e Irwig sopesaron los beneficios y los daños de una intervención sobre el supuesto, no siempre cierto, de que los beneficios de una intervención aumentan conforme el riesgo del desenlace aumenta, mientras que el daño de dicha intervención se mantiene constante. El beneficio superaría al daño si el riesgo inicial del desenlace sobrepasa determinado umbral65. El clínico debería estimar el riesgo, la reducción del riesgo aportada por la intervención y el daño ocasionado por ella antes de proponer al paciente una pauta de acción. El paciente debería conocer esa información y participar en la decisión que se tomará. Los valores y las preferencias del paciente, recordemos, constituyen, junto con la mejor evidencia disponible y la pericia clínica individual, los pilares de la práctica basada en la evidencia52.
Otros autores han hecho hincapié en los obstáculos a la aplicación a los pacientes de las evidencias: cuando las circunstancias exteriores no facilitan la aplicación de diversas intervenciones —por no estar disponible la tecnología o el medicamento, por razones organizativas, por insuficiente formación del personal sanitario, etc.—, cuando la presión del tiempo de asistencia es tal que apenas queda tiempo para la lectura crítica o cuando el escaso tiempo libre no se emplea adecuadamente66.
AUTOEVALUACIÓN
El último paso de la práctica basada en la evidencia es la autoevaluación. En todo proceso de aprendizaje y en cualquier empresa que se aborde se deben hacer evaluaciones periódicas con el objetivo último de mejorar el rendimiento. La evaluación permite conocer los puntos débiles y fuertes para permitir tomar medidas correctoras. La autoevaluación se aplica a los otros 4 pasos previos: la formulación de preguntas clínicas susceptibles de respuesta, la búsqueda de las mejores evidencias externas, la lectura crítica de la literatura médica y la aplicación de esa lectura a los pacientes concretos19.
La autoevaluación de la lectura crítica debe comenzar por la pregunta previa ¿se hace alguna vez una lectura crítica de evidencias externas? En caso contrario, ¿cuáles son los obstáculos para hacer la lectura crítica y de qué modo se pueden superar?19. En este sentido, la autoevaluación no debe interpretarse como un proceso individual. Al contrario, el proceso de lectura crítica de la literatura debería ser un proceso colectivo de los miembros de los servicios de nefrología, en donde se compartan las habilidades de todos y en donde los hallazgos de los trabajos individuales —como los de los temas de lectura crítica— supongan un beneficio para el trabajo de todos.
CONCLUSIONES
En la práctica clínica, la lectura crítica de la literatura médica surge de la formulación de preguntas clínicas que revelan lagunas del conocimiento en el tratamiento, el diagnóstico, el pronóstico o la etiología de las enfermedades. Se deben adquirir habilidades específicas para la formulación de esas preguntas, para la búsqueda bibliográfica de los artículos o guías de práctica clínica más adecuados para responder a esas preguntas y para la propia lectura crítica de la literatura.
Para llevar a cabo una lectura crítica adecuada, es necesario poder dominar las particularidades de los tipos de diseño más comunes, los ensayos controlados y aleatorizados, las revisiones sistemáticas, los estudios de exactitud de las pruebas diagnósticas, los estudios pronósticos y los estudios para detectar efectos adversos. Ese dominio solo se puede adquirir con la práctica. La autoevaluación periódica contribuye a mejorar ese aprendizaje.
Conflicto de intereses
El autor declara que no tiene conflicto de intereses potencial relacionado con los contenidos de este artículo.
Conceptos clave
1. La lectura crítica de la literatura médica debe enmarcarse dentro de la práctica de la medicina basada en la evidencia.
2. La lectura crítica debe complementarse con la aplicación de las guías de práctica clínica basadas en la evidencia y con la lectura de literatura secundaria.
3. El aprendizaje de la práctica basada en la evidencia mejora la competencia clínica.
4. Antes de la lectura crítica se deben dominar las habilidades de formular preguntas clínicas y de buscar los artículos o las guías más adecuadas para contestar esas preguntas.
5. Se deben dominar los criterios de lectura crítica de ensayos controlados y aleatorizados, de revisiones sistemáticas, de estudios de exactitud de las pruebas diagnósticas, de estudios pronósticos y de estudios de daño o efectos adversos.
6. El conocimiento de la mejor evidencia disponible hay que aplicarlo a la práctica clínica teniendo en cuenta la pericia clínica y los valores y preferencias del paciente.
7. La autoevaluación periódica debe llevarse a cabo para mejorar todo el proceso de la lectura crítica y la práctica basada en la evidencia.
Correspondencia: Fernando J. García López
Centro Nacional de Epidemiología.
Instituto de Salud Carlos III.
Avda. Monforte de Lemos, 5. 28029 Madrid.
fjgarcial@isciii.es