La relación entre parásitos y glomerulonefritis (GN) está bien documentada en determinadas parasitosis, no así en casos de Strongyloides stercolaris (S. stercolaris), donde hay pocos casos descritos, siendo la mayoría GN de cambios mínimos. Reportamos un caso de hiperinfestación por S. stercolaris en un paciente afectado de una GN membranosa tratado con corticoides por vía oral con resultado fatal para el paciente. Este caso nos aporta una doble enseñanza: en primer lugar, acerca de una asociación rara de estrongiloidiasis y GN membranosa, y en segundo lugar, sobre la importancia de establecer un diagnóstico de sospecha y tratamiento adecuados ante determinadas infecciones o enfermedades con poca expresividad clínica antes de iniciar cualquier tratamiento inmunosupresor.
The relationship between parasites and glomerulonephritis (GN) is well documented in certain parasitoses, but not in cases of Strongyloides stercolaris (S. stercolaris) where there are few cases described being the majority GN of minimal changes. We report a case of hyperinfestation by S. stercolaris in a patient affected by a membranous GN treated with oral corticosteroids with fatal outcome for the patient. This case provides a double teaching: first about a rare association of strongyloid and membranous GN and second about the importance of establishing a diagnosis of suspected and appropriate treatment for certain infections or diseases with little clinical expression before starting any immunosuppressive treatment.
La relación entre parasitosis y glomerulonefritis (GN) está bien documentada en malaria, schistosoma, tripanosoma, toxoplasma, leishmania visceral, equinococo y filaria. No así en casos de Strongyloides stercolaris (S. stercolaris), donde hay pocos casos descritos, siendo la mayoría GN de cambios mínimos (GNCM). Por otro lado, la inmunosupresión utilizada para el tratamiento de la enfermedad renal puede desencadenar, en estas situaciones, un síndrome de hiperinfestación por Strongyloides con resultado fatal para el paciente, de ahí la importancia de establecer un diagnóstico de sospecha y tratamiento adecuados en aquellos pacientes que se consideren de riesgo. Reportamos un caso de hiperinfestación por S. stercolaris en un paciente afectado de una GN membranosa, tratado con corticoides por vía oral.
Caso clínicoSe trata de un paciente varón de 52 años, natural de Ecuador; llevaba más de un año viviendo en España, con antecedentes previos de hipertensión arterial y dislipidemia en tratamiento con lisinopril y atorvastatina. Es remitido a urgencias por hallazgo en unos análisis de control, en su centro de salud, de insuficiencia renal, con una creatinina plasmática (Crp) de 4,3mg/dl y filtrado glomerular estimado (FGe) por CKD-EPI de 13ml/min/1,73 m2. Seis meses antes tenía una Crp de 1,36mg/dl y una orina elemental con proteinuria y microhematuria. En las pruebas complementarias se objetivó una proteinuria glomerular de 10 g al día con microhematuria. Los estudios serológicos (virus de la hepatitis B y C, VIH, CMV, virus de Epstein-Barr) y de autoinmunidad (anticuerpos antinucleares, anticuerpos anticitoplasma de neutrófilos, anticuerpos antimembrana basal glomerular, proteinograma, complemento, antígenos de núcleo extraíbles) fueron negativos/normales. Los anticuerpos antifosfolipasa A2 no estaban disponibles en ese momento. Presentaba eosinofilia leve fluctuante ocasional (1-12%, con eosinófilos 100-900/mm3).
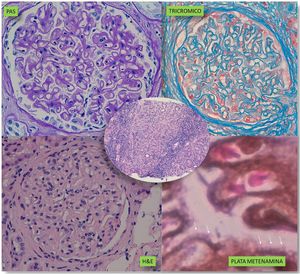
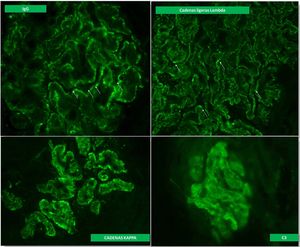
Se realizó una biopsia renal con diagnóstico de GN membranosa en estadio 2-3, con marcada inflamación intersticial (fig. 1). La inmunofluorescencia directa mostró positividad para depósitos granulares en la membrana basal para IGG, cadenas kappa y lambda, y en menor proporción para C3, siendo negativas para el resto de las inmunoglobulinas y C1q (fig. 2). Ante estos hallazgos con importante inflamación intersticial y dada la insuficiencia renal del paciente, se decidió iniciar tratamiento con prednisona a dosis de 60mg/día. Además, se añadieron al tratamiento amlodipino, darbepoetina, furosemida, bicarbonato, atorvastatina, hierro, omeprazol, trimetropin/sulfametoxazol, calcio y vitamina D.
Al mes acude a la consulta refiriendo anorexia y dispepsia inespecífica. La función renal había mejorado hasta una Crp de 2,3mg/dl y FGe 30ml/min/1,73 m2, al igual que la proteinuria, a 2 g/día. En la analítica destacaba hiponatremia moderada (127 mEq/l) con hipercaliemia (6,7 mEq/l), elevación de CA 125 y corticotropina con cortisol en plasma normal. Se decide ingreso hospitalario para completar estudio y al cuarto día inicia con febrícula, taquicardia, bradipsiquia e hiporreactividad. Unas horas después desarrolla crisis comicial generalizada, con signos meníngeos. Se realiza una tomografía computarizada craneal que descarta lesiones ocupantes de espacio y hemorragias agudas; se inicia tratamiento empírico con ceftazidima y ampicilina, y se realiza punción lumbar que muestra datos compatibles con meningitis bacteriana. El cultivo del LCR identifica Escherichia coli, por lo que se sustituye la cefalosporina por un carbapenem. La evolución es mala y a las 48 horas desarrolla disnea, con insuficiencia respiratoria global severa y fluctuaciones del nivel de consciencia, por lo que requiere traslado a la UCI con el diagnóstico de shock séptico secundario a meningitis para ventilación mecánica asistida y soporte con aminas inotrópicas.
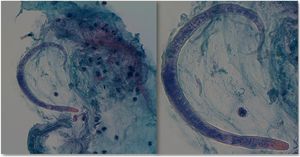
Durante su estancia en la UCI desarrolla bicitopenia, que requiere hemotransfusión; síndrome de distrés respiratorio del adulto secundario a neumonía por Criptococcus neoformans; nuevo cultivo del LCR con crecimiento de un Enterococcus faecium; fracaso renal oligoanúrico que precisa HDFVVC; desnutrición severa y polineuropatía del enfermo crítico. En el estudio anatomopatológico del lavado del líquido broncoalveolar (LBA) se objetiva un infiltrado inflamatorio con eosinófilos y presencia de parásitos indicativos de S. stercolaris (fig. 3), que posteriormente se identifican también en el coprocultivo. Recibió tratamiento con meropenem, vancomicina, anfotericina B liposómica y posteriormente con fluconazol, trimetropin/sulfametoxazol, ivermectina y albendazol. Durante el seguimiento crece un CMV en sangre (1.000 copias/ml), por lo que se añade ganciclovir. Pese a negativizar el coprocultivo, el cultivo de LBA y los hemocultivos, el paciente no mejora clínicamente y persiste en situación de coma vigil. El electroencefalograma pone de manifiesto un severo enlentecimiento y supresión difusa de la actividad cerebral, y la resonancia magnética cerebral identifica señales de hiperintensidad en T2 en la región parasagital frontal derecha y el asta occipital del ventrículo lateral derecho, indicativos de persistencia de proceso inflamatorio/infeccioso. Pese a mantener un tratamiento antibiótico adecuado a los cultivos, el paciente fallece tras desarrollar insuficiencia respiratoria por una neumonía nosocomial por Stenotrophomona maltophilii.
DiscusiónEste caso clínico pone de manifiesto el devastador pronóstico de un síndrome de hiperinfestación por S. stercolaris en un paciente inmunosuprimido por corticoides y que a priori no parecía tener otros factores de riesgo. El S. stercolaris es un helminto de ciclo telúrico que mide 2,5mm en estado adulto femenino y entre 0,3-0,6mm en estado de larva, que habita principalmente en el este de Europa, sureste asiático, América del Sur y África subsahariana, con índices de prevalencia cercanos al 30%1. España fue país endémico, sobre todo en el área mediterránea, aunque en las últimas décadas han aumentado los casos importados debido a la inmigración2. Se contagia por contacto con el suelo o por ingesta de comida o agua contaminada. Vive en la mucosa del yeyuno superior y se reproduce partenogénicamente, completando su ciclo vital pasando de larva rabditiforme no infectiva a larva filariforme infectiva que autoinfecta al huésped atravesando la luz intestinal, llegando a los linfáticos de la pared y de ahí al torrente sanguíneo, desde donde alcanza el hígado y posteriormente el pulmón, el riñón y el sistema nervioso central, autoperpetuándose su infección.
Cuando sucede una invasión intestinal o pulmonar de un gran número de larvas, puede desencadenarse un fracaso multiorgánico que se conoce como síndrome de hiperinfestación. Es más frecuente en pacientes de edad avanzada, con enfermedad renal, diabéticos, malnutridos, en situaciones de aclorhidria e inmunosuprimidos por cualquier causa (lepra, corticoterapia, VIH, HTLV-I, tratamiento con antifactor de necrosis tumoral alfa, postrasplante de órgano sólido o médula ósea3-12 y, aunque infrecuente, también puede darse en pacientes inmunocompetentes.
El diagnóstico de una parasitosis por S. stercolaris puede realizarse detectando los parásitos en heces o en otras muestras biológicas en el caso de hiperinfestación. La visión directa de heces se utiliza de manera rutinaria en los laboratorios pero tiene una sensibilidad muy baja, mejorando algo dicha sensibilidad si se utilizan muestras repetidas. También se puede recurrir al cultivo de heces en agar y a métodos de inmunoanálisis directos o indirectos, detectando anticuerpos frente a Strongyloides9.
La ivermectina se considera el tratamiento de elección en cuadros de hiperinfestación. Tiabendazol y albendazol consiguen resultados de remisión comparables en infecciones no complicadas, siendo peor tolerados que ivermectina9. En España, la ivermectina debe solicitarse como medicación extranjera y la dosis convencional recomendada es de 0,2 μg/kg/día durante 2 días, siendo preciso repetir la dosis a los 15 días9. En casos de dosis acumulada de prednisona superior a 420mg en 4 semanas, algunos autores remiendan profilaxis en pacientes de riesgo de infestación13.
En los 10 casos reportados en la literatura de síndrome de hiperinfestación por Strongyloides14, el 88,9% eran varones, con edad media 48 años (24-79), con inicio con dolor abdominal como síntoma más frecuente (88,9%) y en menor porcentaje fiebre (66,7%), infiltrados pulmonares (66,7%), diarrea (44,4%), eosinofilia (66,7%) y mortalidad del 22,2%. En datos globales, la eosinofilia no supera un 20-35% y suele tener un carácter episódico, no continuo. Se duda sobre su valor pronóstico, ya que parece representar una adecuada respuesta inmune Th2 pero los datos son contradictorios. Es fundamental el diagnóstico de sospecha en pacientes inmunosuprimidos, especialmente en tratamiento con corticoides, con eosinopenia o eosinofilia, con enteropatía pierde proteínas o síndrome de malabsorción, náuseas, vómitos e íleo, y en pacientes procedentes de países endémicos. Chan et al.14 refieren el caso de un varón vietnamita de 72 años, con residencia en Australia, afectado de diabetes mellitus y asma, que tras cirugía laparoscópica reciente desarrolla síndrome de hiperinfestación y fallece al séptimo día de iniciar el tratamiento con ivermectina. Clínicamente se ha asociado a cuadros seudoobstructivos y puede llegar a complicarse con procesos tumorales, como adenocarcinoma de colon, linfoma GIT de células T y linfoma MALT de estómago y colon15, en relación con coinfección por Helicobacter pylori, y resolución al tratar ambas infecciones. El mecanismo asume la interacción de un antígeno del parásito con la mucosa colónica provocando un estímulo continúo de los linfocitos T.
En una extensa revisión de los casos de estrongiloidiasis reportados en España desde el año 2000 al 20152 se recogen 18 casos; el 66,7%, varones con una edad media de 40 años (21-70). El 94,4% es de origen foráneo, mayoritariamente sudamericanos (82,3%) y en segundo lugar del oeste de África (17,6%). Solo se reporta un autóctono desde el 2006. El 77% de ellos estaban inmunosuprimidos por corticoterapia, VIH, HTLV y trasplante de órgano sólido. La clínica inicial fue digestiva en un 55,6% de casos, con síndrome febril acompañante en un 27,8%. Un caso cursó con síndrome nefrótico, sin más datos, por lo que no se ha incluido en el cómputo total. La mortalidad fue del 11,1%.
Hay descritos 18 casos que asocien infestación por Strongyloides con enfermedad glomerular, 11 de ellos con diagnóstico histológico (tabla 1)10,16-23. Casi todos inician entre 4-8 semanas tras el inicio del tratamiento corticoideo y la mayoría de ellos son definidos como GNCM. En líneas generales, el diagnóstico de la GN precedió al de la parasitosis, que se desenmascaró tras el tratamiento corticoideo, excepto en el caso referido por Hsieh et al.16, que inició con la parasitosis y la GN se desarrolló 3 meses después, resolviéndose tras iniciar tratamiento con ivermectina. Cuatro de los pacientes fallecieron; en el resto se resuelve la parasitosis y la enfermedad renal, salvo en uno de los casos descritos por Gravellone et al.22, un ecuatoriano afectado de GN focal y segmentaria tratado con prednisona que tras resolución de la infestación por Strongyloides persiste con la afectación renal.
Resumen de casos de infestación por Strongyloides con síndrome nefrótico publicados en la literatura
| Caso | Edad/sexo/raza | Tiempo inicio desde inicio corticoides | Biopsia renal | Resolución |
|---|---|---|---|---|
| Mori et al. (1998)17 | 62/varón/japonés | 4 semanas | CM. Expansión de matriz mesangial con escaso daño tubular por infiltración monocítica y necrosis.IF IgM mesangial | Resolución |
| Wong et al. (1998)18 | 42/mujer/Hong Kong | 6 semanas | CM. 1/6 SL fibrosas. Leve/moderada atrofia tubularIF negativa | Resolución |
| Yee et al. (1999)19 | 55/Varón/Hong Kong | 6 semanas | CM. Hipercelularidad mesangial.IF Ć3 granular en la MBGME: fusión pedicelar, aumento de celularidad y matriz mesangial sin inmunodepósitos | Resolución |
| Morimoto et al. (2002)20 | 60/mujer/japonesa | 8 semanas | CMIF negativa | Fallecido |
| Hsieh et al. (2006)16 | 72/mujer/taiwanesa | No cuantificada | CM, infiltrado intersticial focal linfocitario. Túbulos dilatados parcheadamente con signos de regeneración epitelialIF: Ć3 mesangialME: borramiento de podocitos sin depósitos electrón densos | Resolución |
| Sathe y Madiwale (2006)23 | 38/mujer/india | 12 semanas | MP. Esclerosis glomerular generalizada. Fibrosis y atrofia túbulo-intersticial. | Fallecida |
| Miyazaki et al. (2010)21 | 69/varón/japonés | 40 días | CM. No atrofia tubular ni fibrosis intersticialIF negativa. ME borramiento de podocitos sin depósitos electrón densos | Fallecido |
| Gravellone et al. (2015)22 | 31/varón/ecuatoriano58/varón/ecuatoriano | No se especifica24 semanas | FySGN mesangial | ResoluciónResolución |
| Abdullah et al. (2018)1 | 67/varón/Puerto Rico | 4 semanas | CMIF: depósitos lineales en la MBG de IgG y cadenas kappa de significado inciertoME: fusión podocitaria | Resolución |
| M. Ortega (2018) | 53/varón/Ecuatoriano | 4 semanas | GNMb. Infiltrado túbulo-intersticial y fibrosis. IF: IgG, kappa, lambda, C3 | Fallecido |
El caso descrito ilustra la elevada mortalidad y gravedad de un síndrome de hiperinfestación por Strongyloides desencadenado por la inmunosupresión necesaria y utilizada habitualmente en el tratamiento de las enfermedades glomerulares. Este caso nos aporta una doble enseñanza, primero acerca de una asociación rara de estrongiloidiasis y GN membranosa, y la segunda y más importante, sobre la trascendencia de establecer un diagnóstico de sospecha y tratamiento adecuados ante determinadas infecciones o enfermedades con poca expresividad clínica en aquellos pacientes de riesgo antes de iniciar cualquier tratamiento inmunosupresor. Es mandatorio prestar especial atención al riesgo individual de cada paciente de complicaciones infecciosas, remitiéndonos a la historia clínica e investigando en su procedencia, conductas o viajes de riesgo. En el caso de S. stercolaris, una eosinofilia leve y fluctuante en pacientes procedentes de zonas endémicas puede ser la única alteración que nos ayude a establecer un diagnóstico de sospecha.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.