INFECCIONES BACTERIANAS
Introducción y definiciones
A pesar del avance en la calidad y esperanza de vida del paciente portador de trasplante de órgano sólido (TOS), las infecciones, especialmente las causadas por bacterias multirresistentes (MR), amenazan la progresión de los avances conseguidos1.
La infección es la segunda causa de muerte en el TOS, y causa aproximadamente el 18% de los fallecimientos. En el trasplante renal (TR), la prevalencia de infecciones por bacterias MR en el período postrasplante es del 14%, y es más frecuente en los primeros meses pos-TR. Estas infecciones disminuyen de forma directa la supervivencia del injerto y del paciente2-6.
Ante el aumento progresivo en la incidencia de estas infecciones, se han establecido unas definiciones según el grado de resistencia a los diferentes antibióticos dependiendo del tipo de bacteria1,6:
• MR: resistencia a uno o más agentes en 3 o más categorías antimicrobianas activas frente a las bacterias aisladas (Staphylococcus aureus se define MR si es resistente a meticilina).
• Extremadamente resistente (XR): susceptibilidad a no más de 2 clases de antimicrobianos activos frente a las bacterias aisladas.
• Panresistencia: ausencia de susceptibilidad a todos los agentes antimicrobianos activos frente a las bacterias aisladas.
En los pacientes TOS, las infecciones por enterobacterias MR/XR y bacilos gramnegativos (BGN) no fermentadores MR/XR están aumentando, mientras que por S. aureus han disminuido.
Factores de riesgo y políticas de control
Se ha establecido una serie de factores de riesgo (FR) para presentar una infección por una bacteria MR. A continuación se enumeran los FR comunes a todos los TOS y los específicos en el caso de los TR1,4,6.
Trasplante de órgano sólido:
• Hospitalización prolongada.
• Vías centrales.
• Sondas vesicales.
• Nutrición parenteral.
• Intubación orotraqueal.
• Terapia renal sustitutiva.
Trasplante renal:
• Trasplante combinado páncreas-riñón.
• Retraso en la función del injerto en trasplante con donantes con criterios expandidos.
• Estenosis ureterales/reflujo vesicoureteral pos-TR.
• Alteraciones de la vía urinaria.
• Necesidad de reintervención quirúrgica.
• VHC (virus de la hepatitis C) positivo.
Por otro lado se han establecido una serie de recomendaciones para controlar la aparición y contagio de este tipo de infecciones. Las políticas de control recomendadas se muestran en la tabla 1.
Bacilos gramnegativos
Enterobacterias
Las infecciones por enterobacterias MR son causa del aumento de las infecciones nosocomiales (12% de incidencia), y se ha objetivado un incremento de las resistencias combinadas y múltiples en este tipo de microorganismos1,6.
Según el tipo de resistencia se pueden dividir en:
• Betalactamasa: cuyos representantes más relevantes serían:
– Betalactamasas de espectro extendido (BLEE): Escherichia coli y Klebsiella pneumoniae.
– AmpC: Enterobacter spp., Citrobacter freundii, Morganella morganii.
• Carbapenemasa: K. pneumoniae, el más relevante.
Betalactamasas
La incidencia particular de infecciones por enterobacterias BLEE en el TR es aproximadamente del 12%7. En el TR, el 70% de los casos de infecciones por enterobacterias MR son infecciones del tracto urinario (ITU).
Factores de riesgo establecidos para las infecciones por bacterias betalactamasa en los portadores de TR2,7,8.
• Trasplante combinado páncreas-riñón.
• Colonización intestinal.
• Exposición previa a antibióticos de amplio espectro.
• Necesidad de hemodiálisis (HD) postrasplante.
• Obstrucción de la vía urinaria.
Por otro lado, el TR se ha identificado como FR independiente para padecer una bacteriemia por enterobacterias MR.
En cuanto a las políticas de screening y descolonización, no está contraindicado el TR en un paciente colonizado por microorganismos BLEE/AmpC, aunque esto sí que se ha relacionado con una peor evolución. A pesar de que la colonización intestinal se describe como un factor de riesgo de infecciones por enterobacterias productoras de betalactamasa, en el caso particular del TR no existe evidencia que apoye la recomendación de realizar screening universal para descartar colonización intestinal en todos los pacientes6.
Infección del lecho quirúrgico. Las enterobacterias, especialmente las productoras de betalactamasa, son unas de las principales causantes de la infección del lecho quirúrgico. En el TR, la incidencia de infección del lecho quirúrgico se ha descrito entre el 2 y el 20%, aunque la mayoría de las series describe una incidencia menor del 10%9. Este tipo de infecciones se ha correlacionado con la supervivencia del injerto y del receptor en el período pos-TR inme diato9,10.
Las bacterias más frecuentes son: S. aureus, estafilococos plasmocoagulasa negativos (EPCN), Enterococcus spp., enterobacterias (50%) y Pseudomonas aeruginosa9.
Factores de riesgo más aceptados para la infección del lecho quirúrgico9.
• Diabetes mellitus.
• Obesidad.
• Reintervención quirúrgica.
Recomendación para la prevención de infecciones del lecho quirúrgico. Como profilaxis antibiótica pre-TR se recomienda tratamiento con cefazolina, excepto en pacientes en los que coexistan varios FR para la infección del lecho quirúrgico, en los que se recomienda valorar otras pautas profilácticas (p. ej., ertapenem) (grado de evidencia D).
Carbapenemasas
Las infecciones por bacterias carbapenemasas (CR) han presentado una incidencia creciente en los últimos años, con un alto índice de recaídas. Presentar una infección por una bacteria CR incrementa la mortalidad (40% en estudios realizados en TR). En particular, la infección por K. pneumoniae CR en pacientes con TR se asocia con un mayor riesgo de muerte precoz a los 6 meses del trasplante11,12.
La ITU es la infección más frecuente por este tipo de bacterias en el TR11.
Factores de riesgo para sufrir una infección por bacteria carbapenemasa1,11,12.
• Trasplante combinado páncreas-riñón.
• Colonización intestinal.
• Obstrucción de la vía urinaria, con necesidad de catéteres o stents ureterales.
Las políticas de screening y descolonización son similares a las de las infecciones por bacterias betalactamasas; el TR no está contraindicado en el paciente colonizado por BGN CR, aunque el riesgo de infección del injerto y la muerte del paciente probablemente están elevados. A pesar de que la colonización intestinal se describe como un factor de riesgo en las infecciones por enterobacterias CR, en el caso particular del TR no existe evidencia que apoye la recomendación de realizar screening universal para descartar colonización intestinal en todos los pacientes6.
Bacilos gramnegativos no fermentadores
Introducción y epidemiología
De forma general en el TOS, P. aeruginosa es una causa relevante de neumonía y bacteriemia en el postrasplante inmediato. Otros representantes de este grupo de bacterias, como Burkholderia spp., Stenotrophomonas maltophilia y Achromobacter xylosoxidans, presentan incidencias mucho menores. Por otro lado, en el TOS, el 50% de las especies de Pseudomonas aisladas son MR13.
Hay escasos datos sobre la prevalencia de las infecciones por estos microorganismos en población con TR en España.
Factores de riesgo1
• Trasplante previo.
• Haber padecido una infección nosocomial.
• Estancias en UCI.
• Shock séptico
Screening y descolonización. No está contraindicado el TR en el paciente colonizado por BGN no fermentadores MR. A diferencia de las infecciones por enterobacterias, no existen datos en TR para valorar su influencia en la supervivencia del injerto o del paciente. Como norma general, el screening para descartar colonización en pacientes que van a recibir un TR no está recomendado6.
Infecciones del tracto urinario
Introducción y epidemiología
La ITU es una de las infecciones con más alta frecuencia en el pos-TR14. Su incidencia varía dependiendo del tipo de afectación al que nos refiramos:
• Bacteriuria asintomática (BA): aislamiento microbiológico en orina sin clínica. Las diferentes series recogen una incidencia aproximada del 40% en el primer año pos-TR.
• ITU recurrente: con 2 definiciones aceptadas, tiene una incidencia de entre el 5-30% según las diferentes series15,16.
– 3 o más episodios en 12 meses.
– 2 o más episodios en los últimos 6 meses.
En cualquiera de los 2 casos, en la última década ha aumentado la incidencia de ITU provocadas por microorganismos MR17.
Factores de riesgo de infección del tracto urinario8,14,15
• Edad avanzada.
• Sexo femenino.
• Necesidad de HD en el período postrasplante.
• Diabetes mellitus como FR para tener una ITU por un microorganismo MR.
Infección del tracto urinario recurrente
Las ITU recurrentes están producidas, principalmente, por bacterias MR; la más frecuente es E. coli14. Ante la aparición de ITU recurrentes se recomienda siempre descartar alteraciones de la vía urinaria (vejiga neurógena, estenosis ureterales, reflujo vesicouretral) que puedan corregirse quirúrgicamente. Sin embargo, la mayoría de los episodios no tiene causa anatómica y solo precisa tratamiento médico. En el caso particular de pacientes con poliquistosis renal, que mantengan sus riñones propios, se debe valorar siempre la infección de quistes.
Aunque en el momento actual está en controversia la asociación de la ITU recurrente con una mayor disfunción del injerto a largo plazo, sí que está aceptado que aumenta el riesgo de cicatrices en el injerto16,18,19.
Factores de riesgo16
• Infección por una bacteria MR.
• Persistencia de la bacteriuria tras tratamiento adecuado.
• Edad avanzada (> 60 años).
• Reintervención.
Los clásicos factores de riesgo de ITU recurrente en la población general (sexo femenino o diabetes) no han demostrado ser aplicables en el TR.
Tratamiento
No se recomienda realizar screening sistemático de cultivo de orina en portadores de TR más allá de los 2 meses pos-TR, siempre que no sean portadores de algún tipo de dispositivo urológico (sonda vesical, catéteres o stents ureterales, nefrostomías). Se ha demostrado que, en estos pacientes, el tratamiento de las bacteriurias asintomáticas no aporta ningún beneficio y, aún más, incrementa el riesgo de seleccionar microorganismos MR20a.
Infecciones del tracto urinario recurrentes
No existen datos en TR sobre la eficacia de los diferentes tipos de profilaxis antibiótica. Asimismo, hasta el momento tampoco se ha demostrado la eficacia de las vacunas bacterianas individualizadas frente a las ITU en los pacientes portadores de TR. Por último, tampoco hay datos sobre la eficacia de medidas no farmacológicas como el extracto de arándano.
Dentro de los antibióticos recomendados:
• Fosfomicina: posible opción en TR por no haberse incrementado las resistencias a este fármaco en la última década17.
• Nitrofurantoína: en dosis profiláctica es la medida más útil en mujeres no trasplantadas. Sin embargo, actualmente existe una alarma de la Agencia Española de Medicamentos y Productos Sanitarios sobre el riesgo de neumonitis intersticial con su uso como profilaxis20b.
Posibles opciones preventivas
Está en discusión el impacto de los antibióticos de amplio espectro como profilaxis en el trasplante (especialmente meropenem o imipenem) sobre el riesgo de ITU recurrentes. Hasta el momento, no se ha demostrado una clara eficacia de las terapias de descolonización intestinal en la incidencia de ITU a largo plazo en el TR.
Staphilococcusaureus resistente a meticilina
Introducción
S. aureus es una bacteria grampositiva con una alta prevalencia mundial: 1,5-3% de portadores asintomáticos en la población general21.
En relación con S. aureus resistente a meticilina (SARM), cuando produce infección activa, la bacteriemia por SARM alcanza índices de mortalidad del 20%. En los TOS, el SARM se asocia a las diferentes complicaciones perioperatorias: bacteriemia, infección de la herida quirúrgica (aunque con menor frecuencia que los BGN), colecciones intraabdominales y neumonía22.
Epidemiología
S. aureus es la principal causa de bacteriemia nosocomial en Europa.
En el TOS, la incidencia está disminuyendo en los últimos años (sexta causa de infección activa), pero la infección activa por SARM conlleva una alta mortalidad23.
No existen muchos datos sobre su prevalencia (portadores/ infección activa) en la población portadora de TR. La mayoría de los datos son de estudios de trasplante hepático y se sabe que el 8,5% (0,1-27%) de los pacientes en el momento del trasplante hepático son portadores nasales. El ser portador de SARM pretrasplante y postrasplante incrementa significativamente (6 y 11 veces, respectivamente) el riesgo de padecer infección activa por SARM en el trasplante hepático21,24,25. Estos datos no se han demostrado en TR, y hay escasos datos de incidencia de colonización/infección en TR: 0,5-2%25.
Factores de riesgo para infección activa23,24
• Intervención quirúrgica.
• Exposición a antibióticos de amplio espectro.
• Estancias en UCI.
• Inmunosupresión: esteroides.
• Ser portador de SARM o estar en contacto con portadores.
• Ser portador de cuerpos extraños (vías centrales, catéteres o drenajes abdominales, etc.).
Estrategias preventivas
No existen datos específicos sobre estrategias preventivas para la población trasplantada. Las diferentes estrategias propuestas se han extrapolado de otras poblaciones de riesgo6:
• Higiene de manos y limpieza ambiental.
• Screening y erradicación de SARM en todos los pacientes en el momento de ingresar para el TR.
• Aislamiento de contacto.
• Control de la administración de antibióticos de amplio espectro.
La pauta de descolonización propuesta es mupirocina tópica al 2%: 1 aplicación/12 h durante 5 días + baños con clorhexidina durante 7 días.
Por otro lado existen situaciones que implican únicamente colonización, no infección. Por tanto, se recomienda valorar de forma individualizada la necesidad de tratamiento antibiótico en el postoperatorio en pacientes asintomáticos cuando se ha aislado un SARM en esputo, drenajes o exudado de herida quirúrgica.
Enterococo resistente a vancomicina
Dada la escasa entidad, en nuestro medio y hasta el momento, de las infecciones por enterococo resistente a vancomicina (EVR) recogemos únicamente un resumen de las recomendaciones para su abordaje6,23.
INFECCIÓN POR CLOSTRIDIUM DIFFICILE
Introducción y epidemiología
Clostridium difficile (CD) es un bacilo grampositivo formador de esporas. Es la causa principal de la diarrea nosocomial asociada al uso de antibióticos. En la última década se ha observado un incremento en la gravedad de la infección por CD, influido por la aparición de cepas hipervirulentas (RT027 y 078)26-28.
Existe, sin embargo, una importante variabilidad clínica, desde portadores asintomáticos hasta pacientes que sufren megacolon tóxico. Dependiendo de la presentación clínica se ha establecido una graduación de la infección por CD:
• CD leve: diarrea sin signos ni síntomas de colitis.
• CD moderado: diarrea con datos de colitis (fiebre, dolor abdominal).
• CD grave: leucocitosis > 15.000 células/μl, hipoalbulinemia (< 3 g/dl) y/o deterioro de la función renal (> 1,5 veces la creatinina sérica basal)
Al igual que la gravedad de la infección por CD, su incidencia ha aumentado en la última década. En el caso particular de los pacientes portadores de TOS, se ha observado una prevalencia del 3-16%. En el TR la incidencia se ha establecido en < 2%29.
En el caso de los pacientes inmunodeprimidos, las recurrencias representan un problema en aumento. Se definen como la reaparición de nuevos síntomas dentro de las siguientes 8 semanas tras la completa resolución de una infección por CD después de un tratamiento adecuado. Se han establecido recurrencias de la infección por CD del 19,7% del total de TOS, mientras que en el TR se han descrito índices de recurrencia de hasta el 34%27.
Factores de riesgo más aceptados para la infección por Clostridium difficile recurrente26,29.
• Edad > 65 años.
• Historia previa de infección por CD.
• CD previo grave.
• Hospitalización prolongada.
• Uso prolongado de antibióticos.
• Uso prolongado de inhibidores de la bomba de protones.
• Hipogammaglobulinemia.
Opciones terapéuticas
Las medidas generales recomendadas cuando se diagnostica una infección por CD incluyen30:
• Retirada del antibiótico inductor y del resto de los medicamentos que hayan podido predisponer a la infección por CD, tan pronto como sea posible.
• Aislamiento de contacto.
• Evitar el contagio con el lavado de manos, más eficaz que las soluciones alcohólicas.
En la tabla 2 se recogen las recomendaciones terapéuticas para el tratamiento de la infección por CD dependiendo del grado de gravedad o de si se trata de un primer episodio o de una recurrencia.
Fidaxomicina. 200 mg vía oral con/sin comida cada 12 h, 10 días. Antibiótico perteneciente al grupo de los antibacterianos macrocíclicos con las siguientes propiedades:
• Pobre absorción en el tracto gastrointestinal, que alcanza elevada concentración en las heces.
• Bajo riesgo de selección de EVR.
• No descritas interacciones medicamentosas.
• Perfil de seguridad y tolerabilidad alto.
Su eficacia para producir curación clínica es similar a la de la vancomicina oral en el tratamiento de la infección por CD leve-moderada. Sin embargo, en el grupo de pacientes que recibían tratamiento antibiótico concomitante, la fidaxomicina fue más eficaz que la vancomicina oral en conseguir dicha curación. Se ha descrito que la fidaxomicina podría ser más favorable en la reducción de la aparición de recaídas31,32.
Trasplante fecal. Se trata de la transferencia al receptor de heces frescas de donantes sanos (por colonoscopia, enema o sonda nasogástrica) para restablecer la microflora intestinal dañada.
Se ha descrito una alta eficacia del trasplante fecal (TF) en el tratamiento de las recaídas múltiples. Sin embargo, los datos en pacientes con TOS se han extraído únicamente de experiencias clínicas.
En un estudio publicado recientemente en los pacientes que presentan recidiva de la infección por CD, el TF por colonoscopia fue el más coste-efectivo, seguido del realizado por enema y del tratamiento con fidaxomicina.
Hay estudios que muestran la seguridad y eficacia del TF para el tratamiento de la infección por CD recurrente, refractaria o grave en pacientes inmunocomprometidos. Sin embargo se han descrito hasta un 30% de efectos secundarios en el TOS33-37.
En el futuro es posible que el TF se simplifique y estandarice con la administración de las bacterias fecales criopreservadas en cápsulas, aún no disponibles.
Nuevas terapias. El uso excesivo de antibióticos está condicionando, en gran parte, por formas recurrentes y graves de infección por CD en relación con resistencia microbiana, lo que obliga a la búsqueda de nuevas pautas terapéuticas. Las siguientes terapias se encuentran actualmente en proceso de investigación, algunas con buenas perspectivas de futuro30,38,39:
• Anticuerpos antitoxinas (bezlotoxumab).
• Inhibidores de la esporulación y germinación.
• Inhibidores de las adhesinas.
• Inhibidores de la formación del biofilm.
• Sortasa.
• Biosíntesis del p-cresol.
• Acción sobre los factores del huésped.
INFECCIÓN POR CITOMEGALOVIRUS RESISTENTE A GANCICLOVIR
Introducción y epidemiología
El citomegalovirus (CMV) es uno de los patógenos más relevantes en el TR. Puede causar enfermedad invasiva y modular el sistema inmune del receptor, lo que implica un aumento en la morbimortalidad de este.
El desarrollo del ganciclovir (GCV) y su derivado, valganciclovir (ValGCV), supuso una importante mejora en la supervivencia de los pacientes con enfermedad por CMV. Se trata de un análogo de los nucleósidos que precisa de su fosforilación a través de la proteincinasa viral (UL97) previamente a su acción inhibiendo la polimerasa viral (UL54).
El 98% de los pacientes portadores de TR con enfermedad por CMV responde adecuadamente al tratamiento con GCV. Sin embargo, se ha descrito una incidencia global de un 2% de enfermedad por CMV resistente a GCV (GCV-R) con diferente incidencia dependiendo del estatus CMV pretrasplante40-42:
• Estatus D+/R–: 10-15%.
• Receptores +: 0,15%.
• En la bibliografía, no se han descrito casos en pacientes con estatus CMV D–/R–.
Factores de riesgo descritos para sufrir una enfermedad por citomegalovirus resistente a ganciclovir40,41,43.
• Estatus CMV D+/R–.
• Alto grado de inmunosupresión.
• Infradosificación de GCV/ValGCV.
• Viremias subclínicas prolongadas.
• Tratamiento anticipado en pacientes D+/R–: incidencia del 7-14% frente al 3-6% en los pacientes que reciben tratamiento profiláctico.
• Tratamiento profiláctico durante 6 meses.
Diagnóstico de resistencias
Se han establecido una serie de definiciones con referencia a la enfermedad por CMV GCV-R40,44:
• Sospecha de resistencia: persistencia de replicación viral, a pesar de 2 semanas de tratamiento antiviral adecuado.
• CMV refractario (resistencia clínica): persistencia de replicación viral en ausencia de resistencia confirmada.
• CMV resistente (resistencia virológica): resistencia confirmada (mutación en UL97 y/o UL54) tras realizar genotipo (el 50% de los pacientes con sospecha clínica).
Basado en lo anterior, cuando existe una sospecha de resistencia se recomienda realizar un análisis de resistencias para esclarecer la presencia en el virus de mutaciones en los genes UL97 y UL54. Las técnicas que se utilizan para el análisis de resistencias pueden tener falsos negativos, dado que no detectan mutaciones que solo están presentes en < 20% de la carga viral analizada45. Es posible que las nuevas técnicas de secuenciación de nueva generación aumenten la sensibilidad de dicho análisis. En la práctica clínica habitual es importante recalcar que se precisa una carga viral mínima de 1.000 copias/ml para poder realizar el análisis de resistencias.
Las mutaciones descritas en la actualidad pueden afectar a los siguientes genes:
• Gen UL97 (las más frecuentes, representan el 90% de las mutaciones diagnosticadas): codifica para una proteincinasa responsable de la fosforilación inicial del GCV en las células infectadas. Por tanto, solo provoca resistencias a GCV. Dependiendo del tipo de mutación producirá un grado diferente de GCV-R.
• Gen UL54 (solo el 10% de las mutaciones diagnosticadas): codifica para una ADN-polimerasa viral, enzima objetivo de muchos fármacos antivirales. Como consecuencia da lugar a resistencias cruzadas. Mutaciones en el gen UL54 se pueden describir asociadas o no a mutaciones en el UL97.
Opciones terapéuticas
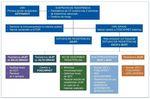
El grupo Prometeo propone un algoritmo de diagnóstico y tratamiento de la enfermedad por CMV ValGCV/GCV-R, en el que se plantean los tratamientos alternativos que se exponen a continuación (fig. 1).
Figura 1. Algoritmo diagnóstico y de tratamiento de enfermedad por citomegalovirus (CMV) ValGCV/GCV-R. CV: carga viral; GCV: ganciclovir; IGIV: inmunoglobulinas intravenosas; imTOR: inhibidores del ligando de la rapamicina en los mamíferos (mammalian target of rapamycin); ValGCV: valganciclovir.
Incremento de la dosis de ganciclovir (intravenoso)
Útil en casos de resistencias secundarias a mutaciones en el UL97 de bajo grado46. La principal limitación de esta opción terapéutica es la alta incidencia de efectos secundarios hematológicos. Esto obliga, en numerosas ocasiones, al ajuste de dosis o a la suspensión de otros fármacos mielotóxicos, y tienen especial relevancia los ajustes de dosis o suspensión del micofenolato que, en pacientes de alto riesgo inmunológico, como consecuencia pueden desencadenar un rechazo.
Inmunosupresión basada en imTOR (vía oral)
Los inhibidores del ligando de la rapamicina en los mamíferos —mammalian target of rapamycin— (imTOR), como tratamiento inmunosupresor de novo o de introducción precoz (< 3 meses pos-TR), han demostrado, en estudios prospectivos y ensayos clínicos, un efecto protector frente al CMV comparados con otros inmunosupresores. En los pacientes tratados con imTOR, la incidencia de infección o enfermedad por CMV se ha descrito como significativamente inferior. Se han descrito series de casos de infección por CMV GCV-R con buena respuesta tras la introducción de un imTOR47,48. Aun así existe escasa evidencia para recomendar su utilidad en casos de CMV GCV-R.
Foscarnet (intravenoso)
Fármaco con mecanismo de acción similar a GCV (ADN-polimerasa como objetivo), por lo que presenta resistencia cruzada en casos de mutaciones del gen UL54. De nuevo, sus mayores limitaciones se deben a su toxicidad, dado que es un fármaco nefrotóxico y cardiotóxico41,44.
Cidofovir (intravenoso)
Fármaco con mecanismo de acción similar a GCV (ADN-polimerasa como objetivo), por lo que presenta resistencia cruzada en casos de mutaciones del gen UL54. Tiene un alto grado de toxicidad: nefrotóxico y toxicidad medular y ocular. Su eficacia en casos de enfermedad por CMV Val-GCV/GCV-R no está demostrada41,44.
Inmunoglobulina anticitomegalovirus (intravenosa)
Se utiliza ampliamente como tratamiento de soporte en CMV GCV-R en pacientes embarazadas. Sin embargo, los datos sobre su eficacia son escasos y contradictorios41,44. Podría tener una especial utilidad en pacientes con hipogammaglobulinemia.
Leflunomida (vía oral)
Se ha demostrado su utilidad en estudios in vitro, dado que tiene un mecanismo antiviral diferente. No inhibe la síntesis del ADN viral sino que actúa en una etapa más tardía impidiendo el ensamblaje final del virión evitando la formación de la nucleocápside viral. Como consecuencia, es uno de los fármacos que no presenta resistencias cruzadas. La toxicidad descrita es especialmente hepática, digestiva y neurológica (neuropatía periférica). A pesar de su esperanzador papel en la enfermedad por CMV GCV-R, los datos disponibles hasta el momento solo están basados en experiencias clínicas, y no hay ensayos clínicos que los avalen. El rango de respuesta descrito in vivo es solo de un 50%, con un lento descenso de la carga viral49,50. Se ha planteado como tratamiento de CMV GCV-R en asociación con un antiviral utilizando la leflunomida como inmunosupresión de mantenimiento.
Artesunato (vía oral)
Antimalárico que inhibe la replicación viral in vitro e in vivo. De nuevo, los datos que se encuentran en la bibliografía se basan solo en experiencias clínicas muy limitadas y no hay ningún ensayo clínico. Por otro lado, su utilidad solo se ha descrito en casos de enfermedad por CMV moderada51.
Maribavir (vía oral)
Fármaco inhibidor de la pUL97 y que tiene un mecanismo de acción diferente a GCV, cidofovir y foscarnet. Sin embargo, ya se ha descrito un subtipo de mutación UL97 altamente resistente a maribavir. Hasta el momento, a la espera de la publicación de los resultados de 2 ensayos clínicos realizados, los datos disponibles se han extraído solo de experiencias clínicas: el 60% con buena evolución51-54. Sin embargo, su uso como tratamiento profiláctico en trasplante de médula ósea y trasplante hepático no ha obtenido buenos resultados, aunque se postula que las dosis utilizadas en estos ensayos puede que fueran excesivamente bajas.
Letermovir (vía oral)
Inhibe la terminasa viral, y tiene una buena disponibilidad oral y una escasa toxicidad. Hasta el momento no se han descrito resistencias cruzadas. Presenta buenos resultados en profilaxis y tratamiento preventivo51-54, aunque quedan pendientes ensayos clínicos que confirmen las expectativas.
Inmunoterapia adoptiva con células T (intravenosa)
Opción principalmente utilizada en trasplante de médula ósea con algún caso publicado en TR, por lo que su recomendación está limitada porque solo se han publicado casos clínicos. Precisa banco de donantes del que extraer linfocitos T activos51-54. En este momento, no se dispone de datos adecuados sobre los efectos secundarios y la cinética de los linfocitos T citotóxicos que se administran.
Conflicto de intereses
Los autores declaran que no tienen conflicto de intereses potencial relacionado con los contenidos de este artículo.
Correspondencia:
Natalia Polanco
Hospital Universitario 12 de Octubre.
Avda. de Córdoba, s/n. 28041 Madrid.
nipolanco@yahoo.es
Revisión por expertos bajo la responsabilidad de la Sociedad Española de Nefrología.