El número de pacientes que inician terapia renal sustitutiva aumenta cada año, siendo la hemodiálisis (HD) en centro la terapia con la mayor incidencia y la segunda en prevalencia, solo por detrás del trasplante renal1. A lo largo de los años, la población atendida en HD ha ido adquiriendo progresivamente una mayor edad y comorbilidad, presentando una elevada tasa de mortalidad que se mantiene en torno a un 13-14%, muy superior a la de las otras formas de terapia renal sustitutiva1.
Históricamente, la evaluación de la «diálisis adecuada» se ha basado en el aclaramiento de solutos de pequeño peso molecular. Sin embargo, las guías KDIGO del 2019 sobre inicio, elección de modalidad, acceso y prescripción de diálisis nos recuerdan que debemos buscar objetivos de tratamiento centrados en el paciente teniendo en cuenta sus preferencias, siendo necesario para ello la utilización de múltiples medidas para evaluar la adecuación de diálisis2.
Conscientes de todos estos retos, y con el objetivo de fomentar la colaboración entre distintos centros y profesionales para lograr una verdadera individualización en la prescripción de la HD, recientemente se ha constituido el Grupo de Hemodiálisis en Centro de la Sociedad Española de Nefrología. El presente artículo tiene como objetivo destacar los principales aspectos que forman parte de la individualización de la prescripción y los desafíos para los próximos años de la HD en centro.
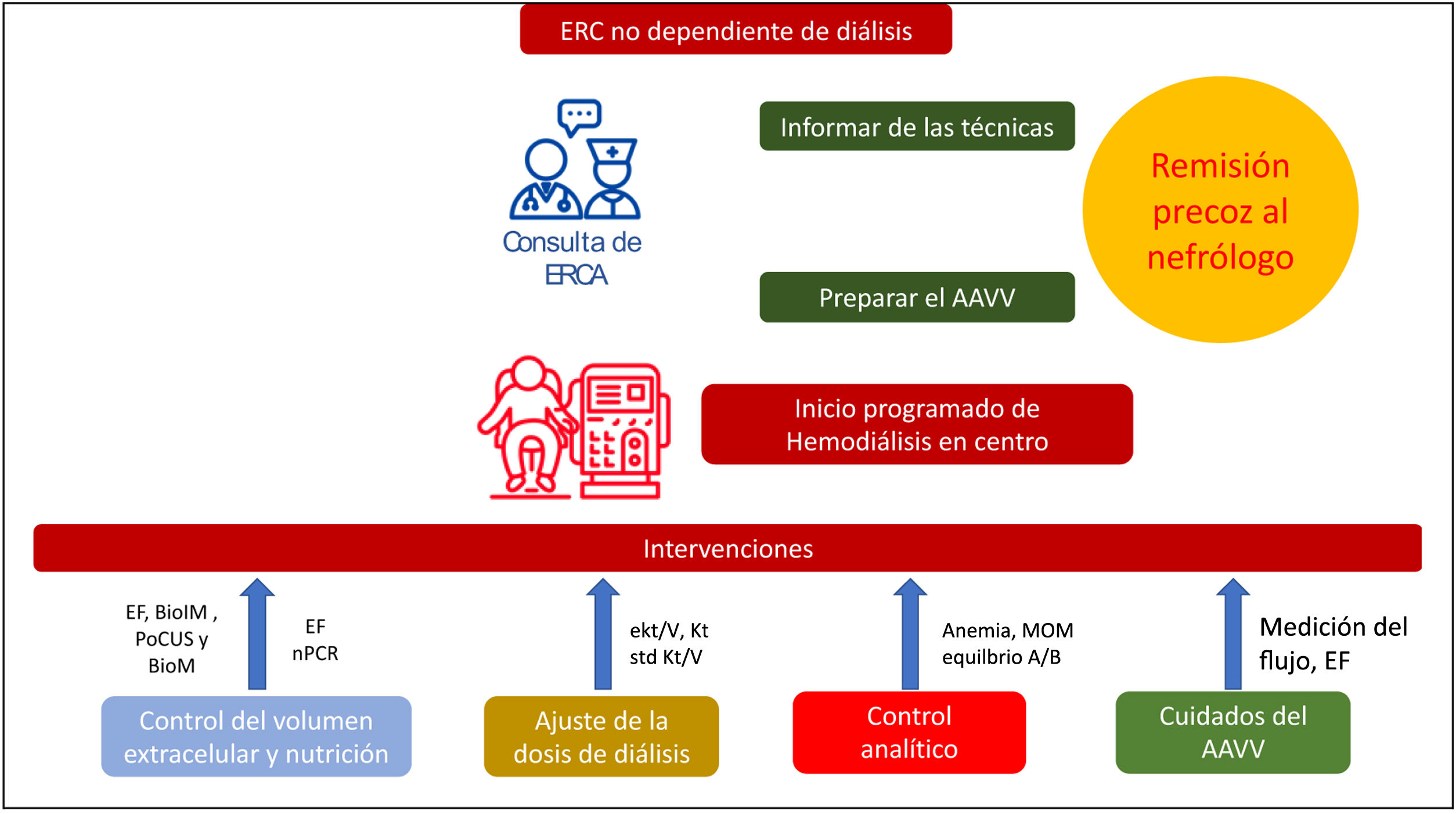
El camino para llevar a cabo esta individualización comienza en las consultas de enfermedad renal crónica avanzada que tiene entre otros objetivos una correcta información sobre las distintas modalidades de tratamiento renal sustitutivo. Para aquellos que elijan como modalidad la HD en centro continúa siendo un desafío que lo hagan de manera programada con un acceso vascular permanente y maduro. En la figura 1 podemos ver representada de manera esquemática los principales cuidados del paciente en diálisis en la que se pueden ver algunos de los aspectos que forman parte de esa individualización.
Representación esquemática de los principales cuidados del paciente en hemodiálisis.
AAVV: acceso vascular; A/B: ácido base; BioIM: bioimpedancia; BioM: biomarcadores de congestión; EF: examen físico; eKt/V: Kt/V urea equilibrado; ERC: enfermedad renal crónica; ERCA: enfermedad renal crónica avanzada; Kt: aclaramiento en la sesión; MOM: metabolismo óseo-mineral; nPCR: tasa de catabolismo protéico normalizada; PoCUS: Point-of-care ultrasonography; std Kt/V: Kt/V estándar semanal.
A pesar de la importante evolución tecnológica de la HD, las enfermedades cardiovasculares son la principal causa de mortalidad en este grupo de pacientes3. Más allá de los factores de riesgo tradicionales, factores relacionados con la uremia y con la técnica de diálisis, como son las fistulas arteriovenosas en especial de alto flujo, los gradientes electrolíticos y la interacción con las membranas son mecanismos adicionales que facilitan la aparición de alteraciones morfológicas y funcionales en el corazón4, aumentando el riesgo de patologías cardiovasculares como la insuficiencia cardiaca que aparece en el 20-40% de los pacientes en HD5,6.
Recientemente, la congestión adquiere especial interés en pacientes en HD ya que se asocia a una elevada mortalidad7 y a alteraciones morfológicas del corazón como la hipertrofia del ventrículo izquierdo, la disfunción diastólica, la insuficiencia tricuspidea o la disfunción del ventrículo derecho8. Uno de los mayores retos a la hora de abordar la congestión en el paciente en HD es su difícil cuantificación mediante parámetros clínicos como el peso seco9 o incluso mediante bioimpedancia10. Estas, valoradas de forma aislada, tienen una baja sensibilidad y su interpretación es compleja, por lo que emerge el concepto de la valoración multiparamétrica de la congestión11. Esta nueva visión incluye el uso de nuevas herramientas como la ecografía a pie de cama (Point-of-care ultrasonography o PoCUS por sus siglas en inglés)12 y el uso de biomarcadores novedosos de congestión como el antígeno carbohidrato 12513. La integración de parámetros clínicos, ecográficos, bioquímicos y la bioimpedancia permitirán en un futuro personalizar la congestión y establecer estrategias individualizadas de descongestión con el objetivo de lograr una ultrafiltración adecuada.
El arte de ultrafiltrarEn los últimos años hemos aprendido que los estados de depleción por elevadas ultrafiltraciones (>13ml/kg/h) también se asocian a mayor mortalidad por isquemia tisular y desarrollo de estados inflamatorios14,15, lo cual remarca la necesidad de monitorizar la volemia y ultrafiltrar de manera individualizada. Los monitores de HD vienen equipados con biosensores y biocontroles basados en ultrafiltración ajustada al volumen intravascular, modificación de conductividad, de presión arterial, tasa de relleno vascular, modificación de la temperatura, o bien oscilaciones en la saturación de oxígeno. Un adecuado conocimiento de las herramientas será de utilidad para mejorar la tolerancia.
Por tanto, en el «arte de ultrafiltrar» debemos tener en cuenta diversas cuestiones: es necesario estimar objetivamente el peso seco sin olvidar individualizarlo mediante la valoración clínica, así como recalcularlo cuando la situación del paciente se modifica. Además, debemos utilizar todas las herramientas que aportan los monitores para realizar una adecuada ultrafiltración, evitando pérdidas excesivas y asegurando una adecuada tolerancia. Nuestro objetivo en la próxima década ha de ser continuar incorporando a nuestra práctica habitual todos estos biosensores.
Buscar la frecuencia idealActualmente desconocemos el número óptimo de sesiones semanales que debe recibir un paciente y este probablemente varíe en función de su situación clínica.
La mayoría de pacientes reciben 3 sesiones semanales en base a motivos arbitrarios y de gestión de las unidades de diálisis. Esta frecuencia con una duración de 3-5h por sesión es considerada por las Guías KDOQI/201516 como «programa convencional de HD». Sin embargo, este planteamiento es cuestionable al no diferenciar entre pacientes incidentes o prevalentes, con función renal residual (FRR) o sin ella.
Por otro lado, en pacientes prevalentes un número mayor de sesiones se asemejaría más a la depuración renal nativa. Así, programas con 5-7 sesiones semanales son definidos como HD frecuente16. Sin embargo, este planteamiento ha obtenido resultados no concluyentes en varios ensayos17–20. Además, la HD frecuente se asocia con un efecto deletéreo sobre el acceso vascular y una pérdida acelerada de la FRR16.
Por el contrario, en pacientes incidentes podemos implementar un programa de HD incremental, iniciando con una o 2 sesiones según sea su aclaramiento renal de urea cuantificando periódicamente su FRR. Los datos publicados del primer ensayo con HD incremental son muy prometedores21, estando otros estudios en marcha22. También debemos considerar los programas de HD a días alternos (cada 48h), que evitan el período largo y su alta mortalidad23 o la diálisis paliativa o decremental, que acorta las sesiones priorizando el bienestar y la calidad de vida del paciente. Así, la frecuencia óptima debería ser dinámica, centrada en el paciente, con una/2 sesiones al inicio (si mantiene FRR), pasando a convencional (3-4 sesiones) o frecuente (5-7) según necesidades y disminuyendo su número en etapas finales para mejorar su calidad de vida.
Individualizar el líquido de diálisisEl líquido de diálisis (LD) tiene un papel crucial en cada sesión de HD pues según su composición se pueden producir cambios en la sangre del paciente que pueden tener consecuencias clínicas.
La composición del LD es clave para obtener la eficacia de depuración buscada, sin olvidarnos de que se debe hacer en condiciones de seguridad óptimas24. Debemos tener en cuenta cuando prescribimos la sesión cuál es nuestro objetivo, según las características de cada paciente. Sabemos que podemos modificar determinados parámetros en el LD, lo que nos permite mejorar la tolerancia del paciente a la sesión, como por ejemplo el sodio o el potasio25, o mejorar determinados parámetros clínicos como es el control del metabolismo óseo-mineral, mediante cambios en la concentración de calcio26 o magnesio27.
Uno de los puntos clave de la individualización del LD es la conductividad, ya que pequeños cambios pueden tener consecuencias clínicas relevantes para el paciente. Dos de los componentes químicos esenciales para mantener la correcta conductividad del LD, y por tanto la conductividad con la que dializamos al paciente, son el sodio3 y el bicarbonato28. Otro elemento que va a influir directamente en la conductividad del LD es la temperatura; de forma general, la conductividad específica aumenta un 2% de su valor por cada incremento de un grado de temperatura.
En el momento presente es posible individualizar de una forma rápida, sencilla y eficaz el LD en cada sesión de HD de cada paciente. Esta posibilidad es una potente herramienta de la que disponemos en nuestra práctica clínica diaria, permitiendo mejorar la tolerancia a las sesiones de HD sin perder eficacia.
Elección de membranas – dializadorLa evolución en el desarrollo de las membranas de diálisis ha sido realmente muy productiva y siempre acorde a la evolución tecnológica de los monitores y modalidades de diálisis. La mejoría continua en estas membranas, con mejores sistemas de producción, como la nanotecnología, han proporcionado nuevas generaciones de dializadores que mejoran su eficiencia. La mayoría de dializadores de alto flujo pueden ser utilizados en modalidades de HD de alto flujo y de hemodiafiltración. Otras membranas tienen la propiedad de su mayor capacidad de adsorción, como el PMMA29, siendo unas de las membranas con mejores resultados de supervivencia en modalidad de HD en estudios japoneses30. Como alternativa a los dializadores sintéticos están los dializadores celulósicos de última generación, como el triacetato de celulosa, con eficacia y biocompatibilidad similar a los sintéticos. Incluso los de última generación se pueden utilizar en técnicas de hemodiafiltración con alto volumen convectivo31. En la actualidad tenemos un problema no resuelto con las membranas sintéticas y es que presentan en un pequeño porcentaje (3%) reacciones adversas moderadas o graves, que desaparecen al cambiar a una membrana celulósica. Es importante identificar la causa y los factores desencadenantes para evitar esta complicación32.
Recientemente se ha dado un nuevo avance en las membranas aumentado el tamaño de los poros, poros de medio cut-off, que permiten una mayor permeabilidad sin necesidad de convección33. De hecho, estos dializadores, deberían solo utilizarse en HD, o tal y como se ha denominado, en HD extendida34.
El último eslabón en el que se podría seguir progresando es el de añadir a las membranas difusivas y convectivas una segunda membrana (carbón activo o resinas hidrofóbicas) para potenciar la adsorción. Nos referimos a diálisis con doble filtro con regeneración del ultrafiltrado del paciente tras pasar por un cartucho adsorbente35, o experiencias provenientes principalmente desde China que están trabajando con un cartucho adsortivo que añaden al tratamiento de HD convencional36.
La utilización de la adsorción para la eliminación de toxinas urémicas unidas a proteínas, como p-cresol sulfato e indoxil sulfato, podría ser una herramienta útil para disminuir la morbimortalidad de los pacientes en diálisis, ya que la elevación de sus niveles plasmáticos se ha asociado con un aumento de mortalidad y eventos cardiovasculares en pacientes con enfermedad renal crónica37.
Un aspecto que cada vez va cobrando más relevancia es la exposición que el paciente en HD sufre al bisfenol A, tóxico ambiental que forma parte del policarbonato presente en las carcasas o en la propia membrana de algunos filtros de diálisis como es el caso de la polisulfona o del «polyester-polymer alloy»38. Varios estudios, entre los que destacamos uno español, han demostrado que la utilización de polisulfona frente a polinefrona (sin bisfenol A) se asociaba en estos pacientes a un aumento a nivel sanguíneo del bisfenol A y, secundariamente, de los niveles de radicales libres intracelulares y marcadores inflamatorios circulantes (IL-6, TNF-α, proteína C reactiva)39.
Revertir la fragilidadA pesar del envejecimiento progresivo de la población, el mejor manejo de las complicaciones cardiovasculares y la mejora en la tolerancia al tratamiento gracias a los avances tecnológicos han permitido una mayor flexibilidad en la inclusión en programas de HD a pacientes de edad cada vez más avanzada y con mayor comorbilidad. Todo esto se relaciona con un aumento de la prevalencia de fragilidad, considerada predictora de discapacidad, hospitalización, caídas, pérdida de movilidad, enfermedad cardiovascular y muerte40. Las personas con enfermedad renal crónica están más predispuestas a desarrollar fragilidad (15-21%), especialmente aquellas en HD (hasta un 73% dependiendo de la herramienta utilizada)41. La fragilidad es un síndrome biológico de disminución de la reserva y la resistencia a los factores estresantes y puede estar asociada con desnutrición, sarcopenia, dinapenia y otras complicaciones de la enfermedad renal crónica42.
Esta situación plantea un cambio de escenario en la atención al paciente en HD, siendo imprescindible la introducción sistemática del cribado de la fragilidad, a fin de identificar a aquellas personas frágiles y prefrágiles, más vulnerables a la aparición de eventos adversos para que puedan beneficiarse de medidas preventivas o terapéuticas que reviertan total o parcialmente este estado.
A pesar de las implicaciones clínicas de la fragilidad, en la actualidad no se realiza un cribado de forma rutinaria en muchas unidades de HD, quizá debido a que no existe consenso acerca de la herramienta a utilizar43. Las herramientas actuales de evaluación de la fragilidad se pueden dividir en las fundamentadas en la fragilidad física como el fenotipo de fragilidad de Fried44 que se centra en la evaluación funcional y es la definición más aceptada en la actualidad, o la multidimensional, siendo los más utilizados el Frailty Index45, derivada de esta, la Clinical Frailty Scale46, la Edmonton Frailty Scale47 o la escala FRAIL48, validadas para población en diálisis. La implementación del uso de estas escalas en la práctica clínica diaria no es fácil pues algunas consumen mucho tiempo y necesitan de instrumentos auxiliares.
Acceso vascular y estado nutricionalEs bien conocido que comenzar diálisis con un acceso permanente se asocia a mejores resultados para los pacientes, sin embargo, el inicio de diálisis con un acceso maduro y funcional continúa siendo un desafío.
Aunque están ampliamente aceptados los beneficios de las fístulas49, las guías KDIGO del año 20192 nos recuerdan que el «fístula first» no es apropiado para todos los pacientes, hay que reconsiderar los paradigmas establecidos para el acceso vascular dentro de la estructura del «life plan» individual del paciente con enfermedad renal crónica, teniendo en cuenta, no solo sus características vasculares, sino también sus objetivos y preferencias.
La prevalencia del desgaste proteico-energético es mucho más frecuente en diálisis (hasta un 20-50%) que en fases prediálisis porque el procedimiento dialítico induce un estado catabólico proteico neto, influenciado por la técnica de diálisis y una respuesta inflamatoria sistémica en relación con la biocompatibilidad del sistema50. Dado que el estado nutricional es uno de los principales factores tratables que afectan al pronóstico y evolución de los pacientes con enfermedad renal crónica, la única forma de prevenir y tratar precozmente a estos pacientes es realizando una evaluación del estado nutricional de los pacientes con enfermedad renal crónica, a ser posible ya desde la etapa prediálisis. La forma más sencilla es la realización de un registro dietético de 3 días (incluyendo día de diálisis, de no diálisis y festivo), pero existen diferentes test validados en la población en diálisis como el Malnutrition Inflamation Score (MIS) o la Valoración Global Subjetiva, así como nuevas herramientas informáticas prácticas (www.nutrendial.cat)50 que nos permiten calcular fácilmente la prevalencia de PEW y compararla con estos scores (MIS y SGA).
ConclusiónLa HD en centro ha experimentado importantes cambios tanto desde el punto de vista tecnológico como en su concepto de adecuación, así como del perfil de pacientes que atiende, siendo imprescindible una individualización real de la prescripción de la diálisis basada en objetivos de tratamiento centrados en el paciente.