Introducción Circunstancias como el género, la edad, la presencia de diabetes mellitus (DM) y la insuficiencia renal tienen impacto sobre la composición corporal de los pacientes. Sin embargo, a la hora de evaluar parámetros nutricionales como el tejido magro y graso de los pacientes en hemodiálisis (HD) se emplean valores de referencia provenientes de población sana.
ObjetivosAnalizar la composición corporal mediante bioimpedancia espectroscópica (BIS) de 6.395 pacientes en HD para obtener valores de referencia de índice de tejido magro (ITM) y de índice de tejido graso (ITG) procedentes de pacientes en HD y confirmar su validez al demostrar que aquellos con un ITM por debajo del percentil 10 calculado para su grupo tienen mayor riesgo de muerte.
Material y métodos Usamos la BIS para determinar el ITM e ITG de nuestra cohorte de pacientes en HD en España. Calculamos el percentil 10 y el percentil 90 del ITM e ITG en cada decil de edad de pacientes, agrupados según su género y presencia de DM. Recogemos parámetros clínicos, analíticos y demográficos.
ResultadosObjetivamos que los valores del percentil 10 y del 90 de ITM/ITG varían en función del grupo (edad, género y presencia de DM) y que, tras ajustar por otros factores de riesgo como la sobrehidratación, los pacientes con ITM inferior al percentil 10 tienen mayor riesgo relativo de muerte (OR 1,57) que aquellos con valores superiores.
ConclusionesMonitorizar el ITM e ITG de los pacientes en HD CON adecuados valores de referencia puede ser útil para identificar situaciones de riesgo en los pacientes en HD.
Circumstances such as gender, age, diabetes mellitus (DM) and renal failure impact on the body composition of patients. However, we use nutritional parameters such as lean and fat tissue with reference values from healthy subjects to assess the nutritional status of haemodialysis (HD) patients.
AimsTo analyse body composition by bioimpedance spectroscopy (BIS) of 6395 HD patients in order to obtain reference values of lean tissue index (LTI) and fat tissue index (FTI) from HD patients; and to confirm its validity by showing that those patients with LTI below the 10th percentile calculated for their group have greatest risk of death.
Material and methodsWe used the BIS to determine the LTI and FTI in our cohort of HD patients in Spain. We calculated the 10th percentile and 90th percentile of LTI and FTI in each age decile for patients grouped by gender and presence of DM. We collected clinical, laboratory and demographic parameters.
ResultsThe LTI/FTI 10 and 90 percentile values varied by group (age, gender and presence of DM) and, after adjusting for other risk factors such as fluid overload, those patients with LTI lower than percentile 10 had a higher relative risk of death (OR 1.57) than those patients with higher values.
ConclusionsMonitoring the LTI and FTI of patients on HD using suitable reference values may help to identify risk in this patient population.
Circunstancias como la edad1–5, el género5,6, la diabetes mellitus (DM)1,5,7 o la insuficiencia renal8,9 tienen impacto en la composición corporal de los pacientes. De hecho, y en general, los pacientes añosos presentan menor tejido magro que los jóvenes; el contenido magro de las mujeres es menor que el de los hombres; los pacientes con DM suelen tener mayor tejido graso que los no diabéticos y los pacientes en diálisis parecen tener menor tejido magro y graso que los sanos, probablemente por encontrarse en un estado hipercatabólico10 y con una ingesta/absorción insuficiente de nutrientes11–13.
Por ello, y dado que la presencia de mayor tejido magro se ha relacionado con mejor supervivencia14,15 en los pacientes en hemodiálisis (HD), se debe disponer de valores de referencia16 adaptados a la población en HD que tengan en cuenta características como la edad, el género o la DM, y que permitan evaluar adecuadamente parámetros de composición corporal como el ídice de tejido magro (ITM) o el índice de tejido graso (ITG).
El uso de los monitores de composición corporal se ha extendido en las unidades de HD por su fácil manejo así como por estar validados en población sana y en población en HD16–20. En este estudio se utiliza el Body Composition Monitor (BCM; Fresenius Medical Care, Bad Homburg, Alemania) basado en bioimpedancia espectroscópica (BIS).
El objetivo del estudio es, en primer lugar, describir la composición corporal de 6.395 pacientes y calcular los percentiles 10 y 90 de ITM/ITG en los 4 grupos de pacientes (hombres diabéticos, hombres no diabéticos, mujeres diabéticas, mujeres no diabéticas) según su edad, para emplear dichos percentiles como referencia al evaluar su contenido graso y magro. En segundo lugar, estudiar la mortalidad de la población para demostrar que la presencia de un ITM por debajo del percentil 10 calculado para su grupo conlleva un elevado riesgo de muerte en HD, y confirmar que los valores referencia de ITM/ITG aportados son válidos.
Material y métodosPacientesSe trata de un estudio observacional de cohortes retrospectivo sobre composición corporal de 6.395 pacientes (incidentes y prevalentes) en HD tratados en 57 unidades de HD de FMC en España. El periodo de estudio transcurre desde enero de 2012 hasta diciembre de 2014.
Los criterios de inclusión: pacientes tratados en clínicas Fresenius Medical Care (FMC) en España durante el periodo de inclusión (incidentes y prevalentes) con al menos una medición de BCM. Los criterios de exclusión son: pacientes portadores de marcapasos y amputados.
Todos los pacientes están registrados en la base de datos EuCliD® (Fresenius Medical Care's European Clinical Database), descrita en trabajos previos21,22, y todos han firmado el consentimiento informado.
DiseñoLos pacientes son agrupados en función de su género y presencia de DM, y subagrupados por deciles de edad. Se recoge el resultado del primer BCM de los pacientes, y se calcula el percentil 10 y el percentil 90 de ITM e ITG en cada decil de edad en los 4 grupos. Se registraron todos los fallecimientos y sus causas, y se lleva a cabo una regresión logística para determinar el odds ratio (OR) de muerte de variables entre las que se incluye la presencia de «ITM inferior al percentil 10».
Valoración de composición corporal por body composition monitorLa medición con BCM fue realizada antes de la sesión de HD con el paciente sentado, por personal de enfermería formado y entrenado, siguiendo un protocolo común de colocación del paciente y de los electrodos. Se seleccionó y analizó la primera medición de BCM de todos los pacientes.
De los datos del BCM se registraron: sobrehidratación absoluta en litros (OH) como peso pre-HD menos peso normohidratado calculado por BCM, sobrehidratación relativa (ROH, %) calculada como el cociente de OH por el agua extracelular en litros, ITM (kg/m2) e ITG (kg/m2) ajustados por la talla.
Recogemos la tensión arterial sistólica y diastólica de los pacientes en decúbito supino antes de HD, y calculamos la tensión arterial media del mes (sistólica y diastólica).
Parámetros demográficos, analíticos y terapéuticos o relacionados con la sesión de hemodiálisisRecogemos la edad, tiempo en HD, índice de Charlson ajustado a la edad, la presencia de DM y la causa de enfermedad renal y fallecimiento.
Los datos analíticos se recogen pre-HD en la sesión intermedia de la semana. La variables analizadas fueron: hemoglobina, albúmina (83,9% mediante el método bromocresol verde y 16,1% mediante bromocresol violeta) y proteína C reactiva.
Respecto a la HD registramos: acceso vascular en uso, el tiempo efectivo medio por sesión de HD (T); Kt/V por dialisancia iónica; el número de hipotensores por mes y el cálculo del índice de resistencia a la eritropoyetina.
Análisis estadísticoEl análisis estadístico se realizó mediante el paquete estadístico SPSS (IBM SPSS, Inc., Chicago, IL, EE. UU.), versión 19. Se utilizó el test Kolmogorov-Smirnov para identificar las variables no paramétricas y estas fueron transformadas en su logaritmo (ej.: PCR). Las variables cualitativas se expresan como porcentajes y las cuantitativas como media±desviación estándar. Las pruebas t de Student, test de Mann–Whitney o ANOVA son usadas para comparar variables cuantitativas, según su distribución normal o no paramétrica. El test Chi cuadrado se usó para variables cualitativas. Un valor de p < 0,05 fue considerado estadísticamente significativo. La regresión logística multivariante se realizó como análisis de supervivencia para detectar el OR (riesgo relativo de muerte) de variables como el «ITM menor al percentil 10» con un intervalo de confianza del 95%. En este análisis se incluyeron factores de confusión como la edad, género, tiempo en HD, acceso vascular (catéter), índice de Charlson ajustado a edad, sobrehidratación (ROH>15%) y albúmina plasmática.
ResultadosLas características basales de la cohorte se muestran en la tabla 1. Las causas de enfermedad renal fueron: no filiada (31,5%), nefropatía diabética (21,8%), glomerulonefritis (15,3%), nefroangiosclerosis (12,2%), nefropatía túbulo-intersticial (9,5%), poliquistosis renal (7,2%) y otras (2,6%). En cuanto al acceso vascular: el 31,8% de los pacientes se dializaban a través de catéter y el 68,2% de fístula arteriovenosa autóloga o heteróloga.
Características basales de 6.395 pacientes en hemodiálisis
| Parámetro | Media (DE) |
|---|---|
| Edad (años) | 67,6 (14,7) |
| Género (% mujeres) | 37,3 |
| Causa de enfermedad renal (NF) | 31,5 |
| Diabetes mellitus (%) | 28,5 |
| Enfermedad Cardiovascular (%) | 30,3 |
| Acceso vascular (% catéter) | 31,8 |
| Tiempo en HD (meses) | 36,7 (43,3) |
| ROH (%) | 10,9 (9,7) |
| TAS/mes (mmHg) | 134,6 (21,1) |
| TAD/mes (mmHg) | 66,5 (12,0) |
| ITM (kg/m2) | 11,5 (2,9) |
| ITG (kg/m2) | 14,8 (6,5) |
| Í. Charlson ajustado | 5,5 (1,9) |
| Dosis de diálisis (eKt/V) | 1,7 (0,3) |
| Hemoglobina (g/dL) | 11,3 (1,5) |
| IRE (UI/kg/sem/g/dL) | 9,3 (8,9) |
| logPCR | 1,6 (1,5) |
| Albúmina (g/dL) | 3,8 (0,4) |
| Tiempo efectivo por sesión (minutos) | 236,8 (19,4) |
Í. Charlson ajustado: índice de Charlson ajustado por edad; IRE: índice de resistencia a la eritropoyetina; ITG: índice de tejido graso; ITM: índice de tejido magro; NF: no filiada; PCR: proteína C reactiva; ROH: sobrehidratación relativa; TAD: tensión arterial diastólica; TAS: tensión arterial sistólica.
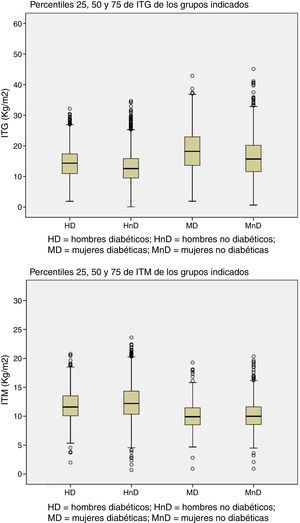
Los pacientes son agrupados por género y presencia de DM. Los percentiles 25, 50 y 75 de ITM e ITG se calculan para cada uno de los 4 grupos (fig. 1).
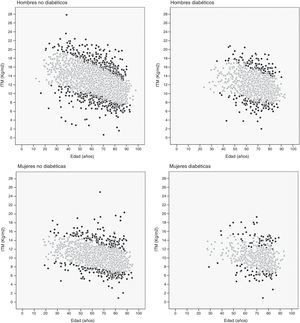
También se calculan los percentiles 10 y 90 de cada decil de edad en los 4 grupos de pacientes. La figura 2 muestra la distribución de los pacientes en función de su ITM: aquellos con un ITM inferior al percentil 10 o superior al percentil 90 (puntos negros), y aquellos con un ITM entre el percentil 10 y el 90 (puntos grises).
Un total de 707 pacientes fallecieron durante el seguimiento (11,1%), la mayoría de ellos por causa cardiovascular (41,6%). De los pacientes que no fallecieron: el 79,1% seguían en HD en centros FMC; el 10,8% se trasladaron a centros no FMC; el 7,8% se trasplantaron; el 1,9% interrumpieron el tratamiento renal sustitutivo y el 0,4% recuperaron la función renal.
El resultado del análisis de supervivencia mediante regresión logística multivariante se muestra en la tabla 2. Incluye el factor «ITM inferior al percentil 10 de su grupo y edad» y otros como: edad, género, tiempo en HD, índice de Charlson, acceso vascular, sobrehidratación (ROH superior al 15%) y albúmina.
Regresión logística con odds ratio e intervalo de confianza
| Regresión logística | Univariante | Multivariante |
|---|---|---|
| ITM menor a p10 | 1,860 (1,494-2,314)* | 1,576 (1,127-2,204)* |
| ROH>15% | 1,920 (1,638-2,250)* | 1,625 (1,262-2,091)* |
| Edad (por año) | 1,048 (1,041-1,056)* | 1,029 (1,015-1,044)* |
| Género (hombre) | 1,083 (0,920-1,274) | 1,154 (0,894-1,490) |
| Tiempo en HD (meses) | 1,006 (1,005-1,008)* | 1,009 (1,006-1,012)* |
| Ac. vascular (catéter) | 1,755 (1,464-2,104)* | 1,627 (1,260-2,100)* |
| Í. Charlson ajustado | 1,325 (1,270-1,382)* | 1,140 (1,043-1,247)* |
| Albúmina (g/dl) | 0,417 (0,337-0,515)* | 0,612 (0,457-0,819)* |
Ac. vascular: acceso vascular; HD: hemodiálisis; Í. Charlson ajustado: índice de Charlson ajustado por edad; ITM: índice de tejido magro; ROH>15%: sobrehidratación relativa mayor al 15%.
El trabajo aporta valores de referencia (percentil 10 y 90) de ITM e ITG ajustados por edad, género y DM para población en HD, procedentes de población en HD. El análisis descriptivo confirma el efecto de algunas circunstancias sobre la composición corporal de los pacientes en HD, tales como la edad1–4, el género6 y la DM1,7 y, por tanto, la necesidad de evaluar la composición corporal de los pacientes teniendo en cuenta estas circunstancias.
El tamaño de la muestra, que representa una sustancial proporción de los pacientes en HD en España, es una de las fortalezas del trabajo. Esto nos permite obtener rangos de referencia de ITM e ITG para los pacientes en HD procedentes de sujetos con sus mismas características. Según nuestro conocimiento, hasta el momento, los valores de referencia de los parámetros de composición corporal obtenida mediante BIS procedían de pacientes sanos6.
Además, se objetiva que la presencia de menor tejido magro, definido como «ITM inferior al percentil 10 de su grupo», conlleva elevado riesgo de fallecer en HD (OR 1,57), y con ello demuestra que los valores referencia aportados en el trabajo son válidos, orientativos y adecuados.
El estudio muestra que la asociación entre ITM bajo y mortalidad permanece estadísticamente significativa, incluso después de ajustar por otros factores de riesgo como el tiempo en HD23, acceso vascular24, índice de Charlson1,6,7, sobrehidratación relativa superior al 15%7,25–29 y albúmina23,30–33.
Estudios previos han examinado la relación entre poco tejido magro (expresado en forma de ITM inferior al percentil 10 en el presente estudio) y peor supervivencia en HD34. Entre las posibles causas destacamos que una menor masa magra puede ser un signo de malnutrición35,36 o señal de inflamación36, que el tejido magro puede ser depósito de toxinas urémicas y, por tanto, un menor tejido magro puede indicar mayor concentración de toxinas urémicas en sangre36,37, que el aumento de tejido magro (y de masa muscular) se asocia con actividad física y esta mejora la rigidez vascular y la resistencia a la insulina1,36 y, por fin, la conocida relación entre masa muscular y mortalidad causada por infecciones en pacientes en HD, ya que los pacientes con enfermedad renal crónica tienen una inmunodeficiencia adquirida que puede verse exacerbada en pacientes con poca masa muscular por compartir factores de riesgo tales como la hipoalbuminemia y la desgaste proteico energético (DPE)2.
De acuerdo con las posibles explicaciones, debemos decir que los pacientes con ITM inferior al percentil 10 presentan mayores niveles de PCR, pero sus dosis de diálisis son las recomendadas por las guías38–41. Así pues, la composición corporal de los pacientes en HD, y especialmente el ITM inferior al percentil 10, podría reflejar un estado patológico subyacente (procesos inflamatorios o malnutrición) o quizá podría predisponer a los pacientes a situaciones de riesgo, como las infecciones.
Los resultados del trabajo señalan una serie de medidas diagnósticas y terapéuticas que los clínicos deben tener presentes para pacientes en HD con ITM bajo42. En primer lugar, hay que tratar de identificar las causas del tejido magro bajo y resolver la causa subyacente; en segundo lugar, determinar si la intervención nutricional en forma de suplemento oral o intravenoso puede ser útil en ese tipo de pacientes y en tercer lugar, mejorar la dosis de diálisis si la causa se atribuye a la infradiálisis.
El estudio muestra los valores del percentil 10 y del 90 ajustados por edad, género y DM en un importante número de pacientes en HD en España. Dichos valores de ITM/ITG pueden ser utilizados por los clínicos como valores de referencia para evaluar la situación nutricional de los pacientes en HD. De hecho, empleando dichos valores como guía, se demuestra que la presencia de un «ITM inferior al percentil 10» de su grupo está relacionado con mayor riesgo de muerte, incluso tras ajustar por otros factores como la sobrehidratación.
Una de las limitaciones del estudio es que no se tuvo en cuenta la raza de los pacientes; la razón es que la gran mayoría de ellos eran de raza caucásica1, pero son necesarios valores de referencia para otras razas. Otras limitaciones son que no se registraron las intervenciones (como el aporte nutricional o la actividad física), ni circunstancias (como las hospitalizaciones) y sus efectos sobre la composición corporal y la morbimortalidad de los pacientes. Esto se podría tener en cuenta para futuros trabajos. De la misma manera, a medida que se vayan incorporando más pacientes a la muestra, se podrá tener en cuenta también el tiempo en HD como factor de agrupación.
En conclusión, nuevas herramientas diagnósticas como el BCM nos permiten evaluar simultáneamente la situación hídrica y nutricional de los pacientes en HD. Monitorizar la composición corporal de los pacientes y evaluarla empleando valores de referencia adecuados puede ser de gran utilidad para identificar situaciones de riesgo que se puedan prevenir o tratar.
Ahora queda pendiente demostrar en estudios prospectivos si la intervención nutricional con aumento del tejido magro puede conducir a la mejora de la supervivencia.
Conflicto de interesesTodos los autores son empleados de Fresenius Medical Care.
AgradecimientosA todos los médicos de las clínicas Fresenius Medical Care-NephroCare, sin cuyo trabajo hubiese sido imposible este estudio.
Aguilera Jover, Josep; Ajenjo Mas, Enrique; Al Massri, Mohamad; Alcalá Rueda, María Luisa; Almoguera González, Ana María; Álvarez Francos, Marta; Amoedo Rivera, María Luisa; Ampuero Mencía, Jara; Aramburu Hostench, Javier; Araque Juan, Alicia; Ariza Fuentes, Francisco Javier; Arruche Herrero, M. Mercedes; Bar, Andrzej Witold; Barbacid Santos, Ignacio Alberto; Barbetta, Massimo; Barbosa Puig, Francisco; Barrera Padilla, Rosario; Berdud Godoy, Isabel; Berlanga Alvarado, José Ramón; Blanco Santos, Ana; Calvar García, Carlos Alberto; Cantón Guerrero, Petra; Carazo Calvo, María Eugenia; Cardoso Represa, Alejandro; Carretero Dios, Diana; Cid Parra, María Cruz; Cives Muiño, Alejandro Daniel; Contreras Ríos, Juan José; Corredera Romero, M. Teresa; Crespo Navarro, Antonio; de Miguel Anasagasti, Teresa; Devesa Such, Ramón; Durán Sánchez, Victorino; El Rifai El Sayed, Abdallah; Espada Guerrero, Rosa María; Estadella Llobet, Concepció; Estrada Patricia, Nora; Faez Herrera, Yamile; Faiña Rodríguez-Vila, Beatriz; Feliz Díaz, Tamara Carmelina; Fernández Robres, M. Amparo; Fernández Carbonero, Enrique; Fernández de Diego, Álvaro; Fernández Marchena, Dolores; Fernández Chávez, Abelardo Claudio; Fernández Solís, María Antonia; Gad, Noura; Galán González, Josefa; Galano Quiala, Marilee; Gallego García, María José; García Guijosa, M. Ángeles; García Lacomba, Juan José; García Crespo, María del Mar; García de Vinuesa Calvo, Elena; García-Izquierdo Otero, Ambrosio; Giner Segui, Rafael; Giráldez Casasnovas, José Diego; Gómez Couñago, Inmaculada; González Olmedo, Petronila; Gorostiza Rodríguez, Guillermo; Grisales Arroyave, Juan Carlos; Gurpegui Prieto, María Luz; Hernández Moreno, María Teresa; Herrera Denis, Imara; Hidalgo García, Patricia; Hurtado Muñoz, Sara; Ibrik Ibrik, Omar; Insense Pons, Alberta; Izaguirre Martín, Ana Isabel; Jordan Pérez, Joel; Juan Pérez, M. Ángeles; Loras Amorós, Laura; Macías Galán, Rosa María; Márquez Ramón, Juan Antonio; Martín Gil, Alfredo Javier; Martín Pérez, María Belén; Martínez Rubio, M. Pilar; Matas Serra, Margarita; Merin Serra, Ana; Mestres Capdevila, Rosa; Mora Macia, Josep; Moreno Vega, Darío Manuel; Moreno Muñoz, María Victoria; Morente Esquivel, Jorge Camilo; Moreso Mateos, Francesc; Munteanu, Oana Mihaela; Nin Zulueta, Jordi; Olivares Ortiz, Álvaro Mauricio; Olivas Ferrandis, Juan Luis; Ortuño Celdran, Tomás Antonio; Pascual Domínguez, Francisco Javier; Paz Martín, Rodrigo; Pérez Velasco, Cristina; Pons Aguilar, Mercedes; Ruiz Carrero, María Asunción; Puyuelo Lanao, Trinidad; Quintana Rozadilla, Elena; Quintanilla Valles, Nuria; Quiroz Morales, Manuel Augusto; Redondo García, Concepción; Requena Soriano, Juan Francisco; Riaño Castañedo, María Jesús; Ribera Tello, Laura; Rico Salvador, Inmaculada; Ríos Moreno, Francisco; Rivera Pérez, Mariana; Rodríguez de Oña, María del Mar; Romero Nieves, M. del Carmen; Romero Jiménez, Rafaela; Romero Mallorca, Alonso; Rubia García, Francisco Manuel; Rueda Lombillo, María Emma; Ruiz Caro, María Caridad; Ruiz Roda, Jesús; Ruiz Alaminos, Jesús Daniel; Ruiz Losada, Ana María; Sánchez Enríquez, Carlos Alberto; Sánchez García, Olga María; Sánchez Sancho, Mercedes; Sánchez Torres, Dolores; Santos Herrera, Marta; Sastre Romaniega, M. Lourdes; Sese Torres, Josep; Setién Conde, María Ángeles; Silgado Rodríguez, Gema; Simonyan, Hamazasp; Soler García, Jordi; Soto Montañez, Carlos Antonio; Sujan Sujan, Seema; Suria Arenes, Miguel Carlos; Uribe Echeverri, Juan Diego; Valdés Chiong, Evaristo; Valentín González, Félix; Vázquez Cruzado, Juan; Vidiella Martorell, Juan; Villaverde Ares, M. Teresa; Virguez Pedreros, Leonardo.