La hipertensión arterial debida a una causa identificable (hipertensión arterial secundaria) afecta aproximadamente al 5-10 % de los pacientes hipertensos. Las causas más frecuentes de hipertensión arterial secundaria son la enfermedad renal parenquimatosa, la enfermedad renovascular, el hiperaldosteronismo primario y el síndrome de apnea del sueño. Otras causas menos frecuentes son el feocromocitoma, los hipercortisolismos, las alteraciones tirodeas, el hiperparatiroidismo primario, la coartación aórtica y el consumo de fármacos. En principio, se sospechará hipertensión arterial secundaria cuando exista elevación brusca de la presión arterial en pacientes jóvenes o mayores, en casos de hipertensión arterial resistente al tratamiento y en ausencia de antecedentes familiares de hipertensión arterial esencial. El diagnóstico debe ir orientado por la sospecha clínica y se confirmará mediante la realización de las exploraciones complementarias oportunas. La relevancia de la detección de hipertensión arterial secundaria reside en que es una situación potencialmente reversible con tratamiento específico.
Conceptos clave
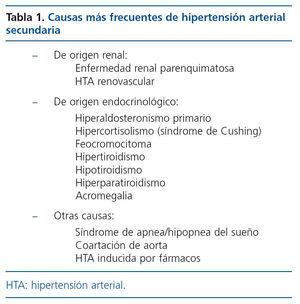
1. La HTA secundaria suele detectarse en un 5-10 % de los pacientes hipertensos.
2. La anamnesis, la exploración física y el protocolo inicial de estudio del paciente hipertenso constituyen los métodos básicos para descartarla.
3. Las causas más frecuentes de HTA secundaria son las enfermedades renales (parenquimatosas o renovasculares), el hiperaldosteronismo primario, la HTA inducida por fármacos y el SAHS.
4. Con cierta frecuencia el tratamiento de la causa de una HTA secundaria no lleva a la normalización de la PA debido a la alta prevalencia de HTA subyacente o a un daño vascular endotelial ya establecido.
INTRODUCCIÓN
La hipertensión arterial (HTA) es un importante factor de riesgo para el desarrollo de enfermedades cardiovasculares, tales como la enfermedad cerebrovascular, la enfermedad coronaria, la insuficiencia cardíaca, la enfermedad renal crónica y la enfermedad vascular periférica1.
Se estima que su prevalencia oscila entre un 20 y un 40 % de la población, dependiendo de los países2. En la gran mayoría de los casos la HTA es esencial y se relaciona con un origen multifactorial, incluyendo la edad, factores genéticos y hábitos de vida. En un porcentaje menor de casos la HTA es secundaria o de causa identificable y puede tener un tratamiento específico. Por este motivo, el protocolo de estudio inicial del paciente con HTA contempla tres aspectos fundamentales: 1) la confirmación del diagnóstico de HTA; 2) la evaluación y estratificación del riesgo cardiovascular del paciente; y 3) descartar HTA secundaria.
El diagnóstico de HTA se realiza mediante la medida adecuada de la presión arterial (PA) en la consulta y se confirma con medidas fuera de la consulta, ya sea con automedida de la presión arterial o monitorización ambulatoria de la presión arterial3,4.
Los objetivos de la valoración del riesgo cardiovascular son predecir la probabilidad de fallecer o de sufrir un evento cardiovascular en un intervalo de tiempo definido e instaurar el tratamiento preventivo correspondiente. Para ello se han desarrollado diferentes modelos predictivos, tales como las tablas de riesgo cardiovascular del estudio de Framinghan5, las tablas SCORE6,7 y las tablas de la guía para el manejo de la HTA de las sociedades europeas de hipertensión y cardiología4. Estos sistemas de clasificación del riesgo cardiovascular son básicos en la práctica clínica para la toma de decisiones en pacientes hipertensos.
Por último, el tercer objetivo de la evaluación inicial del paciente con HTA es establecer la causa. En el 90-95 % de ellos no se detectará una causa concreta y el diagnóstico será HTA esencial o primaria. En un 5-10 % de los pacientes hipertensos se detectará una causa potencialmente corregible y el diagnóstico será HTA secundaria8. Aunque clásicamente se ha asociado la HTA secundaria como una situación curable, en un porcentaje importante de casos la HTA se perpetúa aunque se corrija la causa de HTA secundaria bien por la elevada prevalencia de HTA esencial subyacente o por un proceso establecido de daño vascular. Las causas más frecuentes de HTA secundaria se exponen en la tabla 1.
¿CUÁNDO SOSPECHAR UNA HIPERTENSIÓN ARTERIAL SECUNDARIA?
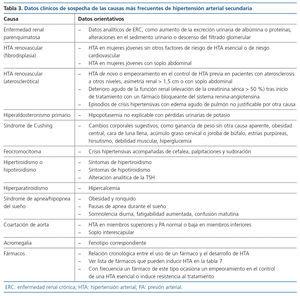
La HTA secundaria es una patología relativamente poco frecuente, por lo que será necesario un alto índice de sospecha para detectarla. Las situaciones clínicas clásicas que orientan hacia ella se exponen en la tabla 2, aunque conviene tener presente que, dada la elevada prevalencia de HTA esencial, este será con frecuencia el diagnóstico final aun en circunstancias de sospecha de HTA secundaria.
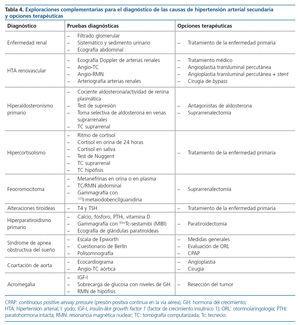
La orientación diagnóstica de la HTA secundaria se dirigirá hacia una determinada causa o grupo de causas en función del contexto y las características clínicas de cada caso (tabla 3). El estudio del paciente con sospecha de HTA secundaria puede ser costoso y requerir pruebas diagnósticas invasivas no exentas de riesgos, por lo que se valorará de manera individual cada caso para realizar una búsqueda etiológica lo más selectiva posible y siempre que el diagnóstico pueda conllevar cambios en el manejo terapéutico. En la tabla 3 se exponen los datos clínicos de sospecha de las causas más frecuentes de HTA secundaria y en la tabla 4 las exploraciones complementarias para el diagnóstico y las principales opciones terapéuticas.
ENFERMEDAD PARENQUIMATOSA RENAL
La HTA es un hallazgo frecuente en pacientes con enfermedad renal aguda o crónica9. Las principales manifestaciones de la enfermedad renal son el descenso del filtrado glomerular, excreción elevada de albúmina o proteínas en orina o la presencia de un sedimento urinario patológico. La patogénesis y tratamiento de la HTA puede variar con el tipo de afectación renal y su duración. Los pacientes con enfermedad renal aguda suelen tener expansión de volumen por retención de sodio y activación del sistema renina-angiotensina-aldosterona. En pacientes con enfermedad renal crónica suelen jugar un papel relevante la retención de sodio, la activación del sistema renina-angiotensina-aldosterona, la activación del sistema nervioso simpático, el hiperparatiroidismo secundario, el tratamiento con factores estimulantes de la eritropoyesis y la alteración de la función endotelial y modificaciones en la pared vascular.
HIPERTENSIÓN ARTERIAL RENOVASCULAR
El término de HTA renovascular o vásculo-renal hace referencia a la elevación de la PA atribuible a la reducción de la perfusión renal. La mayoría de los casos es debida a la obstrucción de la arteria renal principal ya sea por una lesión aterosclerótica o por una displasia fibromuscular. En la población general probablemente es causa de menos de un 1 % de la HTA10, mientras que en pacientes con HTA grave y otras manifestaciones de aterosclerosis puede estar presente hasta en un 35 % de los casos11.
Las situaciones clínicas en las que está indicado descartar HTA renovascular son las siguientes12,13: 1) debut de HTA grave o grado 3 (PA sistólica ≥ 180 mmHg o PA diastólica ≥ 110 mmHg); 2) deterioro de la función renal relacionado con el tratamiento antihipertensivo, especialmente si se ha observado una elevación aguda y mantenida de la creatinina sérica > 50 % tras el inicio de tratamiento con un fármaco inhibidor de la enzima de conversión de la angiotensina (IECA) o antagonista de los receptores de la angiotensina II (ARA II); 3) HTA grado 3 en pacientes con aterosclerosis generalizada, especialmente en casos por encima de los 50 años de edad y con antecedentes de tabaquismo; 4) HTA grado 3 en pacientes con un riñón atrófico o con asimetría renal > 1,5 cm sin causa aparente; 5) HTA grado 3 en pacientes con episodios de edema agudo de pulmón o insuficiencia cardíaca refractaria con deterioro de la función renal14; y 6) HTA y soplo abdominal lateralizado (este hallazgo tiene una sensibilidad del 40 % pero una especificidad del 99 %)15.
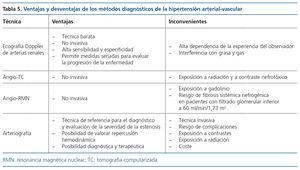
La técnica de referencia para el diagnóstico de la HTA reno-vascular es la arteriografía renal. Sin embargo, debido a su carácter invasivo, existen otras modalidades diagnósticas no invasivas utilizadas para el despistaje inicial. Las ventajas y desventajas de cada técnica quedan recogidas en la tabla 5. La ecografía Doppler proporciona una evaluación funcional y morfológica de las arterias renales. Además de la existencia de asimetría renal, la velocidad picosistólica en la arteria renal y el índice de resistencia en el parénquima renal orientan hacia la presencia de una estenosis significativa. Una velocidad picosistólica por encima de 200 cm/seg sugiere la presencia de una estenosis superior al 60 %, aunque en algunos estudios se sugiere que una velocidad picosistólica superior a 300 cm/seg representa el límite de significación hemodinámica16. Se estima que la velocidad picosistólica tiene una sensibilidad y especificidad del 85 % y 92 % para la detección de la estenosis17. Asimismo, el cálculo del índice de resistencia [1 < (velocidad telediastólica / velocidad pico sistólica)] informa sobre la presencia de daño renal permanente, de manera que un índice de resistencia superior a 0,9 puede indicar la existencia de afectación vascular intrarrenal irreversible18,19. Sin embargo, un estudio Doppler negativo no excluye la estenosis de la arteria renal, por lo que en pacientes con alta sospecha de HTA renovascular se debe valorar la posibilidad de una angiografía mediante tomografía computarizada (TC) o resonancia magnética nuclear (RMN) de las arterias renales. La TC y la RMN de las arterias renales son métodos no invasivos con elevada exactitud para el diagnóstico de la enfermedad renovascular, aunque pueden aparecer complicaciones relacionadas con el empleo de contrastes iónicos en la TC (nefropatía por contraste) y gadolinio en la RMN (fibrosis sistémica nefrogénica asociada con gadolinio). En ambas técnicas una imagen de estenosis superior al 75 % en una o ambas arterias o una estenosis superior al 50 % con dilatación posestenótica sugiere que el paciente puede tener una HTA renovascular. Sin embargo, puede resultar complicado cuantificar el grado de estenosis hemodinámicamente significativa. Estudios experimentales sugieren que una estenosis menor del 60 % no suele producir alteración hemodinámica, por lo que el efecto beneficioso de la revascularización no está garantizado. La elección de la técnica se individualizará teniendo en cuenta las características del paciente y las disponibilidades técnicas del medio. En casos de sospecha clínica y resultados no concluyentes de las técnicas no invasivas se indicará el estudio arteriográfico. Debido al riesgo de los procedimientos diagnósticos invasivos, se aconseja realizarlos solo en aquellos pacientes en los que se espera un beneficio terapéutico subsiguiente11. Otras técnicas como la gammagrafía poscaptopril, la toma selectiva de renina y la actividad de renina plasmática (ARP) no están indicadas en la evaluación inicial, aunque podrían tener su papel para confirmar el diagnóstico.
HIPERALDOSTERONISMO PRIMARIO
El hiperaldosteronismo primario se caracteriza por la inadecuada secreción de aldosterona en ausencia de activación del sistema renina-angiotensina-aldosterona. Sus principales formas son: 1) el adenoma productor de aldosterona (secreción inapropiada de aldosterona secundaria a un tumor unilateral o bilateral de la corteza suprarrenal), que constituye el 35 % de los casos de hiperaldosteronismo primario; 2) la hiperplasia suprarrenal bilateral (ambas glándulas adrenales secretan excesivas cantidades de aldosterona), que constituye el 60 % de los casos; y 3) otras formas menos frecuentes, como el hiperaldosteronismo primario remediable por glucocorticoides (< 1 %), la hiperplasia suprarrenal primaria unilateral (2 %) y el carcinoma adrenal (< 1 %).
El hiperaldosteronismo primario era considerado como una causa infrecuente de HTA, pero la utilización del cociente concentración de aldosterona plasmática/ARP como test de despistaje ha incrementado su prevalencia hasta un 10 %20. En líneas generales, se aconseja descartar el hiperaldosteronismo primario en los siguientes casos21: 1) PA > 160/100 mmHg; 2) HTA resistente; 3) HTA con hipopotasemia espontánea o inducida por diuréticos; 4) HTA e incidentaloma suprarrenal; 5) HTA con historia familiar de HTA en edades jóvenes o enfermedad cerebrovascular en jóvenes (< 40 años); y 6) pacientes hipertensos con familiares de primer grado con hiperaldosteronismo primario.
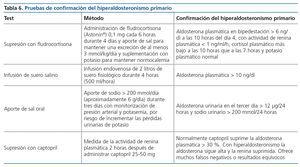
La determinación del cociente aldosterona plasmática/ARP se considera el método de elección para el despistaje del hiperaldosteronismo primario. Los niveles elevados de aldosterona plasmática (> 15 ng/dl o > 150 pg/ml) acompañados de ARP suprimida (< 1 ng/ml/h) o un cociente aldosterona plasmática/ARP elevado con una ARP suprimida sugieren la presencia de un hiperaldosteronismo primario22,23. Sin embargo, es preciso tener en cuenta varios factores que pueden afectar a su sensibilidad y especificidad24. El tratamiento con betabloqueantes, alfametildopa y clonidina puede causar falsos positivos, y los diuréticos (incluidos la espironolactona y el amiloride), los calcioantagonistas dihidropiridínicos, los IECA y los ARA II falsos negativos25-27. Por ello, para la determinación de la ratio se aconseja: 1) suspender los diuréticos al menos cuatro semanas antes de la determinación; 2) suspender betabloqueantes, alfametildopa, clonidina, calcioantagonistas dihidropiridínicos, IECA o ARA II al menos dos semanas antes de la determinación25,26. Para el manejo de la PA pueden utilizarse otros fármacos que no interfieren con el test, tales como verapamilo, alfabloqueantes o hidralacina21,25; y 3) corregir la hipopotasemia, debido a que esta alteración puede estar asociada con falsos negativos en pacientes con hiperaldosteronismo primario. El valor umbral para considerar el cociente aldosterona plasmática/ARP como sugestivo de hiperaldosteronismo primario es 30 ng/ dl/ng/ml/h (o 750 pmol/l/ng/ml/h)21. En ocasiones una ARP muy suprimida conlleva un cociente aldosterona plasmática/ARP elevado aun con una concentración de aldosterona en rango normal. En los casos dudosos se realizará un test confirmatorio basado en la supresión de la secreción de aldosterona mediante sobrecarga de sal o volumen. Los test más utilizados se exponen en la tabla 6. No existen datos concluyentes para recomendar uno u otro. La indicación de estas pruebas en pacientes con alteración de la función ventricular izquierda se individualizará especialmente y, en caso de llevarse a cabo, se hará con la monitorización apropiada. Una vez realizado el diagnóstico de secreción inadecuada de aldosterona, será preciso diferenciar el tipo de afectación suprarrenal utilizando técnicas de imagen o, incluso, la toma selectiva de muestras en venas suprarrenales. La prueba de imagen de elección es la TC con cortes finos (2-3 mm), aunque la TC o la RMN pueden no detectar adenomas milimétricos, o detectar nódulos no funcionantes o nódulos unilaterales en el contexto de una hiperplasia bilateral. Si solo se utilizan TC o RMN para el diagnóstico de lateralización, aproximadamente un 15 % de las cirugías podrían ser inadecuadas y un 4 % en el lado no adecuado28. La toma de muestras selectivas de venas suprarrenales es la técnica de referencia para diferenciar si se trata de una afectación unilateral o bilateral29. Sin embargo, es una técnica difícil, particularmente la cateterización de la vena adrenal derecha por su menor calibre. La toma de muestras suprarrenales debe ser realizada en casos de hiperaldosteronismo primario confirmado en los que se persigue un tratamiento quirúrgico21. Existen tres protocolos diferentes para la toma de las muestras y los criterios usados para detectar lateralización de hipersecreción de aldosterona dependerán del protocolo seguido21. Los pacientes en los que existe lateralización en la toma selectiva de venas adrenales son candidatos para adrenalectomía, que cura la HTA en un 50-60 % de los casos y mejora el control en el resto30. El tratamiento médico con espironolactona, eplerenona o amiloride se reserva para los pacientes con hiperplasia bilateral de glándulas suprarrenales y aquellos pacientes con hiperaldosteronismo primario unilateral que no son candidatos a cirugía o rehúsan el tratamiento quirúrgico. La dosis necesaria de espironolactona puede oscilar entre 50-300 mg/día.
HIPERCORTISOLISMO
El síndrome de Cushing es una condición caracterizada por la exposición crónica e inadecuada a corticoides. Su causa más frecuente es la administración exógena de glucocorticoides. El síndrome de Cushing por corticoides endógenos es debido a la secreción excesiva de ACTH (adrenocorticotropic hormone) en el 80 % de los casos, y menos frecuentemente por secreción ectópica de ACTH o raramente por secreción de CRF (corticotrophin-releasing factor). El síndrome de Cushing independiente de la secreción de ACTH suele representar un 20 % y ser debido en la mayoría de los casos a un tumor adrenal o más raramente a una hiperplasia macronodular adrenal.
El diagnóstico de este síndrome normalmente se basa en la sospecha clínica al detectar facies de luna llena, obesidad central, estrías abdominales de color purpúreo, debilidad muscular proximal y equimosis. Además, el síndrome de Cushing debe descartarse en los casos de HTA resistente y en presencia de un incidentaloma. Asimismo, se recomienda hacer despistaje de este síndrome en pacientes jóvenes con HTA y osteoporosis31. Tras excluir las causas exógenas de hipercortisolismo, se aconseja realizar un despistaje de Cushing endógeno utilizando la medida del cortisol libre urinario, la medida del cortisol en saliva nocturna, el test de supresión nocturna con 1 mg de dexametasona o el test de supresión con dexametasona 2 mg/ día durante dos días31. Una vez establecido el diagnóstico bioquímico, se debe realizar el diagnóstico de localización. Para el síndrome de Cushing independiente de ACTH se recomienda TC o RMN de glándulas suprarrenales, y para las formas dependientes de ACTH RMN del área hipofisaria. Aunque los adenomas hipofisarios son visibles en el 60 % de los casos, una RMN normal no descarta la enfermedad.
FEOCROMOCITOMA
El feocromocitoma es un tumor neuroendocrino derivado de las células cromafines de la médula adrenal en un 80-85 % de los casos o de ganglios extraadrenales (paragangliomas) en un 15-20 % de los casos y se caracteriza por secreción excesiva de catecolaminas produciendo elevación de la PA. El feocromocitoma es una causa poco frecuente de HTA secundaria, responsable de menos del 1 % de los casos. La tríada clásica del feocromocitoma consiste en episodios de sudoración, palpitaciones y cefalea acompañados de elevación de la PA. El patrón de elevación de la PA arterial en el feocromocitoma es variable, pudiendo aparecer elevación mantenida de la PA, elevación mantenida con crisis hipertensivas intermitentes o PA normal con elevaciones puntuales. En aproximadamente el 50 % de los pacientes puede darse hipotensión ortostática. El primer paso en el diagnóstico del feocromocitoma consiste en evidenciar la excesiva producción de catecolaminas, para lo que se utiliza la determinación urinaria y plasmática de catecolaminas, metanefrinas urinarias (normetanefrina y metanefrina) y la concentración urinaria de ácido vanilmandélico. En los últimos años, la medida de las metanefrinas plasmáticas o las metanefrinas fraccionadas en orina es considerada como la más sensible para el despistaje32. Es conveniente tener en cuenta que determinados fármacos pueden interferir con la medida de catecolaminas y metanefrinas33. El test de supresión con clonidina proporciona una evaluación dinámica de la secreción de catecolaminas que permite diferenciar entre aumento de su liberación por activación simpática o por feocromocitoma. La ausencia de supresión de noradrenalina plasmática es altamente predictiva de feocromocitoma. El despistaje bioquímico del feocromocitoma está indicado no solo en pacientes sintomáticos, sino también en aquellos con incidentalomas suprarrenales o con predisposición genética, tales como personas con neoplasia endocrina múltiple tipo 2, síndrome de von-Hipple-Lindau, neurofibromatosis tipo 1 y mutaciones de los genes de la succinato dehidrogenasa.
El diagnóstico de localización del tumor debe realizarse mediante TC o RMN en personas con características clínicas y bioquímicas compatibles con la presencia de feocromocitoma. La TC completa abdominal es la técnica más utilizada para la localización inicial de feocromocitomas adrenales o extraadrenales. Debido a la limitada especificidad de la TC y la RMN, una masa detectada por estas técnicas puede ser identificada posteriormente con gammagrafía con 123I-metaiodobencilguanidina (95-100 % de especificidad).
OTRAS ALTERACIONES ENDOCRINOLÓGICAS RELACIONADAS CON LA HIPERTENSIÓN ARTERIAL SECUNDARIA
Otras alteraciones endocrinológicas relacionadas con el desarrollo de HTA secundaria son las alteraciones tiroideas (hipertiroidismo e hipotiroidismo), el hiperparatirodismo primario y la acromegalia.
El hipotiroidismo se asocia con HTA, aunque los mecanismos no están bien explicados. El hipertiroidismo puede ser también causa de HTA en relación con el efecto estimulador directo sobre la frecuencia y contractilidad miocárdica. Aunque la PA media no está habitualmente elevada, la PA sistólica y el gasto cardíaco pueden estar elevados significativamente. El despistaje debe realizarse mediante la determinación de TSH y hormonas tiroideas34.
El hiperparatirodismo primario ha sido relacionado con HTA incluso en pacientes asintomáticos. En aquellos con hiperparatirodismo primario como parte de un síndrome de neoplasia endocrina múltiple, la HTA suele estar en relación con la presencia de un feocromocitoma. En aquellos con hiperparatirodismo primario esporádico, algunos estudios han mostrado reducción de la PA tras la paratiroidectomía35, aunque estas observaciones no son universales36. El despistaje debe realizarse mediante la determinación de calcio y fósforo plasmático, paratohormona intacta, niveles de vitamina D, y el diagnóstico de localización mediante ecografía y gammagrafía de paratiroides.
La HTA es una complicación relevante en la acromegalia, afectando a un 18-60 % de los pacientes. Los mecanismos no están bien definidos, aunque se postula que el aumento de la reabsorción de sodio y la activación del sistema nervioso simpático mediados por resistencia a la insulina podrían tener un papel importante37.
SÍNDROME DE APNEA-HIPOPNEA DEL SUEÑO
El síndrome de apnea-hipopnea del sueño (SAHS) es frecuente en la población general38 y se relaciona con el desarrollo de HTA y enfermedad cardiovascular39,40. Clínicamente se caracteriza por episodios repetidos de obstrucción completa o parcial de la vía respiratoria alta, dando lugar al ronquido. Otros síntomas que suelen estar presentes son la cefalea, la somnolencia diurna, la fatiga, la confusión matutina con dificultad en la concentración, los cambios en la personalidad, la depresión y las arritmias cardíacas. El método diagnóstico de elección es la polisomnografía nocturna41, aunque su uso puede estar limitado por los recursos disponibles en cada centro. El despistaje del SAHS se realiza habitualmente mediante cuestionarios específicos42,43, aunque aún no se ha definido el método de despistaje ideal debido a la alta tasa de falsos negativos44.
COARTACIÓN DE AORTA
La coartación de aorta es una de las principales causas de HTA secundaria en niños y consiste en un estrechamiento de la aorta descendente típicamente localizada a nivel de la inserción del ductus arterioso distal a la arteria subclavia izquierda. Los hallazgos clásicos son HTA en miembros superiores, pulsos femorales disminuidos o retrasados y PA baja en miembros inferiores. También suele auscultarse un soplo continuo en la pared posterior del tórax. El diagnóstico se realiza mediante técnicas de imagen no invasivas (ecocardiografía y RMN o TC aórticas) que permiten reservar el cateterismo cardíaco para la intervención terapéutica45.
HIPERTENSIÓN ARTERIAL INDUCIDA POR FÁRMACOS
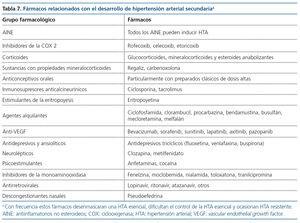
La HTA arterial inducida por fármacos es una causa frecuente de HTA secundaria46. Con frecuencia, los fármacos capaces de inducir HTA desenmascaran una HTA esencial o dificultan el control de una HTA esencial, llegando a ocasionar incluso HTA resistente47. Los fármacos relacionados tradicionalmente con elevación de la PA han sido los antiinflamatorios no esteroideos, antiinflamatorios inhibidores de la ciclooxigenasa 2, los analgésicos incluido el paracetamol, los anticonceptivos orales, los esteroides anabolizantes, los glucocorticoides, los mineralcorticoides, los antidepresivos, inmunosupresores como la ciclosporina y el tacrolimus, la eritropoyetina, algunos antirretrovirales y determinados fármacos antineoplásicos antiangiogénicos (inhibidores del factor de crecimiento vascular endotelial). Los fármacos que se han relacionado con el desarrollo de HTA se exponen en la tabla 747. Con frecuencia no será posible suspender muchos de ellos, por lo que será necesario emprender o aumentar el tratamiento antihipertensivo.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Correspondencia:
Rafael Santamaría
Unidad de Gestión Clínica de Nefrología. Hospital Universitario Reina Sofía.
Red de Investigación Renal REDinREN.
Avda. Menéndez Pidal, s/n. 14005, Córdoba.
rsantamariao@gmail.com