Presentamos una nueva edición de la Guía de Centros de Hemodiálisis. Se enmarca en el programa de actualización de las Guías Clínicas de la Sociedad Española de Nefrología. Es un documento de consenso en el que han colaborado nefrólogos con amplia experiencia en diálisis y expertos de la enfermería nefrológica. La Guía ha sido corregida por un grupo de evaluadores externos. Se ha informado y se ha tomado en consideración la opinión de los pacientes a través de la Asociación de Enfermos Renales (ALCER). Esta Guía incluye en sus diez capítulos aspectos arquitectónicos, logísticos y organizativos. Hace especial énfasis en las necesidades de recursos humanos y su cualificación. Revisa las modalidades actuales de hemodiálisis, su dosificación y adecuación y la monitorización y seguimiento intra e interdiálisis. La hemodiálisis es una de las formas de tratamiento renal sustitutivo, por lo que menciona la necesidad de la inclusión en lista de espera para trasplante y la relación con las unidades de diálisis peritoneal. La calidad de vida del paciente en hemodiálisis comprende la necesidad de relacionarse y viajar por lo que se revisa y estandariza la atención de los pacientes transeúntes. La gestión de calidad es una herramienta necesaria actualmente para lograr la mejora continua de cualquier procedimiento como la hemodiálisis. Esta Guía pretende ser una ayuda para el buen funcionamiento de las Unidades de Diálisis, para los responsables de las mismas, así como para los gestores sanitarios.
We present a new edition of the Hemodialysis Center Guide. It is part of the program of updating the Clinical Guides of the Spanish Society of Nephrology. It is a consensus document in which nephrologists with extensive experience in dialysis and experts in nephrological nursing have collaborated. The Guide has been corrected by a group of external evaluators. The opinion of the patients through the kidney diseases patient association (ALCER) has been reported and taken into consideration. This Guide includes in its ten chapters architectural, logistical and organizational aspects. It places special emphasis on human resources needs and their qualification. Review current hemodialysis modalities, dosage and adequacy, and intra and interdialysis monitoring. Hemodialysis is one of the forms of renal replacement therapy, so it mentions the need for transplant waiting list inclusion and the relationship with peritoneal dialysis units. The patient's quality of life on hemodialysis understands the need to relate and travel so care of transitory patients is reviewed and standardized. Quality management is a tool currently needed to achieve continuous improvement of any procedure such as hemodialysis. This Guide is intended to be an aid for the proper functioning of the Dialysis Units, for those responsible for them, as well as for health managers.
Como describimos a continuación, el tratamiento renal sustitutivo de la enfermedad renal crónica avanzada ha experimentado importantes cambios desde la edición por parte de la Sociedad Española de Nefrología (S.E.N.) de la Guía de Unidades de Hemodiálisis (HD), en el año 2006. Lo mismo podemos decir del tipo de pacientes, con un aumento progresivo de la edad de estos y su actitud ante la enfermedad, reclamando autonomía y total transparencia en las decisiones.
Al mismo tiempo que se han producido estos cambios clínicos y de enfoque terapéutico, también ha evolucionado la metodología de búsqueda, análisis y jerarquización de la evidencia científica en los que se sustentan.
Todos estos hechos explican y justifican la decisión de la S.E.N. por actualizar su Guía de unidades de hemodiálisis 2006, adaptando su metodología y política de edición, actualización y seguimiento a las exigencias actuales.
En la introducción de la edición anterior del 20061 se intentaba sensibilizar sobre la importancia epidemiológica del tratamiento renal sustitutivo (TRS) y no podemos dejar pasar esta oportunidad para exponer la evolución de estos datos en los últimos 15 años.
Según el último Informe Nacional de Diálisis y Trasplante publicado correspondiente al año 20172, los datos de prevalencia presentan un constante crecimiento respecto a los datos del registro del 2002 expuestos en la guía del 2006, siendo actualmente unos 60.000 pacientes en los diferentes tipos de TRS. Actualmente la incidencia está en alrededor de 141 pmp, lo que supone aproximadamente unos 6.500 pacientes al año.
Aún existen diferencias muy marcadas entre las diferentes Comunidades Autónomas y entre las diferentes modalidades terapéuticas. Para este último punto cabe mencionar un incremento sustancial de la diálisis peritoneal y del trasplante renal anticipado para los pacientes incidentes. Esta primera revisión de la Guía de Centros de Hemodiálisis de la S.E.N., publicada en la revista Nefrología1 pretende adecuar su contenido a la nueva situación actual antes mencionada.
Han pasado 13 años desde esa primera edición y el tratamiento renal sustitutivo y sus características han evolucionado. Si nos centramos en los avances técnicos que han acontecido en hemodiálisis, no podemos dejar de mencionar aspectos como la utilización de líquidos de diálisis ultrapuros y con citrato, la generalización del uso de biosensores, la comercialización de membranas con posibilidad de realizar diferentes técnicas dialíticas (hemodiafiltración [HDF], HD), la instalación de programas informáticos integrados y bidireccionales que permiten mejorar la calidad asistencial y seguridad clínica, y tampoco podemos obviar el aumento del uso de técnicas convectivas como la hemodiafiltración en línea (HDF-OL) que ha demostrado una reducción significativa de la mortalidad global frente a la HD convencional.
Del mismo modo, hemos visto nacer nuevas moléculas que se han sumado al arsenal terapéutico para poder tratar a nuestros pacientes, como las eritropoyetinas de vida media más larga, diferentes tratamientos para las alteraciones del metabolismo óseo-mineral, como los activadores selectivos del receptor de la vitamina D, los calcimiméticos, nuevos quelantes del fósforo de base no cálcica y, actualmente, también los nuevos quelantes de potasio.
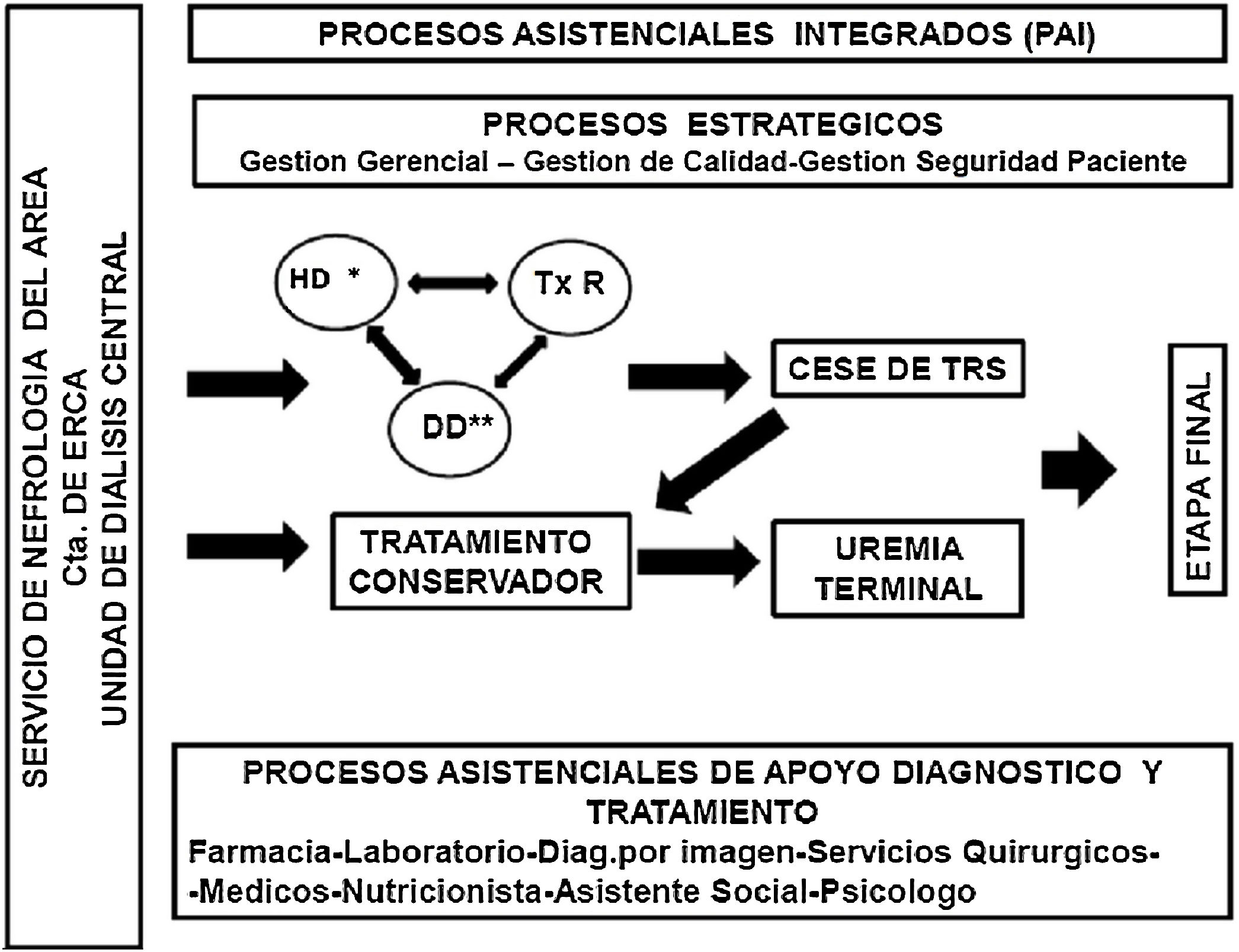
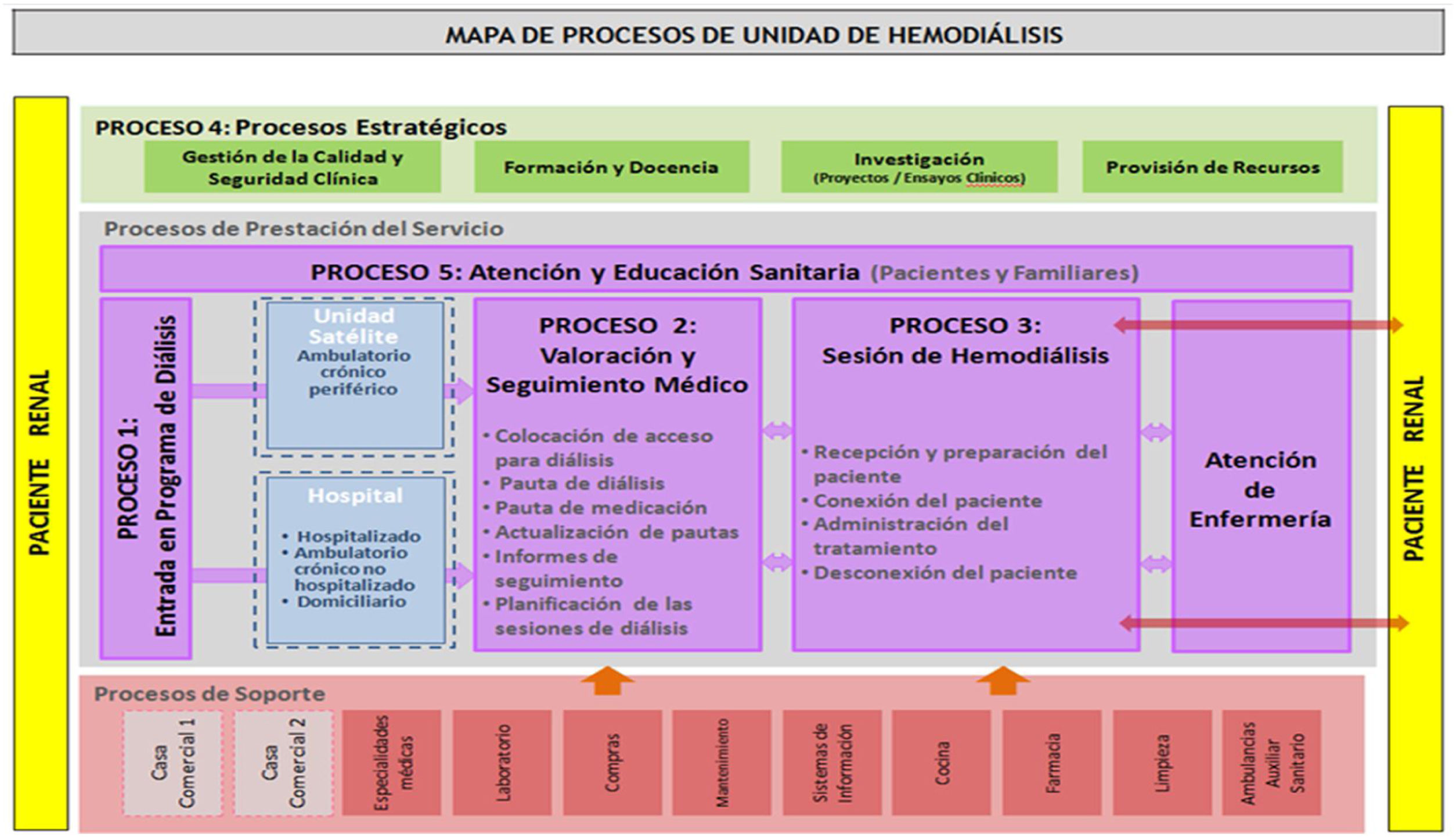
Definición y tipos de centros/unidades de hemodiálisisAntes de proceder a definir los distintos tipos de centros o unidades de diálisis (UD), conviene definir lo que se entiende por las mismas. Una unidad o centro de diálisis es aquella unidad asistencial, hospitalaria o extrahospitalaria que proporciona tratamiento dialítico al paciente que lo precise. En esta guía nos hemos centrado en el tratamiento de hemodiálisis (HD), por lo que nos vamos a referir a la Unidad de Hemodiálisis (UHD). No obstante, es preciso aclarar que, en el caso de las UD hospitalarias, estas deben disponer y ofrecer al paciente todas las opciones de tratamiento renal sustitutivo (TRS), a saber: trasplante (donante cadáver y vivo), HD, técnicas domiciliarias, tanto hemodiálisis domiciliaria (HDD) como diálisis peritoneal (DP), y tratamiento conservador. Cabe destacar que se debe garantizar la satisfacción del derecho que el paciente tiene por ley (Ley de Autonomía del Paciente, 41/2002)3 de recibir la información sobre su enfermedad y las distintas opciones de tratamiento, para poder decidir el que mejor se adapte a su estilo de vida, siempre que no existan contraindicaciones médicas. Además, las modalidades de TRS no deben ser compartimentos estancos; la planificación del tratamiento debería centrarse en el paciente en su totalidad, teniendo en cuenta todas las opciones posibles en cada momento de acuerdo con el estado de salud particular y las preferencias del paciente. Es por ello esencial favorecer la educación y formación del paciente, facilitar la toma de decisión compartida para el TRS, e incluso la confección de una hoja de ruta del paciente en el tránsito a través de las distintas modalidades de TRS4,5.
Las técnicas de diálisis domiciliarias son mejores opciones en términos de coste/efectividad6,7 por lo que se deben priorizar estas opciones en la planificación de los recursos de la red asistencial.
La UHD es una unidad asistencial que ofrece asistencia multidisciplinar en un espacio específico, que cumple unos requisitos funcionales, estructurales y organizativos, y garantiza las condiciones de seguridad, calidad y eficiencia para proporcionar tratamiento dialítico, de acuerdo con los criterios y con la adecuación que recomienda la evidencia. Incluye tanto a la unidad hospitalaria como a la unidad extrahospitalaria, y ambas deben estar perfectamente coordinadas (ver apartado 1.1.4). Los requisitos que debe cumplir la UHD se desarrollarán a lo largo de esta guía.
Desde los inicios de la HD en España, y como consecuencia de la escasez de plazas en los hospitales públicos, esta ha coexistido con la diálisis en el ámbito extrahospitalario. En la actualidad, un gran número de pacientes pertenecientes al sistema público de salud reciben hemodiálisis en centros extrahospitalarios y son atendidos por un grupo también numeroso de nefrólogos que desarrollan su actividad profesional en estos centros. En España, repartidas por toda su geografía, existen 319 unidades de HD tanto extra como intrahospitalarias8.
Definición de unidad o centro de diálisis hospitalariaUnidad que proporciona el tratamiento dialítico dentro del hospital, atendiendo tanto las demandas propias como las que se derivan de su función dentro de la red de recursos sanitarios de su área. La UHD hospitalaria (UHDH) se integra en el servicio de Nefrología, lo que condiciona sus características (estructurales, materiales y de recursos humanos) y funciones. La función de la UHDH es ofertar el servicio de hemodiálisis en el hospital y su área de influencia. Incluye a los pacientes en diálisis de la comunidad autónoma en cuestión, pacientes de otras comunidades autónomas u otros países que, en virtud de los convenios y legislación existentes, deban ser tratados por el Servicio Nacional de Salud. La UHDH se debe reservar para el paciente agudo y para el paciente crónico en TRS hospitalizado, así como al paciente con mayor comorbilidad.
La UHDH debe realizar labores de coordinación de la red asistencial, siendo sus objetivos:
- •
Disponer de unidad de enfermedad renal crónica avanzada (ERCA) que incluya informar y entrenar al paciente sobre su enfermedad y las distintas opciones de tratamiento, facilitando la elección de la técnica más adecuada.
- •
Integrar los tipos de tratamiento sustitutivo de la función renal: trasplante renal de cadáver y de vivo, DP y HD, incluyendo la HDD, y el tratamiento conservador.
- •
Dotar de los medios para la realización de las técnicas de HD habituales: HD convencional, HD de alto flujo, HDF-OL.
- •
Proporcionar soporte asistencial, de formación y docencia a las UHD extrahospitalarios (UHDE) de su área de influencia.
- •
Ofrecer soporte asistencial de diálisis al resto del hospital, tanto para pacientes agudos como crónicos.
- •
Otorgar soporte asistencial de técnicas especiales al resto del hospital (técnicas de diálisis continuas y aféresis terapéutica).
La UHDH debe garantizar la asistencia correcta en HD al paciente programado y al paciente no programado, la asistencia en la unidad de acceso vascular y la inclusión del paciente en lista de espera de trasplante renal en su propio centro o de referencia. Debe tener acceso a camas de hospitalización para ingreso y seguimiento adecuado por parte de Nefrología.
La UHDH debe asegurar la atención urgente, con oferta asistencial durante las 24 horas diarias. Requiere la disponibilidad de un nefrólogo de presencia física cuando se realice alguna sesión de HD.
La clasificación funcional de las UHDH es:
- a)
Diálisis de Pacientes Crónicos: realiza la HD periódica de mantenimiento de los pacientes que acuden al hospital. La estructura arquitectónica, la dotación técnica y de personal, así como el tratamiento de pacientes con infecciones se ajustará a la normativa vigente.
- b)
Diálisis de Pacientes Agudos: esta unidad se destinará a pacientes que, estando ya incluidos en tratamiento renal sustitutivo (pacientes crónicos), requieran hospitalización por un proceso agudo, o a pacientes con patología aguda que precisan temporalmente diálisis. Así mismo, podrán realizarse en esta unidad, técnicas especiales como:
- •
Técnicas de aféresis terapéutica.
- •
Técnicas continuas de depuración extrarrenal.
Deberá disponer de personal de enfermería y auxiliar específico de acuerdo con la normativa vigente.
- c)
Diálisis domiciliaria: esta opción terapéutica estará orientada al control y entrenamiento de aquellos pacientes que opten por la diálisis en domicilio, ya sea HDD o DP.
Centro que proporciona el tratamiento dialítico fuera del hospital (Ley orgánica 15/1999)9 Generalmente están ubicados en zonas estratégicas del área sanitaria: Centros de Salud, Hospitales Comarcales u otras dependencias que cumplan los criterios de adecuación de Servicio Sanitario y están vinculados a un Servicio de Nefrología.
Estos centros están regulados por los contratos de Gestión de Servicios Públicos para el tratamiento de HD en Centros concertados a pacientes del Sistema Sanitario Público9. Estos contratos son adjudicados por los servicios de salud de las diferentes comunidades autónomas. Incluye a los pacientes en diálisis derivados de las UHDH u otros en virtud de los convenios y legislación existentes. Requiere de la presencia de un nefrólogo durante la sesión de diálisis.
Siempre que el Servicio de Salud concierte con entidades privadas, se deberá considerar la necesidad de establecer una relación funcional entre el Servicio de Nefrología de referencia y el centro extrahospitalario que permita que los pacientes atendidos en ambos centros dispongan de las mismas oportunidades en cuanto a la terapia dialítica y otros tratamientos, la realización de pruebas complementarias, acceso a la lista de trasplante e interconsultas con otras especialidades.
Es deseable que para mejorar la continuidad asistencial de los pacientes en diálisis derivados a las UHDE se establezca un sistema de conexión informática entre el hospital y la UHDE. Se trata de habilitar una conexión informática entre ambos centros, permitiendo el acceso a la información de los pacientes compartidos. Estos potencian la equidad, seguridad, eficiencia, fiabilidad y confidencialidad de los tratamientos a estos pacientes.
Comparte, en general, características de la UHDH, excepto que no atiende al paciente agudo y que puede no ofertar todas las modalidades posibles de la cartera de servicios. La coordinación entre la UHDE y la UHDH es relevante para garantizar la equidad y calidad de la HD.
Objetivos de una unidad de hemodiálisisLas UHD tanto hospitalarias como extrahospitaliarias tienen como objetivo proporcionar tratamiento dialítico a aquellos pacientes que lo precisan de acuerdo a los criterios y con la «adecuación» que recomienda la evidencia científica contemplada en las guías clínicas, procesos asistenciales integrados, protocolos y otros instrumentos de gestión clínica.
Otros objetivos específicos de una UHD son:10
- •
Mejorar la información y la atención de los pacientes sobre el TSR.
- •
Fomentar el trasplante renal de donante vivo.
- •
Garantizar la calidad técnica recomendada, así como los aspectos sociales necesarios al paciente.
- •
Garantizar un adecuado acceso vascular, priorizando la fístula arterio-venosa interna (FAVI) en todos los casos técnicamente posibles.
- •
Aumentar el porcentaje de pacientes que acceden a HD con fístula arteriovenosa viable y operativa.
- •
Garantizar que todos los pacientes de las unidades de HD sean tratados con líquido de diálisis ultrapuro.
- •
Fomentar la participación activa del paciente.
- •
Aplicación de los protocolos clínicos de diagnósticos y tratamiento de las complicaciones de la técnica de HD.
- •
Mantener un adecuado nivel científico y de innovación tecnológica.
- •
Mejorar las capacidades y habilidades de todos los profesionales.
- •
Las UHDH deben dar soporte técnico y científico a las UHDE.
Como bien se ha comentado con anterioridad, es necesario establecer una relación funcional, así como asegurar una comunicación eficaz y continuada entre las unidades de diálisis o centros extrahospitalarios y los servicios de Nefrología de referencia para poder garantizar la equidad en la atención sanitaria de los pacientes.
Para favorecer esta relación será necesario:
- •
El uso de tecnologías de la información fácilmente accesibles, como el teléfono o el correo electrónico. Disponer de una historia clínica compartida y, si no es posible, por lo menos proporcionar acceso a los diferentes sistemas informáticos con el fin de facilitar el intercambio de información clínica y evitar desplazamientos innecesarios del paciente2. Para estos dos puntos es necesario cumplir la normativa vigente respecto a la protección de datos de carácter personal (LOPD y RGPD).
- •
Establecer los circuitos de derivación de los pacientes en ambos sentidos.
- •
Definir protocolos clínicos consensuados acerca del tratamiento mediante depuración extrarrenal, de sus complicaciones y patología asociada (anemia, alteraciones del metabolismo óseo mineral).
- •
Realizar reuniones comunes con carácter periódico para tratar temas clínicos o bien de organización.
- •
El centro de referencia deberá asumir los procesos urgentes, los pacientes agudos, los pacientes crónicos en TRS hospitalizados por cualquier causa o bien cuando estos requieran una modalidad de diálisis que no pueda prestarse en su centro extrahospitalario.
- •
Criterios de calidad comunes con el centro de referencia (Normas ISO 9001).
En forma paralela a la evolución experimentada durante estos años por la enfermedad renal y su enfoque terapéutico, también han evolucionado los conceptos y estrategias de búsqueda y difusión del conocimiento clínico.
Aunque sujeto a numerosos elementos de controversia, se considera que las Guías de Práctica Clínica (GPC) desarrolladas de forma rigurosa y con la metodología adecuada (Grading of Recommendations, Assessment, Development and Evaluation [GRADE]) tienen un papel decisivo en la transmisión de conocimiento clínico y en la mejora de la calidad asistencial11,12.
Para la realización de una GPC se requiere:
- a)
Un problema clínico bien definido por médicos expertos y otro personal concernido (enfermos, otro personal sanitario).
- b)
Una estrategia de búsqueda estructurada y sistematizada de la producción científico-clínica publicada, realizando un análisis de su calidad y valor probatorio que requiere, generalmente, la colaboración de metodólogos y documentalistas.
- c)
Sobre estas bases, el grupo de expertos formula recomendaciones, adoptadas por consenso, que respondan a los distintos aspectos del problema planteado.
- d)
El mayor nivel de transparencia (evidencia bibliográfica, metodología, conflicto de interés). Controles de revisión interna y externa.
- e)
Participación, en distintos niveles, de todos los estamentos implicados en el procedimiento clínico analizado (enfermería, otros profesionales sanitarios, pacientes, industria).
En el desarrollo de una GPC nos encontramos con:
- a)
Aspectos descriptivos o conceptuales (definiciones, clasificaciones, convenios, aspectos organizativos, etc.) que pueden resolverse utilizando las tradicionales revisiones narrativas.
Puede observarse en el índice temático de nuestro trabajo, que la mayoría de los temas del mismo (capítulos 1, 2, 3, 6, 7, 8, 9) son descriptivos y/o conceptuales, incluyendo aspectos como el análisis de la estructura arquitectónica de una Unidad de Hemodiálisis, dotación de personal, descripción y reconocimiento de las distintas modalidades de HD, atención de los pacientes de forma transitoria, etc.).
Estos temas pueden resolverse con la metodología clásica de las revisiones narrativas. Los trabajos realizados bajo estos epígrafes incluyen una amplia revisión bibliográfica tanto de la literatura nefrológica como de cualquier otro tipo de información relacionada con el tema (documentos y disposiciones oficiales, protocolos de los Centros de Evaluación de Tecnologías Sanitarias, toma de posición de otras sociedades, etc.).
El documento resultante ha sido sometido a un proceso de revisión por otros nefrólogos expertos en el tema (Anexo 1) y consultado con profesionales de enfermería nefrológica (SEDEN) y asociaciones de enfermos renales (ALCER).
Finalmente, el borrador final de la guía ha permanecido expuesto en la web de la S.E.N. durante un mes para que los asociados o cualquier persona pudieran tener acceso a conocerla y enviar comentarios a la misma con anterioridad a su publicación definitiva.
- b)
Aspectos que analizan problemas clínicos de interés en HD (como comparación del resultado de distintos procedimientos terapéuticos o diagnósticos, elementos pronósticos o epidemiológicos, etc.).
Puede observarse en el listado temático de nuestra guía la presencia de tres temas básicamente clínicos: los capítulos 4, 5 y, parcialmente, el 10. Estos temas incluyen aspectos descriptivos, conceptuales y valorativos y han sido desarrollados por nefrólogos expertos en forma de revisión narrativa precedida de una búsqueda bibliográfica exhaustiva (PubMed, Cochrane) y desarrollada con la metodología descrita en el apartado anterior.
La S.E.N. y los profesionales que realizan la actual guía son conscientes de la necesidad de profundizar en aspectos muy concretos de estos temas clínicos para acreditar el rigor científico y el valor probatorio de las conclusiones y recomendaciones, utilizando una metodología que garantice la recopilación sistemática y rigurosa de la evidencia bibliográfica publicada y el análisis de la calidad de la misma. Entre estos métodos, la metodología GRADE ha sido universalmente empleada para la realización de Revisiones Sistemáticas y Guías de Práctica Clínica13–15.
Para mejorar el rigor y nivel de evidencia científica de esta área de nuestra especialidad, se está trabajando en una serie de revisiones sistemáticas en temas clínicos que servirán de base para la formulación de recomendaciones y que se irán publicando en la revista Nefrología con el nombre común de Guías de Hemodiálisis.
Equipo que realiza la guíaPara la actualización de la Guía de Unidades de Hemodiálisis del año 20061, la Junta Directiva de la S.E.N. ha seleccionado a los más prestigiosos especialistas de cada materia objeto del estudio, muchos de los cuales ya participaron en la redacción del pasado documento.
La selección fue realizada de forma independiente, teniendo en cuenta criterios de idoneidad profesional y científica, así como ausencia de conflictos de interés.
Inicialmente se procedió a la elección de los coordinadores con base en su autoridad investigadora, experiencia profesional y capacidad organizativa. Con su intervención y de acuerdo con la JD, se seleccionaron al resto de los panelistas de cada uno de los temas y otros colaboradores externos e internos, muchos de los cuales ya participaron en la redacción del pasado documento. Se acompaña mini-curriculum para mostrar la idoneidad de los profesionales que colaboran en la guía, así como su declaración de conflicto de interés (Anexo 2).
Población a la que va dirigida la guía- •
Profesionales médicos, enfermeras y auxiliares que trabajen en Unidades de Diálisis.
- •
Gestores y directores de hospitales y centros extrahospitalarios que dispongan de Unidades de Hemodiálisis.
- •
Administraciones públicas sanitarias.
- •
Asociaciones de pacientes renales.
- 1)
Definir los criterios de la S.E.N. sobre los requisitos estructurales y funcionales que deben reunir las Unidades de hemodiálisis extrahospitalarias.
- 2)
Definir las relaciones de la Unidad de Nefrología extrahospitalaria con la estructura funcional del área sanitaria (Unidad hospitalaria/Servicio de Nefrología; Diálisis Peritoneal; Trasplante renal).
- 3)
Analizar aspectos concretos de práctica clínica, especialmente aquellos que su implantación sea exigible y/o recomendable en todas las unidades de hemodiálisis. Se realizarán siguiendo la metodología GRADE, formulando, por consenso del grupo redactor, las preguntas clínicas pertinentes (PICO), el diseño de las revisiones sistemáticas y los procesos de toma de decisión (metodología GRADE-Delphi) para la elaboración de las recomendaciones.
- 4)
Los documentos resultantes, tendrán el carácter de posición institucional (position statement) de la S.E.N. y se irán realizando a lo largo del tiempo bajo el epígrafe general de Guías de Hemodiálisis y serán editadas en la revista Nefrología, sitio Web de la S.E.N. y Nefrología al día.
Los locales donde se instalen las UHD deben reunir las condiciones de habitabilidad e higiene requeridos para cualquier centro sanitario. El diseño del edificio debe adaptarse a las condiciones climatológicas, de temperatura y sonoridad en función de su ubicación16–28.
Serán de obligado cumplimiento las Normativas Legales Vigentes que sobre este tipo de locales se tengan en cada Comunidad Autónoma, así como las Normativas Estatales y europeas al respecto, tanto para la construcción como para la puesta en marcha, mantenimiento y controles posteriores29–34.
Es necesario garantizar un entorno libre de barreras arquitectónicas y disponer de un acceso rápido, cómodo y seguro para el transporte de los pacientes que permita unos tiempos adecuados en la asistencia.
Sería interesante dimensionar la Unidad en función de la teórica demanda habiendo realizado un análisis demográfico del entorno (tasas de prevalencia por grupos de edad y características de la población del área) con una proyección de la población a 10 años.
Este capítulo se refiere tanto a Unidades de Hemodiálisis Hospitalarias como Extrahospitalarias. En el caso de las hospitalarias estarán integradas en un entorno que incluye la consulta de ERCA, unidad de diálisis domiciliaria (peritoneal y hemodiálisis), pudiendo compartir algunos de los locales que se especifican, como la sala de espera.
Zonas o localesEn los locales de hemodiálisis de crónicos predominará el ambiente doméstico sobre el hospitalario, presentando un aspecto grato y manteniendo en buen estado de conservación y limpieza.
El diseño general deberá tener en cuenta la versatilidad de los diferentes ambientes que permita la máxima comodidad para pacientes, familiares y personal sanitario, asegurando su intimidad y permitiendo un ambiente dinámico y funcional.
Área administrativa (Admisión / Recepción / Secretaría)18- •
Ubicada a la entrada de la unidad con acceso visible y sencillo.
- •
El mostrador de atención debe estar diseñado con una zona baja para poder atender a personas en silla de ruedas.
- •
Deberá permitir el acceso y estancia de personas con movilidad reducida (sillas de ruedas, etc.).
- •
Tendrá una superficie mínima de 9 m2. Podrá estar integrada o formar parte de otras estancias y dependencias de tipo administrativo.
- •
Este local debe disponer de medios de comunicación (voz y datos). El mostrador es un puesto de trabajo dotado de ordenadores, reprografía, teléfono y fax.
- •
El área permitirá realizar las funciones de control, atención e información general al usuario.
- •
Debidamente señalizada, con un directorio de información.
- •
Que permita el acceso y estancia de sillas de ruedas y demás discapacitados.
- •
Dispondrá de material mobiliario cómodo que permita una espera confortable y relajada a todos los pacientes y acompañantes de cada turno.
- •
Dispondrá de espacio para la espera en sillas de ruedas.
- •
Estará ubicada contigua a los vestuarios de los pacientes, próxima a la sala de hemodiálisis y dispondrá de servicios sanitarios adjuntos.
- •
Por tratarse de un lugar de concentración de personas, será lo suficientemente amplio, bien ventilado e iluminado, permitiendo un ambiente agradable y relajado para los pacientes y los familiares.
- •
Con una superficie superior a 1,5 m2/paciente de cada turno de HD. Superficie mínima de 20 m2.
- •
Deben ubicarse cerca de la sala de espera y de los vestuarios de pacientes.
- •
Al menos un aseo por cada 10 puestos o fracción con diferenciación por sexos.
- •
Debe haber un aseo adaptado para pacientes con movilidad reducida, con lavabo e inodoro adecuados y ausencia de barreras arquitectónicas.
- •
Todas las puertas de los aseos, duchas y vestuarios abrirán hacia el exterior y las cerraduras permitirán la apertura exterior en caso de emergencia, como medida de seguridad.
- •
Dispondrá de pulsadores de llamada de emergencia al exterior, acústicos y/o visuales.
- •
Con áreas diferenciadas por sexos.
- •
Estará dotada de taquillas o casilleros para objetos personales.
- •
Debe existir un aseo y vestuario individual para los pacientes con serología positiva para virus B.
- •
Próxima a la sala de Hemodiálisis.
- •
Por cada puesto la superficie mínima será de 8 m2.
- •
Las separaciones entre puestos permitirán la circulación cómoda del personal sanitario, así como el paso de sillas de ruedas y camillas.
- •
Idealmente los pacientes deberán estar dispuestos de forma que se asegure cierta privacidad, además de ser visibles en todo momento por el personal del centro.
- •
Se recomienda la disposición de biombos portátiles (mejor que cortinas colgadas de raíles empotrados en el techo) entre los distintos puestos de tratamiento con objeto de lograr privacidad visual sin condicionar la penetración de la luz natural en la sala.
- •
Dispondrá de sillones o camas automatizados, cómodos y que permitan posición de Trendelenburg.
- •
Se dispondrá de un peso de precisión de enfermos, que permita el pesado de sillas de ruedas.
- •
En el control de enfermería se podrán realizar de forma cómoda los trabajos informáticos y de lectura o escritura propios de enfermería. Debe disponer infraestructuras de telecomunicación, sistema de comunicación con los pacientes, transporte de neumático y alarmas: protección contra incendios, gases y tratamiento y suministro de agua de diálisis.
- •
Desde cada puesto de enfermera se podrán controlar todos los puestos de hemodiálisis que dependan de ella.
- •
Cada puesto de tratamiento debe estar dotado de un sistema de llamada a enfermería.
- •
La sala debe disponer de espacio para el lavado de manos del personal que atiende a los pacientes. Cada lavabo debe permitir el fácil uso por parte del personal: de codo, pedal o automático.
- •
Contiguo al lavabo de personal se deben ubicar los contenedores de residuos clínicos, punzantes y asimilables a urbanos.
- •
Se debe disponer de suficientes dispensadores de solución hidroalcohólica.
- •
Se recomienda que la distribución y redes de aguas, concentrados, eléctrica e informática, se realicen por cajetines individualizados, desmontables y de fácil acceso, que permitan su reparación o sustitución sin que sean precisos trabajos de albañilería.
- •
Cada puesto eléctrico de hemodiálisis dispondrá de diferencial individualizado.
- •
La instalación eléctrica permitirá una iluminación adecuada al tipo de asistencia, tanto en sala como en el control de enfermería y dispondrá de iluminación indirecta para el descanso de los pacientes.
- •
Cada puesto de tratamiento debe estar dotado de una toma de datos conectada al servidor mediante una red local.
- •
Se recomienda la posibilidad de conexión por WiFi.
- •
Si se dispone de instalaciones audiovisuales, cada puesto de hemodiálisis dispondrá de auriculares individualizados.
- •
Dispondrá de tomas de oxígeno y vacío (bien en red, individual o portátil).
- •
La sala dispondrá de sistema de calefacción y aire acondicionado, que permita un ambiente y temperatura agradable.
- •
Deberá tener un monitor de reserva por cada ocho monitores operativos.
- •
Con instalación eléctrica, toma de aguas y drenajes.
- •
Puede estar anexa a la sala de tratamiento del agua.
- •
La superficie estará en consonancia con el dimensionamiento de los elementos del tratamiento de agua.
- •
Se recomienda que esté situada lo más cerca posible de la sala de hemodiálisis.
- •
Debe estar suficientemente ventilada/refrigerada para disipar el calor y gases generados por el tratamiento y desinfecciones.
- •
El suelo estará impermeabilizado, contando con un sumidero suficiente.
- •
Deberá tener una capacidad de almacenamiento de agua de aporte para cubrir las necesidades de un día de diálisis.
- •
Se atendrá a las recomendaciones de la Guía de gestión de calidad del líquido de diálisis (LD) (segunda edición, 2015)37.
- •
Adecuado y dotado de material que permita el almacenamiento y preparación de las medicaciones.
- •
Con superficie mínima de 8 m2.
- •
Almacén de material limpio y/o estéril. Almacenaje y conservación de medicación, de acuerdo con la Ley 25/90 de 20 diciembre del Medicamento y demás normas complementarias que la desarrollan. Preparación de material clínico.
- •
Estará dotada de frigorífico a 4°C, con control homologado de temperatura y alarma en caso de mal funcionamiento. Armarios y dispositivos apropiados para este tipo de almacenajes (estanterías, vitrinas, etc.). Panel de información y protocolización, así como repisa apropiada para premedicación.
- a)
Tendrá una superficie mínima de 8 m2 y deberá cubrir las necesidades de:
- ∘
Almacenamiento temporal de ropa sucia y/o basura.
- ∘
Limpieza de material.
- •
Tanto la recogida de residuos, como su almacenaje provisional se ajustará a la normativa legal vigente.
- •
Se dispondrá de un almacén general con capacidad de almacenaje de recambios y para el material fungible mínimo necesario para una semana.
- •
Espacio para los carros de ropa limpia y almacenamiento para material textil (mantas, almohadas, toallas), que debe estar diferenciada de la sucia (a ubicar temporalmente en el oficio de clasificación de residuos).
- •
Dispondrá de armario o zona específica cerrada para materiales inflamables y volátiles.
- •
Existirá al menos un local para consulta, con zona de exploración diferenciada que garantice la intimidad del paciente, equipada con lavamanos, mesa de despacho con su silla y dos sillas de consulta con una superficie entre 12 y 19 m2.
- •
Puede servir como espacio polivalente para otros usos (psicólogo, trabajador social).
- •
Dotada con mobiliario e instalaciones adecuadas.
- •
Puede servir como espacio polivalente para otros usos (psicólogo, trabajador social).
- •
Se dispondrá de vestuarios con una taquilla por cada miembro de plantilla, que podrán estar ubicados dentro de la Unidad de Diálisis o bien en Unidades Centralizadas Generales.
- •
La unidad estará dotada de un WC por cada 15 mujeres o fracción, por turno, y un WC por cada 25 hombres o fracción por turno.
- •
Se dispondrá de un lavabo clínico de personal por cada 10 enfermeras/os o fracción.
- •
Podrá ser el general centralizado.
- •
Se dispondrá de una sala, contigua a la sala de hemodiálisis, que permita el tiempo preceptivo de descanso por turnos del personal sanitario.
- •
Superficie mínima de 12 m2.
- •
Según la normativa general sanitaria.
- •
Dentro de la sala de Hemodiálisis o en un espacio próximo a la zona de fácil acceso existirá:
- ∘
Carro o mesas auxiliares o de curas.
- ∘
Carro de parada completo, con monitor de constantes vitales portátil.
- ∘
Electrocardiógrafo portátil de 12 canales.
- •
Se recomienda la dotación de un ecógrafo para el control y manejo de los accesos vasculares.
Se sugiere la existencia de: aseos públicos, cercanos a la sala de espera; una sala de curas, que se puede asimilar algún despacho; oficio de comidas, asimilable al área de descanso de personal y sala de reuniones polivalente / biblioteca / sesiones / docencia.
Condiciones generales29–34,48,49Serán de obligado cumplimiento las normativas legales local, autonómica, estatal y europea vigentes para la construcción, funcionamiento y eliminación de barreras arquitectónicas de este tipo de instalaciones, así como de toda la normativa de aplicación general, Real Decreto 556/1989, de 19 de mayo, por el que se arbitran medidas mínimas sobre accesibilidad en los edificios, Ley 8/1993, de 22 de junio, de promoción de la Accesibilidad y Supresión de Barreras Arquitectónicas de la Comunidad de Madrid, y Ley 51/2003, de 2 de diciembre, de igualdad de oportunidades, no discriminación y accesibilidad universal a personas con discapacidad.
Los locales donde se instalen las unidades de HD deben reunir las condiciones de habitabilidad e higiene requeridos para cualquier centro sanitario.
La mayor parte del Centro destinada a la asistencia se dispondrá en planta baja, si ello no fuera posible, deberá tener ascensor utilizable para silla de ruedas y camilla.
Los suelos de la unidad de hemodiálisis serán de algún material impermeable y resistente a ácidos y otros productos químicos utilizados en la HD.
La estructura general de la Unidad, la circulación de personas y material según los sistemas de transporte:
- •
Circuito unidad de crónicos 1,50 m de ancho.
- •
Zona de posible giro de camillas 2,00 m de ancho libre.
- •
Zona de posible giro de camas 2,40 m de ancho libre.
La instalación eléctrica consistirá en una doble línea alternativa de corriente, a fin de garantizar el funcionamiento de la unidad en caso de fallo del suministro eléctrico en una de ellas. La unidad dispondrá de suministro eléctrico de emergencia ante cortes en el suministro eléctrico de la red. Como mínimo, la red de emergencia incluirá los monitores de hemodiálisis, la planta de tratamiento de aguas, las neveras de medicación y de muestras biológicas y la iluminación ambiental. Se recomienda que no sea inferior a 4.000W por puesto de diálisis.
La instalación eléctrica asegurará al máximo el suministro, disponiendo de grupo electrógeno (general o propio) con capacidad mínima de funcionamiento durante, al menos, una sesión de hemodiálisis (cinco horas).
Todas las tomas eléctricas estarán dotadas de diferencial individual y existirá un cuadro eléctrico general con cuadros diferenciados por puesto de hemodiálisis.
Se cumplirá en todos sus aspectos el reglamento eléctrico vigente de baja tensión del Ministerio de Industria.
Se asegurará el agua de aporte a la UHD mediante una doble acometida de agua, un depósito de agua no tratada suficiente para un día y en el caso de UHD hospitalaria mediante el aljibe correspondiente.
Se dispondrá de las correctas instalaciones de protección, señalización y evacuación, con luces y salidas de emergencia conforme a la normativa vigente, que aseguren de forma correcta el plan de evacuación, el de antincendios u otras emergencias.
Se deberá disponer de certificado técnico acreditativo del cumplimiento de la normativa vigente en materia de seguridad en edificios, salida de emergencia y protección antiincendios.
Se recomienda que las salas permanezcan vacías entre los distintos turnos a fin de facilitar la limpieza y desinfección de las mismas antes del inicio del siguiente turno de tratamientos. Para ello, los techos, paredes y suelos estarán fabricados en materiales que garanticen las rutinas de limpiezas periódicas y permitan la utilización de productos de limpieza y desinfectantes.
El centro sanitario tiene la obligación de identificar y clasificar los residuos sanitarios, garantizando su adecuada retirada y eliminación.
El personal de mantenimiento de todas las instalaciones dispondrá del certificado técnico acreditativo correspondiente y cumplirá de forma estricta la normativa vigente.
Ausencia de barreras arquitectónicas18,35,50,51El diseño de la unidad deberá garantizar la accesibilidad de un modo sencillo y seguro a todas las zonas de uso o servicios, teniendo en cuenta que:
- •
No deberán existir barreras arquitectónicas para personas con movilidad reducida. Se deberán cumplir todas las normativas vigentes al respecto, tanto Autonómicas como Estatales.
- •
Es recomendable que el edificio donde se ubique la Unidad de Hemodiálisis disponga de transporte público y acceso para transportes sanitarios, con zona segura de transferencia de pacientes.
- •
Deberá garantizarse el acceso fácil, cómodo, seguro y directo a la Unidad de HD, teniendo en cuenta que pueda ser con silla de ruedas o camilla a lo largo de todos los recorridos (pasillos, ascensores, etc.).
- •
Las vías de acceso, tanto exteriores como interiores, deberán estar señalizadas e identificadas de forma clara y sencilla, y estar libres de mobiliarios u otro tipo de instalaciones y no ser utilizadas como zonas de almacenaje, que impidan o ponga en riesgo la circulación fluida de personas o equipos. También deberán disponer de barandillas, otros elementos de apoyo y sujeción, así como de suelos antideslizantes necesarios para garantizar una adecuada movilidad en las vías de circulación.
Se deberá disponer de un plan de Evacuación de Emergencia, con un diseño arquitectónico acorde al mismo, que cumpla las normativas vigentes al respecto.
Informatización de las unidades de HDExistirá una red informática interna de conexión entre los diferentes ordenadores del centro, peso, monitores de diálisis y otros instrumentos médicos capaces de exportar datos.
Sistema informático capaz de soportar las aplicaciones informáticas necesarias.
La dotación de ordenadores (PC) será la necesaria para permitir acceso desde cada puesto de trabajo y/o sala. La red, máquinas (PC o servidores, en su caso) dispondrán de tecnología actualizada y cumplirán los requerimientos de seguridad y mantenimiento que deberán estar documentado en el plan de gestión.
El sistema informático que gestione la unidad de diálisis debe ser capaz de recibir on-line, mediante un volcado continuo, automático y configurable, los datos de las sesiones de hemodiálisis desde los monitores que hayan sido instalados en la UHD, para permitir llevar el seguimiento desde una sola aplicación informática.
Sería muy recomendable disponer de sistemas informáticos «abiertos» donde pudieran conectarse monitores de diferentes casas comerciales de manera bidireccional.
Incluir un software que incorpore un sistema de trazabilidad de los productos y fungibles empleados en las sesiones de manera automática, registrando productos, lotes y fechas de caducidad.
Incluir un software que genere indicadores de calidad y que sea el soporte de protocolos asistenciales y de procedimientos.
Disponer de un sistema informático de gestión integral que incluya un plan de contingencia que garantice el funcionamiento en caso de problemas informáticos o de red.
Debe contemplar la conexión con las aplicaciones de historia clínica electrónica que implante el Hospital de Referencia bajo un estándar HL7 a través de eventos, servicios web, etc.
El sistema informático de la Unidad de Diálisis deberá contemplar el acceso a la base de datos, registro de Enfermos Renales de cada Consejería de Sanidad.
Zonas de aislamiento18,43–46En el caso de pacientes con serologías positiva para virus B, se dispondrá de una ubicación independiente con un oficio sucio diferenciado.
Los pacientes con marcadores del virus de hepatitis C (VHC) y virus de la inmunodeficiencia humana (VIH), potencialmente contagiosos, no precisan ser dializados en una unidad de aislamiento. Se recomienda su diálisis en una zona específica y la aplicación de las medidas preventivas universales con especial cuidado.
En los pacientes con otras enfermedades infectocontagiosas se seguirán las recomendaciones de Medicina Preventiva en cuanto a su aislamiento.
Las habitaciones para el tratamiento de pacientes infectados requieren un oficio sucio diferenciado.
Debe contar con los equipos e instalaciones descritos para cada puesto de diálisis en la sala general de tratamiento.
Superficie útil no inferior a 16 m2.
En algunas UHD hospitalaria sería recomendable contar una habitación que asegure presión negativa donde se pueda realizar la diálisis.
Economía y ecología52,53Debe ser valorada positivamente la localización de la Unidades de Hemodiálisis en edificios «verdes», que respeten el medio ambiente, optimizando el aporte de agua y el proceso de desechos, y por otro lado que obedezcan a una economía sostenible, como puede ser que la energía empleada sea de origen renovable, como es la energía solar.
Zonas o locales:
- 1.
Área administrativa (Admisión/Recepción/Secretaría).
- 2.
Sala de espera.
- 3.
Aseos para pacientes.
- 4.
Vestuarios para pacientes.
- 5.
Estación de camillas y sillas de ruedas.
- 6.
Sala de tratamiento.
- 7.
Sala de mantenimiento/taller.
- 8.
Sala de tratamiento del agua.
- 9.
Oficio limpio.
- 10.
Oficio sucio.
- 11.
Cuarto de residuos.
- 12.
Almacén.
- 13.
Despacho o consulta médica.
- 14.
Despacho o consulta de enfermería.
- 15.
Vestuarios y aseos para personal sanitario.
- 16.
Área para descanso del personal
- 17.
Servicios sanitarios generales.
- 18.
Otras zonas y locales.
Los pacientes que se incluyen en el programa de HD periódica cada vez presentan una edad más avanzada y un mayor grado de complejidad y comorbilidad, tanto en unidades hospitalarias como extrahospitalarias. Según los datos de los informes anuales de los registros de pacientes renales, la edad media de los pacientes incidentes ha aumentado más de 2 años en los últimos 10 años, llegando a los 64,8 años54, representando los mayores de 65 años el 70% de los pacientes nuevos en tratamiento renal sustitutivo2. En los pacientes mayores de 65 años, la diabetes y la nefropatía vascular, asociadas a una mayor comorbilidad, suponen entre el 65-70% de los pacientes incidentes de más de 75 años2.
Aunque, en teoría, los pacientes atendidos en los centros de HD extrahospitalaria tienen un mayor grado de validez e independencia, la progresión en los últimos años de otras modalidades de tratamiento renal sustitutivo como el trasplante renal anticipado de donante vivo (5% de los pacientes incidentes), el desarrollo de programas de trasplante renal de cadáver de pacientes en asistolia o el impulso dado a la diálisis peritoneal en España, hace que los pacientes más jóvenes y con menos comorbilidad se incluyan en menor proporción en programa de hemodiálisis periódica2.
Establecer unos estándares de dotación de personal en las unidades de diálisis en este entorno cambiante es una labor compleja, siendo lo más adecuado establecer recomendaciones generales para conseguir la eficiencia en la prestación de la asistencia mediante el equilibrio entre las necesidades de los pacientes, el trabajo del personal y los costes del tratamiento55.
Debe entenderse que estas recomendaciones se establecen para centros de diálisis extrahospitalarios18. La organización asistencial del hospital, donde la actividad de diálisis se realiza de forma simultánea con otras actividades como la hospitalización, las consultas externas o la urgencia, además del personal necesario para garantizar la atención continuada (guardias), hace que las necesidades de personal de diálisis no puedan contemplarse de forma aislada.
Organización general de los recursos humanos18El personal que presta servicio en las unidades de hemodiálisis extrahospitalaria debe organizarse como un equipo de trabajo multidisciplinar orientado siempre a las necesidades del paciente y no a las de los profesionales, en el que todos los profesionales maximizan su aportación mediante un trabajo en equipo real, al margen de categorías profesionales.
Cada Unidad de diálisis debe mantener un registro actualizado de los profesionales sanitarios empleados en el que figure la titulación acreditada, la categoría profesional, el grado de cualificación, los demás diplomas, certificados o credenciales profesionales, las necesidades de formación y las actividades formativas realizadas.
De forma anual se pondrá en marcha un plan de formación con las necesidades de formación detectadas de cada grupo profesional, las actividades previstas y la evaluación del cumplimiento.
Cada unidad deberá disponer de un procedimiento de acogida a los profesionales de nueva incorporación. Cada profesional de nueva incorporación tendrá acceso a la información más relevante que le permita el ejercicio de sus funciones.
El centro de diálisis adoptará las medidas necesarias para garantizar la identificación de su personal y la diferenciación del mismo según su titulación y categoría profesional ante los usuarios. Cada profesional sanitario debe estar correctamente identificado por su nombre y categoría profesional.
Responsable asistencialCada unidad de hemodiálisis debe contar con un responsable asistencial, que será obligatoriamente médico especialista en nefrología. El nefrólogo es el responsable del tratamiento de diálisis que se proporciona en el centro.
El responsable asistencial puede no tener dedicación exclusiva al centro pero, en todo caso, será la suficiente para llevar a cabo las responsabilidades de planificar, organizar y dirigir los servicios asistenciales del centro de diálisis. El responsable asistencial puede ejercer también como Gerente del Centro.
Las responsabilidades del puesto incluyen:
- •
Participar en la selección de la modalidad de terapia renal sustitutiva más adecuada para cada paciente.
- •
Asegurar la adecuada monitorización del paciente y del proceso de diálisis.
- •
Asegurar la formación continuada del personal que trabaja en el centro, así como promover la actividad docente e investigadora.
- •
Mantener la necesaria coordinación con el Servicio de Nefrología de referencia.
- •
Asegurar el desarrollo e implantación de sistemas de calidad, así como de un manual de procedimientos de diálisis. En este manual deben constar los diferentes tipos de diálisis que suministra el centro, los procedimientos para realizar la diálisis, normas para la prevención de infecciones, normas para el manejo de pacientes infectados y un plan de prevención de riesgos.
- •
Impulsar la puesta en marcha del plan de seguridad del paciente del centro y la acreditación de la Unidad de Diálisis.
- •
Asegurar que todos los pacientes candidatos a trasplante renal estén incluidos en una lista de espera activa.
Las recomendaciones sobre dotación de personal facultativo de otros países son difícilmente extrapolables a la situación en España. Para establecer esas recomendaciones se ha tomado como referencia la legislación francesa, que establece unos mínimos por puesto y un mínimo por centro19, así como los diferentes conciertos de hemodiálisis extrahospitalaria en vigor en las diferentes Comunidades Autónomas que establecen un mínimo por número de pacientes56–58.
El médico responsable de la prescripción y supervisión del tratamiento de diálisis debe ser obligatoriamente un facultativo especialista en nefrología.
Cada centro de diálisis debe contar con un nefrólogo a tiempo completo por cada 40 pacientes en tratamiento en el centro o fracción, siendo la dotación mínima de un centro de diálisis de dos especialistas en nefrología. Cuando el responsable asistencial tenga dedicación a tiempo completo, se considerará como un nefrólogo más del centro.
Durante el tratamiento de los pacientes, el centro deberá contar con la presencia física de un nefrólogo.
Se deberá asegurar el mantenimiento de la competencia profesional de los nefrólogos estableciendo un plan anual personalizado de formación continuada.
Se recomienda que los facultativos del centro de hemodiálisis establezcan relaciones estables con el Servicio de Nefrología de referencia tanto asistenciales como de formación e investigación. Estas relaciones deberán recogerse en protocolos asistenciales escritos que estarán disponibles para todo el personal.
En los conciertos se debe asegurar la formación continuada de los nefrólogos que trabajan en los centros extrahospitalarios; su rotación periódica por los hospitales de referencia es la forma más apropiada.
La Administración Sanitaria debe incluir una valoración de méritos de aplicación en las ofertas públicas de empleo por cada año trabajado en un Centro de Diálisis Extrahospitalaria Concertado.
Personal de enfermeríaUn elemento fundamental en la calidad de los cuidados que reciben los pacientes de diálisis es la dotación de personal de enfermería que los atiende a lo largo de la sesión.
Existen estudios observacionales que sugieren que una dotación menor de personal de enfermería por paciente puede empeorar los resultados de la diálisis y producir un mayor número de acontecimientos adversos59,60 aunque no se haya demostrado en estudios prospectivos adecuadamente diseñados61.
La dotación de personal de enfermería está ligada principalmente a las necesidades de atención que tienen los pacientes. Existen múltiples factores que modifican las cargas de trabajo, siendo los más importantes:
- •
Grado de dependencia y comorbilidad de los pacientes.
- •
Configuración arquitectónica de la unidad: número de puestos por sala y sesión y la presencia de barreras arquitectónicas.
- •
Necesidades especiales de aislamiento (Guías sobre enfermedades víricas en hemodiálisis de la S.E.N.).
- •
Características de la propia técnica y el tipo de acceso vascular.
En la actualidad no existe en nuestro país ninguna normativa que marque un número mínimo de personal de enfermería por puesto y turno, a diferencia de lo que ocurre en otros países como Francia o en algunos Estados de EE. UU.62,63. Como referencia, existen también recomendaciones como la Renal Society del Reino Unido64, aunque tienen el inconveniente de partir de una organización asistencial diferente e incluso con profesiones sanitarias que no existen en nuestro entorno.
Otras referencias relevantes son los pliegos de bases técnicas de los concursos en vigor de las Administraciones Públicas para la provisión de hemodiálisis en centros extrahospitalarios, que exigen todas una dotación mínima de personal de enfermería por paciente más exigente56,65 Teniendo en cuenta lo recomendado en la edición anterior de estas guías55 la evolución de la población en diálisis, las recomendaciones legales de otros países de nuestro entorno59 y los conciertos en vigor de centros de hemodiálisis extrahospitalaria56,60, los mínimos recomendados son:
- •
Un diplomado/graduado en enfermería titulado por cada cuatro puestos en funcionamiento y ocupados o fracción.
- •
Cada turno de diálisis el centro deberá contar con la presencia mínima de dos diplomados/graduados en enfermería.
- •
Un técnico en cuidados de enfermería con titulación oficialmente reconocida por cada ocho puestos en funcionamiento y ocupados o fracción.
Estas necesidades de personal son dinámicas y se modifican con el tiempo según la complejidad de los pacientes; por este motivo, se recomienda el desarrollo y utilización de escalas de valoración validadas de cargas de trabajo en diálisis 18,66,67.
Se recomienda que cada centro de diálisis cuente con un responsable de enfermería, que junto con el responsable asistencial serán encargados de diseñar los protocolos asistenciales y definir la formación continuada del personal de enfermería del centro. Debe contar con experiencia acreditada en diálisis.
El personal de enfermería que atienda directamente a los pacientes en diálisis deberá tener una experiencia mínima demostrada de al menos tres meses en una unidad de hemodiálisis antes de asumir la responsabilidad del tratamiento de los pacientes.
Se recomienda que en el conjunto del equipo de enfermería que atienda el centro, exista una proporción de personal con amplia experiencia en diálisis (no inferior a dos años), de modo que se garantice por cada turno la presencia de una enfermera capaz de resolver problemas técnicos y de cuidados de enfermería de especial complejidad.
Se deberá definir un programa de formación continuada para asegurar el mantenimiento de las competencias del personal de enfermería.
Personal no sanitarioSe debe garantizar con personal propio o subcontratado los servicios de:
- •
Limpieza.
- •
Mantenimiento preventivo y correctivo de los equipos e instalaciones (monitores y planta de tratamiento de aguas) de que conste el centro.
Si en el centro se atienden más de 60 pacientes, los trámites administrativos asociados a este volumen de pacientes aconsejan contar con una persona que desarrolle labores de Administración/secretaría de forma estable.
Personal de apoyoCada centro de diálisis extrahospitalaria debe poder ofrecer la atención complementaria de un dietista o nutricionista para prestar asesoramiento personalizado en cuanto a las dietas necesarias en pacientes de diálisis. Aunque en los concursos en vigor no se establecen necesidades concretas por número de paciente, sí se recoge como un criterio de calidad la disponibilidad de apoyo nutricional.
Del mismo modo, los problemas sociosanitarios y psicológicos que conllevan este tipo de pacientes hacen aconsejable contar con el apoyo de un trabajador social y de un psicólogo clínico. En este caso, tampoco los concursos en vigor establecen necesidades concretas según el número de paciente, pero sí la disponibilidad de estos profesionales.
Este personal de apoyo puede ser propio, del Hospital de referencia o de las asociaciones de enfermos renales.
Como indicador de la importancia de estos profesionales, las recomendaciones de la Renal Society establecen la necesidad de un dietista y un trabajador social por cada 100 pacientes en hemodiálisis, teniendo en cuenta las particularidades de la organización de su sistema sanitario64.
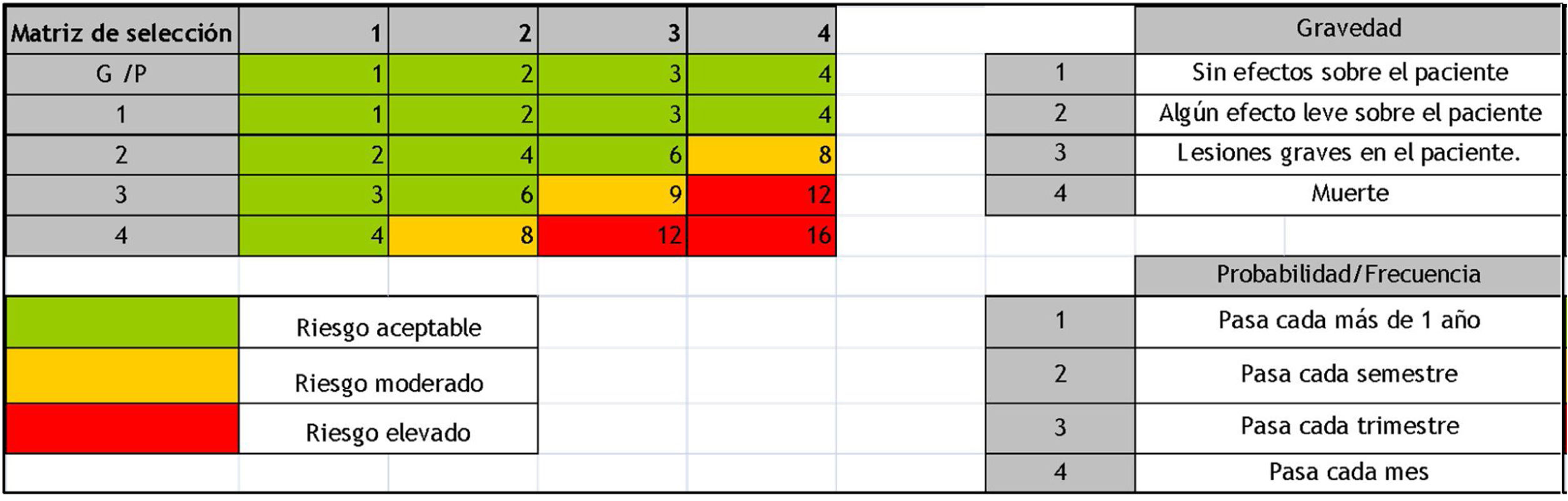
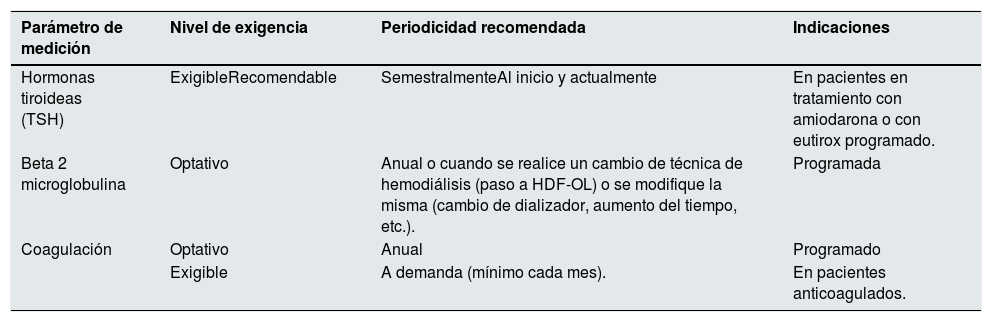
Nivel de evidencia global: C
Modalidades de hemodiálisisIntroducciónLa hemodiálisis, que inició su camino como método para mantener la vida de pacientes muy seleccionados hace 60 años, ha evolucionado a un tratamiento eficaz y bien contrastado que se ha utilizado en millones de pacientes con insuficiencia renal en todo el mundo. En estos años las técnicas de diálisis han evolucionado de forma paralela a los avances tecnológicos, de modo que en la actualidad existen mucha clases de membranas de diálisis, cada vez con mejor biocompatibilidad; las normas sobre el líquido de diálisis son cada vez más estrictas y los monitores de diálisis están automatizados, lo que permite un estricto control de muchos parámetros que influyen en la calidad y en la tolerancia al tratamiento dialítico (temperatura, control de ultrafiltración, composición del líquido de diálisis, entre otros).
Estas mejoras tecnológicas han permitido que en estas décadas se haya modificado la tipología de la población en diálisis, de modo que pacientes mayores y con más patología comórbida se han incorporado a los programas de hemodiálisis. Así, la edad media de la población en hemodiálisis en la década de los 80 era de 45 años68. En el año 2017 había aumentado hasta los 70 años. A pesar de este notorio y progresivo incremento en la edad del paciente en diálisis, la mortalidad anual sobre prevalentes no se ha modificado en los últimos 10 años, si bien sigue siendo elevada, (12,5-15,5% anual, Registro de Diálisis y Trasplante de la Sociedad Española de Nefrología69) y muy superior a la que correspondería a la población general con distribución de edad y sexo equivalente.
Esta elevada morbilidad y mortalidad de los pacientes en diálisis, hace que en las últimas décadas se hayan propuesto diversas modalidades y técnicas que pretenden conseguir la mejor diálisis posible. En este sentido se ha acuñado el término de «diálisis adecuada»71 y que sería aquella diálisis, bien tolerada, que implique la menor morbimortalidad posible, a un coste asumible y que se adapte bien a las expectativas del paciente, permitiéndole su integración social con la mejor calidad de vida posible. Para ello se han diseñado métodos para medir la dosis de diálisis, membranas que permiten aportar más dosis de diálisis, membranas más biocompatibles, esto es, que inducen menos respuestas inflamatorias y potencialmente nocivas; técnicas convectivas que mejoran la capacidad de eliminación de moléculas de medio peso molecular; técnicas adsortivas que mejoran la eliminación de toxinas unidas a proteínas, así como técnicas de diálisis que implican una mayor frecuencia de los procedimientos. Sin embargo, en los últimos años hemos sido conscientes de que las diferentes técnicas de diálisis existentes a menudo habían reportado resultados que no eran relevantes para los pacientes o sus cuidadores70–73, y que factores centrados en el paciente, como su autonomía, flexibilidad de horario, la portabilidad de la técnica y la posibilidad de viajar, la tolerancia o su efecto sobre el estado nutricional y la capacidad funcional deben ser objetivos prioritarios a la hora de comparar los beneficios de un tipo u otro de hemodiálisis.
Tanta diversidad en las técnicas y en las modalidades de diálisis significa que todavía no se ha conseguido la «diálisis adecuada» que se pretende; sin embargo, aunque históricamente no existía una clara evidencia que demostrara que un tipo de hemodiálisis era superior a otro, la aparición en los últimos años de varios ensayos controlados con un suficiente tamaño muestral, así como los grandes registros de pacientes que han analizado esta cuestión en términos de morbi-mortalidad, nos han permitido conocer la forma en que el empleo de altos volúmenes convectivos, una hemodiálisis más frecuente o la hemodiálisis domiciliaria son estrategias que se asocian a una mejor supervivencia y calidad de vida respecto a la hemodiálisis estándar74–76.
En este capítulo se definen las modalidades de hemodiálisis reconocidas por la S.E.N. y se resume brevemente la evidencia disponible sobre su utilidad y seguridad en el tratamiento de la enfermedad renal crónica.
Modalidades de hemodiálisis: definicionesEn función de determinadas características de los elementos estructurales que componen el sistema extracorpóreo de diálisis (dializador, líquido de diálisis), de la ubicación (centro de diálisis, hemodiálisis domiciliaria), del tipo de mecanismo de transporte de agua y solutos utilizado (difusión, convección o adsorción) y del número de procedimientos semanales, se reconocen distintas modalidades de hemodiálisis. Los centros de diálisis pueden disponer de todas o sólo de algunas de estas modalidades, pero deben disponer de un manual de funcionamiento y de protocolos específicos para cada una de las modalidades de hemodiálisis que oferten.
La elección de la modalidad de hemodiálisis debe realizarse en función de las características del paciente (edad, superficie corporal, patología comórbida, acceso vascular, evolución clínica, situación respecto al trasplante) y estructurales del centro. Es aconsejable mantener un registro de todos los pacientes en el que conste modalidad de hemodiálisis y el motivo de la indicación.
A continuación se definen las distintas modalidades de hemodiálisis en función de diversos parámetros.
Modalidades de hemodiálisis en función de las características del dializador, flujo de sangre y del dializadoLas características del dializador a considerar son las siguientes:
- •
Biocompatibilidad de la membrana:
- ∘
Hemodiálisis con membranas de celulosa o celulosa modificada. Menor biocompatibilidad.
- ∘
Hemodiálisis con membranas sintéticas. Mayor biocompatibilidad.
- •
Capacidad de ultrafiltración (permeabilidad convectiva): en función del Coeficiente de Ultrafiltración (Kuf):
- ∘
Membranas de Bajo Flujo. Kuf < 10mL/h/mm Hg/m2.
- ∘
Membranas de Alto Flujo: Kuf > 20mL/h/mm Hg/m2.
- •
Eficiencia (permeabilidad difusiva): en función del coeficiente de Transferencia de Masa (KoA):
- ∘
Baja Eficiencia: KoA < 600mL/min.
- ∘
Alta Eficiencia: KoA > 600mL/min.
En función de estas características se describen las siguientes modalidades de hemodiálisis:
Hemodiálisis de bajo flujo (HD-BF)Esta modalidad ha sido la más utilizada hasta hace 20 años. En ella se utiliza un dializador de baja permeabilidad hidráulica y el tamaño de los poros es pequeño (antiguamente de cuprofano, aunque actualmente se utilizan otras celulosas modificadas o membranas sintéticas). Se utiliza como tampón el bicarbonato (hasta hace pocos años el tampón predominante era el acetato). La depuración se realiza mediante mecanismo difusivo. No depura las grandes moléculas y lo hace de manera insuficiente con las medianas. Podemos diferenciar entre baja eficacia (dializadores de baja eficiencia, KoA < 600mL/min, Kuf < 10mL/h/mm Hg, flujo de sangre entre 200 y 300mL/min y flujo de líquido de diálisis de 500mL/min) y alta eficacia (dializadores de alta eficiencia, KoA > 600mL/min, Kuf 10-20mL/h/mm Hg, flujos de sangre entre 300 y 500mL/min y flujo del líquido de diálisis entre 500-1.000mL/min. Este tipo de diálisis pretendía inicialmente reducir el tiempo de diálisis mejorando el rendimiento de los procesos de difusión, con lo que se mantenía una dosis de diálisis adecuada. Posteriormente, el objetivo ya no fue reducir el tiempo, sino el poder ofertar una mayor dosis global de diálisis.
Hemodiálisis de alto flujo (HD-AF)Esta técnica pretende mejorar la calidad de diálisis mediante un dializador de alta permeabilidad con un mayor tamaño de los poros. Se utilizan membranas sintéticas, de alta biocompatibilidad y alto flujo (Kuf > 20mL/h/mm Hg/m2, normalmente superiores a 40). Mejora el aclaramiento de moléculas de peso molecular mediano. El transporte sigue siendo difusivo, si bien existe más transporte convectivo que en las modalidades anteriores. Se necesita de un líquido de diálisis puro, estéril, ya que casi siempre se producirá cierto grado de retrofiltración77. Para alcanzar la máxima eficiencia de los mismos, se recomienda flujos de sangre elevados.
Hemodiálisis extendidaEsta técnica utiliza también un dializador de alta permeabilidad, pero el tamaño de los poros es aún mayor, con un punto de corte medio (MCO, medium cut-off) respecto al riñón nativo (65 kDa), lo que permite eliminar moléculas como las cadenas ligeras de las inmunoglobulinas, pero minimizando las pérdidas de albúmina. Con estos dializadores se puede, además, obtener una mayor depuración de moléculas medias respecto a los dializadores de alto flujo, ya que, gracias a un diseño caracterizado por un menor diámetro interno de los capilares, optimiza la retrofiltración, asociando a la difusión un mayor transporte convectivo interno, lo que se ha denominado como hemodiafiltración interna78.
HemodiafiltraciónSon las modalidades consideradas más eficientes para optimizar la depuración de pequeñas y medianas moléculas y utilizan, además del transporte difusivo, el convectivo. Precisa membranas de alta biocompatibilidad, eficiencia y flujo, monitores complejos con estricto control de la ultrafiltración y elevada pureza del líquido de diálisis. Se emplea una tasa de ultrafiltración elevada (3-30 L/sesión), siendo necesario reponer la mayoría del volumen ultrafiltrado con un líquido de sustitución de forma sincronizada que debe tener una adecuada composición electrolítica, estéril y sin pirógenos. La reposición puede hacerse antes (pre-dilucional) o después (post-dilucional) de la entrada de la sangre en el dializador. Es una técnica que depura de forma muy eficiente las pequeñas y medianas moléculas, sin que exista retrofiltración.
Hay muchas variedades de hemodiafiltración en las que se debe diferenciar entre técnicas con volumen de reinfusión bajo (inferior a 15 litros) y técnicas de hemodiafiltración con elevados volúmenes de reinfusión (superior a 15 litros). El grupo de trabajo EUDIAL, de la Sociedad Europea de Nefrología, redefinió la HDF como aquella técnica que combina la difusión con la convección, con un volumen de intercambio superior al 20% del total de sangre procesada79.
Asimismo, todos los estudios aleatorizados, en su análisis secundario, mostraron la superioridad de la HDF-OL con un volumen de reposición elevado. Por estos motivos la recomendación actual es que los pacientes deberían recibir un volumen de reposición superior a 21 litros o un volumen convectivo total (volumen de reposición más la pérdida de peso alcanzada durante el tratamiento) superior a 23 litros.
HDF con un volumen de reinfusión inferior a 15 litros:
- •
Biofiltración o hemodiafiltración convencional. La reposición se realiza con un volumen inferior a 2 litros/hora.
- •
Biofiltración sin acetato (AFB,acetate-free biofiltration): El líquido de diálisis no tiene solución tampón, la ultrafiltración es pequeña, de unos 2-3 litros a la hora y la reposición se hace con una solución de bicarbonato de entre 6 a 12 litros por sesión. Con esta técnica se consigue un gran control del equilibrio ácido-base, ya que puede individualizarse el aporte de bicarbonato.
- •
Diálisis con doble filtro (PFD,paired filtration dialysis): Se utilizan dos filtros en serie, en los que se separa el transporte convectivo del difusivo y se utilizan al máximo estos mecanismos. En el primer filtro, de alto flujo y eficiencia, no llega el líquido de diálisis y sólo se produce transporte convectivo. El segundo filtro, a continuación del anterior, es de baja eficiencia y en él se realiza el transporte difusivo con el líquido de diálisis. No existe, por tanto, retrofiltración alguna. La reinfusión se realiza habitualmente entre los dos filtros.
- •
Diálisis con doble filtro con regeneración del ultrafiltrado (PFD–carbón). Idéntica a la anterior, si bien se utiliza como líquido de reinfusión el propio ultrafiltrado del paciente tras pasar por un cartucho adsorbente (carbón activo o resinas hidrofóbicas), lo que permite la eliminación mediante adsorción de las moléculas unidas a proteínas.
HDF con un volumen de reinfusión superior a 15 litros:
- •
Hemodiafiltración en línea uon-line(HDF-OL). Es la técnica que se considera actualmente más eficiente y se caracteriza por que el propio monitor de diálisis genera el líquido de sustitución de forma continua a partir del líquido de diálisis. Evita el almacenamiento del líquido de reposición, si bien necesita que el líquido de diálisis tenga unas características de pureza determinadas (líquido ultrapuro) y un alto volumen de reposición, entre 5-10 litros/hora, con el objetivo de alcanzar más de 21 litros por sesión. Existen diferentes modalidades de HDF-OL, dependiendo del lugar donde se administre el volumen de sustitución en el circuito extracorpóreo: pre-dilucional (antes del dializador), post-dilucional (después del dializador) y mixta o pre-posdilucional (antes y después del dializador). La HDF-OL con dilución intermedia (mid-dilution), es una alternativa a la HDF-OL mixta que utiliza un dializador específicamente diseñado para que la sangre entre por un haz de fibras centrales y regrese, en sentido contrario, por fibras periféricas. El líquido de reinfusión se incorpora en la mitad de los dos tramos del dializador; así, en el primer tramo se produce una hemodiafiltración post-dilucional y en el segundo tramo una hemodiafiltración pre-dilucional.
- •
Hemodiafiltración con doble filtro con regeneración del ultrafiltrado (HFR,hemo-filtrate-reinfusion). Utiliza un dializador con doble cámara más un cartucho de resina, en el que el propio líquido ultrafiltrado del paciente es reinfundido posteriormente a su regeneración en este cartucho de resina, añadiendo el mecanismo de adsorción a los mecanismos de difusión y convección. En una primera fase la sangre pasa a través de un dializador de alta permeabilidad donde, mediante transporte exclusivamente convectivo, se genera un ultrafiltrado que a su vez pasa a través de una resina hidrofóbica (fase adsortiva) para retener las toxinas ligadas a proteínas. Posteriormente el ultrafiltrado se devuelve a la sangre, que pasa por un tercer filtro de baja permeabilidad (fase difusiva) que permite la eliminación de pequeñas moléculas, así como la ultrafiltración necesaria para realizar un balance hídrico negativo adecuado80.
- •
Hemofiltración. No hay líquido de diálisis, por lo que no hay difusión, sólo transporte convectivo. Precisa de grandes volúmenes de ultrafiltrado que se reponen con líquido de sustitución (más de 20 litros por sesión). Precisa de membranas de alta permeabilidad. No depura de forma adecuada las pequeñas moléculas, por lo que es una técnica en desuso para la enfermedad renal crónica, al menos en nuestro país, si bien se sigue empleando en las unidades de cuidados intensivos, como técnica continua y lenta debido a su buena tolerancia hemodinámica.
En función del número de procedimientos semanales, aplicando cualquiera de las modalidades anteriores, se describen.
Hemodiálisis incrementalUno o dos procedimientos semanales.
Hemodiálisis convencionalTres procedimientos semanales. Motivos arbitrarios y, sobre todo, de estrategia de gestión de las unidades de diálisis, hacen de esta modalidad de diálisis la más utilizada.
Hemodiálisis con cuatro sesiones semanales o a días alternosUna experiencia interesante, empleada en Lecce (Italia) con cuatro sesiones semanales o diálisis a días alternos. Se intenta con este esquema evitar el período largo de fin de semana y, por tanto, que el periodo interdiálisis siempre sea inferior a 48 horas.
Hemodiálisis diariaCinco o más procedimientos semanales. Esta modalidad de hemodiálisis se realiza desde el año 1967, pero es en los últimos años en los que ha cobrado relevancia. Las razones por las que se está realizando cada vez más esta técnica hay que buscarlas en el convencimiento de que es más parecida a lo que hace el riñón nativo, que está dializando de forma continua las 24 horas, a la no mejoría en la morbimortalidad de los pacientes en diálisis tres días en semana, a pesar de las evidentes mejoras en las técnicas de diálisis y a los buenos resultados actualmente disponibles de la hemodiálisis diaria en sus dos modalidades:
- •
Hemodiálisis diaria corta: 1,5-2,5 horas, 6-7 días a la semana corta diaria.
- •
Hemodiálisis larga nocturna: 6-8 horas, preferentemente domiciliaria.
Se realiza en un centro de diálisis, pudiendo ser un centro satélite o un hospital, con personal médico y de enfermería asistiendo en la terapia. Es la más frecuente y, en nuestro medio, representa más del 99%.
Hemodiálisis domiciliariaSe realiza en el domicilio del paciente tras entrenar a dicho paciente o a un familiar que se encarga de administrar el tratamiento dialítico. El paciente debe tener una situación clínica estable y un adecuado acceso vascular. Aunque en nuestro medio dicha técnica históricamente representa menos del 1% de los pacientes prevalentes en hemodiálisis, en la última década ha aumentado considerablemente el número de pacientes que reciben este tipo de terapia, debido en parte a los beneficios clínicos que se relacionan con los regímenes más intensivos de HD, así como el desarrollo de monitores de hemodiálisis específicamente diseñados para su utilización en domicilio81. La hemodiálisis domiciliaria históricamente se ha realizado con un monitor de hemodiálisis estándar con un flujo de baño de 500-700mL/min, por lo que era imperativo la instalación de una planta de aguas en el domicilio del paciente, lo que sin duda ha limitado el desarrollo de este tipo de terapia. Sin embargo, desde hace unos años se dispone de monitores portátiles que utilizan un flujo de baño bajo (150-200mL/h) y que permiten realizar una diálisis diaria efectiva con volúmenes muy bajos de dializado (25-30 L/sesión) al mantener una fracción de flujo muy bajo (el índice de flujo de dializado dividido por el flujo de sangre). Esto permite el uso eficiente del dializado y minimiza el requisito de espacio de suministro de almacenamiento y consumo de agua, pudiendo incluso obviar la instalación de una planta de aguas y utilizar bolsas precargadas de 5 L como líquido de diálisis, de manera similar al baño de diálisis utilizado en diálisis peritoneal82.
Hemodiálisis en centro con autocuidadoAunque las sesiones de hemodiálisis se realizan en un centro satélite de diálisis, es el propio paciente quien se encarga de administrarse su propio tratamiento dialítico, tras un entrenamiento adecuado. El paciente debe tener una situación clínica estable y un adecuado acceso vascular. El personal de enfermería en el centro es mínimo y no es necesaria la presencia física de personal médico durante el tratamiento, con el consiguiente ahorro de costes. La prevalencia de pacientes que utilizan esta técnica en nuestro medio es residual y no del todo conocida, mientras que en países con población más dispersa, como Australia o Canadá, existe mayor experiencia, habiéndose descrito mejor calidad de vida en este grupo de pacientes, respecto al grupo de pacientes que se dializan en centro con plenos cuidados realizados por el personal de enfermería83.
Modalidades de hemodiálisis en función de las características del pacienteHemodiálisis de enfermos agudosBien con insuficiencia renal aguda o con insuficiencia renal crónica avanzada que necesitan diálisis de forma urgente. Se benefician de membranas de alto flujo, permeabilidad difusiva y biocompatibilidad.
Hemodiálisis de pacientes crónicosPacientes con insuficiencia renal crónica avanzada que necesitan diálisis de forma continuada y se incluyen en programa crónico de hemodiálisis.
Resultados de las diferentes modalidades de hemodiálisisEn 1996 la Agencia de Evaluación de Tecnologías Sanitarias publicó un informe de evaluación de los diferentes tipos de membranas de hemodiálisis en el que se ponía de manifiesto la falta de información científica relevante procedente de estudios prospectivos randomizados, si bien se estimaba que los siguientes grupos de pacientes podrían recibir un beneficio adicional si se trataban con dializadores de membranas sintéticas, sin entrar en consideración en la modalidad de diálisis en que se emplearan84:
- •
Pacientes que presenten alguna de las siguientes comorbilidades:
- ∘
Bronconeumopatía crónica obstructiva severa.
- ∘
Miocardiopatía dilatada severa.
- ∘
Desnutrición progresiva.
- ∘
Infecciones repetidas.
- ∘
Polineuropatía.
- ∘
Amiloidosis.
- ∘
Pacientes en hemodiálisis no incluidos en lista de espera para trasplante por contraindicación definitiva, en los que se espera una permanencia en diálisis a largo plazo.
- ∘
Pacientes con fracaso renal agudo.
Dos décadas después, a raíz de los diferentes trabajos publicados en los últimos años, muchos ellos con alto nivel de evidencia, la propia Agencia ha publicado un nuevo informe sobre la HDF-OL, evaluando la seguridad, efectividad, costes e indicaciones de uso de esta técnica85. En ella se constata que la técnica de HDF-OL no sólo no presenta problemas adicionales de seguridad o tolerancia con respecto a la HD-AF, sino que además reduce significativamente el riesgo de muerte por todas las causas en comparación con la HD-AF. En la fecha de publicación de dicho informe (2016), la evidencia disponible no era concluyente con respecto a los efectos de la HDF-OL sobre la tasa de hospitalización, las variaciones en las necesidades de eritropoyetina, la tensión arterial, la velocidad de crecimiento en niños, ni sobre la amiloidosis asociada a diálisis, no habiéndose demostrado además diferencias en relación con la calidad de vida ni al estado nutricional con respecto a la HD-AF.
Desde la publicación de este informe se han reportado varios trabajos sobre las diferentes modalidades de hemodiálisis, incluyendo metaanálisis de ensayos clínicos aleatorizados, y que se resumen a continuación en algunas de las modalidades de diálisis más utilizadas y más prometedoras.
Hemodiálisis de alto flujoComparado con la HD-BF, la HD-AF aclara mejor las moléculas de mediano y gran tamaño. Aunque muchos trabajos han descrito ventajas significativas asociadas a la HD-AF en diversos parámetros clínicos como un menor riesgo de amiloidosis por beta2 microglobulina, una mejoría en la dislipemia asociada a la enfermedad renal o una menor estimulación de neutrófilos y monocitos86–88, sólo existen tres ensayos aleatorizados que han analizado la supervivencia como objetivo primario: el estudio HEMO y el estudio EGE, en pacientes prevalentes, y el estudio MPO, en pacientes incidentes. En el estudio HEMO, 1.846 pacientes prevalentes dializados tres días en semana fueron randomizados en un diseño dos por dos a recibir bien una dosis de diálisis habitual (Kt/Ve: 1,05) o elevada (Kt/Ve: 1,45), y una hemodiálisis de bajo flujo o alto flujo. Los hallazgos globales demostraron que la mortalidad global fue un 8% inferior en el grupo de alto flujo, sin que esta diferencia tuviera significación estadística86. Se encontró una menor tasa de mortalidad y hospitalización de origen cardiológico (RR: 0,80 y 0,87, respectivamente) en el grupo de alto flujo. También se apuntaba una menor mortalidad en los pacientes en el grupo de alto flujo que llevaban más tiempo en diálisis antes de la randomización, lo que se confirmó en un análisis secundario89, de tal forma que en el grupo que llevaba mucho tiempo en diálisis (8,6 años) antes de la randomización, el tratamiento con HD-AF disminuyó la mortalidad tanto la total (RR 0,68) como la de causa cardiaca (RR 0,63), comparado con la diálisis de bajo flujo. No se encontró este efecto beneficioso en el grupo que como media llevaba sólo 1,5 años en diálisis antes de la randomización.
El estudio HEMO no confirmó las expectativas sobre el efecto beneficioso que se esperaba asociado a una mayor dosis de diálisis. Por otra parte, el efecto sobre la morbimortalidad asociado a membranas de alto flujo fue muy inferior al comunicado en series retrospectivas, en las que la utilización de estas membranas en pacientes no diabéticos se asociaba a una disminución de la mortalidad del 66–76%90,91. Dichos resultados fueron confirmados en un estudio prospectivo realizado en Francia sobre la influencia de la membrana de diálisis en la supervivencia en 650 pacientes (46% con membranas de alto flujo), en el que se observó una reducción en la mortalidad del 38% con la utilización de membranas de alto flujo92. El estudio HEMO fue muy criticado, tanto por la población seleccionada (menor de edad y con más porcentaje de pacientes de raza negra que en la población americana en hemodiálisis), como por el hecho de ser pacientes prevalentes, el haber estado previamente dializados en más de un 60% con alto flujo, así como por la reutilización de los dializadores y la limitación en la duración de la sesión de diálisis. Por otro lado, la proporción de transporte convectivo en el grupo de alto flujo fue pequeño, lo que puede haber enmascarado el efecto teórico beneficioso atribuido a este transporte93.
El estudio MPO incluyó a 738 pacientes incidentes en hemodiálisis europeos, sin reutilización de dializadores, que fueron aleatorizados a recibir hemodiálisis mediante membranas de bajo o alto flujo. Tras un seguimiento de 3 a 7,5 años, el análisis de supervivencia no mostró diferencias significativas entre ambos grupos. Sin embargo, en el subgrupo de pacientes con niveles de albúmina < 4g/dL y en los pacientes diabéticos sí se observaron tasas de supervivencia significativamente más altas en el grupo de alto flujo en comparación con el grupo de bajo flujo94.
El estudio EGE asignó aleatoriamente a 704 pacientes en hemodiálisis tres veces por semana a dializadores de alto o bajo flujo y diálisis ultrapuro o estándar con un diseño factorial de dos por dos. El resultado primario fue una combinación de eventos cardiovasculares fatales y no fatales durante un seguimiento mínimo de tres años. De nuevo no se observaron diferencias significativas en el resultado primario entre el flujo alto y el flujo bajo, así como entre el dializado ultrapuro y estándar. Sin embargo, los análisis secundarios sugirieron que la supervivencia libre de eventos cardiovasculares fue significativamente mejor en el grupo de alto flujo en comparación con el grupo de bajo flujo para el subgrupo de pacientes con fístulas arteriovenosas y de pacientes diabéticos, mientras que el empleo de agua ultrapura tuvo un efecto positivo en la supervivencia libre de eventos cardiovasculares en aquellos pacientes con más de tres años de diálisis95. En el subgrupo de pacientes con FAVI, la supervivencia global más alta se observó en pacientes tratados con HD-AF y líquido de diálisis ultrapuro, lo que sugiere un efecto sinérgico de ambas intervenciones.
En conjunto, los resultados de los tres estudios sugieren que las membranas de alta permeabilidad tienen un efecto beneficioso sobre la supervivencia en los subgrupos de pacientes en riesgo, como aquellos diabéticos o con larga permanencia en diálisis, y siempre que tengan un adecuado acceso vascular que permita optimizar el uso de la HD-AF96,97. En 2010, una revisión sistemática y metaanálisis de Cochrane encontraron que la HD-AF no modificó la mortalidad por todas las causas (10 estudios, 2.915 participantes), pero sí disminuyó la mortalidad cardiovascular (cinco estudios, 2.612 participantes, RR 0,83; IC del 95%: 0,70 a 0,99)98. Dos metaanálisis posteriores que incluyeron 7 y 8 estudios, con 4.412 y 4.967 pacientes, respectivamente, han demostrado una disminución del riesgo de muerte por cualquier causa y por causa cardiovascular con el uso de HD-AF respecto a la HD-BF99,100. A la luz de estos hallazgos, desde 2015 las guías KDOQI recomiendan el uso de membranas de alta permeabilidad y biocompatibilidad y que, en caso de restricciones económicas, debería indicarse al menos en pacientes diabéticos, con hipoalbuminemia o aquellos con larga permanencia en diálisis101.
Hemodiálisis expandidaEn un intento por mejorar los resultados clínicos respecto a los dializadores de alto flujo a través del aumento del aclaramiento de medianas moléculas más grandes (> 20 kDa), disponemos desde hace muy pocos años de dializadores con un punto de corte medio (MCO, medium cut-off) que permiten eliminar moléculas de hasta 45 kDa, como las cadenas ligeras de las inmunoglobulinas, pero minimizando las pérdidas de albúmina102,103. La depuración de medias y grandes moléculas es claramente superior a la HD de alto flujo, con resultados similares, superiores o inferiores con respecto a HDF-OL102,104–107. Aunque esta técnica ofrece una oportunidad única para mejorar la depuración de medianas moléculas sin la necesidad de utilizar un líquido de reposición como en la HDF-OL, los beneficios clínicos de este tipo de técnica son inciertos y deben ser avalados en futuros ensayos clínicos108. Únicamente se ha descrito una mejoría de algunos síntomas urémicos en series cortas de casos, incluyendo el prurito, el síndrome de piernas inquietas y el tiempo de recuperación postdiálisis109, y se ha demostrado en un pequeño ensayo clínico aleatorizado un mejor perfil inflamatorio con esta técnica en comparación a la HD-AF110.
HemodiafiltraciónEl transporte convectivo juega un papel muy importante en el transporte de solutos de peso molecular mediano como la beta2-microglobulina, leptina y la vitamina B12 y de substancias intermedias como los productos de glicosilación avanzada, dimetilarginina y homocisteína. Estas sustancias se han implicado en la fisiopatología de la amiloidosis, la malnutrición, las complicaciones infecciosas y la enfermedad cardiovascular, tan prevalentes en los pacientes en hemodiálisis periódica111. Es por ello que, sin abandonar el transporte difusivo, se han diseñado varias modalidades de hemodiálisis que intentan aprovechar al máximo el transporte convectivo. Estas modalidades de hemodiálisis incluyen la AFB, la PFD, la PFD con regeneración de ultrafiltrado y la HDF-OL, que precisan de membranas biocompatibles de alto flujo y permeabilidad, así como monitores muy precisos en el control de la ultrafiltración y en la infusión del líquido de reposición y, en el caso de la HDF-OL, de agua de diálisis «ultrapura». El impacto de estas técnicas de hemodiafiltración en el coste global del tratamiento renal sustitutivo es importante, por lo que se hace necesario conocer con exactitud cuáles son los beneficios reales que se obtienen con estas técnicas y qué población sería la que más se podría beneficiar de las mismas85.
Hasta la publicación a partir del año 2012 de los resultados de los cuatro grandes ensayos aleatorizados que han evaluado como objetivo primario el efecto de la HDF-OL en la supervivencia, la evidencia para recomendar este tipo de técnica sobre la HD-AF era limitada y se basaba en grandes estudios de cohortes y pequeños ensayos de intervención. Dichos estudios mostraron beneficios en parámetros indirectos de morbi-mortalidad, incluyendo mejor aclaramiento de medianas moléculas y fósforo, menor riesgo de síndrome de túnel carpiano, menor inflamación con menor consumo de eritropoyetina, mayor estabilidad hemodinámica intradiálisis y mejor preservación de la masa muscular112–121. Durante ese periodo se publicaron algunos metaanálisis y revisiones sistemáticas en los que bajo el concepto de «hemodiafiltración» se incluyeron técnicas ya en desuso, como la AFB o la PFD, y que no consideraron la cantidad de volumen convectivo como un factor de confusión, lo que llevó a obtener resultados conflictivos al comparar la hemodiálisis convencional con las terapias convectivas122–125. Fue el estudio DOPPS el primero en describir una mejor supervivencia en los pacientes en hemodiafiltración siempre que se alcanzara un volumen convectivo mínimo (15–25 L/sesión)126, lo que llevó a la realización de los cuatro grandes ensayos multicéntricos aleatorizados que han comparado la hemodiálisis estándar con la HDF-OL: el estudio CONTRAST (n=714), el estudio turco (n=782), el estudio ESHOL (n=906) y el estudio FRENCHIE (n=381)127–130.
Aunque el análisis primario de los dos primeros estudios no demostró una mejor supervivencia en los pacientes en tratamiento con HDF-OL, los análisis post hoc de ambos estudios sí observaron un descenso en el riesgo de muerte en el subgrupo de pacientes que alcanzaron altos volúmenes convectivos (> 22 L/sesión)127,128. El estudio ESHOL, a diferencia de los dos anteriores, sí alcanzó un alto volumen convectivo (≥ 22,9 L/sesión) en el grupo de HDF-OL, demostrando en el análisis primario una disminución del 30% del riesgo de muerte por cualquier causa y por causa cardiovascular en el grupo de HDF-OL respecto al grupo tratado con HD-AF129. El cuarto estudio (FRENCHIE) se realizó en pacientes mayores de 65 años y se centró en la tolerancia dialítica, obteniéndose un volumen convectivo medio en el grupo de pacientes con HDF-OL postdilucional entre 19,9 L/sesión en el momento basal y 22,5 L/sesión en el mes 24130. Aunque la proporción de pacientes que experimentaron al menos un evento adverso asociado con el tratamiento y la supervivencia no difirieron entre el grupo de HDF-OL y HD-AF, sí se observó una incidencia significativamente menor de hipotensión sintomática intradialítica y de calambres musculares en el grupo tratado con HDF-OL.
Un metaanálisis posterior con los datos individuales de los pacientes de los cuatro estudios ha intentado definir cuál sería la dosis convectiva mínima necesaria para mejorar la supervivencia de los pacientes en HDF-OL, analizándose un total de 2.793 pacientes divididos en tertiles según el volumen convectivo. Tras una mediana de seguimiento de 2,5 años, la HDF-OL redujo el riesgo de mortalidad por todas las causas en un 14% (IC 95%: 1-25%) y la mortalidad cardiovascular en un 23% (IC 95%: 3-39%). El mayor beneficio de supervivencia fue para los pacientes que recibieron el mayor volumen convectivo (> 23 L/sesión mediante HDF-OL postdilucional) para la mortalidad por cualquier causa (HR: 0,78 [IC 95%: 0,62-0,98]) y por causa cardiovascular (HR: 0,69 [IC 95%: 0,47-1,00])131. Dicho metaanálisis también mostró como algunos subgrupos de pacientes (ancianos, cardiópatas o con larga permanencia en diálisis) serían los que más se podrían beneficiar de un mayor volumen convectivo132. Una vez demostrada la mejor supervivencia de la HDF-OL respecto a la HF-HD, siempre que se alcance el objetivo de 23 L/sesión de volumen convectivo (equivalente a un volumen de infusión de 21 L/sesión en pacientes con una ultrafiltración media de 2 L/sesión), quedará por resolver si dicho tratamiento es capaz además de mejorar la calidad de vida desde la perspectiva del propio paciente y si es coste eficaz. Para resolver estas cuestiones se ha puesto en marcha el estudio CONVINCE, un estudio financiado por la Unión Europea que incluirá a 1.800 pacientes prevalentes en hemodiálisis y aleatorizará a los pacientes a HD-AF o a HDF-OL de alto volumen convectivo (> 23 L/sesión) durante un período de seguimiento de 3 años133.
Hemodiafiltración con capacidad adsortivaLa eliminación de toxinas unidas a proteínas es un tema que no está bien resuelto ni por la HD-HF, la hemodiálisis extendida ni por la HDF-OL101,102, habiendo sido consideradas estas toxinas como las principales responsables de las lesiones cardiovasculares de los pacientes con enfermedad renal crónica134. En los últimos años se han desarrollado técnicas adsortivas como la HFR que mediante el paso del ultrafiltrado a través de un cartucho de resina combina la adsorción, la convección y la difusión. Aunque dicha técnica ha demostrado en un pequeño ensayo clínico cruzado mejorar la eliminación de toxinas unidas a proteínas, el estado inflamatorio y endotelial y el estrés oxidativo, respecto a la HDF-OL135, en el momento actual es difícil interpretar cuál es la relevancia clínica de la adsorción como factor independiente de morbimortalidad, que deberá ser evaluado en futuros ensayos clínicos. Otra técnica que puede permitir combinar la adsorción con la hemodiafiltración puede ser el empleo de membranas de polimetilmetacrilato (PMMA) de alto flujo136. Aunque los resultados clínicos precisan ser evaluados mediante estudios de intervención, en un reciente análisis del registro japonés se ha observado una mejor supervivencia asociada al uso de membranas de PMMA137.
Hemodiálisis diariaEl esquema convencional de diálisis tres días por semana sigue presentando una mortalidad del 15% anual, fundamentalmente por causas cardiovasculares, según el Informe de Diálisis y Trasplante de la S.E.N. del año 201369; el grado de malnutrición y la hiperfosforemia siguen siendo muy elevados, y el grado de rehabilitación y la calidad de vida del paciente en diálisis sigue siendo muy inferior al óptimo.
Una hemodiálisis lo más fisiológica posible sería aquella que tiende a reproducir lo que hace el propio riñón, que dializa las 24 horas todos los días. Es por ello que en los últimos años se está replanteando la frecuencia de la diálisis y cada vez hay más centros que están incorporando programas de hemodiálisis diaria para pacientes seleccionados. Esta hemodiálisis permite un perfil de concentración de solutos mucho más regular, con menores concentraciones pre-hemodiálisis de urea, creatinina, potasio e hidrogeniones, entre otros. Además, la ultrafiltración es mucho más suave y gradual, con las ventajas de la estabilidad cardiovascular que esto representa; por otra parte, favorece un mayor aporte de dosis de diálisis que la que puede obtenerse con la hemodiálisis tres veces en semana138.
Desde 1982 hasta 1997, se habían publicado experiencias de unos 20 centros en todo el mundo. En el año 2000 este número había aumentado a más de 200 centros. La S.E.N. tiene en marcha un registro de hemodiálisis diaria, para conocer el grado de implementación de esta modalidad de diálisis en nuestro país.
Las dos modalidades de diálisis diarias más extendidas son las siguientes:
- a)
Hemodiálisis diaria corta de alta eficiencia: 1,5-2,5 horas, 6-7 días a la semana. Habitualmente se usan técnicas de hemodiafiltración con flujos sanguíneos y de dializado elevados y con dializadores de gran superficie.
- b)
Hemodiálisis larga nocturna: 6-8 horas, preferentemente domiciliaria. Se utiliza hemodiálisis convencional con membranas biocompatibles, con flujos sanguíneos 200-300mL/min y de dializado (100-300mL/min) bajos.
En comparación con la hemodiálisis convencional, la hemodiálisis diaria corta de alta eficiencia permite una mejor depuración de toxinas urémicas y una mayor estabilidad hemodinámica, dado que reduce el acúmulo de líquido interdiálisis y por tanto evita elevadas tasas de ultrafiltración durante la sesión de diálisis. Varios cientos de estudios observacionales y un único ensayo aleatorizado139 (Frequent Hemodialysis Newtwork daily [FHNd] trial) han demostrado los beneficios clínicos de la hemodiálisis corta diaria. El estudio FHNd fue un estudio multicéntrico que incluyó a 245 pacientes que fueron aleatorizados a recibir hemodiálisis frecuente seis días a la semana o hemodiálisis convencional. Los dos objetivos primarios fueron la mortalidad combinada con cambios en la masa ventricular durante el primer año, o con cambios en la salud física durante el primer año, que fueron significativamente mejores en el grupo de hemodiálisis frecuente (HR 0,61 [IC 95% 0,46-0,82] para muerte o cambio en la masa ventricular izquierda y HR 0,70 [IC 95% 0,53-0,92] para muerte o cambio en la salud física)138. El beneficio en la supervivencia en el grupo de hemodiálisis corta diaria se mantuvo tras una mediana de 3,6 años de seguimiento tras finalizar el estudio FHNd75, que demostró además un mejor control de la presión arterial y un mejor balance de fósforo en el grupo de hemodiálisis frecuente75,139–142. De acuerdo a numerosos estudios observacionales, la hemodiálisis corta diaria también puede asociarse con una mejor calidad de vida143, mejor apetito144, menor necesidad de antihipertensivos y quelantes del fósforo108, y menor tasa de hospitalizaciones145. Como aspectos negativos, la HD corta diaria podría aumentar las complicaciones del acceso vascular, incluyendo la trombosis108, aunque la punción de la fístula mediante la técnica del ojal podría reducir estas complicaciones146. Los estudios de costes también parecen ir a favor de la HD corta diaria en comparación con la hemodiálisis estándar, dado que la menor tasa de hospitalización y de medicación compensarían el mayor gasto en fungibles147.
La hemodiálisis larga nocturna también se asocia con importantes beneficios clínicos respecto a la hemodiálisis convencional, incluyendo una mejor depuración de toxinas urémicas, un mejor control de la presión arterial y de los niveles de fósforo, con menor necesidad de fármacos, reducción de la hipertrofia ventricular izquierda, así como una mejoría en alguno de los aspectos relacionados con la calidad de vida y en la fertilidad. Estos datos han sido corroborados por diversos estudios observacionales y tres ensayos clínicos148–153. El ensayo más importante fue el Frequent Hemodialysis Newtwork nocturnal (FHNn) trial, que aleatorizó a 87 pacientes a recibir hemodiálisis nocturna seis noches a la semana o hemodiálisis convencional tres días a la semana, siendo los objetivos primarios similares al del estudio FHNd. A diferencia de éste, y probablemente por su menor tamaño muestral, el FHNn no pudo demostrar beneficios en la supervivencia148. Varios estudios observacionales, algunos de ellos de gran tamaño muestral, sí han descrito una mejor supervivencia asociada a la hemodiálisis nocturna respecto a la hemodiálisis estándar, pudiendo incluso ser comparable a la de los pacientes trasplantados de donante cadáver154–157. Otro estudio, aunque no muestra reducción de la mortalidad, demuestra menor riesgo de hospitalizaciones158. Los costes globales y las hospitalizaciones también parecen ser favorables a la hemodiálisis nocturna respecto a la hemodiálisis estándar147,159. Como aspectos negativos, la hemodiálisis frecuente podría aumentar las complicaciones del acceso vascular, pudiendo además acelerar la pérdida de la función renal residual160,161.
Hemodiálisis domiciliariaLa HDD permite esquemas más flexibles y fisiológicos que la HD estándar, como la HD corta diaria o la HD nocturna, por lo que los mismos beneficios anteriormente descritos con estas técnicas se van a poder obtener en los pacientes que se dializan en su domicilio. Aunque la calidad de la evidencia es limitada, pues la mayoría de los estudios son observacionales, entre los beneficios descritos se incluye un mejor control del estado de hidratación y de la presión arterial con una menor tasa de ultrafiltración y de antihipertensivos162,163; un mayor control de los niveles de fósforo, con menor necesidad de quelantes164; una disminución del estado inflamatorio y mayor libertad dietética, optimizando el estado nutricional165 y mejorando la calidad de vida166–169. Adicionalmente, la HDD ofrece otras ventajas clínicas respecto a la hemodiálisis diaria realizada en centro, como son la ausencia de efectos adversos sobre el acceso vascular170, una mejor relación coste-eficacia171,172 y una mayor oportunidad para la rehabilitación y el acceso a la reinserción laboral del paciente173.
La supervivencia observada en distintas cohortes de pacientes es mucho más alta en los pacientes tratados con HDD respecto a los que se dializan en centro, alcanzando hasta un 89% y un 50% a los 5 y 15 años de evolución, respectivamente76,173–179. Las razones por las que la HDD se asocia con una mejor supervivencia del paciente no se conocen con precisión. Además de los beneficios clínicos antes comentados y de la existencia de un potencial sesgo de selección inherente a todo estudio observacional (los pacientes en HDD suelen ser más jóvenes y suelen tener menor comorbilidad en comparación con los pacientes en el centro)180,181, factores psicológicos como el hecho de que el paciente mantenga su autonomía e independencia y evite el llamado síndrome de indefensión aprendida (estado psicológico por el cual una persona se siente incapaz de modificar una situación aversiva o dolorosa) pueden contribuir a los mejores resultados observados con la HDD182,183. Consciente de todos estos beneficios potenciales, en los últimos años la S.E.N. ha constituido un Grupo de Trabajo para el desarrollo de la HDD en España184.
Hemodiálisis en pacientes con fracaso renal agudoEl fracaso renal agudo es una complicación hospitalaria frecuente y se asocia a una elevada mortalidad (50-70%) y a un elevado riesgo de desarrollo de enfermedad renal crónica. Hasta un 10% de los que sobreviven quedarán en hemodiálisis periódica185. Las principales cuestiones que se han planteado en las últimas décadas sobre el tratamiento sustitutivo del fracaso renal agudo tienen que ver con el tipo de técnica y de membrana a utilizar. Los numerosos estudios que se han realizado en este sentido permiten contestar de forma razonable a estas cuestiones:
- a)
Tipo de técnica: ha habido una gran controversia en la literatura sobre el tratamiento del fracaso renal agudo con hemodiálisis intermitente o con técnicas lentas de hemofiltración o hemodiafiltración continuas, habitualmente en pacientes que precisan atención en las Unidades de Cuidados Intensivos. Las técnicas lentas han sido consideradas más ventajosas debido a su mayor capacidad de ultrafiltración, lo que no limita la nutrición parenteral y su mejor tolerancia hemodinámica. Sin embargo, los estudios aleatorizados y controlados diseñados para observar diferencias en la mortalidad y en la recuperación de la función renal han mostrado resultados dispares a favor de una u otra técnica, de manera que la evidencia no demuestra la superioridad de un tipo de terapia renal sustitutiva sobre la otra186–190. Los metaanálisis publicados tampoco han demostrado diferencias en términos de mortalidad123,191–196. En este sentido, las actuales guías KDIGO sugieren utilizar tanto las técnicas continuas como las intermitentes como un tratamiento complementario del fracaso renal agudo, sin recomendar preferentemente ninguna de las dos197, de manera que la decisión sobre la utilización de una u otra técnica dependerá en gran medida de las características del paciente y de la posibilidad en la utilización de una o de las dos técnicas en cada centro particular. Por otra parte, el coste de las técnicas de hemodiafiltración continuas es muy superior al de la hemodiálisis intermitente198.
- b)
Tipo de membrana: la biocompatibilidad y la permeabilidad son las dos características de la membrana de diálisis que se han sugerido que podrían afectar a la mortalidad del paciente con fracaso renal agudo y a la recuperación de su función renal. En un metaanálisis con 867 pacientes, Subramanian et al. observaron una mayor mortalidad en los pacientes tratados con membranas de celulosa no modificada. Este efecto no se mantenía si se comparaban membranas sintéticas con membranas de celulosa modificada (más biocompatibles)199. En otro metaanálisis tampoco se encontraron diferencias significativas en la morbimortalidad entre pacientes dializados con membranas de celulosa modificada y los tratados con membranas sintéticas200. Aunque existe discrepancia sobre si el uso de membranas biocompatibles se asocia con mayores tasas de recuperación de función renal201–203, en la práctica clínica en el tratamiento del fracaso renal agudo se utilizan membranas biocompatibles, y no las basadas en celulosa, tal y como recomiendan las actuales guías KDIGO197. Por otra parte, muy pocos estudios han comparado el efecto de la permeabilidad de la membrana en el pronóstico del paciente con fracaso renal agudo, no observándose diferencias significativas entre las membranas de alta y baja permeabilidad en la recuperación de la función renal y la supervivencia de los pacientes con fracaso renal agudo201–204. Sin embargo, la posibilidad de aportar mayor eficacia dialítica puede justificar el uso de las membranas de alto flujo, a pesar de su mayor coste.
Los centros de diálisis pueden disponer de todas o sólo de algunas de estas modalidades, pero deben disponer de un manual de funcionamiento y de protocolos específicos para cada una de las modalidades de hemodiálisis que oferten.
La elección de la modalidad de hemodiálisis debe realizarse en función de las características del paciente (edad, superficie corporal, patología comórbida, acceso vascular, evolución clínica, situación respecto a la lista de espera del trasplante) y estructurales del centro. Es aconsejable mantener un registro de todos los pacientes en el que conste la modalidad de hemodiálisis y el motivo de la indicación.
Dada la diversidad de opciones disponibles y la necesidad de un ajuste personalizado del tratamiento de diálisis, la opinión de los nefrólogos debe ser imprescindible para establecer los requisitos técnicos de los diferentes concursos relacionados con la diálisis, así como su participación activa en la valoración de las diferentes ofertas propuestas (evidencia grado C).
Tratamiento del agua y dializadoEl tratamiento de aguas, las características de pureza del agua de diálisis y la solución de diálisis final deben seguir las recomendaciones de las guías de la S.E.N. sobre líquidos de diálisis publicadas en su última versión en el año 201637. Las características del líquido de diálisis dependerán en gran medida de las técnicas de diálisis que se empleen en cada centro, si bien la tendencia es a conseguir que todas las unidades utilicen agua ultrapura, ya que cuanto mayor es la pureza del agua de diálisis, menos riesgo hay de que se produzcan fenómenos inflamatorios resultados de la exposición al líquido de diálisis (evidencia grado C).
Dosis de hemodiálisis: dosificación y adecuación del tratamiento dialíticoIntroducciónLa hemodiálisis, como cualquier otro tratamiento, necesita una dosificación y una pauta de administración. Para ello se han diseñado y obtenido métodos cuantitativos que garantizan que el paciente reciba una dosis mínima adecuada.
Diferentes guías de práctica clínica abordan este problema1,101,205–207, recomendando una medición basada en el modelo cinético de la urea (MCU), y estableciendo una dosificación mínima recomendada. En la anterior GPC de la S.E.N.208, se incorpora la medición a través de dialisancia iónica o Kt entre los métodos recomendados.
Dosis mínima de tratamiento- •
Como regla general, la dosis mínima recomendada para hemodiálisis en régimen de tres sesiones semanales es un Kt/V igual o superior a 1,3 y/o un porcentaje de reducción de urea (PRU) del 70% y/o Kt/Ve de 1,1 y/o un Kt mayor que el deseado ajustado a superficie corporal (evidencia grado A).
- •
Incrementar la dosis de diálisis medida por Kt puede mejorar la supervivencia del paciente en hemodiálisis, y reducir el riesgo de hospitalización (evidencia fuerte).
- •
La dosis de diálisis determinada por algún método en relación con el MCU debe de ser medida al menos mensualmente (evidencia no calificada).
- •
Si se dispone de monitores con biosensores de dialisancia iónica, se recomienda realizar el seguimiento de la dosis de diálisis por el Kt (evidencia fuerte).
Las recomendaciones actuales se basan en estudios observacionales valorando la relación entre dosis de diálisis y mortalidad. El National Cooperative Dialysis Study (NCDS)209,210, fue el primer estudio que relacionó la cinética de la urea con la evolución clínica de los pacientes determinando unos niveles mínimos de toxicidad o dosificación de diálisis. En este estudio prospectivo de 160 pacientes comprobaron que el grupo de enfermos con menor concentración de urea tenía una menor morbimortalidad. Un posterior reanálisis de los resultados por Gotch y Sargent211, en 1985, les llevó a expresar la dosis de diálisis como Kt/V, observando que un Kt/V > 0,8 se asociaba a una mejor evolución clínica. A partir de los resultados del NCDS, el MCU tuvo una gran aceptación y difusión.
Posteriormente se han publicado varios estudios evidenciando la relación entre dosis de diálisis y mortalidad. En 1993, Owen et al.212, en un corte transversal de 13.473 pacientes, observaron como el riesgo relativo (RR) de muerte disminuía progresivamente con un incremento en el PRU de un 45 a un 70%. En 1994, Collins et al.213, en un corte de 1.773 pacientes, observaron como el RR de muerte disminuía progresivamente con un incremento del Kt/V de menos de 1 a 1,4. En 1996, Held et al.214, en un estudio multicéntrico americano de 2.311 pacientes, observaron que el quintil con Kt/V < 0,9 tenía un 20% más probabilidad de fallecer con respecto al quintil de referencia con Kt/V 1,06-1,16, mientras que el quintil con Kt/V mayor de 1,33 el riesgo disminuía un 29%. Por cada 0,1 unidad de Kt/V, se reduce la mortalidad en un 7%. En este mismo estudio, Bloembergen et al.215 observaron que una dosis más baja de diálisis aumentaba el riesgo de mortalidad por cualquier causa sugiriendo la hipótesis que la dosis baja de diálisis promueve la aterosclerosis, la infección y la malnutrición. Hakim et al.216 en un estudio observacional a cuatro años, incrementaron el Kt/V de 0,82 en 1988, a 1,33 en 1991, con una reducción de la mortalidad anual de un 22 a un 9%. Parker et al.217 incrementaron el Kt/V de 1,18 a 1,46, disminuyendo la mortalidad anual de un 23 a un 18%. Yang et al.218, en un estudio observacional de 337 pacientes, observaron que la mortalidad bruta anual disminuyó de un 16 a un 13 y a un 8% con el incremento del Kt/V de 1,3 a 1,5 y 1,7, respectivamente. Los mejores resultados publicados de supervivencia han sido en el grupo de Tassin, Francia: 445 pacientes con diálisis de och horas de duración y un Kt/V de 1.7, (Daugirdas monocompartimental 2ª generación), con acetato, cuprofán de 1 m2, QB 200-250mL/min y QD 350-500mL/min219.
El estudio HEMO220,221, prospectivo y randomizado, comparó un grupo con una dosis mínima recomendada, Kt/V de 1,25 o Kt/Ve 1,05, con un grupo de alta eficacia con un Kt/V de 1,65 o Kt/Ve 1,45. Aunque este estudio ha sido ampliamente comentado desde el punto de vista metodológico, el resultado final no ha sido concluyente en demostrar que el grupo de alta dosis disminuyera la mortalidad respecto a la dosis convencional86.
Las recomendaciones actuales de dosis de diálisis, según el estudio multicéntrico americano, son un Kt/V igual o superior a 1,3 y/o un PRU del 70%214. Según la guía práctica para hemodiálisis (DOQI) de la National Kidney Fundation, recomienda un Kt/V mínimo de 1,2 y/o un PRU del 65%101, aunque recomienda un Kt/V de 1,3 y un PRU del 70% para asegurar estos mínimos. Para evitar el efecto rebote y los desequilibrios intercompartimentales es recomendable utilizar el Kt/Ve. Las recomendaciones de Kt/V de 1,3 o un PRU del 70% serían equivalentes a un Kt/Ve de 1,1 o un PRUe del 64%, respectivamente222.
Comentada la importancia de la dosis de diálisis, no debemos olvidar que anualmente se realizan tan sólo determinaciones mensuales, bimensuales o trimestrales para calcular la dosis de diálisis extrapolando el resultado de estas 4, 6 o 12 mediciones a todo lo que ocurre en las 156 sesiones anuales. Las guías clínicas DOQI recomiendan calcular la dosis como mínimo de manera mensual101.
En cada proceso de hemodiálisis intervienen múltiples factores que pueden influir en la eficacia dialítica, por lo que parece lógico que se hayan creado sistemas de control que cuantifiquen en cada sesión y en tiempo real la dosis que el paciente recibe. En este sentido, en la actualidad, diferentes monitores han incorporado biosensores que miden de forma no invasiva, utilizando las propias sondas de conductividad de las máquinas, la dializancia iónica efectiva que es equivalente al aclaramiento de urea (K) y, por tanto, permite calcular la dosis de diálisis223–225, sin sobrecarga de trabajo, determinaciones analíticas ni coste adicional. La medición sistemática del K por el tiempo transcurrido de diálisis nos permite obtener el Kt, una forma real de medir la dosis de diálisis, expresada en litros.
Varios autores que han trabajado con dialisancia iónica en hemodiálisis y expresado el valor como Kt/V si bien la correlación con el Kt/V analítico es buena, los resultados difieren significativamente, lo que demuestra la variabilidad entre métodos226,227. Introducir un V basado en cálculos antropométricos o en la impedancia eléctrica228, generalmente infraestima el Kt/V en relación al determinado analíticamente226,227,229,230.
Algunos autores han propuesto un método de re escalado del Kt/V en función de la superficie corporal231,232, o utilizar métodos alternativos para medir la dosis de diálisis en lugar de la V233, pero no han sido ampliamente aceptados en la comunidad nefrológica.
Con la incorporación de la dialisancia iónica, se propuso Kt en lugar de Kt/V como un método para monitorizar la dosis de diálisis234 porque permite evitar la curva de supervivencia en forma de J, que se produce cuando los pacientes se distribuyen de acuerdo con el URR o Kt/V235. En un estudio anterior, la dosis mínima de Kt se individualizó en términos de superficie corporal236 y se validó en 59.644 pacientes norteamericanos en un estudio transversal (marzo de 2004) como medida predictora durante un período de un año237:
En la población española, la monitorización de la dosis de diálisis con Kt en lugar de Kt/V identifica de 25 a 40% de los pacientes que no alcanzaron el Kt mínimo al mismo tiempo que alcanzaron Kt/V238–240, especialmente en mujeres, pacientes con catéteres venosos centrales y pacientes con bajo peso corporal238.
Esta posibilidad de monitorizar la dosis de diálisis en tiempo real se refleja en el interés creciente en políticas de calidad que conducen a una mejora en la dosis de diálisis. Así, entre el estudio en población americana en el 2006237, donde el Kt medio alcanzado fue 51 litros, 0,3 litros en media más que el deseado, en la población española en 2013238 se alcanzaron 52,6 litros de Kt medio, 3,3 litros más que el objetivo. Más recientemente241, también en población española, se alcanzaron 55,1 litros de Kt medio, 6,5 litros más que el objetivo. Estos datos suponen que en los últimos 10 años se ha mejorado la adecuación de la dosis medida por Kt desde un 53% que consiguen una dosis mínima, a un 67 y 81%, respectivamente.
Recientemente, Maduell et al.241 reportan un estudio prospectivo observacional sobre 6.129 pacientes en hemodiálisis en 63 centros en España, en el que el riesgo de mortalidad muestra un progresivo incremento cuando no se alcanza el Kt prescrito ajustado a superficie corporal. Más aún, este riesgo se reduce cuando se alcanzan 1 a 3 litros sobre el objetivo mínimo o más. Del mismo modo, cuando se alcanzan 9 litros o más sobre el objetivo mínimo de Kt ajustado a superficie corporal, se reduce el riesgo de hospitalización. El diseño observacional del estudio no permite establecer una relación causal entre mortalidad y dosis de diálisis, en la que el único estudio randomizado no fue concluyente al respecto, tal como se comentó con anterioridad86, por lo que se recomienda ser especialmente cauteloso en este aspecto en diseños no randomizados242. La aplicación estadística del Propensity Score Matching sobre la muestra permitió identificar que los que reciben una mayor dosis de diálisis por Kt tienen un riesgo de mortalidad reducido, independientemente del resto de las comorbilidades y del propio Kt/V, si bien se requiere un estudio randomizado para su definitiva constatación. Se observó que la mortalidad de los pacientes que alcanzaban un Kt/V mínimo y un Kt mínimo fue del 12,5%, mientras que los pacientes que alcanzaban un Kt/V mínimo, pero no el Kt mínimo fue del 23,5%. La nueva fórmula recomendada para obtener la recomendación mínima de Kt, a tenor de los resultados obtenidos en este estudio, sería una modificación de la anterior:
Dosis mínima de Kt en litros = (1/[0,0069+(0,0237/ASC)])+2)
Tiempo y frecuencia de diálisisLa diálisis se realizará al menos tres veces por semana con una duración de al menos 12 horas semanales, salvo que el paciente presente una función renal residual significativa.
Se puede considerar el incremento de la duración de la diálisis o de la frecuencia semanal en situaciones de inestabilidad cardiovascular, hipertensión arterial refractaria pese a la ultrafiltración o hiperfosforemia.
En el paciente incidente con función renal residual mantenida es posible la individualización de su tratamiento de forma incremental, si bien se requieren estudios controlados para su estandarización.
No hay trabajos en la literatura actual que demuestren claramente el posible beneficio del tiempo de diálisis independientemente de la dosis. Aunque algunos sugieren que el tiempo de diálisis puede ser un factor independiente en la evolución del paciente243,244, otros concluyen que es muy difícil de separar tiempo y dosis245.
Tal como se recoge en las guías europeas sobre estrategias en diálisis246, en consonancia entre otros con el registro japonés de diálisis247, no hay evidencias de que se pueda reducir la duración de la sesión por debajo de las cuatro horas sin comprometer el resultado, razón por la que en esta guía consideramos esta recomendación como razonable.
La relación entre el incremento de tiempo y/o frecuencia con la supervivencia sigue siendo controvertida. Si bien es cierto que se han sugerido mejores resultados con la diálisis larga244, frecuente139 y larga frecuente148, e incluso una relación entre mortalidad y el periodo interdiálitico del fin de semana248, no es menos cierto que también se han encontrado buenos resultados de supervivencia en diálisis más cortas con un esquema convencional. Es complicado realizar estudios randomizados de elevado tamaño muestral para poder concluir con certeza sobre este aspecto, además de que esquemas terapéuticos basados en una mayor frecuencia pueden tener problemas organizativos, incrementar el coste y aumentar los problemas sobre el acceso vascular139, además del fenómeno de burnout descrito hasta en el 41% de los pacientes en un metaanálisis de 2006249. Por tanto, aunque no se pueda establecer como recomendación generalizada, en determinadas situaciones, puede estar indicado el aumento del tiempo y/o la frecuencia.
La diálisis larga mejora el control de la presión arterial en el paciente en hemodiálisis244, del mismo modo que el incremento del tiempo de diálisis reduce la tasa de ultrafiltración horaria y mejora la estabilidad hemodinámica243. Datos similares sobre la presión arterial139 y el control de volumen se han descrito con el aumento de la frecuencia, incluso en pacientes con alta comorbilidad145,250.
El incremento en el tiempo251 o en la frecuencia139,149 puede mejorar el control de fósforo en pacientes con hiperfosforemia persistente.
Recientemente, algunos autores252–254 preconizan la hemodiálisis progresiva o incremental en población incidente, con la finalidad de preservar la función renal residual, lo cual puede mejorar la eliminación de moléculas de diferentes pesos moleculares, facilitar la normohidratación y mejorar la supervivencia255,256. En la actualidad no existe información suficiente que nos permita establecer qué pacientes pueden beneficiarse, ni una estandarización de la progresividad, aunque algunos estudios están proyectados o en ejecución257.
El cálculo de dosis de hemodiálisis y sus recomendaciones se refieren a un esquema de tres sesiones semanales. Sin embargo, si la frecuencia de diálisis cambia la dosis es más difícil de comparar. El Kt/V semanal, que sería una forma sencilla, no nos sirve ya que sabemos que una diálisis más frecuente es más eficaz. Las recomendaciones del DOQI para hemodiálisis convencional son de un Kt/V semanal de 3,6 mientras que éste disminuye a 2,0, cuando se emplea una técnica continua como la diálisis peritoneal, basándose en la experiencia clínica de los nefrólogos tratando a miles de pacientes durante más de 20 años. El camino desde el Kt/V de 3,6 para tres sesiones semanales a un Kt/V de 2,0 para una técnica continua como la diálisis peritoneal incluye las variaciones de frecuencia de 4, 5, 6 y 7 sesiones por semana.
Varios autores han realizado diferentes propuestas para cuantificar la dosis de diálisis cuando hay variaciones en la frecuencia: aclaramiento renal equivalente de urea (EKR), publicado por Casino y López236; el Kt/V estándar (Kt/Vstd) propuesto por Gotch237; el porcentaje de reducción de urea semanal238:
Casino y López238, se puede calcular con tres fórmulas, según los autores:
EKR1 (mL/min) = G / TAC, siendo G la generación de urea y TAC la concentración de urea.
EKR2 (mL/min) = (40 * PCRn – 0,17) / (5,42 * TAC), siendo PCRn la tasa de catabolismo proteico normalizada para su peso corporal.
EKR3 (mL/min) = Según gráfica publicada por los autores con el Kt/V y la frecuencia.
Gotch237:
Kt/Vstd = (G / Cm) * t / V; siendo Cm la media de los valores pico de urea prediálisis.
Como no se determina la urea prediálisis en cada sesión, se puede calcular a partir de la gráfica publicada por el autor con el Kt/V y la frecuencia.
Maduell238:
PRU = número de sesiones * [100 * (C1 - C2) / C1]
Accesos vascularesEl correcto funcionamiento y mantenimiento del acceso vascular es indispensable para el desarrollo normal de la hemodiálisis por lo que nos remitimos a las Guías de la S.E.N. sobre accesos vasculares12.
Monitorización del proceso de hemodiálisisObjetivos- a)
Asegurar que todos los pacientes de hemodiálisis, independientemente del centro en el que se dialicen, son sometidos a unos controles analíticos y clínicos mínimos que permitan su adecuado control y tratamiento. Sin embargo, estos requisitos mínimos no eximen de la primera obligación de la diálisis: la individualización. Existen pacientes en los que por diferentes motivos no basta con los criterios mínimos y se debe asegurar que tiene acceso a una atención adecuada.
- b)
Asegurar que la evaluación clínica, la cumplimentación de la historia clínica y la monitorización del paciente de hemodiálisis, se realizan con una periodicidad adecuada por médicos nefrólogos.
- c)
Asegurar el acceso a estas prestaciones para todos los pacientes en hemodiálisis, independientemente del tipo y localización geográfica del centro.
En esta guía se describe el contenido mínimo de la historia clínica que debe tener un paciente en hemodiálisis. La calidad de la historia clínica facilitará la atención adecuada al paciente en diálisis y una buena continuidad asistencial por los diferentes estamentos.
Recomendaciones generales- a)
La recepción inicial de un paciente en diálisis debe contemplar la realización de una historia clínica detallada al inicio de programa en la que se describan los aspectos que serán descritos a continuación.
- b)
Dado que la historia clínica de un paciente en hemodiálisis puede prolongarse durante años, y es algo en constante evolución, es de vital importancia una cumplimentación adecuada en tiempo y forma. Esto significa:
- •
Tiempo: se recomienda que los registros de los acontecimientos más importantes (nuevas patologías, ingresos…) se realicen puntualmente en el momento de recibir la información, de esta manera la historia clínica siempre estar actualizada. La actualización de la historia clínica debe ser una tarea constante del nefrólogo de las unidades de hemodiálisis.
- •
Forma: el registro de esta información se realizará de manera que, a pesar del paso del tiempo, este siempre disponible y de fácil acceso, tanto para los nefrólogos del centro, como médicos de cabecera y hospital de referencia. Se recomienda, por ello, que esta información se registre con la fecha (día/mes/ año) en la historia clínica global del paciente dentro del apartado correspondiente a su patología (CARDIOLÓGICO, NEUMOLÓGICO) en el apartado REVISIÓN POR SISTEMAS y actualizar los DIAGNÓSTICOS.
- c)
La historia clínica informatizada del paciente del centro de diálisis debe ser compartida en tiempo real con el hospital de referencia, por si el paciente acude de urgencia y para que pueda ser evaluado por otros especialistas.
- d)
El apartado EVOLUCIÓN CLÍNICA de los sistemas informáticos servirá para registrar los eventos más importantes en el seguimiento del paciente, pero no debe impedir cumplimentar la historia clínica por apartados y los diagnósticos, que facilita el acceso a la información.
- e)
Se deberá vigilar que la historia clínica está actualizada cuando el paciente sea remitido a otro centro de hemodiálisis o cuando sea remitido a su Hospital de referencia.
- f)
Se facilitará a todos los pacientes un informe médico actualizado, como mínimo cada seis meses, y cada vez que tengan una incidencia importante.
Estos son los datos mínimos para cumplimentar al inicio del programa de diálisis y después se irán actualizando.
- a)
Datos de filiación. Nombre y apellidos / Dirección y teléfonos (propio y de familiares cercanos) / Ciudad y código postal / Fecha y lugar de nacimiento/ DNI / N.° Seguridad Social / N.° SIP.
- b)
Historia de la enfermedad actual nefrourológica. Se describirá brevemente y de forma cronológica la patología renal que le ha conducido a diálisis, así como la evolución y el tiempo de seguimiento por el nefrólogo.
- c)
Antecedentes familiares. Antecedentes de diabetes mellitus (DM) / hipertensión arterial (HTA) / cardiopatía isquémica / muerte de causa cardiovascular precoz. Antecedentes de nefropatía, sordera familiar, alteraciones oculares. Antecedentes oncológicos.
- d)
Antecedentes personales previos a su inclusión en hemodiálisis. HTA / DM / dislipemia / hiperuricemia / ingresos previos / intervenciones quirúrgicas / antecedentes ginecológicos.
- e)
Alergias. Reseñar tipo de alergia y si hay estudio por alergología.
- f)
Hábitos tóxicos. Tabaquismo / alcohol / otras drogas.
- g)
Sociales. Nivel de formación / situación laboral.
- h)
Revisión por sistemas:
- •
Hematológica y transfusiones sanguíneas: anemia, poliglobulia, administración de hierro IV, uso de eritropoyetina, presencia de resistencia a la eritropoyetina, alteración de la coagulación, transfusiones de sangre previas (número y fechas), antiagregación / anticoagulación y causa.
- •
Cardiovascular: hipertensión arterial, arterioesclerosis, cardiomiopatía, cardiopatía isquémica (tipo), pericarditis, calcificación arterial, valvulopatías, episodios de edema agudo de pulmón, arritmias, derrame pericárdico.
- •
Enfermedad vascular periférica: claudicación intermitente, calambres, insuficiencia venosa, antecedentes de trombosis venosa periférica, amputaciones.
- •
Digestiva-hepatopatía: pirosis, disfagia, habito intestinal (estreñimiento/diarrea), náuseas, vómitos, antecedentes de hemorragia digestiva (melenas / hematemesis), intolerancia alimenticia, hemorroides sangrantes, problemas vesícula biliar, eventración / hernia abdominal. Marcadores víricos VHB, VHC y VIH a su inicio de HD. En caso de hepatopatía tratada: tratamiento recibido, duración, fecha de finalización, negativización o no de carga viral.
- •
Neumológica: derrames pleurales, calcificaciones pulmonares hipertensión pulmonar, síndrome de apnea de sueño, criterios EPOC / insuficiencia respiratoria, usuarios de broncodilatadores, oxígeno domiciliario o presión positiva continua en la vía aérea (continuous positive airway pressure [CPAP]) nocturna, asma bronquial, hiperreactividad bronquial, antecedentes de neumonías, hemoptisis ni TBC. Animales domésticos.
- •
Neurológica: encefalopatía, alteraciones cognitivas, neuropatía periférica (sensitiva o motora), disfunción del sistema autonómico, enfermedad cerebrovascular, cefalea.
- •
Infecciosas: relacionadas con el acceso vascular, víricas (HB, HC, HIV) urogenitales, intraabdominales, etc.
- •
Dermatológica: Orurito, eccemas cutáneos, xerosis cutánea, calcificáis.
- •
Acceso vascular: fístulas: fecha de realización, localización, desarrollo, complicaciones (robo, hiperaflujo, aneurismas); trombosis (fecha), infección (fecha); catéteres: localización, fechas, trombosis, malfuncionamiento.
- •
Metabolismo mineral y óseo: osteodistrofia renal, osteoporosis, hueso adinámico, fracturas, tratamientos y fechas de instauración y suspensión, uso de captores del fósforo, tolerancia y adherencia.
- •
Vacunación del paciente: pauta de vacunación: HB, neumococo, antigripal, antitetánica.
- •
Endocrina: diabetes mellitus tipo I o tipo II, tiroides.
- •
Neurológico/psiquiátrica: antecedentes de ansiedad o depresión.
- •
Oftalmológica: glaucoma, cataratas, calcificaciones corneales, retinopatía diabética.
- •
Ginecológica: embarazos, menopausia, hemorragia vaginal, última mamografía, ultima densitometría ósea, ecografía ginecológica, citología vaginal.
- •
Musculoesquelético: dolor articular, mialgias.
- •
Urinario: varones: problemas prostáticos.
- •
Nutrición: parámetros nutricionales, uso de estimulantes del apetito o suplementos dietéticos, dificultades para la masticación o la deglución, obesidad, potasemia.
- •
Otros: sensorio, psicomotricidad e intelecto. Ánimo y adaptación a la diálisis, alteraciones auditivas o visuales, psicomotricidad y alteración de la marcha, usuario de bastón/silla de ruedas. Portador de lentes correctoras / prótesis auditiva / prótesis dental. Continencia de esfínteres / portador de pañal / sondaje uretral permanente / colostomía. Autónomo / dependiente / precisa ayuda para las ABVD (actividades basales de la vida diaria). Adecuada cumplimentación dietética / transgresor dietético habitual. Adherencia al tratamiento farmacológico / incumplimentador del tratamiento farmacológico.
- •
Vive con… / Vive solo / en residencia de ancianos, con adecuado apoyo familiar / aislamiento social. Viene a su primera sesión solo/acompañado por… Sale de casa a diario. Vida activa para la edad. Vida sillón-cama-WC.
- •
Situación en lista de espera de trasplante renal.
- g)
Exploración física: completa al inicio del programa. Se anotarán los signos vitales iniciales incluyendo la presión arterial (brazo derecho e izquierdo) y la frecuencia cardiaca en decúbito supino y en bipedestación. Se registrará la talla, peso e índice de masa corporal (IMC). Nivel de consciencia y orientación. Coloración y estado de hidratación. Adenopatías supraclaviculares, axilares o latero cervical. Ingurgitación yugular a 45°. Bocio. Pulsos carotideos palpables y simétricos presencia de soplos. AC: ritmon, soplos, extratonos, roces. AP: murmullo vesicular, crepitantes, roncus o sibilancias. Abdomen: blando, depresible, doloroso o no a la palpación. Soplos abdominales. Hepatomegalia o esplenomegalia. Masas abdominales. Blumberg, Murphy. Ascitis. MMII: edemas, pulsos femorales, tíbiales, poplíteos y pedios. Exploración neurológica: pares craneales, déficit motor o sensitivo.
- •
Otros datos de interés:
- i.
Índice de comorbilidad de Charlson.
- ii.
Encuesta de Satisfacción del paciente.
- h)
Exploraciones complementarias: del hospital de referencia. Debe aportar de forma inicial RX Tórax, ECG, ecocardiografía y ecografía abdominal.
- i)
Analítica inicial (con marcadores víricos: VHC, VHB, HIV)
- •
Pauta de hemodiálisis inicial.
- •
Tratamiento inicial.
Se irán registrando en la historia clínica del paciente según su evolución y de manera puntual los siguientes apartados, registrando las fechas:
- •
Adecuación de diálisis.
- •
Cambios en la prescripción del paciente.
- •
Complicaciones de la diálisis.
- •
Acceso para hemodiálisis y sus complicaciones.
- •
Situación hematológica y transfusiones de sangre.
- •
Situación cardiovascular y sobrecarga de volumen.
- •
Complicaciones infecciosas.
- •
Metabolismo mineral y óseo.
- •
Alteraciones electrolíticas.
- •
Situación nutricional.
- •
Situación endocrinológica.
- •
Hospitalizaciones del paciente (considerar comprobación marcadores hepatitis según tiempo y causa del ingreso).
- •
Psicológica y social del paciente.
- •
Situación respecto al trasplante renal.
- •
Exploraciones complementarias realizadas.
- •
Evolución de los análisis de sangre.
- •
Vacunación de los pacientes.
La pauta de hemodiálisis se modificará según necesidades y situación clínica del paciente, siendo recomendable disponer de un registro, en el que se pueda seguir las modificaciones de la pauta de hemodiálisis a lo largo del tiempo.
Con periodicidad anual se hará un informe que incluirá un examen físico completo, revisión por sistemas y los aspectos más relevantes de la evolución del paciente durante ese periodo.
Vigilancia durante la sesión de hemodiálisisSe hará hincapié en los siguientes aspectos:
- •
Vigilancia y ajuste del peso seco: se realizará en cada sesión de hemodiálisis, valorando la existencia de sintomatología o semiología de hiper/hipovolemia (HTA de inicio reciente o mal control con los fármacos habituales, disnea en el periodo previo a la hemodiálisis, ortopnea, hipotensiones, calambres, edemas, ingurgitación yugular, crepitantes a la auscultación, etc.). Se valorará la realización de bioimpedancia como herramienta de ajuste del peso seco.
- •
La vigilancia del peso en el período previo a su incorporación a programa de hemodiálisis y las ganancias de peso interdiálisis nos pueden aportar información sobre el estado nutricional de los pacientes.
- •
Vigilancia del funcionamiento del acceso vascular258: se deben de valorar aquellos datos que de forma precoz detectan una disfunción antes de cualquier prueba diagnóstica. Para ello debemos se debe llevar un registro del acceso vascular, donde se incluirán los más usados:
- ∘
Exploración física (edemas, aneurismas y signos infecciosos).
- ∘
Presiones del acceso vascular: presión venosa dinámica, presión intra-acceso o estática.
- ∘
Recirculación del acceso vascular.
- ∘
Alteración de la adecuación de la diálisis.
- ∘
Valoración de los puntos de punción.
- ∘
Hemostasia.
Individual para cada paciente.
Los datos que se deben registrar en las sesiones de hemodiálisis son:
- a)
Nombre del paciente, alergias, fecha, identificación del monitor, técnica de diálisis, hora de inicio y fin de la sesión e identificación de la enfermera o enfermeras responsables de la sesión.
- b)
Material de diálisis: dializador, agujas, líquido de cebado, líquido de reposición, tipo de heparina, concentrado ácido y bicarbonato.
- c)
Balance de líquidos: peso seco, peso pre-HD, peso post-HD, ganancia de peso interdiálisis, pérdida de peso intradiálisis y líquido perfundido durante la sesión.
- d)
Acceso vascular: tipo de acceso, localización, estado, funcionalidad, fecha de realización, fecha de 1.ª punción y cuidados especiales.
- e)
Cuidados especiales durante la sesión: ultrafiltración máxima tolerada, ingesta, acomodo, etc.
- f)
Programa de sesión:
- •
Heparina de purgado, heparina continua o en bolus inicial y posteriormente horaria, hora de fin de heparina.
- •
Tiempo de diálisis, ultrafiltración (UF) programada.
- •
Perfil de UF.
- •
Perfil de conductividad.
- g)
Control de constantes: la tensión arterial y la frecuencia cardíaca se registrarán al inicio, final y horaria, así como todas las que requiera el estado del paciente. Debe registrarse la temperatura corporal. Se monitorizará la tensión arterial horaria.
- h)
Control de parámetros del monitor: flujo sanguíneo (Qb) real, presión arterial y venosa, presión transmembrana (PTM), temperatura del baño, conductividad, flujo de baño y UF horaria y UF total.
- i)
Estado final del dializador y líneas.
- j)
Control de glucemia en los pacientes diabéticos.
- k)
Medicación administrada.
- l)
Extracciones analíticas.
- m)
Comentarios médicos.
- n)
Comentarios de enfermería.
Se debe de anotar en la Hoja/Gráfica de Tratamiento el número de lote de los dializadores, líneas sanguíneas y líquidos de diálisis. Se debe llevar un registro de los fármacos que se utilizan en las salas por semanas anotando número de lote y fecha de caducidad. La importancia de esto radica en poder seguir la trazabilidad de los fármacos y productos utilizados en las sesiones de diálisis254.
Controles analíticos y pruebas complementarias del paciente en hemodiálisisObjetivoEn esta guía se describen los principales parámetros relacionados con el control del paciente en hemodiálisis, así como la periodicidad de las determinaciones.
Recomendaciones generalesSe debe asegurar que al paciente estable en hemodiálisis se le realizan los controles analíticos y pruebas complementarias mínimas definidas en esta guía y con la frecuencia aquí descrita. Sin embargo, estos requisitos mínimos no eximen de la realización de todos aquellos controles adicionales que se consideren necesarios de forma individualizada a cada paciente, según el criterio de su nefrólogo responsable.
JustificaciónAdemás de las programadas, se realizarán todas aquellas analíticas que se consideren oportunas, con periodicidad variable, en función de posibles contingencias clínicas y cambios en la estabilidad del proceso que requieran intervención terapéutica.
Consideramos importante que, incluso en los centros extrahospitalarios, se pueda ampliar la analítica rutinaria según las necesidades del paciente (solicitudes de otros especialistas, ampliación de estudios en casos concretos), con el fin de evitar a los pacientes visitas innecesarias al hospital y pinchazos adicionales.
- •
Las analíticas deben estar planificadas anualmente de común acuerdo con el laboratorio de referencia y los centros serán los encargados de controlar que estas se realizan a todos los pacientes.
- •
Los centros deben conocer el método de medición usado en su laboratorio de referencia, así como la forma más adecuada de manipular las muestras para facilitar una correcta interpretación de los resultados (1B).
Justificación: esta recomendación es especialmente relevante para la medición de paratohormona (PTH)259 calcidiol y otras hormonas, así como para la albúmina (con importantes diferencias entre métodos que usan el azul o el púrpura de bromocresol).
- •
La extracción, en los pacientes en hemodiálisis, debería realizarse siempre en el mismo periodo corto, es decir, pre-diálisis a mitad de semana.
Justificación: esta sugerencia es especialmente relevante para la medición de fósforo donde existen variaciones en la medición entre el periodo corto y largo. La medición en periodo corto se asoció más, predijo mejor que la medición en periodo largo su asociación con mortalidad260.
Controles analíticos y periodicidad de mediciónEs aconsejable establecer anualmente, junto al laboratorio de referencia, una planificación de las analíticas a realizar durante el año en curso.
Anemia y metabolismo férricoRecomendación
| Parámetro de medición | Nivel de exigencia | Periodicidad recomendada | Indicaciones |
|---|---|---|---|
| Hemograma (Hb, Hcto, VCM, CHCM) | Exigible | Mensual y a demanda | Programado |
| Plaquetas | Exigible | Mensual y a demanda | Programado |
| Leucocitos y fórmula | Exigible | Mensual y a demanda | Programado |
| Ferritina, IST | Exigible | Cada 2 meses | Programado |
| Reticulocitos | Recomendable | Cada 2 meses | Programado |
| Porcentaje de hematies hipocromos | Recomendable | Cada 2 meses | Programado |
| Ac fólico | Recomendable | Anual y a demanda | ProgramadoEn los pacientes con resistencia a los estimulantes eritropoyéticos |
| Vitamina B12 | Exigible | Semestral y a demanda | ProgramadoEn los pacientes con resistencia a los estimulantes eritropoyéticos |
| Proteína C reactiva (PCR) | Exigible | Mensual y a demanda | Programado |
Justificación
Los estimulantes eritropoyéticos deben ser titulados en función de los niveles de hemoglobina. Para ello, la determinación de hemoglobina ha de realizarse con la frecuencia necesaria que permita estos ajustes de dosis, en el momento adecuado. Durante la fase de corrección de la anemia, los niveles de hemoglobina deben ser monitorizados una vez cada 2 a 4 semanas. Durante la fase de mantenimiento, una vez la hemoglobina está estabilizada, los niveles de hemoglobina deben ser medidos cada 1 a 3 meses (en opinión del grupo de expertos consideramos que debe monitorizarse mensualmente) (Nivel de evidencia C)261–266.
El valor fisiológico de la hemoglobina en adultos sanos depende de la edad, género y raza. Por lo tanto, se deben establecer criterios para la anemia considerando dichos factores.
El estado del metabolismo del hierro se debe monitorizar regularmente en los pacientes en diálisis. Las diferentes guías recomiendan la monitorización regular del estado del hierro (cada 1–3 meses) durante el inicio o la titulación de la dosis de estimulantes eritropoyéticos, en pacientes que reciben tratamiento intravenoso con hierro para evitar la toxicidad (2B): una ferritina sérica sistemáticamente superior a 800 microgramos/L sin evidencia de inflamación (PCR normal) puede sugerir sobrecarga de hierro. (1B) y en pacientes con niveles de Hgb estables265,266.
En nuestro medio, las dos determinaciones que mejor miden el estado del metabolismo férrico y están, probablemente, al alcance de todos los centros, son la ferritina y el índice de saturación de la transferrina. Los niveles de ferritina se utilizarán para medir los depósitos de almacenamiento de hierro y el índice de saturación de la transferrina informa de la disponibilidad del hierro para la eritropoyesis. Los datos obtenidos de estas mediciones se han de interpretar con precaución en pacientes con ERC, ya que la ferritina es un reactante de fase aguda que se ve afectada por la inflamación, especialmente en aquellos pacientes en diálisis en quienes existe inflamación subclínica267,268.
La medición periódica de la proteína C reactiva nos puede ayudar a identificar estos pacientes y a interpretar correctamente los parámetros de anemia y metabolismo férrico, por lo que recomendamos su determinación mensual junto a la hemoglobina269,270.
Los niveles de ferritina e IST no deben medirse hasta que no haya transcurrido al menos una semana desde la última dosis de hierro intravenoso, pues podría dar valores falsamente elevados. Recomendamos la coordinación del administración de hierro semanal, mensual o quincenal coincidiendo con el día de la analítica263–266.
En lugar, o además, de la determinación de la ferritina e índice de saturación de la transferrina se pueden utilizar, si están disponibles, otras pruebas de estado de hierro, tales como porcentaje de hematíes hipocrómicos que expresa el déficit funcional de hierro y el contenido de hemoglobina de los reticulocitos. La medición de los niveles de hepcidina no ha demostrado ser clínicamente útil o superior a otras pruebas estándar de estado de hierro en pacientes con ERC, por lo que no se recomiendan de rutina271,272.
Los pacientes en hemodiálisis son suplementados frecuentemente con vitamina B12 y ácido fólico. Un estudio reciente ha demostrado que las concentraciones más altas de B12 y las más bajas de ác. fólico se asocian con una mayor mortalidad por todas las causas en pacientes en hemodiálisis, independientemente de las variables sociodemográficas y de laboratorio273.
Se requieren estudios adicionales para determinar los objetivos óptimos de nivel de B12 y de folato en esta población, pero parece prudente monitorizar periódicamente los niveles de estas vitaminas, máxime si están suplementados. Por otra parte, en casos seleccionados de resistencia a la acción de los agentes eritropoyéticos, se deben monitorizar las concentraciones séricas de vitamina B12 y ác. fólico274.
El déficit de vitamina B12 está aumentando en los pacientes mayores con pobre ingesta de proteínas y/o uso de antiácidos tipo inhibidores de la bomba de protones y su déficit puede incrementar la resistencia a la eritropoyetina.
Metabolismo mineral y óseoRecomendación
| Parámetro de medición | Nivel de exigencia | Periodicidad recomendada | Indicaciones |
|---|---|---|---|
| Calcio y fósforo | Exigible | Mensual | Programado |
| RecomendableA demanda | Con mayor frecuencia en condiciones especiales. | Modificación de dosis de vitamina D / calcimiméticos.Hipercalcemia/hipocalcemia Hiperfosfatemia / hipofosfatemia.Paratiroidectomía (postparatiroidectomia requieren frecuencia mayor).Tratamiento antiresortivos (especialmente denosumab si se considera por riesgo/beneficio). | |
| PTH | Exigible | Bimestral/trimestral | Programado |
| Exigible | Mensual | Modificación de dosis de vitamina D y/o calcimiméticos. | |
| Fosfatasa alcalina | Exigible | Cada 3-6 meses | Programado |
| Aluminio sérico | Exigible | Anual | Programado |
| Aluminio agua de diálisis | Exigible | Semestral | Programado |
| 25 (OH) Vitamina D (Calcidiol) | Exigible | Al inicio y cada 6 meses (verano e invierno). | ProgramadoEn tratamiento con vitamina D nativa (colecalciferol, ergocalciferol o calcidiol-calcifediol). |
Justificación
Los niveles de calcio, fósforo y paratohormona (PTH) deben ser medidos en todos los pacientes en hemodiálisis. Las guías KDIGO aconsejan el control de Ca y P cada 1-3 meses y de PTH cada 3-6 meses, aunque recomiendan controles más frecuentes en pacientes en tratamiento275,276.
En nuestra opinión, la periodicidad mínima que recomendamos es la determinación programada de PTH cada dos meses y de calcio y fósforo mensual. Esta frecuencia se justifica en base a que las decisiones en el tratamiento del complejo CKD-MBD han de basarse en las tendencias de los valores e interpretados en su conjunto, por lo que una mayor frecuencia en la determinación nos ofrecerá una visión más realista del paciente. Por otra parte, medidas frecuentes de valores como el fósforo, que dependen de la adherencia de los pacientes, ayudarán al cumplimiento terapéutico.
En pacientes bajo tratamiento, especialmente en etapa de titulación de dosis, es necesaria una mayor frecuencia de medición para analizar eficacia y efectos secundarios.
Se recomienda conocer el método de determinación del laboratorio de la PTH.
La fórmula matemática del producto calcio-fósforo (Ca x P) no aporta información independiente a los valores separados de calcio y fosforo evaluados en su conjunto, por lo que no consideramos necesaria su medición277.
La fosfatasa alcalina total es una determinación que puede ser cuestionada.
Las KDIGO aconsejan su determinación cada 12 meses o más frecuentemente si la PTH es elevada. El grupo de expertos consultado para la elaboración de estas guías considera que, a pesar de que todavía no hay mucha evidencia, su determinación puede ser útil, junto a la PTH, como predictor del recambio óseo en pacientes sin enfermedad hepática y, en la actualidad, puede ser de especial interés su medición en pacientes en los que nos planteamos iniciar un tratamiento para la osteoporosis. Aquellos pacientes con niveles de PTH y fosfatasa alcalina relativamente bajos pueden hacer sospechar la existencia de una enfermedad ósea adinámica, y en estos casos, los agentes antiresortivos estarían contraindicados. Consideramos, por tanto, exigible su determinación con una periodicidad cada seis meses. Es probable que en un futuro próximo con el tratamiento del riesgo de fractura debamos empezar a pedir FA ósea278,279.
Aunque recientemente el contenido de dializado de aluminio está bajo un mejor control, con los dobles sistemas de ósmosis y la obtención de agua ultrapura en la mayoría de las unidades, y los captores de fosfato que contienen aluminio se han reemplazado en gran medida con otros captores, la acumulación de aluminio no ha desaparecido completamente, y puede ser debida a un accidente280.
El aluminio se añade al agua como floculante de la materia orgánica en cantidades que varían según la época del año, por lo que sus niveles pueden llegar a ser muy elevados. En estas situaciones la única forma de conseguir niveles óptimos en el líquido de diálisis es trabajar en serie con dos ósmosis inversas. Aunque algunos grupos no recomiendan su determinación rutinaria281, nosotros consideramos una medida de seguridad y vigilancia la determinación de aluminio en agua cada seis meses y aluminio séricoanualmente. Se debe determinar también de manera extraordinaria en aquellas situaciones en que se sospeche toxicidad alumínica en la unidad (anemia microcítica, demencia u osteomala)37.
Es aconsejable la medición de niveles de vitamina D (calcidiol) para prevenir y tratar la frecuente insuficiencia o deficiencia de esta prohormona. Deben monitorizarse los niveles de vitamina D cada seis meses en los pacientes suplementados para evitar toxicidad y ajustar las dosis282–285.
La medición de calcio posthemodiálisis es cuestionado, con opiniones mayoritarias en los expertos consultados acerca de la no necesidad de medición, por lo que esta guía no puede recomendar de forma rutinaria su medición. En caso de determinarlo en pacientes concretos, se estudiaría el perfil habitual en cada paciente con su calcio pre y post y su ultrafiltración habitual con medicación estable, en mitad de semana dos o tres veces para precisar el perfil de ganancia de calcio individual de dicho paciente y, preferiblemente, utilizando calcio iónico. La individualización del calcio de dializado de acuerdo con los niveles de calcio en suero de prediálisis puede prevenir o disminuir las excursiones no deseadas tanto de calcio en suero como de PTH286.
Serología vírica y enzimas hepáticasRecomendación
| Parámetro de medición | Nivel de exigencia | Periodicidad recomendada | Indicaciones |
|---|---|---|---|
| GPT, GGT | Exigible | Mensual | A la entrada de diálisis y programado. |
| Ac VHC | ExigibleRecomendable | SemestralTrimestral | A la entrada de diálisis y programado. |
| PCR-VHC | ExigibleRecomendable | SemestralTrimestral | A la entrada de diálisis y programado. |
| Ag HBs y Ac HB core | Exigible | Anualmente/Trimestralmente en los pacientes con Ac HBs negativos. | A la entrada de diálisis y programado. |
| DNA viral del VHB | Recomendable | Al inicio y cada tres meses si Ac HBc y/o ac HBs son positivos. | Cuando el AcHBc sea positivo y el AcHBs sea negativo o positivo. |
| Ac HBs | Exigible | Semestralmente | A la entrada en hemodiálisis y programado. |
| HIV | Exigible | Anual | A la entrada de diálisis y programado. |
Justificación
Todo enfermo que comienza tratamiento con hemodiálisis debe tener estudio serológico del VIH, virus de la hepatitis C (preferiblemente mediante PCR-VHC cualitativa y Ac-VHC) y frente al virus de la hepatitis B (como mínimo AgHBs, AcHBs y AcHBc) con la finalidad de ser filiado frente a dichos virus y poder plantear tratamientos, aislamiento o vacunación frente al VHB en los pacientes candidatos42,287,288.
Vigilancia enzimática y serológica
VIH: aunque no son exigibles estudios posteriores, serían conveniente las determinaciones anuales42.
VHC: considerar la infección por VHC es esencial para identificar la transmisión en las unidades de hemodiálisis. Los CDC y las guías KDIGO 2018 recomiendan que a todos los pacientes en hemodiálisis de mantenimiento se les debe determinar los niveles de anti-VHC y ALT al momento de la admisión42.
Los Ac anti-VHC se determinarán semestralmente y la ALT mensualmente en pacientes susceptibles de ser infectados.
En todo paciente en hemodiálisis debe determinarse, al menos cada seis meses, los Ac frente al VHC mediante ELISA de 3.a generación y/o PCR cualitativa (preferentemente esta última). La frecuencia de esta determinación debería ser cada tres meses en las unidades de riesgo aumentado: 1) prevalencia > 20% del total; 2) relación enfermera/paciente superior a 1/4 en unidades sin aislamiento por sala o por turno; 3) unidades con tres o más turnos; 4) unidad en la que se haya detectado una seroconversión al VHC, y mensual en los pacientes que presenten aumento de enzimas hepáticas.
En los pacientes con PCR cualitativa positiva para el VHC se debe determinar la carga viral y el genotipo del VHC para completar el estudio y filiación de la infección289.
VHB: se deberán determinar los Ac-HBs y Ac-HBc en todos los pacientes de la unidad, al menos, una vez al año42.
Los pacientes deberían ser vacunados previo al inicio de HD (etapa prediálisis). Si no se ha iniciado o completado la vacunación de VHB al inicio de HD, debe realizarse lo antes posible. Se ha de evaluar la eficacia de la vacunación en todos los pacientes289.
Se debería determinar la carga viral a todos los AcHBc positivos, independientemente de los niveles de AcHBs, al inicio de la HD y después trimestralmente, ante el riesgo en esta población de reactivación de un VHB e un paciente con VHB oculto290.
Enzimas hepáticas: en todo paciente en hemodiálisis deben determinarse, como mínimo cada dos meses, las enzimas hepáticas GPT y GGT. Es aconsejable que esta determinación sea mensual, sobre todo en unidades con riesgo aumentado42,289.
Situaciones especiales:
- •
Ante toda seroconversión al VHC deben determinarse enzimas hepáticas cada mes y anticuerpos y PCR a todos los pacientes de la unidad mensualmente durante el periodo ventana (seis meses).
- •
En los pacientes con infección resuelta por VHC que hayan sido tratado con los últimos retrovirales se recomienda la determinación de la PCR-VHC cada seis meses291,292.
Ver dosificación de diálisis.
Iones y equilibrio ácido-baseRecomendación
| Parámetro de medición | Nivel de exigencia | Periodicidad recomendada | Indicaciones |
|---|---|---|---|
| Potasio | Exigible | Mensual | Programado |
| Sodio | Exigible | Cada 2 meses | Programado |
| Magnesio | Exigible | Cada 2 meses | Programado |
| Bicarbonato o CO2 Total | Exigible | Cada 2 meses | Programado |
| Potasio post hemodiálisis | Recomendable | Cada 2 meses | Programado |
| Bicarbonato posthemodialisis | Recomendable | Cada 2 meses | Programado |
Justificación
La composición del dializado es un aspecto crítico de la prescripción de hemodiálisis. A pesar de esto, se carece casi por completo de datos de ensayos clínicos que nos ayuden a guiar la composición óptima del dializado. A menudo, las concentraciones de los componentes clave se eligen de forma intuitiva, y la composición del dializado se puede determinar de forma predeterminada según las especificaciones del fabricante del dializado o las prácticas de las instalaciones de hemodiálisis. Recientemente se ha hecho hincapié en la importancia de seleccionar el contenido en bicarbonato, calcio, magnesio y potasio del dializado293.
Los niveles de bicarbonato en suero tanto altos como bajos se asocian con un mayor riesgo de mortalidad en pacientes que reciben hemodiálisis. Recientemente ha surgido preocupación con respecto al dializado con alto contenido de bicarbonato y la alcalemia inducida por diálisis, pero se necesitan más estudios para determinar el objetivo óptimo en este momento. El tratamiento óptimo puede requerir el conocimiento de los parámetros ácido-base tanto antes como después de la diálisis, con decisiones de tratamiento individualizadas que sopesan los riesgos de la acidosis prediálisis, la alcalinización intradialítica rápida y la alcalosis posterior a la diálisis al tiempo que explican las comorbilidades de un paciente. En la práctica clínica no está del todo claro cuándo intervenir, ya que la variabilidad dentro de un paciente individual puede obstaculizar la toma de decisiones clínicas. Un artículo reciente ha propuesto una solución novedosa para minimizar la alcalosis intradialítica mientras aún se trata adecuadamente la acidosis. La premisa subyacente es que la expansión de la reserva de bicarbonato de plasma en la primera parte de un tratamiento de diálisis genera un gradiente que es suficiente para llenar los tampones intracelulares. La administración adicional de álcali causa alcalosis, pero no tiene un efecto importante en los almacenes de tampón. Por lo tanto, el bicarbonato de dializado alto es útil inicialmente, pero luego es perjudicial, y el bicarbonato de dializado debe disminuirse progresivamente durante el resto del tratamiento de diálisis. Se necesita más trabajo para determinar la utilidad de esta maniobra, así como el enfoque de modelado de dializado específico, ya que esta es una propuesta interesante294–296.
Un número creciente de estudios observacionales han descubierto la relación entre los niveles séricos más bajos de magnesio y la peor supervivencia de los pacientes en hemodiálisis. El magnesio modula la patogénesis de los trastornos óseos y minerales y podría proporcionar un nuevo enfoque terapéutico para la calcificación vascular. Se requieren nuevos estudios de intervención que deben aclarar si la suplementación con magnesio y/o el aumento de la concentración de magnesio en el dializado mejora el pronóstico de los pacientes en hemodiálisis. Se ha demostrado que la mayoría de los pacientes en hemodiálisis hacen balance negativo de magnesio durante la misma297–300.
Uno de los objetivos fundamentales de la prescripción de HD es mantener los niveles séricos de potasio dentro de un rango normal estrecho durante los intervalos intradialítico e interdialítico. Mientras que el rango normal para los niveles séricos de potasio se informa típicamente entre 3,5 y 5,0 mEq/L en la población general, el rango óptimo de concentración de potasio en pacientes en diálisis es mayor y diversos estudios establecen entre 4 y 5,5 mEq/L es el rango de menor mortalidad.
Teniendo en cuenta la tasa extraordinariamente alta de mortalidad cardiovascular en la población en hemodiálisis, es fundamental optimizar el manejo del potasio en pacientes en HD, lo que implica reducir los grandes cambios intradialíticos de potasio y proporcionar una eliminación adecuada de potasio para minimizar la hiperpotasemia. El perfil de potasio en el dializado es un enfoque que puede lograr ambos objetivos manteniendo un gradiente de potasio dializado sérico constante al proporcionar potasio dializado por separado de otros componentes del dializado y disminuir gradualmente la concentración de potasio en el dializado a medida que los niveles de potasio sérico caen.
Debido a que existe evidencia de que el mayor riesgo asociado con el dializado potásico se encuentra entre los pacientes para los cuales existe una aparente falta de coincidencia entre el suero y el dializado (es decir, el uso de dializado potásico < 2 mEq/L para pacientes con potasio ≤ 5 o el uso de dializado potásico > 3 para pacientes con K ≥ 5), es fundamental que la prescripción de potasio en el dializado se revise y ajuste regularmente en respuesta a los niveles de potasio en suero de prediálisis, particularmente durante los períodos vulnerables donde los niveles de potasio en suero pueden alterarse de manera aguda, como después de la hospitalización267,301,302.
El sodio sérico (natremia) en los pacientes en hemodiálisis no muestra un valor constante, aunque tiene una variación baja, y es necesario corregirla para la glucemia. El coeficiente de variación del sodio es mayor en diabéticos, en quienes la natremia es más baja. Se ha demostrado que existe una falta de asociación de la natremia con la situación de volumen, lo que apoya la necesidad de una individualización del aporte de sodio y sal durante la sesión de hemodiálisis. Para lograr una sesión de HD isonatrémica, la concentración de sodio en el dializado debe coincidir aproximadamente con el sodio sérico del paciente, y todo el sodio obtenido en el período interdialítico debe eliminarse por convección. La concentración sérica de sodio pre-HD se puede utilizar como referencia para la prescripción de sodio en el dializado en la HD crónica303–305.
Nos parece recomendable incluir la determinación periódica de estos valores pre y post hemodiálisis en la práctica clínica, para poder individualizar los tratamientos, y debido a la variabilidad de alguna de las determinaciones, como el bicarbonato, es necesario determinarlos con frecuencia, por lo que sugerimos determinaciones cada 2 meses.
Observaciones: para que los resultados de la gasometría venosa sean válidos se recomienda que la muestra sea tomada anaeróbicamente evitando formación de burbujas a temperatura de 2-8 °C; es decir transportados en hielo, o realizar la medición a los 15 minutos de la extracción286–299.
Riesgo cardiovascularRecomendación
| Parámetro de medición | Nivel de exigencia | Periodicidad recomendada | Indicaciones |
|---|---|---|---|
| Colesterol total, C-LDL, C-HDL, triglicéridos | Exigible | Al inicio y anual. En enfermos tratados con estatinas u otros fármacos antilipemicos siempre que se modifique la dosis. | Programado |
| Glucemia | Exigible | Cada 2 meses | Programado |
| Hemoglobina glicosilada | Exigible | Cada 6 meses | En pacientes diabéticos |
| Troponina T | Recomendable | Anual | Programado |
Justificación
Con las nuevas evidencias respecto al manejo de los lípidos en los pacientes renales, las guías KDIGO de manejo de los lípidos en ERC publicadas en 2013, recomiendan la evaluación del perfil lipídico (colesterol total, colesterol LDL, colesterol HDL, triglicéridos) a todo paciente incluido en hemodiálisis (1C); sin embargo, no recomienda la determinación rutinaria de estos en la mayoría de los pacientes (no graduado)306–309.
Diversos estudios han demostrado que la prevalencia de enfermedad cardiovascular en los pacientes en diálisis es muy elevada y la mortalidad por esta causa es 10-30 veces más frecuente que en la población general. En la población general, existe una relación clara entre el colesterol LDL y los principales eventos ateroscleróticos. Sin embargo, en pacientes con ERC, el colesterol LDL muestra una asociación negativa con estos resultados a niveles de colesterol LDL inferiores a la media y una asociación plana o débilmente positiva con la mortalidad a niveles más altos de colesterol LDL. En general, los datos disponibles sugieren que la reducción del colesterol LDL es beneficiosa para la prevención de eventos ateroscleróticos importantes en pacientes con ERC y en receptores de trasplante de riñón, pero no es beneficiosa en pacientes que requieren diálisis310,311.
Así, en adultos en hemodiálisis, KDIGO recomienda evitar el inicio de estatinas o combinaciones de estatinas/ezetimibe; sin embargo, no se recomienda suspender el tratamiento en pacientes en diálisis que ya reciben estatinas o combinaciones de estatinas/ezetimibe312.
Estas recomendaciones se basan en varios ensayos que incluyen 4D (Die Deutsche Diabetes Dialyse)313, AURORA (un estudio para evaluar el uso de rosuvastatina en sujetos en hemodiálisis) y análisis de subgrupos de SHARP304753314.
Varios estudios epidemiológicos apuntan a que este mayor riesgo cardiovascular no se explica únicamente por la elevada prevalencia de factores de riesgo o de enfermedad cardiovascular, por lo que se ha invocado el papel de los factores o marcadores de riesgo emergentes (lipoproteína-a, hiperhomocisteinemia, hiperfibrinogenemia, inflamación, etc.), cuya prevalencia en la población en hemodiálisis es elevada. Consideramos que su determinación de rutina en los pacientes en diálisis todavía no puede ser recomendada de manera general por la falta de evidencia en pacientes en hemodiálisis, sus efectos paradójicos en esta población y la ausencia de tratamientos específicos eficaces315–317.
Las personas con diabetes en hemodiálisis son altamente vulnerables, con comorbilidades complejas y tienen un alto riesgo de resultados cardiovasculares adversos. En particular, los pacientes con un control glucémico deficiente son susceptibles a diversas influencias, lo que lleva a una mayor fluctuación en la glucosa plasmática, con un mayor riesgo de hiperglucemia e hipoglucemia. Dado que la hipoglucemia puede llevar a un peor pronóstico y calidad de vida, es necesario controlar los niveles de glucosa en plasma con el objetivo de mejorar el pronóstico y evitar la hipoglucemia. Por otra parte, la hiperglucemia prolongada conduce a una glucosilación no enzimática de las proteínas y produce productos Amadori, como la albúmina glicada (GA) y la hemoglobina glucosilada (HbA1c). La utilidad de la HbA1c en el contexto de la enfermedad renal crónica (ERC) puede ser problemática debido a la alteración de la vida útil de los glóbulos rojos, el uso de hierro y/o la terapia con eritropoyetina, la uremia, etc., e infraestimar el control de la glucemia. Por lo tanto, se ha sugerido la GA como un marcador alternativo, como un índice glucémico más confiable y sensible en pacientes con ERC. Además de la concentración media de glucosa en plasma, la GA también refleja la glucosa en plasma posprandial y la excursión glucémica. Además, con una vida media de aproximadamente 2-3 semanas, la GA puede reflejar el estado de la glucosa en sangre más rápidamente que la HbA1c. La GA también es un precursor temprano de los productos finales de la glicación avanzada (AGE), que causan alteraciones en diversas proteínas celulares y orgánulos. Parece razonable determinar la HbA1c o preferentemente la GA en pacientes diabéticos al menos dos veces al año318–320.
La troponina en concentraciones elevadas se asocia con un peor pronóstico cardiovascular a largo plazo en pacientes con insuficiencia renal severa. Las concentraciones elevadas de troponina T han ofrecido mejores resultados que la troponina I, probablemente porque identifica de forma más específica el daño miocárdico menor y la coronariopatía silente. Por otra parte, la troponina T ha mostrado estar asociada, de forma independiente, con el grado de severidad de calcificaciones de arterias coronarias en pacientes asintomáticos en hemodiálisis. Por tanto, además de los marcadores clásicos de riesgo cardiovascular deberían incluirse como nuevos marcadores válidos los niveles elevados de proteína C reactiva y de troponina T. Por otra parte, los pacientes en diálisis tienen niveles anormalmente elevados de troponina T con respecto a población general, por lo que disponer de una valor anual puede ayudar a interpretar los resultados ante un evento agudo321–323.
NutriciónRecomendación
| Parámetro de medición | Nivel de exigencia | Periodicidad recomendada | Indicaciones |
|---|---|---|---|
| Proteínas totales y albúmina | Exigible | Bimestral | Programado |
| Prealbúmina | Recomendable | Bimestral | Programado |
| Colesterol | Recomendable | Semestral | Programado |
| Creatinina | Exigible | Bimestral | Programado |
| nPCR | Exigible | Bimestral | Programado |
Justificación
La malnutrición es común en los pacientes en diálisis y está íntimamente relacionada con la morbilidad y mortalidad. La valoración del estado nutricional y su tratamiento en los pacientes en diálisis, juegan un papel primordial en la práctica clínica habitual. El estado nutricional en el paciente en hemodiálisis se debe monitorizar periódicamente para identificar precozmente un estado de desnutrición-inflamación y tomar las medidas oportunas324–326.
No existe un marcador único del estado nutricional, y su interpretación es compleja y está influenciada por muchos factores de la diálisis, por lo que su valoración se debe basar en la combinación de varios parámetros bioquímicos y físicos, teniendo en cuenta las limitaciones de cada uno de ellos. Dentro de los parámetros de laboratorio más utilizados para la valoración rutinaria del estado nutricional, están las concentraciones de albúmina, pre-albúmina, transferrina y colesterol; la proteína C reactiva permite identificar condiciones comórbidas inflamatorias, y ayuda a interpretar los niveles séricos de albúmina y prealbúmina y la nPCR es un marcador indirecto de la ingesta de proteínas327–329.
La albúmina es el parámetro bioquímico más utilizado como marcador nutricional, ya que es una determinación que está al alcance de cualquier laboratorio. La hipoalbuminemia se ha definido como predictor de mortalidad en los pacientes con insuficiencia renal; sin embargo, también tiene detractores, y algunos autores como Steinman en Seminars in Dialysis de 2000, recomendaba que los niveles de albúmina fueran eliminados como indicador de malnutrición en el paciente renal. El problema es que puede descender por otras razones (como reactante de fase aguda, por la expansión de volumen plasmático, por redistribución, por pérdida exógena y por disminución en su síntesis) y su valor varía de unos laboratorios a otros según la técnica empleada para su determinación330,331.
Otra posible determinación de estado nutricional es la prealbúmina, cuya vida media es más corta que la de la albúmina, se correlaciona estrechamente con el estado nutricional y es un buen predictor pronóstico. Tiene el inconveniente de que existe un gran solapamiento entre pacientes nutridos y malnutridos; sin embargo, es posible que en un futuro sea un marcador adicional de rutina en los pacientes en diálisis332.
Otros parámetros bioquímicos adicionales, cuyos niveles bajos indican desnutrición y mal pronóstico, son la creatinina y el colesterol total. Los niveles bajos de creatinina prediálisis suelen estar asociados con una reducida masa muscular y son un factor de mal pronóstico. El colesterol sérico total es menos sensible como marcador nutricional330.
La nPCR puede ser infraestimada por influencia de la permeabilidad del dializador; la cantidad de sangre, el flujo del dializado; y la distribución de urea en pacientes obesos, desnutridos o edematosos. En contraste, la nPCR puede ser sobreestimada por el posterior rebote de urea después de la diálisis333–335.
OtrosEn las unidades de hemodiálisis existen pacientes que, además de la insuficiencia renal, presentan otras patologías concomitantes que requieren seguimientos y monitorización especial. A continuación describimos las más frecuentes.
Recomendación
| Parámetro de medición | Nivel de exigencia | Periodicidad recomendada | Indicaciones |
|---|---|---|---|
| Hormonas tiroideas (TSH) | ExigibleRecomendable | SemestralmenteAl inicio y actualmente | En pacientes en tratamiento con amiodarona o con eutirox programado. |
| Beta 2 microglobulina | Optativo | Anual o cuando se realice un cambio de técnica de hemodiálisis (paso a HDF-OL) o se modifique la misma (cambio de dializador, aumento del tiempo, etc.). | Programada |
| Coagulación | Optativo | Anual | Programado |
| Exigible | A demanda (mínimo cada mes). | En pacientes anticoagulados. |
Justificación
La prevalencia de disfunción tiroidea en los pacientes que reciben amiodarona como fármaco antiarrítmico es alta, y a estos pacientes se les debería monitorizar periódicamente los niveles de hormonas tiroideas. Por otra parte, se ha descrito una asociación entre síndrome de enfermedad eutiroidea y mortalidad en pacientes en hemodiálisis.
Se ha propuesto la evaluación regular de la función tiroidea como marcador de riesgo cardíaco en esto pacientes. La amiodarona incrementa el T4 libre, disminuye el T3 libre y transitoriamente incrementa la hormona tiroidea (TSH), y otras veces la hace indetectable. La amiodarona puede inducir a) hipotiroidismo, diagnosticado por bajos niveles de T4 libre y que deben ser tratados con l-tiroxina; b) tirotoxicosis, diagnosticada por niveles elevados de T3 total o libre. Estas alteraciones se excluyen con una TSH normal, controlada dos veces al año336–340.
- •
La beta-2 microglobulina se encuentra elevada en la mayoría de los pacientes de hemodiálisis. En la actualidad no parece existir un tratamiento de utilidad, excepto el transplante renal, que pueda frenar la progresión de la amiloidosis por beta-2 microglobulina o proporcionar alivio sintomático. Las guías DOQI no recomiendan las mediciones de niveles séricos de beta-2 microglobulina (evidencia C). A pesar de ello se ha demostrado un descenso de la beta-2 microglobulina en pacientes dializados con técnicas de alto flujo, por lo que sería deseable su monitorización341,342.
- •
Pacientes con vasculitis: la mayoría de las formas de vasculitis (excepto la vasculitis inducida por hipersensibilidad a fármacos) pueden recidivar. En estos pacientes está indicada la monitorización prolongada y para ello se han utilizado diferentes tests de laboratorio, la mayoría de los cuales son relativamente inespecíficos, como la velocidad de sedimentación globular o la PCR, lo que limita su utilidad. Una vez inducida la remisión, se ha sido sugerido que un aumento de niveles plasmáticos de ANCA, es altamente predictivo de recidiva en pacientes con granulomatosis de Wegener. Sin embargo, la falta de uniformidad al respecto hace que sea más importante la monitorizacion de signos clínicos de enfermedad activa343,344.
Se recomienda que, para evitar la duplicidad de pruebas y que haya pacientes a los que no se les soliciten las pruebas cuando corresponden, a finales de año (septiembre) se aplique un control de las pruebas complementarias realizadas durante el año en curso y se soliciten las pruebas que faltan por pedir.
| Parámetro de medición | Periodicidad | Indicaciones | Nivel de exigencia |
|---|---|---|---|
| Electrocardiograma (ECG) | Anual | A su entrada a HDProgramadoA demanda | Exigible |
| Radiografía de tórax | Anual | ProgramadoA demanda | Exigible |
| Fondo de ojo | Anual | En diabéticosA demanda | Recomendable |
| Ecografía abdominal | AnualCada 2 años | A su entrada a HDPacientes con menos de 5 años de HDPacientes con más de 5 años en HD | ExigibleRecomendableExigible |
| Densitometría | Cada 2 años | A su entrada en HDprogramada | RecomendableRecomendable |
| Ecocardiografía | AnualA demanda | Al inicio de programa de HDProgramado en paciente sin patologíaProgramado en paciente con patología cardiaca | ExigibleRecomendableExigible |
| TAC helicoidal o angioresonancia | Anual | En pacientes incluidos en lista de espera de tx renal (basal)Programado | ExigibleRecomendable según listas de Tx |
| Revisión ginecológica | Anual | Mujeres entre 50 y 65 años | Exigible |
| Bioimpedancia | Cada 6 meses | A su entrada en HDProgramado | Exigible |
| Rx lateral de abdomen | Cada 2 años | A su entrada en HDProgramado | ExigibleRecomendable |
Se utiliza de forma rutinaria para la detección de hipertrofia de ventrículo izquierdo, cardiopatía isquémica y alteración del ritmo.
Recomendación
Es aconsejable su realización con una periodicidad mínima de un año.
Cuándo: los ECG deben realizarse de forma rutinaria antes de la sesión de HD, para que no intervengan otros parámetros que puedan alterarlo. Existe controversia sobre la influencia que la HD tiene sobre el ECG; unos observan una mejoría del ECG tras la HD y otros sostienen en que la HD desencadena unos parámetros alterados.
Girgis et al.345 han visto que la HD produce una mejoría de los parámetros eléctricos, en la mayoría de los pacientes, posiblemente por la mejoría en los niveles de electrolitos y la pérdida de líquido, reduciendo la sobrecarga ventricular. Otros autores han visto cómo la HD alarga el intervalo QT independientemente de la corrección de electrolitos, con el consiguiente efecto arritmógeno; sin embargo, parece más prudente realizar el ECG antes de la HD, salvo que pretendamos realizar otros estudios que aconsejen lo contrario.
Se realizará el estudio pre y post HD si se pretenden determinar diferencias eléctricas, que nos indiquen riesgo cardiovascular.
Cómo: el ECG debe ser de 12 canales para poder determinar de una forma exacta la amplitud de los complejos QRS.
Razonamiento
El objetivo de disponer de una ECG anual es que sirva de referencia en cada paciente en condiciones basales que nos sirva como comparación, por lo que quedarán disponibles en un lugar de fácil acceso en el área de atención al paciente de hemodiálisis.
En el ECG debemos observar:
- •
Hipertrofia ventricular izquierda (HVI): el ECG es menos sensible pero más específico que en la mayoría de las poblaciones; sin embargo, es útil para detectar la HVI. La HVI medida por ECG es un marcador independiente de mortalidad cardiovascular.
- •
Isquemia: Nakamura et al.345 determinaron que el ECG intrahemodiálisis es útil para detectar isquemia. Los pacientes que sufran un descenso del ST mayor de 1mV con respecto al basal tiene una alta probabilidad de tener un evento cardiaco en 21 meses. De igual forma, la presencia de arritmias durante la sesión de HD se relaciona con isquemia miocárdica silente, por lo que se le debería realizar un estudio específico.
- •
Alteración del QT y QRS: la hemodiálisis alarga el QT, lo que favorece el desarrollo de arritmias ventriculares al final de la hemodiálisis o en el periodo inmediato. Existe un alargamiento del QRS tras la sesión de HD que se correlaciona con la pérdida de peso durante la diálisis. Estos parámetros y otros pueden ser usados como marcadores de riesgo de muerte cardiaca. Muchos autores usan la variación del QT antes y después de la HD como un buen marcador de mortalidad cardiovascular. Este valor es denominado dispersión del QT (QTd)7,18, y es influido por un baño bajo en calcio (1,25 mmol/L). El QTc (QT corregido para la frecuencia cardiaca) se define habitualmente como > 460ms en mujeres y > 450ms en hombres. El QT refleja alteración cardiaca de conducción y repolarización, isquemia miocárdica y enfermedad estructural cardiaca, y supone un aumento del riesgo de taquiarritmia. El QTc es un buen marcador de morbimortalidad.
- •
Arritmia y variación de la frecuencia cardiaca: detectar fibrilación auricular paroxística o establecida o arritmias supraventriculares, que se relacionan con un incremento de morbimortalidad.
Recientemente están tomando relevancia las variaciones de la frecuencia cardiaca como marcador de riesgo cardiovascular345–370.
Radiografía tóraxRecomendación
Se recomienda realizar una radiografía de tórax postero-anterior y lateral una vez al año. La radiografía de tórax se realizará siempre cuando el paciente se incorpore a programa de HD, como referencia inicial y de seguimiento posterior.
Razonamiento
El tratamiento dialítico se asocia a frecuentes complicaciones torácicas. Las más comunes son pleuritis, pericarditis, neumonía, osteodistrofia, infecciones, calcificaciones metastásicas y neoplasias primarias o metastásicas. En esta lista no se incluyen problemas específicos agudos como la sobrecarga de líquidos, que requieren una actuación específica y puntual, que requieran, igualmente, la realización de una radiografía de tórax.
La radiografía tórax servirá para detectar lesiones pulmonares, cardiacas, vasculares y óseas de una forma periódica que nos permita controlar la situación del paciente. Los hallazgos radiológicos, en la mayoría de los casos, ofrecen una aproximación diagnóstica rápida y no invasiva, con un alto índice beneficio/coste.
También tiene utilidad para verificar la posición de vías centrales y alteraciones venosas de las fístulas arteriovenosas371–375.
Fondo de ojoRecomendación
No se aconseja su realización de forma rutinaria, aconsejándose solo cuando exista una indicación por una patología concomitante específica que lo requiera.
Razonamiento
Las complicaciones oftalmológicas del enfermo urémico son múltiples (edema de papila, alteraciones vasculares, neuropatía isquémica…); sin embargo, estas patologías, salvo la retinopatía hipertensiva, son poco frecuentes y no precisan de un seguimiento periódico376.
Ecografía abdominalSu realización tiene como interés la detección precoz de cualquier posible malignización de los quistes renales adquiridos. Además, puede descartar otros procesos como neoplasias, patología vascular, ascitis, procesos hepáticos. Su realización es incruenta y aporta mucha información.
Recomendación
La realización será anual de forma voluntaria durante los primeros cinco años en HD. La realización será obligatoria y cada dos años en los pacientes que lleven más de cinco años en diálisis, y en aquellos que se encuentren incluidos en una lista de trasplante, así como siempre que exista hematuria o dolor en fosas renales. Si la ECO es negativa para quistes y masas, el riesgo de malignidad es bajo y la ecografía solo necesita ser repetida en tres a cinco años, a menos que haya síntomas (dolor o hematuria).
Razonamiento
El 22% de los pacientes en hemodiálisis presentan quistes adquiridos en el riñón. La enfermedad quística renal adquirida se desarrolla tras varios años en diálisis. Así,según Narasimhan et al.378, la presencia de esta enfermedad ocurre en aquellos pacientes que llevan una media de 49 meses en diálisis. A los 10 años, entre un 50-80% de los pacientes padecen esta patología. Los síntomas más frecuentes son hematuria, dolor en flanco, infección y litiasis. La realización de ECO de screening ha demostrado incrementar la supervivencia del paciente en diálisis, demostrando un aumento de 1,6 años en la esperanza de vida. Sin embargo, la población en diálisis tiene una esperanza de vida mucho más corta, por lo que el beneficio se mide en días y no es lo suficientemente grande como para justificar el cribado de toda la población de diálisis, pero sí en aquellos que lleven más tiempo.
La probabilidad de desarrollar un carcinoma renal secundario a la enfermedad quística adquirida varía según diferentes estudios entre un 2% a los 7 años y el 7% a los 10 años. Una revisión realizada por Truong et al.379 estima que la probabilidad de malignización de estos quistes es del 0,18% por año. En un análisis realizado por Denton et al.380, al analizar las nefrectomías realizadas durante el trasplante renal, observaron que el 4,2% de los pacientes presentaban un carcinoma renal en diferentes estadios. La mayoría de los casos se desarrollan entre los 8-10 años desde el comienzo de la terapia sustitutiva.
Para la realización de una determinación precoz de los procesos malignos se debe realizar un ECO o TAC anual a aquellos pacientes que llevan en diálisis más de cinco años. La prueba más eficaz en la detección de tumores renales no está determinada. El TAC con contraste es más sensible que la ECO para determinar estos quistes complicados, pero no es superior a la ecografía para detectar tumores sólidos. Actualmente el PET-TAC con c-colina es el método más exacto para diagnosticar este tipo de tumores.
Si la ECO es negativa para quistes y masas, el riesgo de malignidad es bajo y la ecografía solo necesita ser repetida en tres a cinco años, a menos que haya síntomas (dolor o hematuria)377–394.
DensitometríaRecomendación
Es aconsejable su realización al inicio del paciente en HD, y posteriormente dependiendo de las necesidades, pero con una periodicidad mínima de dos años.
Razonamiento
En pacientes en diálisis con evidencia de alteraciones minerales y óseas-enfermedad renal crónica (CKD-MBD) y/o factores de riesgo para la osteoporosis, sugerimos la realización de densitometría para evaluar el riesgo de fractura y los resultados pueden tener un impacto sobre el tratamiento. Hay cada vez más evidencias de que el contenido mineral del hueso medido por densitometría predice fracturas en el paciente en diálisis.
Se ha propuesto simplificar la categorización de la densidad ósea clasificando a los pacientes en dos grupos, a saber, aquellos con «baja densidad ósea» y aquellos con «densidad ósea normal/alta». Por lo tanto, un paciente puede tener una enfermedad ósea de alto recambio con densidad ósea normal/alta, o enfermedad ósea de bajo recambio con densidad ósea baja o normal/alta. También se propone la estandarización de las mediciones de densidad mineral ósea (DMO) se base en la puntuación Z (masa ósea ajustada por raza, edad y sexo) en oposición a la puntuación T (ajustada a la masa máxima de un adulto joven ajustado por sexo y raza). Una baja densidad ósea se definiría como una puntuación Z de −1 o menos, aunque estas últimas recomendaciones fueron controvertidas y no tuvieron la aprobación universal396–400.
EcocardiografíaRecomendación
Se realizará un ecocardiograma basal a la entrada en hemodiálisis. Salvo que sean necesarios con más frecuencia por presentar una patología cardiaca, se realizará un ecocardiograma una vez cada año para observar la evolución de miocardio, válvulas y pericardio. Si existe una patología cardiaca debe de ser realizada con una periodicidad variable según la disfunción y su gravedad, siendo decisión de Cardiología. La ecocardiografía puede indicarnos cardiopatías que exijan un tipo de diálisis concreto.
Razonamiento
El 50% de los pacientes en hemodiálisis mueren de causa cardiovascular. La mortalidad cardiovascular en el paciente en diálisis es 10-20 veces superior a la población sana.
La utilidad del ecocardiograma abarca tres aspectos. El control de la disfunción miocárdica, observar la función valvular y la situación pericárdica.
La disfunción miocárdica es común antes de entrar en diálisis; así, el 75% de los pacientes que se incorporan a programa de hemodiálisis tienen hipertrofia de ventrículo izquierdo. La miocardiopatía urémica se caracteriza por hipertrofia cardíaca, fibrosis cardíaca, alteraciones microvasculares y disfunción diastólica. Es específico para el paciente con enfermedad renal401-402. El diagnóstico se hace por ecocardiografía. En estos pacientes con HVI la masa ventricular en hombres mayor o igual a 134 o en mujeres mayor o igual a 110g/m2 de superficie corporal403.
El mal pronóstico de la HVI puede ser mejorado reduciendo la masa del VI hacia cifras normales. La corrección de la HTA, la sobrehidratación o de la anemia puede reducir la masa de VI parcial o completamente, mejorando el pronóstico del paciente.
En la ERC es usual que se presente enfermedad pericárdica, incluida pericarditis, derrame y pericarditis crónica constrictiva. La IRC puede producir un gran derrame pericárdico en el 20% de los pacientes con esta enfermedad. En hemodiálisis se ha descrito la pericarditis asociada a diálisis, que ocurre en un 13% de los pacientes. Se asocia a dos factores fundamentales: diálisis inadecuada y sobrecarga de líquido. El diagnóstico se hace por ECO y no debemos esperar a que padezca clínica, pues muchas veces pasa inadvertido. De hecho, en pacientes con hipotensión intradiálisis el 50% muestra derrame pericárdico, sin otra molestia404–407.
Las lesiones valvulares son frecuentes en los pacientes en diálisis408–415.
Las anormalidades más frecuentes incluyen engrosamiento valvular y anular, calcificación de alguna valva y signos de insuficiencia y estenosis. La ecografía con doppler es el método de diagnóstico de elección para detectar la presencia de valvulopatías. La ECO de dos dimensiones permite ver la anatomía de la válvula, estructura subvalvular, anillo y otras estructuras cardiacas. El eco doppler permite evaluar el grado de regurgitación/estenosis y el flujo dinámico. Un reciente metaanálisis indica que la calcificación vascular en el paciente en diálisis está asociada con mayor mortalidad por todas las causas, y la cardiovascular en concreto416. El número de válvulas cardíacas calcificadas se correlaciona con el riesgo de mortalidad. La detección de la calcificación valvular es beneficiosa para la estratificación del riesgo del paciente en diálisis417.
En los pacientes con enfermedad valvular conocida, las ecografías seriadas se recomiendan para seguir la progresión de la enfermedad418.
TAC helicoidal o angioresonanciaRecomendación
En los pacientes que son incluidos en lista de trasplante se realizará un TAC helicoidal o una angioresonancia del territorio iliaco a su incorporación a la lista. Con posterioridad se seguirán los diferentes protocolos existentes, que recomiendan realizar otro estudio cada seis meses o cada año.
Razonamiento
Las calcificaciones arteriales son comunes en los pacientes en hemodiálisis y se asocian a una mayor incidencia de patología cardiovascular. Los métodos más usados para evaluar estas calcificaciones son el TAC helicoidal419,420 y la angioresonancia421. Con estas técnicas podemos detectar calcificaciones iliacas, carotídeas y coronarias. Igualmente, su uso es de utilidad para determinar la posibilidad de realizar un injerto en una de las arterias iliacas, contraindicando el trasplante en los pacientes en los que no se pueda llevar a cabo. Permite conocer dónde se puede realizar la anastomosis vascular antes de realizar el trasplante422.
La detección precoz de estas calcificaciones por técnicas no invasivas nos permite modificar las actuaciones médicas, con el fin de reducir su progresión, minimizando el riesgo cardiovascular423.
Revisión ginecológicaRecomendación
En las pacientes entre 50 y 65 años se realizará una revisión ginecológica anual según las recomendaciones ginecológicas para la población general. El nefrólogo tiene que asegurarse que siguen los programas de detección de cáncer de mama, cérvix y útero.
Razonamiento
Estos pacientes tienen una alta incidencia de patología tumoral ginecológica, especialmente de cérvix y endometrio424–427.
BioimpedanciaRecomendación
Es aconsejable su realización al iniciar la HD en el paciente, y posteriormente dependiendo de las necesidades, pero con una periodicidad mínima de seis meses.
Cuándo: la bioimpedancia debe realizarse de forma rutinaria antes de la sesión de HD, para que no intervengan otros parámetros que lo puedan alterar. Existe una influencia de la HD sobre la bioimpedancia, y siempre en reposo media hora.
Se realizará el estudio evolutivo de la bioimpedancia durante el tiempo.
Cómo: en reposo media hora, con una correcta colocación de los electrodos.
Razonamiento
La bioimpedancia es una herramienta que tiene una doble utilidad: el cálculo del peso seco428 y del estado nutricional del paciente429.
El cálculo del peso seco es un valor difícil de determinar, especialmente en las primeras sesiones de diálisis, que además se modifica con el tiempo. Tenemos que reevaluar periódicamente el peso seco del paciente, tanto por desnutrición como por incremento del estado nutricional. La bioimpedancia consigue diferenciar el estado de sobrehidratación y de contracción de volumen, teniendo en cuenta el estado nutricional. Se puede usar para ajustar el estado de hidratación con el fin de mantener la función renal residual430. Se pretende evitar las hipotensiones en hemodiálisis, como los episodios de insuficiencia cardiaca. Este control ayuda a controlar la presión arterial.
En el análisis del estado nutricional, determina el contenido de masa grasa y masa magra o muscular. Los pacientes en diálisis pueden tener un índice de masa corporal normal, y estar mal nutridos y obesos, por predominio de la masa grasa431.
Este dato nos permite orientar el tratamiento nutricional y tiene relación con la morbimortalidad. Los datos obtenidos con la bioimpedancia no se deben usar como un valor objetivo independiente para determinar el peso seco del paciente, sino que se debe utilizar conjuntamente con una valoración clínica del estado de hidratación del enfermo432,433.
RX lateral de abdomenRecomendación
Es aconsejable su realización al inicio del paciente en HD, y posteriormente dependiendo de las necesidades, pero con una periodicidad mínima de dos años.
Razonamiento
La radiografía lateral simple de abdomen es una prueba sencilla para determinar la existencia de calcificación vascular. Se basa en el índice de Kauppila434 testado como marcador de mortalidad435.
Su determinación sirve para orientar diferentes tratamientos del metabolismo mineral, pero también como un indicador pronóstico. La realización protocolizada periódica permite observar la progresión de la calcificación vascular436,437. La progresión debe de variar las diferentes pautas de diálisis y terapéuticas con el fin de controlarla, pues se correlaciona además con calcificación de las arterias coronarias.
Atención de los pacientes de forma transitoriaLas Unidades de Diálisis deben disponer de un procedimiento elaborado de admisión y remisión de los pacientes, que establezca: la coordinación con otros niveles u organizaciones, los procedimientos para la remisión a otros niveles o centros, la definición de las características de los pacientes aceptables y no aceptables por la organización y los criterios de idoneidad para la admisión. Esta información debería ser pública y accesible por internet. Para solicitar la atención sanitaria de diálisis, de forma temporal se deberá cumplimentar una solicitud por escrito, que se enviará al Centro de Diálisis (CD) de destino, acompañada de los informes clínicos pertinentes. Esto no excluye que se puedan realizar contactos previos, telefónicos o por correo electrónico, para informarse si las capacidades del CD cumplen los requisitos, así como su disponibilidad en las fechas solicitadas. En el Anexo 3 se aporta un modelo de solicitud, que incluye todos los datos necesarios para la evaluación de la propuesta. Esta solicitud deberá ir firmada por el paciente y por uno de sus médicos responsables. Se establecen los modelos de historia clínica médica y de enfermería que deben acompañar a la solicitud, Anexos 4 y 5. Se describen: la forma de canalización de la solicitud e información, tipo de respuesta, circunstancias especiales de los pacientes en lista de espera para trasplante, elementos a aportar en el momento inicial de la prestación, elementos a recibir en el momento inicial de la prestación, informe de la asistencia prestada y sus incidencias. En el Anexo 6 se aporta un modelo de respuesta a la solicitud.
IntroducciónUn objetivo primordial del sistema sanitario debe ser la mejora de la calidad de vida de los pacientes. Dentro de la calidad de vida de los pacientes está la posibilidad de viajar y de recibir asistencia sanitaria en el punto de destino de forma segura. Esta necesidad incluye a los pacientes de HD. La asistencia que se presta al paciente debe considerarse como parte de un sistema integrado de lugares, servicios, profesionales sanitarios y niveles de asistencia, que garantice la continuidad asistencial en iguales condiciones que en el centro de origen, esto es, la adecuación entre las necesidades del paciente y el tipo de servicio integral que se le ofrece. La organización garantiza el acceso de los pacientes,al tipo adecuado de asistencia, con base en los resultados de sus procedimientos de evaluación, que tienen en cuenta las necesidades del paciente, el lugar apropiado de asistencia y las capacidades del centro. El paciente que acude al establecimiento en demanda de atención sanitaria, debe ser evaluado de forma personalizada en sus aspectos físico, psicológico y social. Partiendo de esta evaluación, se establece un primer diagnóstico y en consecuencia con él un plan asistencial. El establecimiento determinará las actuaciones acordes con dicho plan, teniendo en cuenta sus posibilidades y limitaciones con el fin de poder recurrir a soluciones alternativas, que en todo caso garanticen el adecuado cumplimiento del objetivo asistencial. La organización debe disponer de un procedimiento elaborado de admisión y remisión de los pacientes que establezca: la coordinación con otros niveles u organizaciones, los procedimientos para la remisión a otros niveles o centros, la definición de las características de los pacientes aceptables y no aceptables por la organización, y los criterios de idoneidad para la admisión.
Para facilitar y mejorar la asistencia sanitaria de diálisis a los pacientes transeúntes es conveniente que a corto plazo se pueda contar con la cartera de servicios y criterios de admisión de pacientes transeúntes de todas las Unidades de Hemodiálisis de España. Esta información sería pública y accesible por internet. Esta información facilitaría la solicitud de una plaza de diálisis para un paciente específico. Otro aspecto a mejorar es la unificación de criterios asistenciales, como por ejemplo marcadores virales, técnicas especiales de diálisis, etc. Estos dos aspectos se deberían incluir en los pliegos técnicos de los conciertos de diálisis.
Forma de solicitudPara solicitar la atención sanitaria de diálisis, de forma temporal, se deberá cumplimentar una solicitud por escrito, que se enviará al CD de destino acompañada de los informes clínicos pertinentes por fax o correo electrónico. Esto no excluye que se puedan realizar contactos previos para informarse de la disponibilidad de plaza en las fechas solicitadas, así como las capacidades del CD para poder asumir pacientes con ciertas características concretas como serologías positivas, cuatro sesiones semanales, necesidad de transporte.
En el Anexo 3 se aporta un modelo de solicitud, que incluye todos los datos necesarios para la evaluación de la propuesta. Esta solicitud deberá ir firmada por el paciente y el médico solicitante.
Paralelamente, si se precisa atención sanitaria de diálisis en otra Comunidad Autónoma, se deberán realizar los trámites a través del Sistema de Información del Fondo de Cohesión (SIFCO).
Información clínica necesariaInforme clínico normalizado: médico y de enfermería.
La solicitud de asistencia sanitaria de diálisis temporal (Anexo 3) se acompañará de un informe clínico médico y otro de enfermería. En el Anexo 4 y 5 se incluyen modelos de los informes médico y de enfermería. Se debe aportar información de todos los apartados que se enumeran. La fecha de los informes tendrá una antigüedad máxima de un mes y en el caso de las serologías víricas, una antigüedad máxima de tres meses.
Canalización de la solicitud e informaciónLos Centros y Unidades de Hemodiálisis (CD) contarán con un listado de los CD de España y tendrán acceso a información de los CD de otros países, para poder dirigir la solicitud directamente. Las Asociaciones de Enfermos y la Administración Sanitaria también deben colaborar en esta tarea, como agentes intermediarios. Se considera aconsejable la existencia de un catálogo de prestaciones de cada uno de los CD.
Tipo de respuestaLos CD deberán contestar por escrito (fax o correo electrónico), a la mayor brevedad a las solicitudes formales, considerándose como óptimo que la respuesta se realice en quince días hábiles. El CD informará de los requisitos administrativos, posibilidades de transporte sanitario y trámites necesarios, así como los mecanismos para continuar el tratamiento con fármacos de dispensación hospitalaria. En caso de que el CD no cumpla con algunos de los requisitos o necesidades del paciente, así lo deberá informar, aportando alternativas de asistencia si las hubiere. En el Anexo 6 se facilita un modelo de respuesta.
Pacientes en lista de espera para trasplante renalLos pacientes en lista de espera para trasplante renal contarán con algún sistema de localización inmediata durante el desplazamiento, por si surge un riñón en su área de origen. Además, deberán contar con información detallada de los medios de transporte más rápidos para volver a su Hospital de referencia. En caso de que esto no sea posible o si el paciente no lo desea, lo comentará antes de su partida para quedar momentáneamente en Contraindicación Temporal. Estos aspectos serán informados al paciente y serán de su responsabilidad.
Elementos a aportar en el momento inicial de la prestación- •
Información clínica (informes médico y de enfermería recientes: fecha inferior a un mes).
- •
Requisitos administrativos (según las especificaciones del punto de destino).
- •
Requisitos de transporte (según las especificaciones del punto de destino).
- •
Medicación (según las especificaciones del punto de destino).
- •
Se recomienda aportar una fotocopia de un ECG reciente.
Medios de comunicación urgente y convencional con el CD: el CD de destino aportará al paciente la forma y las personas de contacto para la asistencia en caso de urgencia (Centro u Hospital de referencia).
Informe de la asistencia prestada y sus incidenciasAl terminar el periodo de asistencia transitoria, el CD de destino remitirá un informe clínico en el que deben constar: las incidencias ocurridas, las asistencias de Urgencia (en su caso), la tolerancia a las diálisis, los resultados analíticos relevantes, los cambios de tratamiento, y toda aquella otra información que el médico y/o la enfermera del CD consideren que puedan ser de interés para el paciente y el personal sanitario de su CD de origen. Informe clínico médico y de enfermería.
Inclusión en lista de espera para trasplante renalRelación entre la unidad de nefrología sin trasplante y el centro de hemodiálisis con la unidad de trasplante renalJustificación
La mejor efectividad del programa de trasplante renal (TR) se conseguirá si hay una coordinación entre los diferentes niveles de atención a los pacientes renales. Es muy importante que cada nivel asistencial conozca y cumpla sus responsabilidades asistenciales en un marco de coordinación y colaboración. Las Unidades de Nefrología sin trasplante, los Centros de Hemodiálisis y las Unidades de Trasplante Renal (UTR) identificarán en cada caso el nivel específico de participación en la preparación y seguimiento de los pacientes para TR.
Es importante la preparación para el TR antes de iniciar diálisis, dado que los resultados son mejores si el trasplante es en fase de prediálisis o cuanto menor es el tiempo de espera en diálisis438. Además, la preparación para el TR en la fase de prediálisis puede facilitar una mayor donación de vivo, que debe ser una opción prioritaria cuando existe esa posibilidad.
Recomendaciones
- a)
Las Unidades de Nefrología sin trasplante y los Centros de Hemodiálisis deberán establecer una relación de colaboración y coordinación con las UTR para facilitar la inclusión y seguimiento de los pacientes con deterioro progresivo e irreversible de la función renal con filtrado glomerular estimado (eFG) < 15mL/min/1,73 m2 en la lista de espera de TR. Cada Unidad de Nefrología sin trasplante renal y cada Centro de Hemodiálisis deberá disponer de una o varias UTR de referencia con las que colaborar y poder remitir a los pacientes.
- b)
Corresponde a las UTR la responsabilidad de la inclusión de un paciente en la lista de espera para el TR de donante cadáver. Las UTR remitirán periódicamente (al menos cada seis meses) a las Unidades de Nefrología sin trasplante y a los Centros de Hemodiálisis el estado de situación de sus pacientes en relación con la lista de espera para TR. Es esencial la comunicación fluida entre ambos niveles asistenciales centrada en las necesidades de los pacientes.
Justificación
La supervivencia y la calidad de vida de los pacientes trasplantados es mejor que en diálisis a igualdad de edad y condiciones de comorbilidad, tanto a corto como a largo plazo439, por lo que debe promoverse activamente.
La historia clínica de los candidatos a trasplante debe ser cuidadosamente evaluada antes de ser descartados definitivamente para el trasplante. Así, pacientes con historia previa de infecciones crónicas, cáncer, enfermedades gastrointestinales, hepatitis vírica, infarto de miocardio o artropatía periférica no siempre representan una contraindicación absoluta. Si el paciente inicialmente es descartado para trasplante hay que tener presente las dificultades de una posterior reevaluación, dado que la larga permanencia en diálisis es un factor de riesgo independiente de mal pronóstico para el trasplante. No obstante, esa reconsideración posterior siempre es una opción que debe permanecer abierta.
La tasa de mortalidad anual en lista de espera es del 5-10%. Estudios de registros han identificado factores de riesgo para dicha elevada mortalidad (edad > 50 años, catéter como acceso para hemodiálisis, índice de Charlson > 3, inactividad física, enfermedad vascular periférica o retrasplante)440–443.
En ocasiones es importante realizar una evaluación psicológica en pacientes en quienes existen dudas acerca del cumplimiento terapéutico, dado que una vez trasplantados el no cumplimiento terapéutico implicará el fracaso del injerto renal. Una historia de intentos de suicidio, pobre cumplimiento de la medicación, psicosis, disfunciones cognitivas o abusos de alcohol o drogas son contraindicaciones relativas para el TR.
Recomendaciones
- a)
Todos los pacientes en diálisis o con eFG < 15mL/min/1,73 m2 deberían ser considerados potenciales candidatos para TR si no hay contraindicaciones absolutas, dado que el TR ofrece una mayor calidad y esperanza de vida que la diálisis.
- b)
Las condiciones que incrementan el riesgo de morbi-mortalidad en el postrasplante deberán ser valoradas cuidadosamente antes de ser consideradas como contraindicaciones absolutas.
- c)
La identificación de pacientes con elevado riesgo de mortalidad durante su permanencia en lista de espera puede ayudar a implementar estrategias para priorizar el trasplante.
- d)
La evaluación psicológica para los candidatos a TR puede ser útil para valorar la capacidad de cumplimiento del futuro tratamiento inmunosupresor, dado que el pobre cumplimiento se asocia con una peor supervivencia renal.
Justificación
El consentimiento informado es un derecho de los pacientes y una obligación de los profesionales sanitarios que está determinado por la legislación vigente en España en materia sanitaria. Es necesario articular una forma efectiva para aplicar el consentimiento informado al TR. Este consentimiento informado para el estudio con el fin de inclusión en lista de espera es responsabilidad de las Unidades de Nefrología y los Centros de Hemodiálisis, si bien el consentimiento informado final para proceder al implante renal debe realizarse en la UTR. Todos los centros deberían disponer de un programa de información y de registro de la actividad informativa aplicada a los pacientes y de un registro de los consentimientos informados.
Recomendaciones
- a)
En las Unidades de Nefrología sin trasplante y en los Centros de Hemodiálisis se dará una información comprensible sobre el TR a todos los potenciales candidatos al mismo, incluyendo morbilidad, mortalidad, resultados comparados con diálisis e información relativa a diferentes fuentes de riñones (donante vivos y cadáver).
- b)
El proceso de evaluación con la consiguiente remisión del paciente a la UTR, solamente se hará si el paciente da su consentimiento informado. Los contenidos de la información que se dé a los pacientes para dar el consentimiento informado en las Unidades de Nefrología sin trasplante y en los Centros de Hemodiálisis se deberán coordinar con las respectivas UTR. Esa coordinación fijará el grado de estudio que se realiza en cada uno de los niveles asistenciales y depende del pacto que se establezca entre dichos niveles asistenciales.
Justificación
El principal objetivo del TR debe ser mejorar la calidad de vida y ofrecer una expectativa de vida como mínimo igual a la que proporciona la diálisis. El TR puede no ofrecer ninguna ventaja a aquellos pacientes con una corta expectativa de vida relacionada con comorbilidades444.
Recomendaciones
- a)
Se considerarán contraindicaciones para el TR: neoplasias malignas activas, arteriosclerosis generalizada severa, insuficiencia orgánica severa sin posibilidad de corrección, infecciones activas, enfermedad psiquiátrica no controlada y consumo activo de tóxicos. En general, cuando haya un proceso activo que pueda empeorar de forma relevante con el proceso del TR (cirugía y tratamiento inmunosupresor), cuando no haya garantías razonables de que el paciente tome la medicación inmunosupresora y cuando la expectativa de vida sea menor de dos años.
Justificación
Ha habido una progresiva mejoría de los resultados del TR en la población de edad avanzada (> 70 años). Esta mejoría de los resultados justifica la extensión del TR445. Por otra parte, cuando se compara la supervivencia de los pacientes ancianos en lista de espera entre los trasplantados y los que permanecieron en diálisis, los resultados son mejores en los trasplantados446.
Una evaluación de la comorbilidad y del riesgo de mortalidad perioperatorio puede ayudar a prevenir complicaciones graves postrasplante.
A los candidatos a TR, especialmente a los añosos, se les debe hacer un especial rastreo para detectar posibles neoplasias ocultas. Por ello, es recomendable realizar un test de sangre oculta en heces, una mamografía en las mujeres de más de 40 años o con historia familiar de cáncer de mama, un antígeno prostático específico (PSA) y una ecografía de próstata en los hombres de más de 50 años y una ecografía renal en los pacientes con enfermedad quística adquirida447.
Recomendaciones
- a)
La edad avanzada por sí misma no es contraindicación para el TR.
- b)
En la población de edad avanzada el TR puede ser ofrecido porque incrementa la posibilidad de supervivencia comparado con la diálisis.
- c)
En los candidatos a trasplante de mayor edad, particularmente a partir de los 50 años, debe realizarse un cuidadoso rastreo para detectar posibles neoplasias ocultas, siguiendo las recomendaciones aplicables a la población general.
Justificación
Es difícil decidir cuál es el mejor momento para trasplantar a un paciente que ha sufrido una neoplasia y que está libre de enfermedad. En este contexto, la individualización y el análisis de cada caso con un especialista de Oncología pueden facilitar la decisión448.
Pacientes con cáncer in situ de piel o de cérvix y con cáncer renal de diagnóstico casual y tratados con éxito se pueden incluir de forma inmediata en lista de espera de trasplante.
Pacientes con cáncer localizado y de buen pronóstico (tiroides, útero, cérvix, laringe, vejiga) deberían esperar de uno a tres años antes de ser incluidos en la lista de espera de trasplante.
A los pacientes con cáncer de mal pronóstico o mayor grado de extensión (pulmón, esófago, estómago, cerebro, vejiga infiltrante) se les desaconseja que se sometan a trasplante renal en un plazo mínimo de cinco años449. Existen casos esporádicos de cánceres de bajo grado de actividad que, aunque no erradicados, permiten el TR450.
Recomendaciones
- a)
En los pacientes con neoplasias previas, el TR sólo debe ser planteado si no hay evidencia de la persistencia de la neoplasia. Es recomendable que el tiempo de espera entre el tratamiento del tumor y el TR se base en el tipo, estadio y grado de la neoplasia, la edad del paciente y la existencia de comorbilidades.
Justificación
La infección por el virus de la hepatitis C es la causa principal de enfermedad hepática después del TR451. Además, el injerto renal también se puede perder en pacientes con hepatitis como resultados de glomerulonefritis provocada por crioglobulinemia. En el seguimiento a largo plazo de los pacientes con hepatitis C trasplantados que no han sido tratados con los nuevos fármacos antivirales de acción directa se ha observado un mayor riesgo de cirrosis hepática y carcinoma hepatocelular. El tratamiento con fármacos antivirales de acción directa, tanto de la hepatitis B como de la hepatitis C, puede realizarse antes o después del trasplante con una alta tasa de éxito, siendo preferible hacerlo antes del trasplante452–454.
El TR en los pacientes tratados y con carga viral negativa no se asocia a mayor morbi-mortalidad postrasplante, al menos a corto-medio plazo455.
Cuando exista infección por el virus de la hepatitis C o hepatitis B con cirrosis hepática deberá proponerse un trasplante combinado riñón–hígado dado el elevado riesgo de fallo hepático postrasplante456.
Recomendaciones
Hepatitis C
- a)
Se recomienda el screening para el virus de la hepatitis C en todos los pacientes. Los pacientes portadores del virus de la hepatitis C pueden ser considerados candidatos para TR dado que la supervivencia postrasplante es superior a permanecer en diálisis. Los candidatos deberán ser evaluados de una forma completa para la enfermedad hepática, porque hay un incremento de riesgo de aceleración de la enfermedad hepática severa después del TR.
- b)
Los pacientes con cirrosis hepática no serán considerados para TR aislado, pero habrá que considerar el trasplante combinado riñón-hígado.
- c)
Los pacientes portadores del virus de la hepatitis C (serología o carga viral positiva) o con hepatitis crónica activa deben ser tratados con antivirales de acción directa durante tres meses antes del TR, hasta conseguir la negativización de la carga viral.
- d)
En aquellos pacientes tratados con fármacos antivirales de acción directa y negativización de la carga viral, el TR no comporta mayores riesgos a corto-medio plazo.
Hepatitis B
- a)
Los candidatos a TR infectados por el virus de la hepatitis B deberán ser evaluados de una forma completa para la enfermedad hepática, incluyendo biopsia hepática si las transaminasas hepáticas están elevadas, porque hay un incremento de riesgo de aceleración de la enfermedad hepática después del TR.
- b)
Cuando exista cirrosis hepática no serán considerados como candidatos para trasplante renal aislado, pero sí se podrá considerar un trasplante combinado riñón-hígado.
- c)
Los pacientes con hepatitis crónica activa pueden ser tratados con fármacos específicos.
Infección por virus de la inmunodeficiencia humana (VIH)
Justificación
Actualmente el tratamiento múltiple antirretroviral ha convertido la infección por el VIH en una enfermedad crónica y ha generado una prolongada expectativa de vida. En varios estudios de TR en pacientes con infección controlada del VIH se han obtenido resultados positivos457. Por estos motivos, la infección por VIH no debe ser considerada como una contraindicación absoluta para el TR458,459.
Recomendaciones
- a)
Los pacientes portadores del VIH con buena adherencia al tratamiento antirretroviral, con carga viral indetectable, con un recuento de células T CD4+mayor de 200/mL de manera estable y ausencia de infecciones oportunistas en los seis meses previos, leucoencefalopatía multifocal progresiva, criptococosis intestinal crónica y linfoma pueden ser evaluados para su inclusión en lista de espera para TR (guías europeas).
Justificación
El grado de recurrencia de la enfermedad renal original después del TR es variable460 y se ha subestimado por varias razones: la duración de los estudios es variable, los criterios utilizados para programar las biopsias de protocolo difieren entre los equipos y las modalidades de diagnóstico utilizadas para la detección temprana de la enfermedad renal original recurrente también varían. Es importante tener en cuenta que los datos recientes han demostrado que en pacientes con ciertas enfermedades renales primarias (glomerulonefritis membrano-proliferativa, glomerulonefritis mesangial por depósitos de IgA, glomerulonefritis segmentaria focal y nefropatía membranosa) la causa predominante (60%) de pérdida de injerto es la recurrencia de la enfermedad renal original. Además, la tasa de supervivencia del injerto a cinco años en pacientes con enfermedad renal original recurrente es del 45%.
Los pacientes con glomeruloesclerosis segmentaria y focal tienen un alto riesgo de recurrencia de la enfermedad renal primaria que varía según la serie del 15 al 50%461. La glomerulonefritis membranosa tiene una recurrencia en adultos del 20-30%462. La glomerulonefritis mesangial IgA presenta una recidiva histológica del 20-60%, siendo muchos menor la recidiva clínica463.
La recidiva de la nefropatía lúpica es rara. La recidiva en la vasculitis IgA manifestada mediante hematuria microscópica y proteinuria se ha encontrado en el 18% de los casos, con pérdida del injerto en el 11% a los cinco años464. La recurrencia de síndrome urémico-hemolítico después del trasplante renal ha sido estimada en un rango que varía del 10-45%, siendo más frecuente en los niños y dependiente del tipo de mutación genética identificada. La tasa de recurrencia de vasculitis asociada a anticuerpos anticitoplasma de neutrófilos (ANCA) es de cerca de 20%.
Tanto la amiloidosis primaria como secundaria puede recidivar en el injerto trasplantado con una frecuencia que varía del 10-40%465. La recurrencia suele desarrollarse en los tres primeros años. En los casos de amiloidosis secundaria, el riesgo de recidiva depende de la actividad de la enfermedad causal. Es necesaria una evaluación exhaustiva de afectación cardiaca a los candidatos a ser incluidos en lista de trasplante. La recurrencia de mieloma múltiple y de enfermedad de cadena ligeras después del TR es frecuente y, en general, se asocia con mal pronóstico, por lo que el paciente debe estar libre de enfermedad antes de plantear el trasplante renal. No obstante, en pacientes con amiloidosis por cadenas ligeras que alcancen remisiones de su enfermedad hematológica preTR con los nuevos tratamientos (melfalán más trasplante autólogo de médula ósea) y no tengan cardiopatía amiloidea, se han observado supervivencias aceptables superponibles a pacientes de elevada comorbilidad como la población diabética466.
Recidiva de lesiones incipientes de nefropatía diabética se ven en el 100% de los casos a los cuatro años, aunque la pérdida del injerto por nefropatía diabética es muy rara467. El trasplante funcionante doble riñón-páncreas puede prevenir el desarrollo de nefropatía diabética468 y servir para tratar la diabetes.
Los resultados del TR en la cistinosis y enfermedad de Fabry son comparables al conjunto de TR con otras enfermedades y no son contraindicación. En los pacientes con hiperoxaluria primaria el tratamiento de elección es el trasplante combinado riñón-hígado en todos los casos.
Recomendaciones
- a)
Los candidatos cuya enfermedad renal sea una glomerulonefritis primaria no tienen contraindicación para ser evaluados para TR, aunque hay un riesgo de recidiva variable según el tipo de glomerulonefritis primaria. En aquellos casos de glomerulonefritis mediadas por anticuerpos circulantes, se recomienda esperar a la desaparición de los mismos en sangre antes de realizar el TR.
- b)
Los candidatos cuya enfermedad renal sea una enfermedad sistémica como el lupus eritematoso, vasculitis IgA, síndrome urémico-hemolítico y vasculitis asociada a ANCA, no tienen contraindicación para el TR, pero es aconsejable la quiescencia clínica de la enfermedad antes del trasplante.
- c)
Los candidatos cuya enfermedad renal primaria sea la amiloidosis requerirán una evaluación muy individualizada para evaluar la capacidad de prevención de la recidiva y el grado de afectación de órganos vitales, como el corazón, antes de ser incluidos en lista de espera para TR.
- d)
Los pacientes con amiloidosis por cadenas ligeras (amiloidosis AL) sin cardiopatía amiloidea y con remisión terapéutica hematológica pretrasplante pueden ser valorados para su inclusión en lista de espera.
- e)
Los pacientes cuya enfermedad renal primaria sea la diabetes mellitus pueden ser incluidos en lista de TR siempre que las comorbilidades graves inherentes a la diabetes no lo impidan (ateromatosis severa generalizada, cardiopatía isquémica no revascularizable, etc.). En aquellos pacientes con diabetes mellitus tipo I sin contraindicación para el TR, habrá que posibilitar también el trasplante simultáneo o posterior de páncreas.
- f)
Los pacientes con cistinosis o enfermedad de Fabry no tienen contraindicación para el TR.
- g)
En los pacientes con hiperoxaluria primaria habrá que considerar el trasplante combinado de riñón e hígado para evitar la rápida recidiva de la enfermedad.
Justificación
La enfermedad cardiovascular es la principal causa de muerte después del TR, por lo que se debe realizar una cuidadosa evaluación cardiovascular previa al procedimiento469,470. Se debe realizar una coronariografía en casos de sospecha de cardiopatía isquémica, recomendándose la cirugía o la angioplastia pretrasplante cuando esté indicada, con el fin de mejorar el pronóstico de los pacientes trasplantados471–473. Es importante la evaluación de las arterias pélvicas por el riesgo quirúrgico que implica y por el riesgo de amputaciones. Se debe tener especial cuidado si hay signos de enfermedad oclusiva vascular periférica442,473. Así mismo, es necesario evaluar la posible patología oclusiva de las arterias carotídeas. En pacientes jóvenes y sin comorbilidad, una evaluación estándar pretrasplante puede ser suficiente474.
Recomendaciones
- a)
La evaluación cardiaca es importante para detectar y tratar la enfermedad coronaria sintomática, la insuficiencia cardiaca secundaria a enfermedad valvular, la miocardiopatía y la pericarditis. La corrección de dichas patologías sería previa a la inclusión en lista de espera para TR.
- b)
La evaluación de arteriosclerosis severa deberá realizarse en los pacientes para detectar afectación en aorta, arterias pélvicas, arterias cerebrales o enfermedad arterial periférica. Si la afectación es severa, deberá tratarse previamente o excluirse de la lista de espera para TR.
Justificación
La evaluación clínica inicial para preparar la posible inclusión en lista de TR se basará en detectar de forma exhaustiva los posibles factores de riesgo y las comorbilidades que pueden afectar al pronóstico del TR. Se tratará de corregirlos si es posible y de determinar si hay contraindicación absoluta447.
Recomendaciones
La documentación inicial para la posible inclusión en lista de espera para TR incluirá:
- a)
Informe clínico completo.
- b)
Evaluación cardiovascular: Rx. tórax, ECG, ecocardiograma, angio-TAC aorto-ilíaco. En pacientes asintomáticos de alto riesgo se recomienda efectuar una prueba de tolerancia al ejercicio estándar o una ecocardiografía con dobutamina. En caso de resultado no concluyente o positivo, se recomienda realizar pruebas de esfuerzo no invasivas o una coronariografía.
- c)
Evaluación de riesgos infecciosos: infecciones bacterianas crónicas (dentadura, sinusitis, litiasis vesicular, prótesis de hemodiálisis, anomalías vía urinaria), infecciones virales crónicas (hepatitis B, C, VIH, citomegalovirus, Epstein-Barr). Por ello se realizarán: cistografía retrógrada (CUMS) si hubiera sospecha de anomalía de la vía urinaria, HBsAg, HBsAc, HBcAc, anticuerpos hepatitis C (si es positivo RNA del virus C), citomegalovirus, Epstein-Barr, toxoplasma.
- d)
Evaluación neoplasia oculta: ecografía abdominal, PSA si más de 50 años, examen ginecológico, tener en cuenta historia familiar o historia de inmunosupresión previa.
- e)
Evaluación hemato-inmunológica: grupo sanguíneo ABO, tipaje HLA y anticuerpos anti-HLA (en la UTR).
Justificación
Un alto porcentaje de pacientes en lista de espera para TR presentan anticuerpos anti-HLA, en la mayoría de los casos como consecuencia de transfusiones, embarazos o TR previos fracasados. Una minoría de ellos son altamente sensibilizados (80% o más de reacción con las células del panel) y suponen del 12-20% de los pacientes en lista de espera. Los pacientes altamente sensibilizados requieren una atención organizativa especial porque es difícil encontrar donantes con un cross-match negativo. El trasplante con donante vivo directo o cruzado puede ser una alternativa terapéutica para estos pacientes.
Recomendaciones
- a)
A los candidatos para TR se les recogerá una muestra de sangre para determinar anticuerpos linfocitotóxicos anti-HLA. La periodicidad será regular (cada 3-4 meses) y dos semanas después de un episodio potencialmente sensibilizante (transfusión, intervención quirúrgica mayor, embarazo). Los resultados estarán incorporados a la información sobre el tipaje en la UTR.
Justificación
El seguimiento regular de los pacientes en lista de espera es importante cuando el tiempo de espera excede 1-2 años. La patología cardiovascular acelerada que se produce en la insuficiencia renal y especialmente en diálisis469,471 hace necesario una reevaluación regular para confirmar la adecuación de la inclusión en lista de espera para TR. Lo mismo cabe señalar en relación al riesgo de enfermedades neoplásicas ocultas448,449.
Recomendaciones
- b)
Los pacientes en diálisis serán remitidos anualmente a la UTR con informe clínico correspondiente para la actualización de su permanencia en lista de espera para TR.
- c)
Anualmente se realizarán: ECG, ecocardiograma y se remitirá la última analítica general.
- d)
Los pacientes en lista de espera para TR se reevaluarán periódicamente durante su período de estancia en lista. El intervalo de tiempo variará según los casos, cada 6-12 meses en pacientes diabéticos con elevada comorbilidad o aquellos con riesgo de elevada mortalidad en lista de espera (TR previo, enfermedad vascular periférica, añosos, etc.) o cada 12-24 meses en el resto.
- e)
Cuando los pacientes en lista de espera presenten complicaciones clínicas intercurrentes que constituyan una contraindicación para el trasplante, deberá comunicarse este hecho a la UTR de referencia para su exclusión temporal o definitiva, según proceda. El paciente deberá ser informado de este hecho. Así mismo, una vez resuelto el problema clínico, deberá considerarse su reinclusión en lista. De existir factores clínicos que supongan un aumento del riesgo para el trasplante o para el manejo clínico del paciente deberá informarse a la UTR y, si fuera procedente, realizar una reevaluación clínica.
La atención a la enfermedad renal crónica (ERC), está excesivamente «fragmentada» esencialmente debido a un modelo sanitario basado en la «enfermedad» fruto de un modelo de atención diseñado para atender «episodios agudos» y no adaptado para responder a los padecimientos crónicos, el cual exige un modelo más centrado en el «enfermo»475 y, por otra parte, asistimos a un profundo cambio en el modelo asistencial, como consecuencia de:
1.° El paciente ha cambiado: es un paciente pluripatológico, más activo, que desea participar en la «toma de decisiones», espera una buena gestión de su enfermedad, usa internet y habitualmente acude a la consulta con conocimientos de su enfermedad y espera continuidad y seguridad en la atención en todo el sistema sanitario476, pero también vivimos en una situación de «cultura del riesgo» («como debemos vivir en un mundo, en el que todo lo que solía ser natural o tradicional, tiene que ser ahora objeto de decisión o elección»)477 y frente a esta «cultura del riesgo» la respuesta es más «autonomía» del individuo478, pero desgraciadamente no somos autónomos y máxime cuando el individuo se encuentra más indefenso, que es cuando está enfermo. Esta situación de incertidumbre, y «autonomía limitada» en el caso de la ERC es más patente en el momento de la elección terapéutica, puesto que no existe actualmente un proceso educacional sistematizado que garantice una «libre elección terapéutica ‘autónoma o preserve’ la calidad del proceso de decisión»479.
2.° El patrón epidemiológico de las enfermedades ha cambiado: en la actualidad, el 70% del gasto sanitario está relacionado con enfermedades crónicas y el envejecimiento de la población. En función de la evolución demográfica, la estimación de la prevalencia de pacientes en TRS con 65 años o más, en las próximas dos décadas, será muy importante: en el año 2026 el incremento se estima en 39% y en 2036 un 41%480. La coincidencia de esta evolución demográfica y el «ajuste» del gasto sanitario es la «tormenta perfecta»481 y para sobrevivir, es necesario actuar «sobre tres pilares –atención centrada en el paciente, eficiencia hospitalaria, y llevar a cabo las intervenciones en el entorno óptimo»481.
3.° Las tecnologías han cambiado y a través de «sistemas de monitorización a distancia», telemedicina, sistemas de apoyo a la «toma de decisiones clínicas» están posibilitando una mejor gestión de la enfermedades crónicas476.
4.° El sistema de salud no está cambiando. Ante esta avalancha de cambios, el sistema de salud, por su estructura organizativa, de financiación y prestación de servicios, no está adaptado para un control de las enfermedades crónicas482.
Frente a este entorno cambiante, los sistemas sanitarios modernos, deben cambiar hacia un modelo de gestión por procesos integrados (PAI) para garantizar la calidad de las prestaciones y la continuidad asistencial.
Por tanto, la atención a la ERC-TRS debe estar basada en un «modelo sanitario centrado en el enfermo» y una «red integrada de servicios»483,484 y debería contar con los elementos siguientes18:
- •
Marco geográfico y poblacional definido (área de asistencia de la ERC).
- •
Definición de recursos humanos y físicos que constituyen la «red».
- •
Definición de los instrumentos de soporte de la red (protocolos, vías clínicas, procesos asistenciales integrados, red de comunicación «on line», etc.) que garanticen la continuidad del proceso y de soporte para todos los profesionales que participan483.
La atención integrada al paciente con ERC forma parte de las estrategias de la S.E.N. y de otras organizaciones, recogidas en el Documento del MSC 201118 y esencialmente supone el cambio de modelo asistencial, pasando de un «modelo basado en ‘episodios’ a otro caracterizado por ‘procesos’» (fig. 1). Mediante este cambio, se superan los «aislamientos» hospitalarios y se integran en una «red articulada en torno al proceso asistencial, garantizando un continuo asistencial»18.
Las características estructurales de las diferentes unidades están ampliamente definidas en Unidad de depuración extrenal: estándares y recomendaciones MSC 201118, pero a modo de resumen, se muestran brevemente:
- a)
Servicio o Unidad de Nefrología del Hospital/área Unidad Renal Central (URC). Es el centro de referencia del área sanitaria diseñada con criterios de planificación estratégica y su actividad será atender tanto las demandas propias, como las que se deriven de su función dentro de la red de recursos sanitarios de su área485 Esta red está constituida funcionalmente por las unidades de diálisis hospitalarias y extrahospitalarias484. Las características funcionales de todos ellos están definidas484 y el marco geográfico, estructura, población y recursos humanos y físicos se muestra en la (tabla 1)18.
Tabla 1.Estructura asistencial del Servicio de Nefrología
Nivel asistencial Actividad/Observaciones Domicilio del paciente DP/HD Apoyo desde URC Atención primaria Prevención primaria/secundariaCriterios de remisión a consulta de nefrologíaCriterios de seguimiento conjunto con URC Hospital local/comarcal< 100.000 habitantes Consulta ERCAUDE satélite Apoyo desde URC Hospital de área sanitaria>250.000 habitantes URC Apoyo a hospital «local» y coordinación de la «red» Hospital regional>1.000.000 habitantes URCUnidad de Trasplante adultos. Apoyo a hospital «local» y coordinación «red» Hospital supraregional Unidad de Trasplante infantil. DP: diálisis peritoneal; HD: hemodiálisis; URC: Unidad Renal Central; UDE: Unidad de Depuración Extrarrenal; ERCA: enfermedad renal crónica avanzada.
- b)
Consulta de enfermedad renal crónica avanzada (ERCA)- Cuidados paliativos renales (CPR). El Servicio de Nefrología deberá establecer de acuerdo a sus peculiaridades, la estructura asistencial de esta unidad, la población susceptible de ser atendida en una consulta de ERCA son los pacientes con ERC E3b o superior (en todo caso FG < 30mL/min). y aquellos que opten por un tratamiento conservador, bien con primer tratamiento o derivados de otras modalidades terapéuticas por la suspensión de la técnica. El objetivo es proporcionar un cuidado integral del paciente en esta situación, con objetivos específicos asistenciales y de información al paciente.
- c)
Unidad de Diálisis Domiciliaria (Diálisis peritoneal/Hemodiálisis Domiciliaria). En su modalidad de HD convencional o HD diaria, atenderá la demanda de aquellos pacientes que por elección personal o indicación médica se dializarán en su domicilio. La hemodiálisis domiciliaria (HDD) es una opción terapéutica consolidada486,487 al igual que la diálisis peritoneal.
- d)
Unidad de Trasplante Renal. El tiempo de permanencia en diálisis es uno de los factores de peor pronóstico para la supervivencia del injerto y del paciente. El trasplante renal anticipado evita los inconvenientes derivados de las técnicas de diálisis, disminuyendo el gasto generado por las mismas18 por tanto, la UDE y la unidad de trasplante renal deberán establecer una relación de coordinación para facilitar la inclusión del paciente de diálisis en la lista de espera de trasplante renal488,489.
Se debe desarrollar una red asistencial con una estructura especifica común con independencia de que cada una de las unidades asistenciales mantengan su propia entidad.
- a)
La estructura civil de las diferentes unidades (ERCA-CPR, Hemodiálisis, Diálisis Peritoneal) deberán cumplir los estándares recomendados en la guía «Unidades de depuración extrarrenal. Estándares y recomendaciones MSC 2011»18.
- b)
La estructura gerencial de la red deberá contar con un Director–Coordinador, así como un responsable de enfermería y un órgano colegiado en el que estén representados todas las unidades integradas en la red. Se establecerá un calendario de reuniones periódicas de la red.
- c)
La organización debe disponer de un documento de Historia clínica común (HC), única y en red con acceso on line. La HC tiene que garantizar unas funciones determinadas que van desde la asistencia, la docente, la investigación, la gestión clínica y la planificación de recursos asistenciales, aspectos jurídico-legales y control de la calidad asistencial. Debe ser única para cada persona acumulando toda su información clínica y, además, ser integrada de forma que contenga la información de todos los contactos y episodios del paciente490.
Así mismo, deberá desarrollar protocolos de atención e indicadores de proceso para garantizar la calidad asistencial y seguridad del paciente (fig. 2).
- a)
La red asistencial deberá disponer de una comunicación eficaz y continuada basada en las modernas tecnologías de la información y comunicación (TIC) que posibilite no solo la comunicación de profesionales, sino también el desplazamiento innecesario de pacientes.
- b)
La realización de pruebas complementarias desde los Centros de Diálisis Extrahospitalarios, se harán de acuerdo a los «conciertos» establecidos con los diferentes servicios autonómicos de Salud.
- c)
Se deberán desarrollar actividades de docencia y de I+D+I.
- d)
La transferencia de pacientes entre las diferentes modalidades terapéuticas se debe establecer de acuerdo a los protocolos y guías clínicas vigentes.
Concepto de historia clínica electrónica180,488.
Los indicadores de proceso (ID) son «una variable con características de calidad, cantidad y tiempo, utilizada para medir, directa o indirectamente los cambios en una situación y apreciar el progreso alcanzado en abordarla. Provee también una base para desarrollar planes adecuados para su mejoría»492.
Son más sensibles que los indicadores de resultados para determinar reales diferencias en la calidad de la atención prestada y de fácil interpretación, aunque carecen de valor intrínseco y solamente son válidos si están asociados a un resultado.
Los ID nos ayudarán a evaluar la calidad de los PAI, son:
1.° Indicadores de proceso de transferencia-elección terapéutica desde ERCA-CPR (tabla 2).
Indicadores de proceso de transferencia desde ERCA a CPR
| Denominación | Proceso de salida desde ERCA - Cumplimentación resumen ERCA |
| Fórmula | Número de personas que cumplen criterios de elección de TRS/tratamiento conservador establece la guía x 100/número de personas totales que salen de ERCA |
| Definición | Personas que cumplen criterios de elección terapéutica -Tratamiento conservador |
| Tipo indicador | Proceso |
| Dimensión | Eficacia-Efectividad |
| Fundamento | Necesidad de elección tratamiento de TRS – tratamiento conservador según criterio de guía clínica |
| Población del indicador | Población en ERCA |
| Fuente de datos recomendada | Guía clínica |
| Periodicidad | Semestral |
| Estándar | 100% |
CPR: cuidados paliativos renales; ERCA: enfermedad renal crónica avanzada; TRS: tratamiento renal sustitutivo.
2.° Indicadores de proceso de transferencia entre técnicas de TRS: HD-TxR-DD (DP-HDD) (tabla 3).
Indicadores de proceso de transferencia entre tecnicas de TRS
| Denominación | Proceso de transferencia entre técnicas de TRS |
| Fórmula | Número de personas que cumplen criterios de transferencia que establece la guía x 100/número de personas totales transferidas |
| Definición | Personas que cumplen criterios de transferencia de técnica |
| Tipo indicador | Proceso |
| Dimensión | Eficacia-Efectividad |
| Fundamento | Necesidad de transferencia según criterio de guía clínica |
| Población del indicador | Población en TRS |
| Fuente de datos recomendada | Guía clínica |
| Periodicidad | Semestral |
| Estándar | 100% |
TRS: tratamiento renal sustitutivo.
3.° Indicadores de proceso de transferencia entre ERCA y tratamiento conservador (tabla 4).
Indicadores de proceso de transferencia desde ERCA a TC
| Denominación | Proceso de transferencia ERCA a TC |
| Fórmula | Número de personas que cumplen criterios de transferencia que establece la guía x 100/número de personas totales transferidas |
| Definición | Personas que cumplen criterios de transferencia de técnica |
| Tipo indicador | Proceso |
| Dimensión | Eficacia-Efectividad |
| Fundamento | Necesidad de transferencia según criterio de guía clínica |
| Población del indicador | Población en ERCA-TRS |
| Fuente de datos recomendada | Guía clínica |
| Periodicidad | Semestral |
| Estándar | 100% |
ERCA: enfermedad renal crónica avanzada; TRS: tratamiento renal sustitutivo; TC: tratamiento conservador.
4.° Indicadores de proceso de comunicación en la red (tabla 5).
Indicadores de proceso de comunicación en la red
| Denominación | Reunión del órgano colegiado de la red |
| Fórmula | Número de reuniones órgano colegiado establecidos en protocolo x 100/número de reuniones totales |
| Definición | Órgano colegiado |
| Tipo indicador | Proceso |
| Dimensión | Eficacia-Efectividad |
| Fundamento | Necesidad de revisión de los PAI |
| Población del indicador | Órgano colegiado |
| Fuente de datos recomendada | Protocolo PAI |
| Periodicidad | Semestral |
| Estándar | 100% |
PAI: procesos asistenciales integrados.
Los indicadores de calidad son los definidos en la Guía de Centros de Hemodiálisis de la S.E.N. del año 20051.
Gestión de seguridad del pacienteLa Organización Mundial de la Salud define la Seguridad del Paciente como la reducción del riesgo de daños innecesarios para el paciente hasta un mínimo aceptable. El daño relacionado con la atención sanitaria es el daño que se deriva de los planes o acciones de un profesional sanitario durante la prestación de asistencia sanitaria o que se asocia a ellos, y no el que se debe a una enfermedad o lesión subyacente1.
El Plan de Calidad del Ministerio de Sanidad, Servicios Sociales e Igualdad (MSSSI) incluye como estrategia número 8: «Mejorar la seguridad de los pacientes atendidos en los centros Sanitarios del Sistema Nacional de Salud». Uno de los objetivos establecidos para alcanzar dicha mejora es «Diseñar y establecer un sistema para la comunicación de los incidentes relacionados con la Seguridad del Paciente». Este objetivo se materializó con el diseño, desarrollo e implantación del Sistema de Notificación y Aprendizaje para la Seguridad del Paciente (SiNASP), sistema desarrollado por el Ministerio de Sanidad, Servicios Sociales e Igualdad para el Sistema Nacional de Salud493. Es, por tanto, de obligado cumplimiento la implantación del SINAPS en toda la red.
Relación de la unidad de depuración extrarenal (UDE) con otras modalidades de tratamiento renal sustitutivo (TRS)De acuerdo a las características definidas en los PAI, las relaciones de la UDE con las otras unidades funcionales serían:
Relación con la consulta ERCAUna asistencia óptima en la fase de ERCA, previa al inicio de TRS, debe contemplar la detección precoz de la enfermedad renal progresiva, intervenciones para retardar su progresión, prevención de las complicaciones urémicas, atenuar las condiciones comórbidas asociadas, indicar o contraindicar el TSR, e informar al paciente de las posibilidades terapéuticas18.
En la transición entre las fases avanzadas de la enfermedad renal crónica, estadios 4 y 5, y los primeros meses de TRS, la mortalidad es extremadamente elevada, especialmente en Hemodiálisis (HD)494,495. Por tanto, hay una serie de procesos de esta «transiciones» especialmente relevantes como:
1.° Explorar la individualización para cada paciente, basándonos en datos como: tasa de progresión y comorbilidad, los cuales no solo tienen un importante valor predictivo en la supervivencia, sino que además pueden tener mucho peso en las tomas de decisiones para individualizar los formatos de transición entre ERCA y TRS496.
2.° Definir el «inicio de TRS ‘ÓPTIMO’», entendido como497:
- •
Cuando el paciente inicia TRS de manera ambulatoria, no hospitalizado.
- •
Con una fístula arterio-venosa madura, o bien cualquier acceso utilizable (catéter por indicación o deseo del paciente) y catéter peritoneal.
- •
En la modalidad de TRS elegida por el paciente y el médico.
Para conseguir un inicio óptimo, la Unidad ERCA debería establecer un proceso «educativo» del paciente y sus familiares basado en:
1. Educación del paciente ERCA:
- •
Fomento del autocuidado.
- •
Fomento de técnicas domiciliarias.
- •
Gestión de dieta.
- •
Gestión de hábitos saludables.
- •
Preservación de capital vascular.
- •
Gestionar fuentes fiables de información en Internet.
- •
Ayuda para gestionar recursos psicológicos disponibles.
- •
Ayuda para gestionar los recursos sociales disponibles.
Cada día es mayor la evidencia de que la educación de los pacientes produce un aumento de la calidad de vida, mejores resultados clínicos biológicos y disminución de los costes sanitarios. No obstante, no hay todavía guías detalladas de cuál es la mejor manera de organizar estos programas de educación y hay una gran variabilidad entre unidades498. Las guías actuales recomiendan la necesidad de diseñar programas de educación para pacientes499, de calidad y sin sesgos500.
2. Test de elegibilidad para las técnicas. Establecer por parte del médico de manera estructurada la existencia de indicaciones y contraindicaciones para la técnica.
3. Asegurar las condiciones para que el paciente pueda participar en la elección de la técnica de tratamiento sustitutivo renal que mejor se adapte a sus necesidades y a su estilo de vida501–503.
4. Disminución del riesgo vascular general y el inherente a la ERCA. Profundizando en el estudio del paciente con una exploración vascular básica que incluya ecocardiograma, eco-doppler de troncos supraaórticos, índice tobillo brazo, y en ocasiones un angiotac de miembros inferiores.
En los pacientes con ERC moderada (3A y 3B), la incidencia de mortalidad cardiovascular es mucho mayor que al inicio del TSR504.
5. Vacunación. Entre las infecciones que presentan mayor riesgo para estos pacientes se encuentran algunas que son prevenibles mediante vacunas, como la hepatitis B505, las infecciones neumocócicas506 y la gripe507.
6. Planificación y realización del acceso vascular. Se recomienda en los pacientes con ERC progresiva considerar la creación del acceso vascular cuando el FGe < 15mL/min/1,73 m2 y/o una estimación de entrada en diálisis en 6 meses12.
7. Gestión del trasplante (de vivo, de cadáver). Se debe tener preparado al paciente elegible para TX para que pueda ser activado en la Lista de espera de TX cadáver el primer día de diálisis. A pesar de la existencia de guías para la evaluación de candidatos para el TX renal, existe una gran variabilidad en el acceso al trasplante508,509.
8. Empezar en el momento adecuado la HD (no antes, no después). Una causa importante de la preparación «no óptima» es el poco conocimiento que tenemos todavía de la predicción de las trayectorias de la ERCA. Los resultados del estudio IDEAL indican que la toma de decisión de cuando iniciar la hemodiálisis periódica se debería hacer usando un enfoque centrado en el paciente, en el que la valoración de síntomas y los objetivos del paciente sean un elemento central, y no el filtrado glomerular Un enfoque razonable es retrasar el inicio de diálisis en individuos asintomáticos hasta la aparición de síntomas y signos urémicos que razonablemente mejorarán con la diálisis.
9. Programación de la primera diálisis. Un inicio óptimo y, por tanto, un indicador de buen desempeño de la unidad ERCA será el manejo/seguimiento del paciente que permita que la necesidad de comenzar diálisis no ocurra de manera urgente.
Una situación especialmente importante es la «transición» de HD a ERCA. El reingreso en esta unidad asistencial debería realizarse en las situaciones siguientes:
- a)
El paciente que inició hemodiálisis por vía urgente, debería ser remitido a la consulta ERCA, para iniciar todo el proceso formativo y poder elegir libremente una técnica renal sustitutiva o tratamiento conservador.
- b)
Cuando existe un cambio en la decisión del paciente sobre la modalidad de tratamiento.
- c)
El paciente trasplantado, cuando pierde el injerto, puede pasar nuevamente por la unidad ERCA (tabla 5).
El alta de esta consulta, independientemente de la Historia Clínica General, deberá acompañarse de un informe-resumen completo de la situación del paciente (tabla 6) de rápida y fácil compresión.
Resumen ERCA
| Edad |
| Sexo |
| Índice de comorbilidad Charlson510 |
| Fragilidad (Índice de FRIED)511 |
| Nivel de dependencia (test de Barthel) 512 |
| Nivel adherencia terapéutica (test Hermes) 513 |
| Nutrición (score Ulibarri) 514 |
| Estatus socioeconómico 515 |
| MAPA (TAS/TAD y patrón) |
| Eco TSA |
| Ecocardiograma |
| IT/B |
| Riesgo de «dying» USRDS516 |
| Vacunación |
| Serología |
| Mantoux – IGRA |
| Lista de trasplante renal (sí/no) |
| Elección terapéutica: |
| * HD (HDH-HDE-HDD) |
| * DP |
| * Tratamiento conservador |
| Consentimeinto informado: |
| * Técnica de TRS |
| * Tratamiento conservador |
| Documento de instrucciones previas |
| Acceso vascular |
ERCA: enfermedad renal crónica avanzada; MAPA: monitorización ambulatoria de la presión arterial; IGRA: ensayo de liberación de interferón gamma eco; TSA: ecografía de troncos supraórticos; I/T: índice tobillo brazo.
Los Cuidados Paliativos Renales (CPR) se definen como un modelo de medicina centrada en el paciente, basada en el tratamiento de los síntomas asociados a la ERCA y respeto a sus preferencias con el objetivo final de mejorar su calidad de vida y deben estar disponibles en toda la trayectoria de la ERCA, desde el diagnóstico hasta el éxitus (fig. 3), siendo aplicables a todas las modalidades de TRS hasta final de la vida y contando con un equipo multidisciplinar517.
Esto significa que el paciente puede elegir directamente tratamiento conservador o bien ser transferido hacia un manejo renal conservador (MRC) en el curso de la trayectoria de las distintas modalidades de tratamiento renal sustitutivo (fig. 4). Para que esto se haga de una forma eficaz y eficiente es recomendable la interrelación entre las distintas unidades de Nefrología y la consulta de ERCA conservadora y la coordinación con otras especialidades implicadas en sus cuidados.
Las guías KDIGO proponen un mapa de ruta que nos lleven a mejorar la atención y la calidad de vida de los pacientes paliativos renales. Estas guías recalcan aspectos fundamentales sobre el porqué y para quién son necesarios, y cuál es el enfoque deseable de los programas de desarrollo de ERCA conservadora y CPR518,519.
El inicio o no de TRS, o la retirada de diálisis crónica, implica haber hecho previamente una adecuada toma de decisiones en la que participen el paciente, la familia y el médico y se debe informar de las ventajas e inconvenientes de cada técnica y de la calidad de vida en TRS y MRC520,521 a sabiendas que no se dispone de un sistema que garantice la libre elección terapéutica479.
El equipo de CPR podría encargarse también de facilitar o poner en conocimiento al resto del equipo la elaboración o la existencia de pacientes con un documento de instrucciones previas. Esto puede ser muy útil en la toma de decisiones y en la comunicación con el paciente, fomentando el diálogo y la sensación de autocontrol522.
La toma de decisiones finalizará con éxito si al paciente le hemos trasmitido que nos importa y que estamos allí para ayudarle a planificar sus cuidados y evitar el sufrimiento, respetando sus preferencias.
La derivación del paciente desde otras áreas se hará basándose en las necesidades de CPR y criterios pronósticos que indiquen una mala evolución en terapia renal sustitutiva (tabla 7)523–525 en las cuales esté éticamente indicada la suspensión de la diálisis debiendo iniciar un plan de cuidados y de soporte avanzados (PCPA).
Indicadores de mal pronóstico en la ERCA con TRS
| Edad > 75 años (la edad por sí sola no es un criterio de mal pronóstico, salvo que se asocie con gran comorbilidad)Comorbilidad (Charlson Comorbidity Index Score)Deterioro funcional: (Karnofsky/performance status < 40)Insuficiencia cardiaca congestiva tipo IVCardiopatía isquémica severa no revascularizableIsquemia crónica MMII IV. AmputacionesNeoplasia con criterios de terminalidadACVA no rehabilitableCalcifilaxis severaInestabilidad hemodinámica persistenteSintomatología severa que no mejora con diálisisDeterioro cognitivo y funcional severoDeseos del paciente: cansancio de la técnica |
ERCA: enfermedad renal crónica avanzada; TRS: tratamiento renal sustitutivo; ACVA: accidente cerebrovascular.
El PCPA se define como aquel que es llevado por un equipo de cuidados renales interdisciplinar (nefrología, CP, psicólogos, trabajadores sociales, atención primaria, etc.) con objetivos centrados en el paciente y la familia. Debe ser un proceso estructurado, eficaz, accesible y continuo. En esta fase es fundamental el manejo de los síntomas, adoptar medidas de confort y contar con habilidades de comunicación en situaciones difíciles. El paciente y la familia deben participar en este plan de cuidados. Esto va a permitir estar preparados para las decisiones que se tomen y tener una atención efectiva al final de la vida y del duelo526,527.
Relación con la unidad de diálisis peritonealEl TRS es un proceso integrado que comprende desde las consultas ERCA hasta las distintas técnicas de diálisis y el trasplante. Es necesaria una planificación global por el elevado coste económico y la repercusión individual y social que tiene. Por ello, las Unidades de DP y HD deben mantener un continuo contacto debido a la transferencia bidireccional entre ambas modalidades de TRS.
Distintos motivos pueden llevar a un paciente en programa de DP a ser transferido a HD de forma transitoria o definitiva. La transferencia transitoria es la que realiza durante un periodo menor de ocho semanas. Sus causas aparecen reflejadas en la tabla 8. En todas estas situaciones se requiere de un descanso peritoneal para poder recambiar el acceso peritoneal, recuperar la integridad de la membrana peritoneal y/o pared abdominal o recuperar la permeabilidad. Las causas de transferencia definitiva a HD aparecen reflejadas en la tabla 9.
Causas de transferencia definitiva a HD
| Infecciones peritonealesComplicaciones graves de la pared abdominalFallo de ultrafiltraciónInfradiálisisProblemas psicosociales:cansancio de la técnica por parte del paciente o cuidadorincapacidad de los mismos para el desarrollo de la técnica |
HD: hemodiálisis.
Numerosos estudios han analizado los factores predictores del fallo de la técnica de DP; así se ha propuesto que la edad avanzada, el transporte peritoneal alto, la reducción en la ultrafiltración, la desnutrición, la diabetes mellitus y la obesidad condicionan una peor supervivencia de la misma516.
El periodo de transición entre DP y HD es complicado. Los pacientes que cambian de modalidad de diálisis de forma no planificada sufren un mayor número de hospitalizaciones y pasan más días ingresados que aquellos que lo hacen de una forma planificada528, además se supone que el paso ordenado a HD conlleva un menor impacto sobre la situación psicológica y la calidad de vida del paciente.
Es frecuente que la transferencia de DP a HD ocurra de forma aguda y por ese motivo no da tiempo a preparar al paciente para HD. Cuando se hace de forma planificada, se puede realizar una adecuada preparación para el cambio, basada fundamentalmente en la creación de un acceso vascular, del cual va a depender la supervivencia del paciente. No está claro en qué momento se debe proceder a la creación del acceso vascular en los pacientes en DP. La realización de fístulas arteriovenosas de forma preventiva en los pacientes incidentes en DP no está recomendada529. Pero, por otro lado, como no se puede predecir en muchos casos cuándo se va a producir la transferencia entre técnica, muchos pacientes van a iniciar HD sin un acceso vascular definitivo y van a necesitar de catéteres venosos centrales. Es conocido que en los pacientes incidentes en HD existe una mayor mortalidad asociada al uso de estos catéteres530,531.
No hay estudios publicados que comparen la supervivencia de los pacientes transferidos de DP a HD en función de si tienen o no una fístula arteriovenosa construida. Sin embargo, parece lógico que la falta de acceso vascular definitivo pudiera tener un impacto negativo.
La supervivencia de los pacientes transferidos de forma definitiva de DP a HD es peor que la de los pacientes incidentes en HD, como primera modalidad de tratamiento renal sustitutivo, al menos durante los primeros 12 meses. Se ha postulado que este pobre devenir se debe a circunstancias propias del fin de la técnica de DP, como la desnutrición, la inflamación o la infradiálisis532. Por todos estos datos, se aconseja realizar el traspaso a tiempo y en forma adecuada.
Transición de hemodiálisis a diálisis peritoneal
El paso de pacientes en HD suele ocurrir por dos motivos. Por un lado, están los pacientes que sufren un inicio no programado de diálisis y que no pudieron recibir previamente información sobre las modalidades de TRS ni, por tanto, optar por la DP. Estabilizada su situación y adecuadamente informado, algunos pacientes son transferidos a DP antes de un año. Otros pacientes que sí eligieron HD pasan posteriormente a DP, generalmente por la falta de acceso vascular, pero también por cambios en las preferencias, sitio de residencia, acceso a cuidadores y otras situaciones clínicas.
El haber pasado previamente por HD impacta negativamente en la evolución del paciente en DP. Así,se ha visto cómo aquellos pacientes transferidos a DP durante el primer año tienen una peor supervivencia de la técnica y una mayor mortalidad533. Datos similares se han publicado al analizar la evolución de los pacientes que pasan a DP en cualquier momento de su evolución534.
En resumen, es preciso que las Unidades de DP y de HD mantengan una relación constante por la necesidad de un paso transitorio o definitivo entre ambas modalidades de TRS. De los resultados publicados de estudios que analizan la transición entre técnicas se puede concluir que el paso de DP y HD debe hacerse de forma planificada siempre que sea posible por el impacto que tiene en la supervivencia. Por otro lado, la repercusión que tiene el haber pasado por HD sobre la evolución de los pacientes transferidos a DP, nos hace pensar en la importancia que tiene en fomento de la DP como modalidad inicial de TRS y la información adecuada sobre las distintas modalidades de TRS. Estos datos vienen avalados por los resultados de un reciente estudio realizado por la Escuela Andaluza de Salud Pública535, según los cuales, los pacientes que inician DP y, después de tres o cinco años, pasan a HD tienen una mayor supervivencia que aquellos tratados con HD desde el primer momento. Además, el modelo de «primero DP» resulta ser más coste-eficiente que iniciar diálisis en HD.
Relación con la unidad de trasplante renalEl trasplante renal anticipado es una realidad científica489 y en la red integral de asistencia al paciente en ERC debe existir una unidad de referencia para el trasplante renal anticipado tanto de donante vivo como de cadáver. La consulta de ERCA y la unidad de Trasplante deberán establecer la necesaria coordinación-protocolos para la inclusión en lista de espera a todo aquel paciente subsidiario de esta opción terapéutica. Así mismo, desde la consulta de ERCA se deberá realizar una actividad proactiva a favor del trasplante de donante vivo.
Gestión de calidad en hemodiálisisIntroducciónLa evaluación y mejora de la calidad asistencial ha sido siempre una preocupación de los profesionales sanitarios. Los primeros intentos por desarrollar el concepto de calidad en el ámbito asistencial se dirigieron a medir la calidad mediante la definición de unos estándares que indicasen que la asistencia prestada era técnicamente adecuada. La acreditación sanitaria, entendida como la evaluación externa y voluntaria respecto a unos estándares profesionales, se puso en marcha ya a principios del siglo XX en EE. UU. mediante diferentes experiencias, que culminaron en el desarrollo de la Joint Commission.
De forma paralela, en el ámbito industrial, el concepto de calidad se introdujo en las organizaciones a finales del siglo XIX, mediante el control de la calidad del producto terminado. Este enfoque no mejoraba la calidad porque simplemente eliminaba los productos defectuosos. Posteriormente, los modelos de calidad fueron evolucionando hacia el aseguramiento de la calidad, cuyo objetivo es prevenir la aparición de defectos garantizando que todo el proceso de producción se realiza según lo planificado. En este entorno surgieron las primeras normas ISO, publicadas por primera vez en 1987.
Los propios modelos de aseguramiento de calidad han avanzado hacia modelos de calidad total. Una organización con un sistema de gestión de calidad total entiende la calidad no como un atributo del servicio que presta, sino como algo que afecta al funcionamiento de toda la organización, en búsqueda de la mejora continua. Así, la norma ISO 9001, a medida que se ha actualizado (5 revisiones en total), no hablaba ya de aseguramiento de la calidad, sino de un sistema de gestión de calidad (SGC).
Por otra parte, el modelo EFQM (European Foundation for Quality Management) aborda las mejores prácticas de gestión para que una organización sea excelente. Ambos modelos tienen como base la gestión por procesos.
En nuestro entorno, un modelo básico de acreditación es la autorización por parte de la Administración que precisan todos los centros de diálisis antes de aceptar pacientes en la Unidad de Hemodiálisis536. Esta autorización se basa en el cumplimiento de la normativa vigente y en la verificación de unos requisitos básicos, dirigidos a garantizar que el centro cuenta con los medios técnicos, instalaciones y profesionales mínimos necesarios para desarrollar las actividades a las que va destinado. Aparte del cumplimiento de estos mínimos, recientemente se han implantado iniciativas tendentes a asegurar la calidad de la prestación en hemodiálisis, exigiendo el cumplimiento de unos estándares clínicos definidos previamente o bien impulsando la obtención de certificaciones externas537. Estas estipulaciones se recogen en el contrato-programa (en centros públicos) o a través de un proceso de licitación en el caso de acuerdo público privado, en el propio concierto (en centros concertados).
Gestión por procesosTodos los sistemas de calidad parten de la premisa de que una organización, para tener éxito, debe tener sus procesos bien organizados y gestionados de forma sistemática. Un proceso se define como un conjunto de actuaciones, decisiones, actividades y tareas que suceden de forma secuencial y ordenada para conseguir un resultado que satisfaga los requerimientos del cliente al que va dirigido534.
La gestión por procesos conlleva crear una estructura coherente de procesos que represente el funcionamiento de la organización y establecer la interacción entre ellos, con el propósito final de asegurar que los procesos se desarrollan de forma coordinada, mejorando de esta forma la efectividad y satisfacción de todas las partes involucradas.
La metodología de la gestión de procesos se basa en las siguientes etapas:
- a)
La elaboración del mapa de procesos de una organización mediante el análisis sistemático de los procesos y procedimientos involucrados en la gestión de la calidad de una unidad de diálisis, mediante una ilustración (fig. 5).
- b)
La identificación de los procesos clave y de las personas que los van a liderar, que deben supervisar y mejorar el cumplimiento de todos los requisitos.
- c)
La gestión sistemática de los procesos.
Los procesos clave son los más importantes para una organización, por incidir directamente en los resultados de los pacientes o en la satisfacción de los clientes. Se deben identificar y gestionar adecuadamente, especialmente los procesos asistenciales, que por su propia complejidad propician las ineficiencias.
Una vez definidos los procesos, deben mantenerse bajo control o «estabilizados», evitando la variabilidad excesiva539. En el ámbito clínico, este enfoque ha propiciado la implantación de guías de práctica clínica, que definen cómo se debe prestar el servicio, basándose en el análisis de las mejores prácticas y evitando la variabilidad.
Una vez estabilizados los procesos, se deben definir las características de calidad de las diferentes actividades que constituyen el proceso y analizar periódicamente si el proceso responde a las expectativas o necesidades de los clientes y si es efectivo o eficiente. Con el fin de medir la eficacia y eficiencia de los procesos y de tener controlado su nivel de variabilidad, se utilizan los indicadores.
Cuando los indicadores u otras fuentes de información detectan desviaciones en el proceso, se deben analizar las causas. El método de análisis utilizado habitualmente es la revisión de la secuencia de actividades, con el fin de detectar desviaciones y mejorar el proceso. La herramienta básica es el ciclo PDCA (Planificar, hacer [Do], Controlar y Ajustar) o ciclo de Deming.
La gestión por procesos presenta varias ventajas importantes538:
- •
Permite la orientación sistemática de todas las actividades hacia las necesidades y expectativas de los clientes.
- •
Facilita la participación de todas las personas que intervienen en los procesos.
- •
En los procesos asistenciales se incluye la medicina basada en la evidencia, a través de la definición de las características de calidad de las actividades.
- •
La definición de indicadores facilita la medición sistemática de los resultados más relevantes de los servicios.
- •
Es una herramienta sencilla y de uso fácil.
La norma ISO 9001 es la norma de referencia por la cual las organizaciones establecen, documentan e implantan sus sistemas de gestión de la calidad539.
Es una norma internacional que se centra en todos los elementos de la gestión de la calidad que una organización debe considerar para tener un sistema efectivo que le permita mejorar la calidad de sus productos o servicios, y que éstos cumplan con los requisitos solicitados por sus clientes.
Las organizaciones que optan voluntariamente por implementar los requisitos de la norma ISO 9001 son auditadas por una entidad independiente (entidad certificadora). Si esta auditoría es superada con éxito, la organización recibe un reconocimiento externo de cumplimiento de la norma en forma de certificado.
Los principios básicos de la ISO 9001 se pueden resumir en ocho puntos540:
- 1.
La Organización está orientada a todos sus Clientes.
- 2.
Liderazgo: entendiendo como líder a todas las personas que tienen alguna responsabilidad en la organización.
- 3.
Mejora continua: mediante el proceso de planificación, realización de objetivos, evaluación y control, análisis y modificación del proceso de planificación (ciclo PDCA).
- 4.
Procesos: entendidos como el conjunto de actividades mediante las cuales se realizan los servicios que recibe el paciente/cliente.
- 5.
Implicación y participación del personal: dar poder a las personas que integran la organización para poder gestionar sus actividades y participar en las mejoras, mediante canales de comunicación bien definidos.
- 6.
Gestión: el sistema de calidad está enfocado a la gestión.
- 7.
Toma de decisiones basada en datos.
- 8.
Relaciones mutuamente beneficiosas con el proveedor.
En la nueva versión de la norma (ISO 9001:2015) se pueden destacar como grandes ejes:
El Contexto de la organización, el Liderazgo, el Enfoque a procesos, la Gestión del cambio y el pensamiento basado en riesgos541.
En versiones anteriores se mencionaban los requisitos de la alta dirección, pero en la nueva versión se hace mención explícita al término «liderazgo» unido a «capacidad de compromiso» como cualidad a demostrar a la hora de dirigir y controlar un sistema de gestión de calidad, dando a entender que, aunque la alta dirección puede delegar autoridad y proporcionar recursos dentro de la organización, debe asumir la responsabilidad última sobre los resultados del mismo.
Respecto al pensamiento basado en riesgos, se entiende como riesgo una desviación que puede afectar a la eficacia de nuestros procesos, dificultando la obtención de los resultados esperados. Una herramienta práctica para identificar los riesgos existentes en una Unidad de Hemodiálisis es la determinación de las cuestiones externas e internas que afectan a la unidad (contexto de la organización) mediante la realización de un DAFO (identificación de D: Debilidades, A: Amenazas, F: Fortalezas y O: Oportunidades), sobre todo si se enfoca por procesos. Si a la hora de definir y planificar un proceso lo hacemos considerando esas posibles situaciones, estaremos en mejor disposición de obtener los resultados que pretendemos.
Una vez identificados los posibles riesgos que puede tener cada uno de los procesos, se aconseja realizar un análisis de causa (¿por qué ha aparecido este riesgo)–efecto (¿qué repercusión tiene este riesgo?) y calcular el índice de riesgo, es decir, cuantificar el nivel de riesgo por ejemplo en función de un índice de Gravedad (G) x Probabilidad (P), para así poder establecer prioridades de acción (fig. 6).
Una herramienta útil para valorar el riesgo es el análisis modal de fallos y efectos (AMFE)542.
Una vez cuantificado el índice de riesgo, se aconseja decidir y planificar las acciones que podrían minimizar este riesgo; es decir, acciones que permitan bajar este valor traducido en una reducción del nivel de riesgo. Una forma práctica de asegurarse un control es asociar indicadores a estos riesgos para poder valorar de forma objetiva la eficacia de las acciones tomadas, pudiendo estos indicadores incorporarse en un futuro a los indicadores generales de la Unidad de Hemodiálisis en cuestión.
Ciertos riesgos no podrán minimizarse, deberán ser asumidos. En estos casos se deberá monitorizar que su valor (índice de riesgo) no aumente con el paso del tiempo, es decir, no podremos rebajar el nivel de riesgo, pero sí monitorizar para que se mantenga y no aumente.
Modelo EFQMEl modelo EFQM, impulsado por la Comunidad Europea, se inicia en 1991 y ofrece un modelo de gestión basado en la Gestión Total de la Calidad, que permite llevar a cabo un modelo de autoevaluación, orientado a la identificación de los aspectos críticos que existen dentro de la organización, utilizando como instrumento el ciclo de mejora continua o ciclo REDER (Resultados --> Enfoque --> Despliegue --> Evaluación --> Revisión)541.
Los resultados excelentes con respecto al rendimiento de una organización, a los clientes, las personas (trabajadores) y a la sociedad en su conjunto se logran mediante un liderazgo que impulse y dirija la Política y Estrategia, las personas de la organización, las alianzas y recursos a través de la gestión de los procesos (fig. 7).
El modelo EFQM y las normas ISO presentan aspectos comunes: permiten a las organizaciones identificar sus puntos fuertes y débiles, contienen requisitos genéricos respecto a un modelo para realizar la evaluación, proporcionan la base para mejoras constantes e implican un reconocimiento externo540.
El modelo EFQM contempla, además de los principios ya mencionados para las normas ISO, criterios de comparación mediante la evaluación de los resultados de la organización (las organizaciones deben ser eficientes además de eficaces). Otros criterios adicionales son la implicación, además de los clientes, de todas las partes interesadas y de la sociedad en su conjunto, así como la importancia que el modelo EFQM da a la participación y satisfacción de los trabajadores543.
Los indicadores de calidadLos Indicadores de Calidad (IC) son uno de los instrumentos que utilizan los modelos de gestión de la calidad (ISO 9000, EFQM, Joint Comission, etc.) para analizar los procesos y los resultados de sus organizaciones sanitarias.
Los indicadores de calidad son útiles porque hacen posible que documentemos la calidad de nuestro trabajo, nos permite ver la dirección y evolución de nuestra organización y compararnos con otras organizaciones optimizando la toma de decisiones que tenemos que hacer para ir mejorando nuestro organización536.
Características de un indicador de calidad idóneo537
El indicador de calidad idóneo tendría las siguientes características: estaría definido y descrito con precisión y basado en la evidencia científica, tendría una alta especificidad y sensibilidad y sería útil para hacer comparaciones con nosotros mismos y con otras organizaciones similares.
Un indicador de calidad es válido cuando mide con eficacia y exactitud lo que intenta medir y es exacto cuando obtiene los mismos resultados tras realizarse la medición repetidamente en distintos pacientes y organizaciones médicas. Un IC válido tiene que ser reproducible y constante.
Tipos de indicadores de calidadLos tipos de IC que utilizamos son:
Indicador basado en ratio: es el más frecuente. En el numerador introducimos las veces que hemos medido el evento que estamos analizando y en el denominador el número total de oportunidades que hemos tenido para que ocurra este evento.
Por ejemplo, Pacientes incidentes de periodo en HD. Numerador: número de pacientes NUEVOS en la Unidad en el periodo de estudio (31 de diciembre); Denominador: número de pacientes en la Unidad al inicio del año (1 de enero).
Indicadores centinela: son aquellos que nos permiten identificar un evento inesperado o de especial relevancia. Este evento requiere de una investigación posterior para analizar y estudiar la causa de este incidente como por ejemplo la tasa de seroconversión de hepatitis C.
Categorías de los sistemas de calidad
En la Calidad de la Atención Médica se pueden distinguir tres dimensiones que a su vez están relacionadas con tres categorías de indicadores de calidad.
Estas tres categorías de indicadores son: los indicadores asociados a la estructura, los asociados a los procesos y los que se asocian con los resultados de la organización médica538.
- a)
Los indicadores estructurales están relacionados con las características del entorno sanitario que afectan la capacidad del sistema para poder atender las necesidades de salud de los pacientes. Por ejemplo: conductividad del agua tratada, porcentaje de cultivos de agua tratada con crecimiento de bacterias inferior al rango, niveles de Aluminio en agua tratada, niveles de endotoxinas en el agua osmotizada (LAL).
- b)
Los indicadores de proceso están relacionado con el propio proceso de hemodiálisis, así como con el manejo de los pacientes. En ella estaría incluido, por ejemplo, el tiempo y frecuencia del tratamiento de hemodiálisis, el tipo de acceso vascular, vacunación de la hepatitis B, etcétera.
- c)
Los indicadores de resultados como el tiempo en tratamiento renal sustitutivo, tasa anual de mortalidad, KTV o el KT de los pacientes; porcentaje de pacientes con PTH entre 150-500 pg/mL, el porcentaje de pacientes con fósforo sérico inferior a 5,5mg/dL, etc.536.
Nissenson539 propone un cambio de paradigma en la forma de enfocar la evaluación de la calidad que estamos dando a nuestros pacientes de hemodiálisis.
Este paradigma los describe como una PIRÁMIDE de CALIDAD.
En la base están los indicadores básicos, los cuales están en su mayoría en nuestras guías del año 2006 (excepto la ganancia de peso y el sodio).
Por encima están los indicadores que son más complejos de gestionar por depender de varios componentes, como son sobrecarga hídrica, el manejo de la enfermedad cardiovascular, etc.
En una escala superior están los indicadores que nos miden la eficacia como la mortalidad o el número de hospitalizaciones.
En el ápice de la pirámide está la calidad de vida del paciente.
Revisión de los indicadoresIndicadores globales (Anexo 7)NOTA: Sin cambios con respecto a los del año 2006. Estos indicadores son útiles para poder analizar las características generales de los pacientes que están siendo tratados en nuestros programas de hemodiálisis facilitando la comparación con otros centros y la evolución de nuestro centro a lo largo del tiempo.
No son (salvo la tasa bruta de mortalidad anual) indicadores como tal, sino términos de referencia, que nos permiten conocer determinadas características de los pacientes y de los centros que influyen en los resultados.
a) Incidencia en hemodiálisis (HD)
Definición
Número de pacientes nuevos que se ha incorporado a la Unidad de HD entre el 1 de enero y el 31 de diciembre de ese año, en relación con el número de pacientes que había en la Unidad al inicio del año. Se considera paciente nuevo aquel que inicia tratamiento de diálisis de forma ambulatoria.
Fórmula
Numerador: 100 x número de pacientes que se han incorporado a la Unidad de HD entre el 1 de enero y el 31 de diciembre.
Denominador: número pacientes en la Unidad al inicio del año (1 de enero).
Unidades: porcentaje.
Periodicidad: anual.
b) Prevalencia de periodo HD
Definición
Es el número TOTAL de pacientes que están siendo o han sido tratados en la Unidad de HD entre el 1 de enero y el 31 de diciembre de ese año.
Fórmula
Suma de pacientes prevalentes a 31 de diciembre del periodo de estudio+bajas en HD (Bajas en HD: éxitus+trasplantados+traslados+recuperación de la función renal).
Unidades: número de pacientes/año.
Periodicidad: anual.
c) Tasa Bruta de Mortalidad Anual
Definición
Es el porcentaje de pacientes tratados en la Unidad que han fallecido entre el 1 de enero y el 31 de diciembre de ese año.
Fórmula
Numerador: 100 x número de muertes hasta el 31 de diciembre.
Denominador: prevalencia de periodo HD.
Unidades: porcentaje.
Periodicidad: anual.
d) Mediana del Índice de Comorbilidad Charlson en pacientes incidentes en HD
Fundamento
El Índice de Comorbilidad Charlson (ICC) es un instrumento útil para poder valorar la comorbilidad y predecir la supervivencia de los pacientes incidentes en hemodiálisis (se propone el Índice original de Charlson modificado) ICC m) por Beddhu et al. (Anexo 8).
Fórmula
Mediana del Índice de Charlson modificado calculado durante el primer mes de tratamiento, de todos los pacientes incidentes.
Unidades: puntuación del índice (numéricas).
Periodicidad: anual.
Anemiaa) Porcentaje de pacientes con hemoglobina objetivo
Comentario
Los KDIGO del año 2012 recomiendan263 no usar agentes estimulantes de la eritropoyesis (AEE) con hemoglobina (Hb) > 11,5g/L, aunque reconoce que algunos pacientes pueden necesitar Hb por encima de estos niveles para mejorar la calidad de vida y entendiendo el posible riesgo asociado con una Hb por encima de estos niveles.
Recomienda, además, que las AEE no se usen para incrementar intencionadamente la Hb > 13g/dL, dado que la posibilidad de tener efectos adversos es mayor que la posible mejoría en la calidad de vida de los pacientes o en la disminución de las necesidades transfusionales.
Las guías KDOQI540 en pacientes en diálisis establecen que la Hb objetivo esté de forma habitual en un rango de 11-12,0g/dL y que la Hb objetivo no supere los > 13,0g/dL. No aplicable a población pediátrica544. El grupo de trabajo sobre anemia de las Guías Europeas Renales (ERBP) sigue las mismas recomendaciones realizadas por las KDOQI del año 2007543.
Debido a la importante variabilidad de la Hb es muy difícil conseguir el objetivo de mantenerlo dentro de un rango estrecho de Hb. Soffritti et al.545 en un estudio retrospectivo observan que solo un 4,3% de los pacientes mantienen una Hb objetivo dentro de un rango de Hb comprendido entre 11-12g/dL durante el periodo del estudio. Portolés et al.546, en un estudio prospectivo multicéntrico, observan que un 3,8% de los pacientes mantienen una Hb dentro de un rango de entre 11-13g/dL durante los 12 meses que duró el estudio.
Por tanto, consideramos que este indicador, que está definido entre unos márgenes tan estrechos, es un indicador de dudosa utilidad que debería ser reconsiderado dado que, por su variabilidad, es un indicador de baja especificidad y sensibilidad.
Se consideran sólo los pacientes que lleven > 4 meses en HD para dar un margen de corrección de la anemia de los pacientes y evitar sesgos entre unidades con diferentes incidencias de enfermedad renal crónica (ECR) estadio 5.
Las mujeres tienen más posibilidades de ser diagnosticadas de anemia y recibir eritropoyetina en exceso. Las guías clínicas de ERC consideran un punto de corte único para anemia para ambos sexos536, teniendo las mujeres fisiológicamente menos hemoglobina que los hombres. Consecuentemente, las mujeres requieren más eritropoyetina para conseguir el mismo hematocrito547.
Fundamento
En los pacientes, con ERC en HD se recomienda que la Hb objetivo esté de forma habitual en un rango entre 11-12g/dL. En caso de varias determinaciones, se usará la media de determinaciones de Hb para cada paciente en ese periodo (un mes). Se admite como adecuada una determinación mensual.
Se consideran sólo los pacientes que lleven > 4 meses en HD para dar un margen de corrección de la anemia de los pacientes.
Fórmula
Numerador: número de pacientes del denominador con Hb media > 11g/dL < 12g/dL durante el período de estudio.
Denominador: número de pacientes en HD (durante al menos cuatro meses), prevalentes del período de estudio.
Unidades: porcentaje.
Periodicidad: mensual.
Estándar: por definir.
b) Porcentaje de pacientes con ferritina en rango óptimo 100-500 μg/L
Fundamento
Los pacientes con ERC en HD deben tener depósitos de hierro suficientes para alcanzar y mantener una concentración de Hb > 11 g/dL y < de 12 g/dL.
Los niveles de ferritina sérica por debajo de 100 μg/L son inadecuados para la regeneración de hemoglobina y sugieren un déficit absoluto de hierro.
Fórmula
Numerador: 100 x número de pacientes con ferritina entre 100-500 μg/L en el periodo de estudio.
Denominador: número de pacientes prevalentes del periodo de estudio.
Unidades: porcentaje.
Periodicidad: bimestral.
Estándar: > 80%.
Diálisis adecuadaPorcentaje de pacientes prevalentes con KT/V objetivo que lleven en HD más de 91 días y que se dializan tres veces por semana
Las guías prácticas de diálisis adecuadas de las KDOQI actualizadas en el año 2015 recomiendan que el spKT/V este en 1,4 por sesión de HD en pacientes tratados tres veces por semana y que el spKT/V mínimo sea de 1,2548. Estas recomendaciones siguen siendo las mismas que en las anteriores guías de la KDOQI. Las guías de adecuación de la diálisis europeas para la diálisis adecuada205 recomiendan el uso del KTV equilibrado (eKT/V) de 1,2 (sp KTV 1,4) para corregir la sobreestimación de la dosis de diálisis que ocurre con el modelo mono compartimental de la ecuación de Daugirdas de segunda generación549.
Fórmula
Numerador: 100 x número de pacientes del denominador con *spKT/V (Daugirdas II) medio de periodo > 1,4 (eKT/V 1,2).
Denominador: número de pacientes prevalentes de periodo, que lleven en HD > 3 meses y que se dializan tres veces por semana.
Frecuencia: bimestral.
Estándar: > 88%.
Porcentaje de pacientes prevalentes con KT
Es preferible utilizar el KT dado que evitamos el error producido al introducir un volumen de estimado de urea que tiende a sobrestimarlo en las mujeres86 o en pacientes de bajo peso y en pacientes jóvenes238,550. En 2005, la dosis mínima de Kt se individualizó de acuerdo con el área de la superficie corporal (BSA)236 y se validó en un estudio adicional237.
Para definir y validar las recomendaciones de Kt mínimo en la población de diálisis española, recientemente se publicó un estudio prospectivo, observacional y multicéntrico550 donde se observó que los pacientes que reciben la dosis adecuada de diálisis por Kt individualizada para BSA mejoraron la supervivencia y redujeron las hospitalizaciones a los dos años, en comparación con las que no lo hicieron. Asimismo, se demostró que prescribiendo una dosis adicional de 3 L o más por encima de la dosis mínima de Kt recomendado podría reducirse potencialmente el riesgo de mortalidad, y con 9 L o más reducirse el riesgo de hospitalización.
Ecuación[1] Kt mínimo =1/ (0,0069+[0,0237/BSA])
Fórmula recomendada por la nueva guía de la S.E.N., adaptada al artículo550:
Ecuación [2] Kt mínimo = (1/[0,0069+(0,0237/BSA])+3
Tabla de Kt individualizada para BSA en Anexo 9.
Fórmula
Numerador: 100 x número de pacientes con Kt mínimo.
Denominador: número de pacientes prevalentes de periodo, que lleven en HD más de 91 días y que se dializan tres veces por semana.
Frecuencia: mensual.
Estándar: > 88%.
Porcentaje de pacientes prevalentes en HDF OL con volumen de reposición recomendado
La hemodiafiltración on-line (HDF-OL) con alto volumen de reposición combina el tratamiento difusivo con el convectivo, permite un mayor aclaramiento de solutos de mediano y alto peso molecular y mejora la tolerancia hemodinámica intradiálisis551. El estudio ESHOL129 demostró que la HDF-OL posdilucional reduce la mortalidad por cualquier causa respecto a la HD en pacientes prevalentes en HD. Posteriormente, la inclusión de los principales ensayos clínicos aleatorizados en un pooling project con más de 2.700 pacientes131 y varios metaanálisis122,125 ha confirmado la disminución de la mortalidad global y cardiovascular. En un análisis post hoc, los tres ensayos clínicos que tenían la mortalidad como variable principal127,128 observaron una asociación entre el volumen convectivo y la supervivencia. A raíz de estos resultados se ha recomendado conseguir un volumen de sustitución superior a 21 L por sesión552.
Fórmula
Numerador: 100 x número de pacientes con volumen de reposición ≥ 21 L.
Denominador: número de pacientes prevalentes de periodo, que lleven en HDF-OL más de 91 días y que se dializan tres veces por semana.
Frecuencia: mensual.
Estándar: > 88%.
Indicadores del líquido de diálisisLos indicadores del agua se han modificado según las recomendaciones realizadas por las Guías de Gestión del Agua de líquido de diálisis (segunda edición 2015)37 y se incluyen las recomendaciones realizadas para la obtención del agua ultra pura.
Agua purificadaConductividad del agua tratada
Fundamento
El agua purificada debe tener una conductividad máxima de 4,3 uS.cm-l a 20°C, según especifica la Real Farmacopea Española y las Guías Europeas. En lugares donde el agua de aporte sea muy dura, de forma transitoria, se puede admitir conductividades menores de 20 uS.cm-1.
Fórmula
Numerador: 100 x número de determinaciones con valores < 5 microsiemens.
Denominador: número total de determinaciones de conductividad del agua tratada en el periodo de estudio.
Unidades: porcentaje.
Periodicidad: mensual.
Estándar: > 80%.
Porcentaje de cultivos de agua purificada con crecimiento de bacterias inferior al rango
Fundamento
La presencia de niveles de crecimiento bacteriano por encima de 50UFC/mL se asocia a una respuesta inflamatoria significativa, con producción de citoquinas y elevación de la proteína C reactiva, y las consiguientes repercusiones en términos de morbimortalidad.
Fórmula
Numerador: 100 x número de cultivos del agua tratada con crecimiento bacteriano < 50UFC/mL.
Denominador: número de cultivos del agua tratada del periodo de estudio.
Unidades: porcentaje.
Periodicidad: mensual.
Estándar: por definir.
Niveles de Aluminio en agua tratada
Fundamento
Para hacer un balance de aluminio negativo debemos mantener una concentración en el líquido de diálisis inferior a 5 ug/L. Las Unidades de Hemodiálisis deberán tener en cuenta las características del agua de la red pública, realizando controles de aluminio en el líquido de diálisis con mayor frecuencia en aquellas redes de distribución de agua, que utilizan con frecuencia alúmina (sulfato de aluminio) como fluoculante. Es aconsejable medir la concentración de aluminio antes y después del tratamiento de agua y después de cualquier modificación en la planta de tratamiento de agua.
Fórmula
Numerador: 100 x número de determinaciones de aluminio del agua tratada < 5 ug/L.
Denominador: número de determinaciones de aluminio en agua tratada del periodo de estudio.
Unidades: ug/L.
Periodicidad: semestral.
Estándar: 100%.
Niveles de endotoxinas en el agua tratada
Fundamento
La contaminación bacteriana es el origen de las endotoxinas, que pueden pasar al compartimento sanguíneo del dializador, bien sea por retro-filtración o, en el caso de las de tamaño más pequeño, por retro-difusión, induciendo un estado inflamatorio por activación de los monocitos. El paso de endotoxinas se ha demostrado en todos los dializadores. La detección de endotoxinas se puede realizar por distintos métodos, siendo el Limulus Amebocito Lisado (Análisis de Lisado de Amebocito de Limulus o LAL) el método más utilizado.
Fórmula
Numerador: 100 x número de determinaciones del denominador con valores < 0,25 UE/mL.
Denominador: número total de determinaciones de LAL realizadas durante ese periodo.
Unidades: porcentaje.
Periodicidad: mensual.
Estándar: 100%.
Agua ultrapuraConductividad del agua ultrapura
Numerador: 100 x número de determinaciones del denominador con valores < 5 microsiemens.
Frecuencia: mensual.
Estándar: > 80%.
Porcentaje cultivos de agua tratada con crecimiento de bacterias inferior al rango
Numerador: 100 x número de cultivos del agua tratada con crecimiento bacteriano < 10UFC/100mL.
Denominador: número de cultivos del agua tratada del periodo de estudio.
Frecuencia: mensual.
Estándar: 100%.
Niveles de aluminio en agua ultrapura
Numerador: 100 x número de determinaciones de aluminio del agua tratada < 5 ug/L.
Denominador: número de determinaciones de aluminio en agua tratada del periodo de estudio.
Frecuencia: semestral.
Estándar: 100%.
Niveles de endotoxinas en el agua ultrapura
Fórmula
Numerador: 100 x número de determinaciones del denominador con valores < 0,03 UE/mL.
Denominador: número total de determinaciones de LAL realizadas durante ese periodo.
Unidades: porcentaje.
Periodicidad: mensual.
Estándar: 100%.
Líquido de diálisisPorcentaje de cultivos líquido de diálisis ultrapura con crecimiento de bacterias inferior al rango
Fundamento
Para minimizar la inflamación del paciente en hemodiálisis todas las Unidades de Diálisis tienen que contar con líquido de diálisis ultrapura para todas las modalidades de diálisis.
Fórmula
Numerador: 100 x número de cultivos del agua tratada con crecimiento bacteriano < 0,01UFC/mL.
Denominador: número de cultivos del agua tratada del periodo de estudio.
Unidades: porcentaje.
Periodicidad: mensual.
Estándar: 100%.
Niveles de endotoxinas en el líquido de diálisis ultrapura
Fórmula
Numerador: 100 x número de determinaciones del denominador con valores < 0,03 UE/mL.
Denominador: número total de determinaciones de LAL realizadas durante ese periodo.
Unidades: porcentaje.
Periodicidad: mensual.
Estándar: 100%.
Acceso vascularPorcentaje de pacientes en los que se lleva un registro gráfico de zonas de punción durante las sesiones de hemodiálisis
Definición de términos
Registro gráfico de zonas de punción. Constará de un esquema de la extremidad de la FAV con un dibujo de la FAV y de las zonas de punción.
Fundamento
En cada sesión de HD es necesario un examen completo y detallado de la FAV y un registro de las zonas de punción. Para ello es de gran utilidad la existencia de un mapa de la FAV con las zonas de punción en la historia clínica del paciente.
Población a la que se aplica: pacientes prevalentes en HD y FAV funcionante.
Fuente de datos: historias clínicas de los pacientes.
Fórmula
Numerador: número de pacientes en HD en los que se registra las zonas de punción x 100.
Denominador: total de pacientes en HD en los que se está puncionando una FAV.
Unidades: porcentaje.
Periodicidad: trimestral.
Estándar: 100%.
Porcentaje de pacientes incidentes con acceso vascular utilizable
Fundamento
El número de pacientes programados que inician hemodiálisis con un acceso vascular utilizable bien sea fístula arteriovenosa (FAV) autóloga o protésica, nos da una indicación de si la planificación de la realización del mismo desde la etapa de prediálisis ha sido adecuada.
Fórmula
Numerador: 100 x número de pacientes con fístula arteriovenosa (FAV) autóloga o protésica utilizable.
Denominador: número de pacientes incidentes en el periodo de estudio.
Unidades: porcentaje.
Periodicidad: anual.
Estándar: > 75%.
Porcentaje de pacientes incidentes portadores de catéter venoso central, sin contraindicación para la realización de una fístula arteriovenosa, a los que se les realiza una fístula arteriovenosa antes de las seis semanas desde que se implanta el catéter
Fundamento
Este indicador evalúa la eficacia del equipo multidisciplinar para reducir el tiempo de exposición del paciente en HD al CVC.
Población a la que se aplica: pacientes con ERC que inician HD a través de CVC.
Fuentes de datos: Historias clínicas de los pacientes.
Fórmula
Numerador: número de pacientes incidentes sin contraindicación para FAV que inician programa de HD a través de un CVC y se les construye una FAV antes de seis semanas x 100.
Denominador: número de pacientes incidentes sin contraindicación para FAV que inician el tratamiento de HD mediante CVC.
Unidades: porcentaje.
Periodicidad: mensual.
Estándar: > 90%.
Excepciones
Pacientes con patologías que sugieran la posibilidad de recuperación de función renal y se decida mantener con CVC o que se nieguen a realizarse una FAV.
Porcentaje de pacientes prevalentes con más de tres meses en programa de hemodiálisis que, a 31 de diciembre del año estudiado, se dializan a través de una fístula arteriovenosa nativa
Fundamento
Indica el grado de implantación de los programas estructurados de seguimiento de la FAV en cada unidad de HD.
Población a la que se aplica: pacientes prevalentes que se dializan en la unidad de HD a fecha del 31 de diciembre del año de estudio.
Fuentes de datos: historias clínicas de los pacientes; programas informáticos.
Fórmula
Numerador: número de pacientes en programa de HD que se están dializando a través de una FAVn funcionante a 31 de diciembre del año estudiado x 100.
Denominador: número de pacientes con más de tres meses en programa de HD a 31 de diciembre del año en curso.
Unidades: porcentaje.
Periodicidad: anual.
Estándar: > 75%.
Comentario
Las diversas guías publicadas hasta la actualidad establecen como objetivo un porcentaje variable, entre un 60 y un 85% de pacientes prevalentes dializándose a través de una FAVn12. En nuestro país, a modo orientativo, los resultados del estudio multicéntrico del grupo de trabajo de gestión de calidad de la S.E.N., publicado en el año 2008, muestran que la mediana del porcentaje de FAVn en los centros de HD es del 50% (percentil 25: 34,5%, y percentil 75: 61,2%)664. En otros estudios, como los de las comunidades de Madrid, Canarias y Cataluña, la tasa de FAVn en el paciente prevalente es del 58,6, 64 y 73,3%, respectivamente 278,950,951. Según el estudio DOPPS 5 (2013-2014), este porcentaje es del 65% para el global de España 32. Considerando estos antecedentes, el estándar se ha establecido por el Grupo Español Multidisciplinario de Accesos Vasculares (GEMAV) en un mínimo del 75%.
Porcentaje de pacientes prevalentes con más de tres meses en programa de hemodiálisis que, a 31 de diciembre del año estudiado, se dializan a través de un catéter venoso central tunelizado
Fundamento
Indica el grado de implantación de los programas estructurados de seguimiento del AV en las unidades de HD.
Población a la que se aplica: pacientes prevalentes que se dializan en la unidad de HD a fecha del 31 de diciembre del año en estudio.
Fuentes de datos: historias clínicas de los pacientes.
Fórmula
Numerador: número de pacientes en programa de HD que se están dializando a través de un CVC tunelizado (CVT) a de diciembre del año en estudio x 100.
Denominador: número de pacientes con más de tres meses en programa de HD a 31 de diciembre del año en curso.
Unidades: porcentaje.
Periodicidad: anual.
Estándar: < 20%.
Tasa anual de trombosis de fístulas arteriovenosas nativas
Definición de términos
Trombosis. Es la anulación funcional de la FAVn, es decir, el flujo sanguíneo (QA) es de 0mL/min, que se traduce por la desaparición del frémito y del soplo en la exploración física.
Pacientes/año en riesgo. Número de días que cada paciente está con un determinado tipo de AV a lo largo de 1 año (máximo 365) dividido por 365. Ejemplo: pacientes con FAVn y número de días de diálisis: paciente A, 365 días, paciente B, 200 días y paciente C, 165; la suma es 730 días. Si dividimos 730 entre 365, el número de pacientes/año en riesgo con una FAVn es de 2.
Fundamento
Indica el grado de implantación de los programas estructurados de seguimiento del AV en cada unidad de HD.
Población a la que se aplica: pacientes prevalentes portadores de FAVn que se dializan en la unidad de HD a lo largo del año de estudio.
Fuentes de datos: historias clínicas de los pacientes.
Fórmula
Numerador: número de trombosis en FAVn en el año en estudio.
Denominador: número total de pacientes/año en riesgo con FAVn en el año en estudio.
Unidades: tasa.
Periodicidad: anual.
Estándar: < 0,15 trombosis/paciente/año.
Tasa anual de trombosis de fístulas arteriovenosas protésicas
Fundamento
Indica el grado de implantación de los programas estructurados de seguimiento del AV en cada unidad de HD.
Población a la que se aplica: pacientes prevalentes portadores de FAVp que se dializan en la unidad de HD a lo largo del año de estudio.
Fuentes de datos: historias clínicas de los pacientes.
Fórmula
Numerador: número de trombosis en FAVp en el año de estudio.
Denominador: número total de pacientes/año en riesgo con FAVp en el año de estudio.
Unidades: tasa.
Periodicidad: anual.
Estándar: < 0,50 trombosis/paciente/año.
Porcentaje de pacientes que se dializan a través de un catéter venoso central no tunelizado durante más de dos semanas consecutivas
Tipo de indicador
Indicador de RESULTADO.
Definición de términos
Catéter venoso no tunelizado (CVNT). Tipo de CVC para HD que no está situado en un túnel dentro del tejido subcutáneo ni dispone de un anclaje en él (cuff).
Fundamento
Un paciente no debe estar más de dos semanas dializándose a través de un CVNT por el mayor riesgo de infección, trombosis venosa y estenosis venosa central.
Población a la que se aplica: pacientes prevalentes que se dializan en la unidad de HD a través de un CVNT.
Fuentes de datos: historias clínicas de los pacientes.
Fórmula
Numerador: número de pacientes en programa de HD que se están dializando a través de un CVNT durante más de dos semanas x 100.
Denominador: número de pacientes en programa de HD que se están dializando a través de un CVNT.
Unidades: porcentaje.
Periodicidad: mensual.
Estándar: < 5%.
Comentario
Ante la ausencia de evidencia, el estándar se ha establecido por consenso del GEMAV.
Porcentaje de fístulas arteriovenosas nativas trombosadas, reparadasquirúrgicamente, que siguen permeables al año
Definición de términos
Trombosis. Similar a los indicadores previos.
Fundamento
Valorar la eficacia de la cirugía en el tratamiento de las FAVn trombosadas, en el contexto del manejo multidisciplinar.
Población a la que se aplica: pacientes prevalentes portadores de FAVn que se dializan en la unidad de HD o están en la consulta de ERCA a lo largo del año de estudio y precisan un rescate quirúrgico después de una trombosis.
Fuentes de datos: historias clínicas de los pacientes.
Fórmula
Numerador: número de pacientes con una FAVn que sigue permeable tras rescate quirúrgico por trombosis al año de seguimiento x 100.
Denominador: número de pacientes con una FAVn que presentan una trombosis rescatada quirúrgicamente y llevan año de seguimiento.
Unidades: porcentaje.
Periodicidad: anual.
Estándar: > 50% al año.
Comentarios
Las guías KDOQI-2006 sugieren un estándar de permeabilidad > 50% al año; las guías canadienses 2006, un 40% al año, y las guías europeas 2007, un 80% al año87,547,550.
El GEMAV ha decidido establecer por consenso una permeabilidad > 50% al año. No obstante, hay estudios272,273, que muestran que la intervención electiva de una FAV disfuncionante aumenta la duración de su permeabilidad respecto a cuándo se repara después de una trombosis. Por tanto, aunque el GEMAV ha decidido establecer por consenso una permeabilidad similar al de otras guías, > 50% al año, es probable que este indicador no esté bien dimensionado.
Porcentaje de fístulas arteriovenosas nativas trombosadas, reparadasendovascularmente,que siguen permeables a los seis meses
Definición de términos
Trombosis. Similar a los indicadores previos.
Fundamento
Valorar la eficacia del tratamiento endovascular en el tratamiento de las FAVn trombosadas, en el contexto del manejo multidisciplinar.
Población a la que se aplica: pacientes prevalentes portadores de FAVn que se dializan en la unidad de HD o están en la consulta de ERCA a lo largo del año en estudio y precisan un rescate radiológico después de su trombosis.
Fuentes de datos: historias clínicas de los pacientes.
Fórmula
Numerador: número de pacientes con una FAVn que sigue permeable tras rescate endovascular por trombosis a los seis meses de seguimiento x 100.
Denominador: número de pacientes con una FAVn que presentan una trombosis rescatada con técnicas intervencionistas radiológicas y llevan seis meses de seguimiento.
Unidades: porcentaje.
Periodicidad: anual.
Estándar: > 50% a los seis meses.
Comentarios
Las guías KDOQI-2006 sugieren un estándar de permeabilidad > 50% a los 6 meses; las guías canadienses 2006, un 40% a los 3 meses, y las guías europeas, un 50% al año86,547,550.
El Grupo Español Multidisciplinario de Accesos Vasculares (GEMAV)* ha decidido establecer por consenso una permeabilidad > 50% a los seis meses.
Enfermedades víricasTasa de seroconversiones de VHC
Fundamento
La transmisión nosocomial horizontal es la principal vía de transmisión actual para el VHC en las unidades de HD. Si se cumplen adecuadamente las Precauciones Universales recomendadas para el control de infecciones, no debería haber seroconversiones42.
Fórmula
Numerador: 100 x número de pacientes que positivizan el VHC en el periodo estudiado (Ac-VHC positivos y/o PCR positivas)
Denominador: número de pacientes en riesgo (con AcVHC y/o PCR-VHC negativas dializados en la unidad).
Unidades: porcentaje.
Periodicidad: al menos semestralmente.
Estándar: 0%.
TrasplantePorcentaje de pacientes remitidos para su evaluación al Centro de Trasplante a los seis meses de entrada en hemodiálisis periódica
Fundamento
Los centros de trasplante, dada su experiencia y especialización, deberían evaluar a todos los pacientes apropiados para su posible inclusión en la lista de trasplante renal.
Se considera como un paciente apropiado, aquel que no presenta contraindicaciones absolutas (ver Guía de Trasplante renal) y que desea ser evaluado para un trasplante renal. La entrada en lista de espera debería realizarse con la mayor brevedad posible, una vez comenzado el programa de hemodiálisis periódica.
Fórmula
Numerador: 100 x número de pacientes que han sido remitidos al centro de trasplante antes de seis meses de entrada en hemodiálisis periódica.
Denominador: todos los pacientes excepto aquellos que tengan contraindicaciones o que rechacen ser incluidos en la lista de trasplante.
Unidades: porcentaje.
Estándar: por definir.
Porcentaje de pacientes en lista de espera que han sido trasplantados
Fundamento
Es un indicador indirecto de la actividad trasplantadora de los centros de referencia y es útil para monitorizar la evolución del número de trasplantes, en relación con los que están incluidos en lista de espera en las Unidades de Hemodiálisis.
Fórmula
Numerador: 100 x número de pacientes trasplantados.
Denominador: número de pacientes en lista de espera.
Unidades: porcentaje.
Periodicidad: anual.
Estándar: por definir.
Satisfacción del pacienteEn Estados Unidos, además de disponer de los indicadores de calidad, se realiza una encuesta de satisfacción de los pacientes que se denomina ICH-CAHPS (In Center Hemodialysis Consumer Assessment Of Healthcare Providers And Systems -Encuesta de evaluación de los pacientes dializados en centros de hemodiálisis sobre los proveedores de la asistencia sanitaria y sistemas)553.
El objetivo es poder valorar la experiencia del tratamiento de hemodiálisis desde el punto de vista del paciente. Desde el año 2014 se ha ido incrementado su uso de forma progresiva al estar bonificado con 10 puntos la realización de esta encuesta de satisfacción del paciente554. En España se han validado principalmente dos encuestas de satisfacción del paciente SERVQHOS modificado para Hemodiálisis.
KDQOL -SFCuestionario de salud SF-36 o del SF-12
Criterio
La Calidad de Vida Relacionada con la Salud (CVRS) es una medida de resultado o tratamiento con hemodiálisis crónica. Debe ser medida mediante un cuestionario debidamente validado.
Fórmula
Numerador: 100 x número de pacientes del denominador que han contestado un cuestionario de CVRS (SF-36 o SF-12).
Denominador: número de pacientes prevalentes en HD, en el momento de la valoración, que están en condiciones de responder un cuestionario.
Unidades: porcentaje.
Periodicidad: anual.
Estándar: > 90%.
Revisor: Fernando Álvarez- Ude.
Comentario
Este es un indicador propuesto por el Dr. Álvarez-Ude, quien es pionero en España en este campo y por tanto una referencia esencial para poder valorar el uso de los cuestionarios de satisfacción del paciente como el SF -36/12 o de sus posibles alternativas.
SERVQUALSERVQUAL es una encuesta de calidad estructurada en 44 ítems o preguntas en las que se evalúan la calidad como la diferencia entre las expectativas y las percepciones del cliente.
El SERVQHOS es una adaptación realizada para valorar la satisfacción de la atención recibida por los pacientes. Ha sido validada para su uso hospitalario en español555 utilizado para medir el grado de calidad percibida por los pacientes en hemodiálisis556–561.
Prevención de riesgosSeguridad en la atención sanitaria es la ausencia o reducción a un mínimo aceptable, del riesgo de sufrir daño innecesario en el curso de la atención sanitaria (fuente: AMSP/OMS: Clasificación Internacional para la Seguridad de los pacientes).
La seguridad de los pacientes es un componente de la calidad asistencial y es obligación de los centros ofertar una hemodiálisis segura, efectiva y eficiente. Los efectos no deseados que se derivan de la atención sanitaria representan una causa no despreciable de morbimortalidad y suponen un elevado coste sanitario562,563.
Tanto el tipo de paciente que se atiende en los centros de hemodiálisis (población de alto riesgo, con elevada comorbilidad y fragilidad) como la creciente complejidad del entorno en el que se trabaja (alta tecnología y gran interacción del factor humano) hacen necesaria la existencia de sistemas que garanticen la seguridad. La técnica de hemodiálisis ofrece una amplia gama de posibilidades de error, que es conveniente identificar de manera específica. Las complicaciones en hemodiálisis son frecuentes, pero muchas de ellas podrían ser evitables o, al menos, minimizarse, si se tuviera la conciencia de que pueden ser eventos adversos y se pusieran en marcha medidas preventivas564 (Anexo 10).
Los centros de diálisis comparten importantes riesgos para la seguridad; los pacientes reportan más ansiedad acerca de las prácticas de seguridad de lo que el personal podría predecir y el personal cree que las unidades son más seguras de lo que realmente muestran los datos disponibles565.
Recomendaciones
- •
Consideramos necesario que los centros dispongan de un Plan de Seguridad; es decir, que tenga establecidas y definidas un conjunto de acciones para disminuir los riesgos de daños innecesarios inherentes a la atención sanitaria566.
- •
Cualquier estrategia utilizada para implementar planes de seguridad en la asistencia sanitaria es útil. Una de estas estrategias es el sistema AMFE o análisis modal de fallos potenciales y sus efectos. Es una técnica de prevención que consiste en implementar acciones correctivas en el proceso, especialmente seleccionadas para reducir el efecto del fallo desde la óptica del usuario final. Esto se logra bien disminuyendo o eliminando la probabilidad de ocurrencia del fallo, bien mejorando el sistema de detección para evitar que su efecto llegue al paciente567,568.
- •
El incremento de la seguridad del paciente en HD requiere, en primer lugar, conocer qué complicaciones cumplen los requisitos para ser consideradas eventos adversos potenciales o reales, y que, por tanto, deban ser registradas para el análisis de sus causas y su prevención; y en segundo lugar, la implementación de prácticas seguras en la prestación asistencial (Índice de Prioridad de Riesgos), empleando, por ejemplo, el AMFE, que permite estratificar los posibles errores y eventos adversos de las unidades de diálisis, y en función de la gravedad o importancia del NPR en el proceso, actuar con mayor o menor premura en el desarrollo e implementación de las acciones de mejora necesarias. Tras un periodo establecido se reevaluará el modo de fallo otorgándole un nuevo NPR. Así con todos y cada uno de los modos de fallo desarrollados en el AMFE569,570.
- •
Es necesaria la existencia de un equipo específicamente dedicado a la seguridad, que debe incluir no solo a profesionales de la salud, sino también a las personas sanas (familiares) y los pacientes. El personal y los pacientes deben ser alentados a expresar sus preocupaciones en un ambiente libre de culpa que se esfuerza por crear una cultura de la seguridad. El responsable de la unidad de diálisis debe establecer una cultura de seguridad y dirigir el proceso de evaluación de la calidad y la mejora del rendimiento571,572.
- •
Cada centro deberá establecer sus propios planes de seguridad. En algunos de los principales eventos adversos, a modo de ejemplo, deben quedar definidas las medidas preventivas se exponen a continuación570.
Nutrición
Fundamento
Porcentaje de pacientes con cifra media de albúmina > 3,5g/dL.
Fórmula
Numerador: 100 x número de pacientes del denominador con cifra media de albúmina sérica en el periodo de estudio > 3,5g/dL.
Denominador: número de pacientes prevalentes en esos puntos de corte.
Periodicidad: bimestral
Estándar: por definir.
Comentario
Unos niveles de albúmina > 3,5mg/dL están asociados con una mejor supervivencia de los pacientes en hemodiálisis573,574, pero los niveles de albúmina están afectados por las características de nuestros pacientes pluripatológicos con múltiples ingresos hospitalarios asociado muchas veces con procesos infecciosos/inflamatorios577,578 que tiene un profundo y sostenido efecto en la disminución de la síntesis de la albúmina y en el incremento de su catabolismo. Además, existe una variabilidad en los niveles de albúmina que se incrementan con la edad de los pacientes579. Estos factores no son modificables con las técnicas de diálisis571,580 y por lo tanto aunque sí que se deben de controlar de forma periódica, como está mencionado en el Capítulo 7 de las Guías del año 2006, no creemos que se deba incluir como una medida cuantitativa que puedan ser utilizados para la evaluación y seguimiento de la calidad del manejo de los pacientes en hemodiálisis.
Dosis media semanal de eritropoyetina (EPO)
Fundamento
La dosis media de EPO mide, de forma indirecta, la eficiencia en el manejo de la anemia y la adecuación a las guías y recomendaciones establecidas por las Sociedades Científicas. Se considera como un indicador de alerta en el manejo general de la anemia. Cambios en este indicador pueden alertar sobre problemas de resistencia, calidad del agua, mal manejo de la ferroterapia, etc.
A título de orientación, la dosis de mantenimiento de EPO en estudios españoles oscila entre 110 y 125 U/kg/semana. Según vías de administración (MAR), el estudio europeo DOPPS lo fija en 109 (predominio de vía sc).
Fórmula
Numerador: dosis media semanal administrada de rh-EPO (U/kg/sem) en el periodo de estudio a los pacientes prevalentes HD de periodo.
Denominador: pacientes mes en riesgo (pacientes tratados con rh-EPO).
Unidades: unidades/kg/semana.
Periodicidad: mensual.
Estándar: a definir, distinguiendo entre vía sc y vía iv.
Dosis media semanal de darbepoetina (U/kg/semana)
Fundamento
El mismo. A título de orientación, la dosis semanal de darbepoetina en pacientes en hemodiálisis está entre 30- 45μg/semana.
Fórmula
Numerador: dosis media semanal administrada de darbepoetina (μg/kg/semana) en el periodo de estudio a los pacientes prevalentes HD de periodo.
Denominador: pacientes mes en riesgo (pacientes tratados con darbepoetina).
Unidades: μg/kg/sem.
Comentario
La respuesta a la administración de EPO en los pacientes en hemodiálisis depende de múltiples factores que no están relacionadas con la calidad del tratamiento y que por tanto son difíciles de modificar por parte del equipo asistencial. Factores inflamatorios (PCR, IL-6, factor de necrosis tumoral), nutricionales como unos niveles bajos de albúmina, el número de hospitalizaciones de los pacientes y las propias características de los pacientes como la edad o el sexo femenino212,581,582.
FinanciaciónLa edición de este documento ha sido sufragada íntegramente por la Sociedad Española de Nefrología (S.E.N.).
Los coordinadores, autores y editores de esta Guía de Unidades de Hemodiálisis, queremos agradecer a todas las personas que han hecho posible la elaboración de la misma y que han participado tanto en la planificación, realización, redacción y revisión de los contenidos.
Mención especial a todos los autores y revisores, así como a la Sociedad Española de Nefrología (S.E.N.) y a sus miembros, por el tiempo y el esfuerzo que cada uno ha dedicado a la discusión de los aspectos más controvertidos y a la aportación de temas de gran alto valor. Creemos que la perspectiva multidisciplinar de todos los profesionales involucrados ha hecho posible el abordaje de diversos temas desde distintos puntos de vista.395,491,575,576,583,584,585
Rafael Pérez García1, Francisco Maduell2.
(1) Servicio de Nefrología, Hospital Universitario Infanta Leonor, Madrid, España.
(2) Servicio de Nefrología, Hospital Clinic, Barcelona, España.
María Dolores del Pino Pino1, Carlos Quereda Rodríguez-Navarro2
(1) Presidenta de la Sociedad Española de Nefrología.
(2) Coordinador de Guías de Práctica Clínica y Documentos de Consenso.
Guillermo Alcalde Bezhold1, Roberto Alcázar Arroyo2, Manuel Angoso de Guzmán3, Mª Dolores Del Pino y Pino4, Domingo Hernández Marrero5, Francisco Maduell6, Alfonso Otero González7, Rafael Pérez García8
(1) Hospital Universitario Araba, Servicio de Nefrología, Vitoria, España
(2) Hospital Universitario Infanta Leonor, Servicio de Nefrología, Madrid, España
(3) Hospital Vithas Consuelo, Servicio de Nefrología, Valencia, España
(4) Complejo Hospitalario Torrecárdenas, Servicio de Nefrología, Almería, España
(5) Hospital Regional Universitario de Málaga, Servicio de Nefrología, Málaga, España
(6) Hospital Clinic, Servicio de Nefrología, Barcelona, España
(7) Complejo Hospitalario Universitario de Ourense, Servicio de Nefrología, Ourense, España
(8) Hospital Universitario Infanta Leonor, Servicio de Nefrología, Madrid, España
Dolores Arenas Jiménez1, Marta Arias-Guillén2, Ángel Martín de Francisco Hernández3, Alejandro Martín Malo4, Rosa Inés Muñoz González5, Rafael Díaz-Tejeiro Izquierdo6, Milagros Fernández Lucas7, Eduardo Gutiérrez Martínez8, Raquel Ojeda López9, Mario Prieto Velasco10, Patrocinio Rodríguez Benítez11, Alfredo José Sáenz Santolaya12, María Fernanda Slon Roblero13, José Luis Teruel Briones14, Fernando Tornero Molina15
(1) Fundación Renal Íñigo Álvarez De Toledo, Servicio de Nefrología, Madrid, España
(2) Hospital Clinic, Servicio de Nefrología, Barcelona, España
(3) Hospital Universitario Marqués de Valdecilla, Servicio de Nefrología, Santander, España
(4) Hospital Universitario Reina Sofía, Servicio de Nefrología, Córdoba, España
(5) Hospital de Galdakao, Servicio de Nefrología, Galdakao (Vizcaya), España
(6) Complejo Hospitalario Universitario de Toledo, Servicio de Nefrología, Toledo, España
(7) Hospital Universitario Ramón y Cajal, Servicio de Nefrología, Madrid, España
(8) Hospital Universitario 12 de Octubre, Servicio de Nefrología, Madrid, España
(9) Hospital Universitario Reina Sofía, Servicio de Nefrología, Córdoba, España
(10) Complejo Asistencial de León, Servicio de Nefrología, León, España
(11) Hospital General Universitario Gregorio Marañón, Servicio de Nefrología, Madrid, España
(12) Hospital Universitario Infanta Leonor, Servicio de Nefrología, Madrid, España
(13) Complejo Hospitalario de Navarra, Servicio de Nefrología, Pamplona, España
(14) Hospital Universitario Ramón Cajal, Servicio de Nefrología, Madrid, España
(15) Hospital Universitario del Sureste, Servicio de Nefrología, Arganda del Rey, España