La brucelosis es una infección zoonótica con alta incidencia en México. La afectación de Brucella se inicia en el sistema reticuloendotelial, con diseminación al bazo, al hígado, al riñón, al sistema nervioso central y a la médula ósea. La afectación renal en la brucelosis no es común, cerca del 3%. La nefropatía asociada a brucelosis se clasifica en 3 tipos: nefritis intersticial aguda, forma crónica con la formación de granulomas con necrosis caseosa y glomerulonefritis asociada a endocarditis por Brucella. Presentamos el caso de una mujer de 40 años que presenta una glomerulonefritis por Brucella asociada a endocarditis, y una revisión del tema.
INTRODUCCIÓN
La brucelosis es una infección zoonótica que se transmite de animales a los seres humanos. Los seres humanos son huéspedes accidentales que adquieren la enfermedad por contacto directo con un animal infectado, por la ingestión de productos alimenticios infectados o por la inhalación de aerosoles.
Existen 4 especies de Brucella: B. suis (cerdos), B. melitensis (ovejas), B. abortus (ganado) y B. canis (perros). Son cocobacilos Gram negativos que carecen de flagelos, endosporas y cápsula. La enfermedad se caracteriza por manifestaciones clínicas como fiebre (90% de los casos), síntomas constitucionales (26%), hepatomegalia (17%), esplenomegalia (16%), linfadenopatías (7%), afectación articular (20%), afectación del sistema nervioso central (3%), afectación cardiovascular (< 3%), afectación renal (2%), transaminasemia (15%) y afectación hematológica (45%).
La nefropatía por Brucella se clasifica en 3 tipos: nefritis intersticial aguda o pielonefritis durante el curso de la infección aguda, forma crónica con granulomas con necrosis caseosa y glomerulonefritis (GMN) asociada a endocarditis por Brucella.
En la afectación aguda existe nefritis intersticial aguda y se presenta con proteinuria, hematuria, piuria y disuria. Si el daño se hace crónico, se desarrollan granulomas que imitan la tuberculosis renal, y se caracteriza por infiltrados linfocíticos y granulomas ocasionales. La GMN asociada a una endocarditis se debe a daño por complejos inmunes; se presenta una afectación glomerular focal, segmentaria o difusa, con proliferación endocapilar prominente y una infiltración leucocitaria. Otros hallazgos histopatológicos en series de casos de GMN asociada a endocarditis reportados fueron la lesión tubular aguda (86%) y la nefritis tubuloinstersticial (88%). El grado de atrofia tubulointersticial y de fibrosis presente era leve (43%) o ausente (37%). En cuanto a la inmunofluorescencia (IF): con depósitos de C3 (94%); IgM (37%); IgA (29%), e IgG (27%).
CASO CLÍNICO
Mujer de 40 años, que acude por presentar fiebre, escalofríos y artralgias con artritis poliarticular simétrica (metatarsofalángicas, rodillas, metacarpofalángicas e interfalángicas proximales) de 1 mes de evolución. Recibió ciprofloxacino y eritromicina, sin haber mejoría.
En la exploración física: presión arterial, 90/70 mmHg; frecuencia cardíaca, 80 lpm; frecuencia respiratoria, 16 rpm; temperatura, 38,5 ºC; oximetría de pulso, 96% al aire ambiental. Estaba consciente, bien hidratada; fondoscopia ocular normal; tórax sin alteraciones; ruidos cardíacos rítmicos con la presencia de soplo III/IV holosistólico mitral y aórtico; abdomen con hepatomegalia sin esplenomegalia; extremidades con lesiones purpúricas.
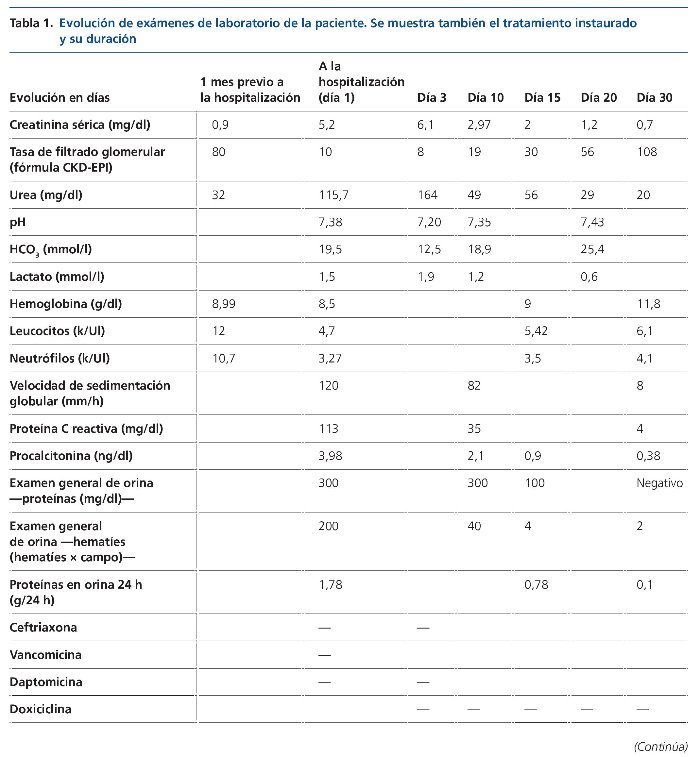
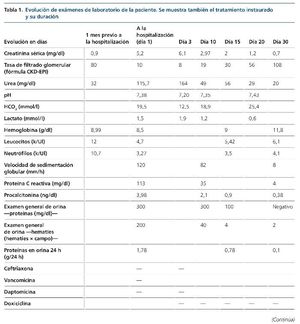
Una hermana con lupus eritematoso sistémico y otra con poliquistosis renal. Refiere consumo de productos lácteos no pasteurizados. Los exámenes de laboratorio y la evolución se muestran en tabla 1. Un examen general de orina mostró: proteínas, 300 mg/dl, 1,74 g/24 h, eritrocitos > 200 hematíes por campo, sin dismorfismos.
En el ecocardiograma se observó: cardiopatía congénita por válvula aortica bivalva; 2 vegetaciones en cada valva de 15 × 5,6 mm y otra de 15 × 5 mm, que condicionan una doble lesión aórtica con insuficiencia aórtica grave y estenosis leve; una fracción de eyección del ventrículo izquierdo del 75%.
Anticuerpos antinucleares, 1:80 patrón moteado grueso; anticoagulante lúpico, negativo; C-ANCA (anticuerpos citoplasmáticos antineutrófilos), negativos; P-ANCA, positivos; complemento, bajo: C3, 30 mg/dl (rango, 90-180 mg/dl), C4 4 mg/dl (rango, 10-40 mg/dl); anticardiolipinas IgG, 10, IgM, 19; factor reumatoide, negativo, y serologías para VIH (virus de la inmunodeficiencia humana), VHB (virus de la hepatitis B), VHC (virus de la hepatitis C), VDRL (prueba serológica para la sífilis), negativas.
Rosa de Bengala, positiva; 2-mercaptoetanol (2-ME), positivo (1:480); aglutininas anti-Brucella IgG, positivas (1:1.600); hemocultivos, urocultivos, mielocultivos y cultivo de secreción, negativos. Durante la hospitalización se complicó con infección del tracto urinario por Escherichia coli BLEE (productora de betalactamasas de espectro extendido) asociada a sonda urinaria. Se administró antibiótico dirigido a endocarditis por Brucella, además de recambio valvular quirúrgico.
Presentó un deterioro progresivo de la función renal (elevación de azoados y oliguria), así como desequilibrio ácido- base con sobrecarga de volumen, por lo que inició hemodiálisis intermitente.
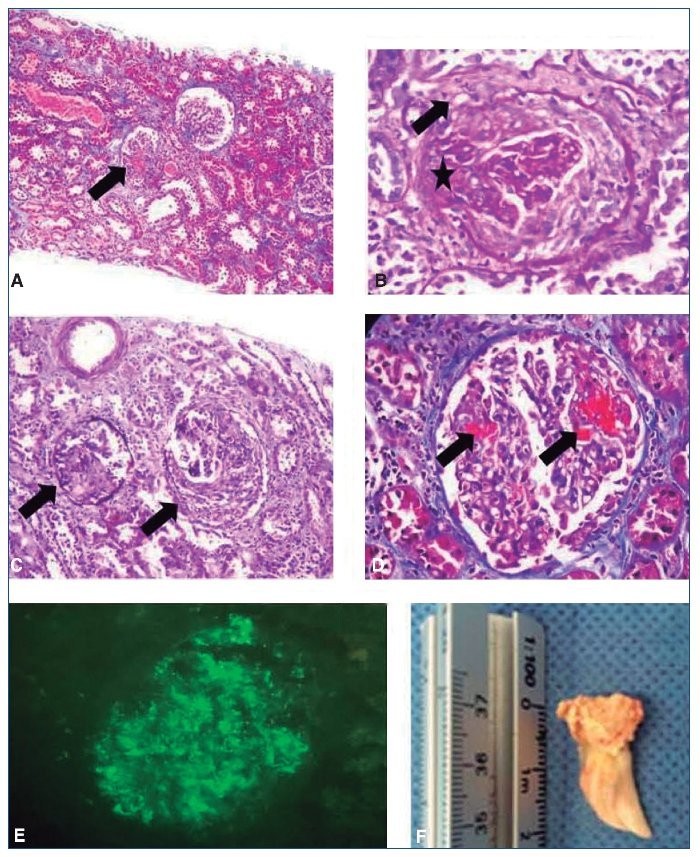
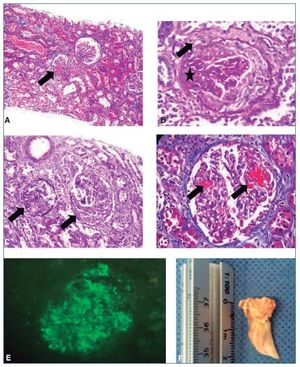
Se realizó biopsia renal percutánea, en la que se observaron 15 glomérulos, de los cuales 1 presentaba esclerosis global, 2 con proliferación extracapilar y medias lunas celulares y 2 con necrosis fibrinoide segmentaria; los restantes exhibían discreta proliferación mesangial y las paredes capilares eran de aspecto normal, sin engrosamiento ni irregularidades de la membrana basal (tinciones de PAS y Jones). No se observó proliferación intracapilar ni la presencia de complejos inmunes. Los túbulos mostraban un citoplasma vacuolado, con fenómeno de no sustitución y pérdida del borde en cepillo. Se observaron escasos cilindros, hialinos y granulosos en la luz, sin atrofia. El intersticio, evaluado con tricrómico de Masson, no exhibía fibrosis y el infiltrado inflamatorio era linfoplasmocitario y afectaba al 20%. Vasos: arterias y arteriolas de mediano calibre, con luces permeables, sin necrosis ni vasculitis. IF directa: las reacciones realizadas para C3c fueron positivas con intensidad de 3(+) y patrón en guirnalda. IgG, IgA, IgM y C1q, negativas (fig. 1).
Figura 1. Biopsia renal: glomerulonefritis necrosante proliferativa extracapilar posinfecciosa. Necrosis tubular aguda, con daño crónico tubulointersticial, a la inmunofluorescencia directa: las reacciones para C3c fueron positivas, con intensidad 3 (cruces) en patrón guirnalda. IgG, IgA, IgM y C1q, negativas.
A) Tinción HE: glomérulos con medias lunas celulares (marcado con flechas), sin daño tubulointersticial crónico. B) Tinción PAS: glomérulo con proliferación extracapilar (marcado con flechas) y media luna celular (marcado con asterisco). C) Tinción de Jones: glomérulo con medias lunas celulares (marcado con flechas). D) Tinción de Masson: necrosis fibrinoide (marcado con flechas). E) Inmunofluorescencia C3c+: patrón en guirnalda. F) Válvula aórtica con calcificación de cuerdas y músculos, en la que se observan cambios degenerativos, con tinción Gram de cocobacilos Gram negativos, levemente con ZN, tricrómica (–) y Giemsa (–).
La paciente requirió hemodiálisis, y conforme se instauró el tratamiento antimicrobiano, así como el reemplazo valvular, la función renal fue mejorando y llegó hasta la normalidad (tabla 1).
Este caso llama la atención por tratarse de una GMN durante el curso de brucelosis asociada a endocarditis, con una susceptibilidad por la anormalidad de la válvula aortica.
DISCUSIÓN
La afectación renal en la brucelosis no es común. En la GMN asociada a endocarditis se pueden presentar niveles bajos de complemento C3 y el patrón histológico demuestra proliferación mesangial, proliferación focal y segmentaria, proliferación difusa y medias lunas.
En la evolución de la enfermedad suele haber mejoría después de los antibióticos, pero pueden persistir anormalidades histológicas, proteinuria e hipertensión arterial.
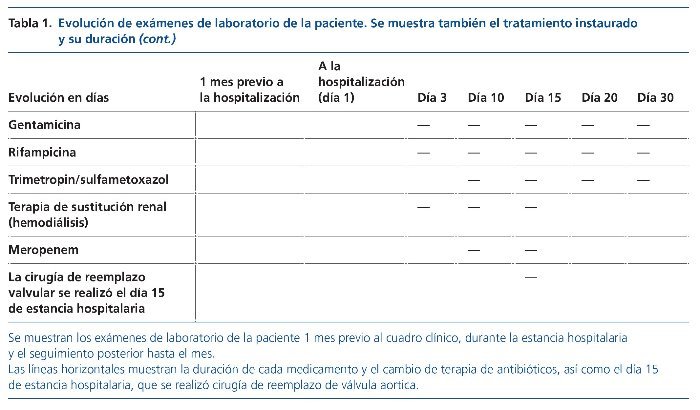
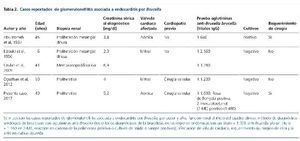
En la literatura existen 5 casos reportados de una GMN asociada a Brucella (tabla 2). En series de casos de GMN asociada a endocarditis, la clínica principal es el daño renal agudo como presentación más frecuente (79%), con hematuria presente en casi todos los casos (97%) y síndrome nefrítico agudo típico en el 10% de los casos. Los factores de riesgo reportados en 29 pacientes son el uso de drogas por vía intravenosa (29%), las prótesis valvulares (18%) y la enfermedad valvular previa (12%). También los niveles bajos de complemento C3 (50%) y, en algunos casos, C4, así como inmunidad activa a los anticuerpos p-ANCA (70%) y ANA (anticuerpos antinucleares) (15%). En el seguimiento de estos pacientes, la mayoría requirió terapia de sustitución renal (> 90%). En el seguimiento de 38 pacientes, 8 murieron (21%), 4 evolucionaron a enfermedad renal terminal (10%), 14 evolucionaron a enfermedad renal crónica (37%) y 12 recuperaron completamente la función renal (32%).
El diagnóstico definitivo de la brucelosis se realiza con la evidencia de Brucella en la sangre o en otros tejidos. Un presunto diagnóstico en pacientes con infecciones activas también se puede realizar mediante la demostración alta de títulos de anticuerpos específicos para Brucella (≥ 1:160). La aglutinación del suero es la prueba indirecta, así como el 2-mercaptoetanol (2-ME), y aún más específica es la reacción en cadena de la polimerasa. Los criterios diagnósticos de la brucelosis en las regiones endémicas son un título ≥ 1:320 en STAT (prueba estándar de aglutinación en tubo) y/o un título ≥ 1:160 en 2-ME. En los casos con GMN, la infección por Brucella se demuestra por los hallazgos en el tejido renal mediante biopsia y, además, por los métodos diagnósticos habituales de dicha infección.
En el caso particular de endocarditis por Brucella, se propone tratamiento quirúrgico o reemplazo de válvula, así como la combinación de gentamicina, rifampicina, doxiciclina y trimetropim con sulfametoxazol, al menos durante 6 semanas.
CONCLUSIÓN
La afectación renal en la brucelosis es rara en las GMN posinfecciosas. En la GMN asociada a endocarditis se puede presentar como un síndrome nefrítico (10%), con niveles bajos de complemento C3 (50%), con patrones histológicos de proliferación mesangial, proliferación focal y segmentaria, proliferación difusa y medias lunas. En las series de casos reportadas existía como factor de riesgo una anormalidad valvular coexistente o ser portador de válvula protésica con el consecuente recambio quirúrgico. A pesar de instaurar el tratamiento antimicrobiano, el daño renal agudo fue una constante, con requerimiento elevado de terapia dialítica (> 90%).
Conflicto de intereses
Los autores declaran que no tienen conflicto de intereses potencial relacionado con los contenidos de este artículo.
Correspondencia: Guillermo Navarro-Blackaller
Servico de Nefrología.
Hospital Civil de Guadalajara.
Calle Hospital, 278. Colonia El Retiro. Guadalajara. 44280 México.
greenavarroblackalle@hotmail.com
Revisión por expertos bajo la responsabilidad de la Sociedad Española de Nefrología.
REFERENCIAS BIBLIOGRÁFICAS RECOMENDADAS
Abu Romeh SH, Kozma GN, Jonhy KV, Sabha M. Brucella endocarditis causing acute renal failure. Nephron. 1987;46:388-9.
Bakri FG, Wahbeh A, Mahafzah A, Tarawneh M. Brucella glomerulonephritis resulting in end-stage renal disease: a case report and a brief review of the literature. Int Urol Nephrol. 2008;40:529-33.
Boils CL, Nasr SH, Walker PD, Couser WG, Larsen CP. Update on endocarditis-associated glomerulonephritis. Kidney Int. 2015 ;87:1241-9.
Ceylan K, Karahocagil MK, Soyoral Y, Sayarlioğlu H, Karsen H, Dogan E, et al. Renal involvement in Brucella infection. Urology. 2009; 73:1179-83.
Elzouki AY, Akthar M, Mirza K. Brucella endocarditis associated with glomerulonephritis and renal vasculitis. Pediatr Nephrol. 1996;10: 748-51.
Hoen B, Duval X. Infective Endocarditis. N Engl J Med. 2013;369:784-5.
Khorvash F, Keshteli AH, Behjati M, Salehi M, Emami Naeini A. An unusual presentation of brucellosis, involving multiple organ systems, with low agglutinatingtiters: a case report. J Med Case Rep. 2007;1:53.
Oguzhan N, Akgun H, Unal A, Ardic I, Caliskan TA, Cilan H, et al. Brucella glomerulonephritis and prosthetic valve endocarditis: a case report. Int Urol Nephrol. 2012;44:643-6.
Pappas G, Akritidis N, Bosilkovski M, Tsianos E. Brucellosis. N Engl J Med. 2005;352:2325-36.
Siegelmann N, Abraham AS, Rudensky B, Shemesh O. Brucellosis with nephrotic syndrome, nephritis and IgA nephropathy. Postgrad Med J. 1992;68:834-6.
Ustun I, Ozcakar L, Arda N, Duranay M, Bayrak E, Duman K, et al. Brucella glomerulonephritis: case report and review of the literature. South Med J. 2005;98:1216-7.