INTRODUCCIÓN
El síndrome de anticoagulante lúpico-hipoprotrombinemia (LAHS) es un extraño trastorno que se caracteriza por el déficit adquirido del factor II de la coagulación (protrombina), junto con la presencia de anticoagulante lúpico (AL), en el que predomina la diátesis hemorrágica sobre la trombofilia1. Presentamos el caso de un varón en el que debutó el lupus eritematoso sistémico (LES) con un fracaso renal agudo por una diátesis hemorrágica en el contexto del LAHS.
CASO CLÍNICO
Paciente varón de 14 años de edad, sin antecedentes familiares de enfermedad renal, con antecedentes personales de trastorno de déficit de atención e hiperactividad y de coartación de aorta, en seguimiento por psiquiatría y cardiología infantil, respectivamente.
Un mes antes de su ingreso, acude a urgencias por orinas hematúricas, por lo que es remitido a medicina interna. En la analítica presentó función renal normal y baja actividad de protrombina, con tiempo de tromboplastina parcial activado alargado.
Acude a urgencias por epistaxis masiva y hematuria macroscópica, motivo por el que consultan con el otorrinolaringólogo y el nefrólogo de guardia.
A su llegada a urgencias, se le realiza un taponamiento nasal, que resulta efectivo, y se extrae analítica tanto de sangre como de orina. Se detecta fracaso renal agudo: creatinina plasmática, 1,7 mg/dl (valores normales [VN], 0,5-1,2); urea, 68 mg/dl (VN, 15-45), y anemia (hemoglobina, 9,8 mg/dl; VN, 13-17,5), con frotis sanguíneo sin datos de hemólisis y una alteración de la coagulación consistente en baja actividad de protrombina con tiempo de tromboplastina parcial activado alargado. En sedimento urinario destacaba hematuria (10% hematíes dismórficos) y proteinuria. Ante estos hallazgos, se decide ingreso a cargo de nefrología y se realiza interconsulta a hematología.
A su ingreso, el paciente presentaba buen estado general y exploración física normal, excepto eritema en zona malar y en lóbulos de las orejas y mínimos edemas maleolares. La presión arterial era de 148/75 mmHg.
Durante la estancia hospitalaria se realizaron diversos estudios, cuyos resultados más relevantes se detallan a continuación. Los datos analíticos más destacados se recogen en la tabla 1. Los ANCA (anticuerpos anticitoplasma de neutrófilos) y las serologías para VHB (virus de la hepatitis B), VHC (virus de la hepatitis C) y VIH (virus de la inmunodeficiencia humana) fueron negativos. La ecografía renal evidenció riñones de ecoestructura y tamaño normales. El electrocardiograma mostró un ritmo sinusal sin alteraciones.
Por parte de hematología se indica la administración de vitamina K y realizan estudio de coagulopatía (tabla 2). En primer lugar, realizan un estudio de mezclas con plasma normal, que consiste en la evaluación de la corrección del plasma del paciente con plasma normal en proporción 1:1 (fig. 1). Se solicitó un estudio de coagulación que demostró un AL circulante y un déficit en la actividad del factor II de la coagulación (protrombina), que se corregía con la mezcla.
Figura 1. Estudio hematológico.
aPTT: tiempo de tromboplastina parcial activada; LES: lupus eritematoso sistémico.
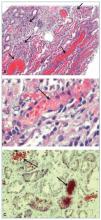
Ante la coagulopatía que presentaba, se indicaron esteroides en bolos (500 mg/24 h durante 3 días), y, una vez corregida la coagulación, se realizó biopsia renal ecodirigida en tiempo real (fig. 2).
Figura 2. Imágenes anatomopatológicas de biopsia renal.
A) Hematoxilina eosina, ×10 de aumento. Se observan 3 glomérulos de características normales, con ligera hipercelularidad mesangial. Asimismo, se observan varios túbulos en la parte inferior llenos de hematíes rojos. Estos hematíes se encuentran en relación con la hematuria producida por la nefropatía lúpica junto con el sangrado de la coagulopatía, que ha producido daño tubular. B) A más aumento se observa un túbulo lleno de hematíes. C) Con método tricómico de Masson, en el túbulo de la parte superior izquierda se observan hematíes normales, mientras que en el de la parte inferior derecha, hematíes dismórficos o degenerados, lo que indica que han estado un tiempo en el túbulo y que han causado el daño tubular.
La función renal sufrió un deterioro progresivo, con disminución del ritmo de diuresis, que precisó sesiones de hemodiálisis en días alternos (fig. 3). El paciente, además, presentó durante su estancia hospitalaria otras complicaciones, como hipertensión arterial de muy difícil tratamiento, con necesidad de medicación intravenosa, estatus convulsivo, plaquetopenia y hemorragia pulmonar, motivo por el que se trasladó a la unidad de cuidados intensivos (UCI), con necesidad de intubación orotraqueal, donde se realizaron 10 sesiones de plasmaféresis con reposición de plasma fresco y se inició ciclofosfamida en bolos quincenales de 500 mg (6 bolos en total).
Figura 3. Gráfico evolutivo de la función renal.
HD: hemodiálisis; UCI: unidad de cuidados intensivos.
Tras el alta de la UCI, la presión arterial se controló y se pudo suspender parte de la medicación hipotensora, y la función renal mejoró progresivamente, por lo que se pudieron suspender las sesiones de hemodiálisis a partir del quinto bolo de ciclofosfamida.
DISCUSIÓN
Ante un paciente en edad pediátrica, con diátesis hemorrágica y con una fuerte sospecha de LES, en el que además se ha detectado AL circulante y déficit de factor II de la coagulación, se debe sospechar el LAHS.
El LASH es un extraño síndrome, con menos de 100 casos referidos en la literatura. En 1960, Rapaport et al describieron por primera vez el caso de una niña de 11 años de edad, con síntomas de lupus y clínica hemorrágica, en presencia de AL y un déficit marcado de factor II de la coagulación2. Se trata de un síndrome que aparece con mayor frecuencia en la edad pediátrica y en mujeres, y que puede estar asociado a infecciones virales y enfermedades autoinmunes (sobre todo al LES, ya sea como primera manifestación o como complicación de esta), aunque también se han descrito casos asociados a fármacos o enfermedades tumorales3. Mientras que el AL, cuando se presenta de manera aislada, se asocia a un elevado riesgo de trombosis, paradójicamente el LAHS presenta riesgo de hemorragia grave cuando el déficit de factor II es marcado3. En cuanto a su mecanismo de acción, Bajaj et al demostraron, en 1983, que el plasma de pacientes con AL e hipoprotrombinemia grave contiene anticuerpos antiprotrombina no neutralizantes, que se unen a la protrombina pero no inhiben su conversión a trombina. Postularon y aportaron evidencia de que estos anticuerpos actúan formando complejos Ag-Ac, que son rápidamente depurados por el sistema monocítico macrofágico, lo que genera una disminución de factor II circulante (déficit adquirido)3.
El tratamiento del LAHS se basa en inmunosupresión, para evitar los eventos hemorrágicos e intentar eliminar el inhibidor del factor II. No existen guías que indiquen cuál es el mejor tratamiento para el LAHS, y la mayoría se basa en un tratamiento con corticoides más algún otro inmunosupresor4. El riesgo trombótico aumenta fuertemente durante el tratamiento debido a la mejoría del nivel del factor II.
A pesar de que el 50% de los pacientes desarrolla hemorragia grave, la tasa de mortalidad es < 5% después de una mediana de seguimiento de 13 meses (rango, 0,5-252 meses). El LAHS asociado a enfermedades autoinmunes se debe diagnosticar y tratar con cuidado, porque la enfermedad es persistente y las complicaciones hemorrágicas graves son comunes5.
En nuestro caso, iniciamos 3 bolos con esteroides sistémicos (metilprednisolona 500 mg/día), y posteriormente se pasó a vía oral a razón de 1 mg/kg peso/día. Tras corrección de valores de coagulación, decidimos la realización de biopsia renal.
Recibimos el diagnóstico histológico de nefritis lúpica mesangial mínima (clase I de la clasificación ISN/RPS de 2003), con inflamación intersticial leve y datos morfológicos sugestivos de daño tubular, en relación con cilindros de hematíes intratubulares, consecuencia de la hematuria macroscópica que el paciente presentaba (fig. 2).
Los brotes de hematuria mascroscópica son deletéreos para el riñón. Se han descrito episodios de insuficiencia renal aguda (IRA) en brotes de hematuria macroscópica, sobre todo en pacientes con diagnóstico de nefropatía IgA. El mecanismo causante de la IRA no solo es la obstrucción de los túbulos por cilindros de hematíes, sino que existen también fenómenos de oxidación e inflamación que afectan tanto a las células tubulares como al intersticio. A mayor duración del brote de hematuria macroscópica, peor será la recuperación de la función renal, incluso un porcentaje no despreciable de pacientes mantiene la insuficiencia renal6.
Tras los hallazgos descritos, y ante el empeoramiento progresivo de la función renal, se añadieron tratamiento inmunosupresor y antipalúdicos al tratamiento del paciente, y el paciente presentó una evolución tórpida inicial seguida de un curso clínico favorable.
CONCLUSIÓN
Es importante destacar la heterogeneidad en las manifestaciones clínicas del LES, que reflejan la complejidad de la patogenia de la enfermedad7. Se sabe que la afectación renal, que es de las más frecuentes, determina el curso y el pronóstico de esta patología.
En pacientes con nefropatía lúpica que clínicamente se presentan con diátesis hemorrágica en combinación con las alteraciones de la coagulación descritas, debemos sospechar la presencia de LAHS.
Es fundamental realizar un correcto diagnóstico y un tratamiento con inmunosupresión de cara a controlar sus manifestaciones clínicas hemorrágicas.
Conflicto de intereses
Los autores declaran que no tienen conflicto de intereses potencial relacionado con los contenidos de este artículo.
Correspondencia: Verónica de la Espada Piña
Servicio de Nefrología.
Hospital Universitario Puerto Real.
Carretera Nacional IV, km 665. 11510 Puerto Real, Cádiz.
veronica.espadap@gmail.com
Revisión por expertos bajo la responsabilidad de la Sociedad Española de Nefrología.