Los fármacos inhibidores de la calcineurina (ICN) constituyen los pilares de la moderna inmunosupresión en el trasplante renal. Sin embargo, contribuyen significativamente a la pérdida crónica de los injertos renales y a la elevada morbimortalidad en esta población por sus efectos deletéreos sobre el injerto renal, el perfil cardiovascular y la patología tumoral. Los fármacos anti-mTOR, sirolimus (SRL) y everolimus (EVE), son potentes inmunosupresores con capacidad antiproliferativa y antimigratoria, propiedades que les confieren un potencial papel protector en la disfunción del injerto, en la optimización de la función renal y en la aparición de tumores. En efecto, ensayos clínicos controlados y estudios observacionales de conversión han demostrado el efecto beneficioso de estos fármacos en términos de función renal, sin incremento significativo de las tasas de rechazo agudo. En esta revisión se analizan las evidencias del empleo de los fármacos anti-mTOR en los siguientes aspectos clínicos de los pacientes con trasplante renal: 1) prevención de la disfunción inmunológica precoz y preservación de la función renal en el uso de novo y conversión precoz o tardía; 2) disfunción crónica del injerto renal; 3) efectos cardiovasculares; 4) diabetes de novo postrasplante, y 5) patología tumoral de novo.
Calcineurin inhibitor drugs (CNI) are the mainstay of modern immunosuppression in renal transplantation. However, they contribute significantly to the chronic loss of renal grafts and the high morbidity and mortality in this population due to their deleterious effects on the renal graft, cardiovascular profile and tumour pathology. Anti-mTOR drugs, sirolimus (SRL) and everolimus (EVE) are potent immunosuppressants with antiproliferative and anti-migratory capacities. These properties mean that they have a potential protective role in graft dysfunction, in renal function optimisation and the appearance of malignant tumours. Indeed, clinical trials and observational studies have demonstrated that conversion from CNI to anti-mTOR-based maintenance therapy has beneficial effects on transplant outcomes in terms of renal function, without significant increase in acute rejection rates. This review article examines the evidence of the use of anti-mTOR in the following clinical situations following renal transplantation: 1) prevention of immune dysfunction and renal function preservation in de novo renal transplantation and after early or late CNI withdrawal; 2) chronic dysfunction of the renal graft; 3) cardiovascular effects; 4) de novo post-transplant diabetes, and 5) de novo tumour pathology.
INTRODUCCIÓN
Los fármacos inhibidores de la calcineurina (ICN) constituyen los pilares de la moderna inmunosupresión, pero sus efectos deletéreos sobre el paciente y el injerto renal contribuyen a que las tasas de supervivencia del trasplante renal (TX) a largo plazo no hayan mejorado acorde a los buenos resultados obtenidos durante el primer año post-TX1.
Durante los últimos años, el advenimiento de nuevos inmunosupresores ha permitido diseñar estrategias terapéuticas encaminadas a minimizar el impacto negativo de los ICN sobre la disfunción crónica del injerto y la comorbilidad cardiovascular y tumoral. Sin duda, esto pudiera incrementar los resultados de supervivencia, especialmente en individuos longevos que reciben el TX de donantes de edad avanzada.
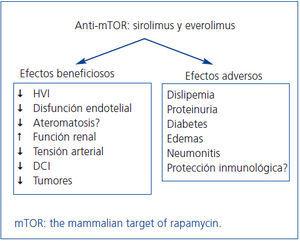
Los fármacos anti-mTOR, sirolimus (SRL) y everolimus (EVE), son potentes inmunosupresores con capacidad antiproliferativa y antimigratoria por bloqueo de la señalización intracelular que regula el crecimiento y la proliferación de las células T2. Esto les confiere un potencial papel protector en la disfunción del injerto renal, al mismo tiempo que pueden optimizar el perfil cardiovascular y reducir la aparición de tumores de novo. Sin embargo, sus efectos secundarios pudieran contrarrestar estos beneficios a más largo plazo (figura 1).
En esta revisión, analizaremos las evidencias del empleo los fármacos anti-mTOR en el campo del TX, profundizando en las evidencias de los siguientes aspectos clínicos: 1) prevención de la disfunción inmunológica precoz y preservación de la función renal en el uso de novo y conversión precoz o tardía; 2) disfunción crónica del injerto renal; 3) efectos cardiovasculares; 4) diabetes de novo post-TX, y 5) patología tumoral de novo.
PREVENCIÓN DE LA DISFUNCIÓN INMUNOLÓGICA PRECOZ Y PRESERVACIÓN DE LA FUNCIÓN RENAL
Uso de novo
Estudios iniciales mostraron que el uso de SRL con y sin inducción, evitando ICN, se asociaba con una mejor función renal frente a regímenes con ciclosporina (CsA) con una similar tasa de rechazos agudos siempre que se asociara con micofenolato mofetil (MMF)3-11. Adicionalmente se observó que, además de optimizar la función renal, esta conducta de usar SRL en lugar de CsA se asociaba a una menor expresión de genes implicados en el desarrollo de la disfunción crónica del injerto (DCI) como el gen que codifica la proteína transforming growth factor (TGF-β) o el Monocyte chemotactic protein-1 (MCP-1)12.
Más recientemente, se ha observado que el tratamiento de inducción con timomoglobulina más el uso de novo de SRL se asocian con una mejor función renal frente a la terapia inmunosupresora convencional (prednisona, tacrolimus y MF), pero el precio a pagar puede ser una mayor tasa de efectos adversos y pérdidas de injertos con el empleo de SRL13. La proteína mTOR regula la diferenciación de las células T-memoria CD814. Asimismo, la combinación de timomoglobulina y SRL se asocia con un mayor grado de preservación y recuperación de los linfocitos T-memoria frente a los que reciben CsA15. Esto bien podría explicar una mayor tasa de disfunciones inmunológicas con el uso de novo de SRL frente a un ICN, especialmente tras la administración de anticuerpos policlonales.
Pero, ¿qué ocurre con EVE? En esta línea, una excelente revisión sobre el uso de este fármaco mostraba que el empleo de 1,5 o 3 mg de EVE más dosis plenas o reducidas de CsA confería una similar tasa de rechazos agudos y supervivencia del injerto que la terapia convencional con CsA y MMF, si bien se observó una menor proporción de rechazos severos utilizando 3 mg de EVE16. En cualquier caso, el empeoramiento de la función renal fue el denominador común en los ensayos clínicos que emplearon dosis más altas de EVE (3 mg/día), pese a la reducción de la CsA, lo que dejaba entrever la necesidad de combinar dosis bajas de un ICN y de un anti-mTOR17,18. En efecto, estudios controlados combinando dosis bajas de CsA y EVE han demostrado que la preservación de la función renal se acompaña de aceptables tasas de rechazos y supervivencia del injerto al primer año de seguimiento19-21, incluido aquellos enfermos con riesgo de función renal retrasada (estudio CALLISTO)22. Algo similar, en términos de preservación de la función renal y tasa de rechazos, ocurre cuando los pacientes son tratados con EVE (1,5 mg/día) y dosis bajas o estándar de tacrolimus (TAC), lo cual pudiera traducirse en una mayor supervivencia del injerto23. En cualquier caso, EVE disminuye la biodisponibilidad oral de TAC de una manera dosis-dependiente24. Por tanto, es mandatorio ajustar dosis y niveles de ambos fármacos cuando se lleven a cabo estrategias de minimización con esta combinación de inmunosupresores.
Con todo, un ensayo clínico muy potente (estudio SYMPHONY) demostró que el uso de SRL de novo sin ICN se asociaba con una alta tasa de disfunciones inmunológicas agudas y una peor función renal frente a otras pautas que incorporaban dosis plenas o reducidas de un ICN25. En cualquier caso, se emplearon dosis y niveles bajos de SRL, lo cual puede constituir un sesgo de la eficacia. Si a este hecho se le añade que el uso precoz o tardío de un anti-mTOR (SRL o EVE) se asocia con una alta tasa de complicaciones de la herida quirúrgica y que estos fármacos son un factor de riesgo independiente de las mismas26,27, su empleo de novo pudiera estar cuestionado. De hecho, la guías KDIGO (Kidney Disease Improving Global Outcomes) de práctica clínica en el trasplante renal desaconsejan el empleo de estos fármacos como inmunosupresión de inicio28. Por tanto, y de acuerdo con un nivel alto de evidencia: 1) el uso de novo de un anti-mTOR (dosis bajas) sin ICN se asocia con una mayor tasa de disfunción inmunológica y de complicaciones de la herida quirúrgica, por lo que no se recomiendan como inmunosupresión inicial, y 2) el uso combinado de dosis bajas de un ICN más un anti-mTOR confiere protección inmunológica, al menos a corto plazo.
Conversión precoz y tardía
A la luz de estos resultados, es posible que la indicación princeps de los fármacos anti-mTOR (SRL o EVE) radique en la sustitución del ICN en los primeros meses post-TX, una vez superada la tormenta inmunológica. Pero, ¿qué evidencias existen de esta actitud terapéutica? En consonancia con este razonamiento, estudios iniciales demostraron que la reducción o la eliminación de la CsA en terapia con SRL durante los primeros meses post-TX podía ofrecer una mejor función renal con una aceptable supervivencia del injerto pese a un ligero incremento en la tasa de rechazos agudos10. Esto fue refrendado en una revisión sistemática con su metanálisis correspondiente que incluyó seis ensayos clínicos controlados, en los que la retirada del ICN en terapia con SRL confería mejor función renal a pesar de un ligero aumento en la tasa de disfunción inmunológica29. Más recientemente, la conversión aleatorizada de CsA a SRL entre la segunda y la tercera semanas post-TX se asoció con una mejoría significativa de la función renal frente a la de los pacientes que continuaron con CsA (estudio SMART)30. Algo similar se ha observado con TAC. La retirada de este fármaco en los primeros meses post-Tx, bajo terapia con SRL, preservaba la función renal frente a una inmunosupresión potente (TAC más SRL) a los 2 años de seguimiento, sin incremento significativo de la proteinuria31. Es posible que este efecto beneficioso precoz se deba, al menos en parte, a la disminución de los índices de resistencia vasculares intrarrenales, como ha sido descrito previamente32.
Por otro lado, en regímenes terapéuticos sin esta combinación farmacológica inicial (TAC más SRL), la sustitución de CsA/TAC por SRL desde el sexto mes post-TX mejoró significativamente la función renal, en especial en aquellos enfermos que partían de un mejor filtrado glomerular (>40 ml/min). Asimismo, se observó una menor incidencia de tumores (estudio CONVERT)33. De manera similar, la conversión de CsA por SRL al tercer mes post-TX con retirada de esteroides al octavo mes se asoció con una mejoría significativa de la función renal (estudio CONCEPT)34. No obstante, esta mejoría en el filtrado glomerular no se acompañó de menos fibrosis intersticial en las biopsias de protocolo realizadas al año de seguimiento35.
Pero, ¿qué ocurre con EVE? En conversiones abruptas y precoces (séptima semana post-TX) de CsA a EVE se evidencia un incremento significativo de la función renal con una aceptable tasa de rechazos agudos a los 6 meses de seguimiento36. Asimismo, estudios observacionales han mostrado que la conversión de un ICN a EVE preserva la función renal a los 6 meses de seguimiento, hecho este relevante si tenemos en cuenta que muchas conversiones se realizaron por deterioro crónico de la función del injerto37-39. Un reciente ensayo clínico en pacientes sin riesgo inmunológico, que recibieron inmunosupresión convencional durante 6 meses, demostró que los enfermos convertidos de CsA a EVE presentaron una menor tasa de rechazos y mejor función renal que aquellos que permanecieron en tratamiento con MMF o con CsA40. Finalmente, datos preliminares de un estudio controlado, multicéntrico español (estudio ERIC) muestran que la conversión de TAC a EVE tras 3 meses de TX se asocia con una tendencia a mejorar el GFR, con un ligero aumento en la tasa de rechazos agudos41. Por tanto, y a la luz de la evidencia disponible (nivel de evidencia moderado), podemos aducir que la conversión de un ICN a un anti-mTOR se asocia con estabilidad de la función renal, lo que puede contribuir a evitar la progresión de la DCI. Como indican las guías KDIGO, esta actitud terapéutica debería considerarse especialmente en individuos de bajo riesgo inmunológico28.
DISFUNCIÓN CRÓNICA DEL INJERTO RENAL
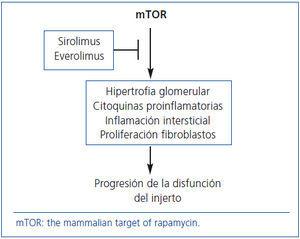
La proteína mTOR intervienen en los mecanismos patogénicos de la progresión de la enfermedad renal crónica. Por tanto, SRL y EVE pueden desempeñar un papel relevante en la prevención de la DCI dadas sus acciones antiproliferativas (figura 2). Pero, ¿qué evidencias existen al respecto?
En el modelo animal de rechazo crónico, la administración de EVE minimiza las lesiones histológicas inherentes a la DCI por mecanismos antiproliferativos o por estimulación de la apoptosis de células que participan en el remodelado tisular42. Asimismo, en la rata sensibilizada que recibe un injerto renal, la administración de EVE disminuye drásticamente el infiltrado celular de la respuesta alogénica y minimiza la fibrosis intersticial/atrofia tubular, lo cual puede contribuir a frenar la progresión de la DCI43.
En el terreno clínico, la retirada de CsA en terapia con SRL a los 3 meses post-TX puede prevenir la aparición de las lesiones de DCI y optimizar la función renal tras 3 años de seguimiento44. Un estudio aleatorizado en pacientes con DCI mostró que la administración de SRL reducía notoriamente la expresión intersticial y vascular de moléculas profibrogénicas frente a los que recibieron dosis reducidas de CsA más MMF. Esto se acompañó de una mejoría de la supervivencia de los injertos a los 2 años de seguimiento45. En esta línea, estudios observacionales de conversión tardía de un ICN a un anti-mTOR (SRL o EVE), principalmente por DCI, han mostrado sistemáticamente mejoría o estabilidad de la función del injerto renal37-39,46, pero se necesitan estudio controlados que confirmen estos hallazgos. A la luz de la poca evidencia existente, las guías KDIGO sólo «sugieren» (pero no recomiendan contundentemente) este cambio terapéutico en pacientes con DCI28. Por otra parte, los anti-mTOR preservan la producción de interferón-gamma, molécula con importante actividad antivírica47, lo cual puede prevenir también la aparición de nefropatía crónica por poliomavirus BK48.
Con todo, los fármacos anti-mTOR pueden generar proteinuria, especialmente en pacientes con daño renal previo49. Esta proteinuria es un predictor de disfunción endotelial y de mortalidad en pacientes con TX, lo que puede empeorar los resultados globales del TX a más largo plazo50. A la luz de lo expuesto, SRL y EVE pueden representar alternativas terapéuticas en pacientes con DCI y mínima o nula proteinuria, siempre que no se asocien con un ICN (nivel de evidencia bajo). Queda por dilucidar el momento exacto de la conversión para optimizar los resultados del TX.
EFECTOS CARDIOVASCULARES
En el corazón, SRL inhibe la proteína mTOR, la cual regula la síntesis proteica intracelular que interviene en el desarrollo de hipertrofia ventricular cardíaca ante estímulos de presión. La administración de SRL en el ratón sometido a una sobrecarga de presión cardíaca disminuyó en un 50% el crecimiento de las células miocárdicas con respecto al grupo control, y esto se acompañó de menor expresión de proteínas que intervienen en los mecanismos de la hipertrofia cardíaca como la S6 ribosomal51,52. Asimismo, en el modelo animal de enfermedad renal crónica, la administración de SRL disminuye el crecimiento de los miocardiocitos y revierte la fibrosis intermiocardiocítica53, hecho éste que pudiera optimizar el remodelado cardíaco. En humanos, estudios observacionales de pocos enfermos muestran que la conversión clínica de un ICN a SRL disminuye significativamente la masa ventricular izquierda (aproximadamente un 30%), independientemente de la tensión arterial54. En cualquier caso, se necesitan estudios longitudinales con un mayor número de enfermos para confirmar estos interesantes hallazgos.
Los fármacos anti-mTOR producen dislipemia de manera dosis-dependiente que puede contribuir al desarrollo de enfermedad cardiovascular post-TX55. Sin embargo, en el modelo animal de ateromatosis (ratones knockout para la apolipoproteína E), la administración de dosis crecientes de SRL fue capaz de reducir en más del 50% las lesiones ateromatosas de la aorta. Esto se acompañó de menor expresión de interleuquinas implicadas en el proceso ateromatoso (IL-10) frente al grupo control56. En esta línea, SRL preserva la función endotelial frente a CsA mantienendo la vasodilatación dependiente de acetilcolina y disminuyendo los niveles de endotelina-157,58. Estas acciones pueden explicar la prevención de la vasculopatía del injerto y la mejoría de la función renal en regímenes terapéuticos que utilizan fármacos anti-mTOR. La traducción clínica pudiera ser una menor rigidez arterial, como se observó en un estudio controlado, en el que la conversión de CsA a EVE se asoció con una menor velocidad de la onda de pulso frente a aquellos que continuaron con CsA59. Finalmente, la administración de anti-mTOR disminuye la incidencia de infección por CMV60,61, efecto que pudiera redundar en una menor aparición de efectos indirectos potencialmente provocados por esta infección oportunista como la cardiopatía isquémica o la enfermedad vascular periférica62,63. Estudios prospectivos futuros aclararán estos interesantes aspectos.
DIABETES DE NOVO POSTRASPLANTE
La proteína mTOR regula la proliferación de la célula beta e interviene en la cadena de señalización intracelular de la insulina. En pacientes estables con DCI, la conversión de CsA a SRL genera resistencia a la insulina expresada por una mayor expresión de los receptores insulínicos celulares (IRS-1 e IRS-2)64,65. En efecto, un estudio observacional del registro americano con miles de pacientes demostró que el riesgo de diabetes de novo post-TX era significativamente mayor en todas aquellas combinaciones farmacológicas que incluyeron SRL frente a otras asociaciones terapéuticas sin este fármaco66. De hecho, la administración de rapamicina en el modelo animal disminuye la sensibilidad a la insulina y reduce hasta un 50% la masa de células beta pancreática por una mayor apoptosis de las mismas, especialmente cuando existe predisposición a desarrollar diabetes mellitus, como ocurre en las ratas obesas67.
Por tanto, y aún con un bajo nivel de evidencia, los anti-mTOR pueden frenar el crecimiento ventricular izquierdo y la progresión de la ateromatosis, si bien pueden predisponer al desarrollo de diabetes post-TX, principalmente en enfermos predispuestos.
PATOLOGÍA TUMORAL DE NOVO
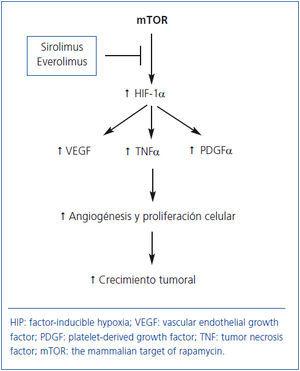
En general, tras el TX existe un incremento en la incidencia de tumores y los ICN desempeñan un papel crucial en su desarrollo68. La proteína mTOR estimula la producción de factores de crecimiento (VEGF, PDGF-α, TNF-α) que incrementan la angiogénesis, la proliferación celular y el crecimiento tumoral (figura 3). De ahí que SRL y EVL puedan frenar potencialmente el desarrollo y el crecimiento de las células neoplásicas69. En esta línea, un estudio observacional del registro americano de más de 30.000 pacientes demostró que los tratamientos inmunosupresores que incluían SRL o EVE disminuían un 60% el riesgo de cáncer cutáneo y no cutáneo frente al tratamiento con ICN70. Un análisis por intención de tratar de un ensayo clínico aleatorizado demostró que la incidencia de carcinomas cutáneos y no cutáneos fue inferior en los pacientes que recibieron SRL frente a aquellos que recibieron CsA más SRL, pero el grupo control recibió una inmunosupresión más potente, lo cual constituye un sesgo importante para valorar el efecto antitmoral de los fármacos anti-mTOR71. Como se comentó previamente, en el estudio CONVERT se observó una menor incidencia de tumores en los pacientes que fueron convertidos de un ICN a SRL33. Por último, un ensayo controlado más reciente en enfermos con neoformaciones cutáneas no melanocíticas demostró que el tratamiento con SRL puede retrasar el desarrollo de nuevas neoplasias e inducir regresión de lesiones preexistenes frente a aquellos enfermos que recibieron CsA72 (nivel moderado de evidencia).
Al mismo tiempo, algunos virus como el herpesvirus o el de Epstein-Barr pueden ser responsables del incremento de neoplasias tras el TX. Los fármacos anti-mTOR pueden optimizar la respuesta específica linfocitaria (linfocitos T) antivírica mediante un incremento en los CD4 y CD8, mecanismo que puede explicar la menor incidencia de infecciones víricas con estos fármacos73. Obviamente, esto pudiera traducirse en una menor aparición de neoplasias de origen vírico. De hecho, en un estudio sorprendente de pacientes con TX y sarcoma de Kaposi, la sustitución de CsA por SRL se asoció con una desaparición de las lesiones histológicas tumorales a los 6 meses de seguimiento, efecto que pareció deberse a una disminución de la angiogénesis y del factor de crecimiento del endotelio vascular (VEGF)74. En esta línea, la guías KDIGO sugieren el empleo de fármacos anti-mTOR en enfermos sometidos a TX con esta patología28. En cualquier caso, se requieren estudios controlados que confirmen el beneficio de los anti-mTOR en el tratamiento de los procesos tumorales.
CONCEPTOS CLAVE
1. El uso de novo de un anti-mTOR sin un ICN confiere mayor riesgo de rechazo y complicaciones de la herida quirúrgica tras el TX.
2. La combinación inicial de dosis bajas de un anti-mTOR y un ICN proporciona una aceptable protección inmunológica a corto plazo.
3. La conversión precoz de un ICN a SRL/EVE puede ofrecer, al menos, estabilidad de la función renal. Si esta maniobra terapéutica evita la disfunción crónica del injerto todavía se desconoce.
4. Con un bajo nivel de evidencia, los anti-mTOR reducen la masa ventricular iquierda y pueden, potencialmente, frenar la ateromatosis tras el TX.
5. Los anti-mTOR pueden incrementar el riesgo de diabetes post-TX, especialmente en individuos predispuestos.
6. SRL y EVE reducen la incidencia de incidencia de neoplasias de novo post-TX.
AGRADECIMIENTOS
Este trabajo ha sido financiado en parte por el Ministerio de Ciencia e Innovación de España (SAF2007-60314).
Figura 1. Potenciales beneficios clínicos y efectos adversos de los fármacos anti-mTOR
Figura 2. Mecanismos de acción de los fármacos anti-mTOR para frenar la progresión de la disfunción crónica del injerto
Figura 3. Potencial mecanismo de acción de los fármacos anti-mTOR para inhibir el crecimiento tumoral