Introducción: La ruta de señalización de Notch está activada en una gran variedad de patologías renales humanas. Recientemente hemos demostrado que la activación de esta ruta no estaría implicada en la fibrosis renal experimental inducida por angiotensina II o hipertensión. Objetivos: Evaluar si la vía Notch está activada en la fibrosis renal asociada a nefroesclerosis hipertensiva. Para validar la hipótesis se estudiaron varias patologías glomerulares caracterizadas por fibrosis túbulo-intersticial. Métodos: Se utilizaron biopsias renales de pacientes con nefroesclerosis hipertensiva, en comparación con nefropatía diabética y nefropatía membranosa en diferentes etapas de progresión. La expresión génica y proteica se evaluó por hibridación in situ e inmunohistoquímica, respectivamente. Resultados: En nefroesclerosis hipertensiva se observó baja expresión renal de proteínas de la vía Notch, no existiendo asociación entre la fibrosis túbulo-intersticial y los niveles de estas proteínas. Por el contrario, en las patologías glomerulares estudiadas se observó una elevada expresión de los transcritos Jagged-1, HES-1 y TGF-β, y de las proteínas Jagged-1 y Notch-1, localizados principalmente en células túbulo-epiteliales. Los niveles de expresión de los componentes de la vía Notch se relacionaron con el grado de fibrosis túbulo-intersticial, lo que confirma la activación de esta vía en nefropatías progresivas. Conclusiones: Nuestros datos muestran que la vía Notch no está activada en el riñón de pacientes con nefropatía hipertensiva, ampliando los resultados de los modelos experimentales de daño renal asociado a hipertensión a la patología humana. Nuestros estudios aportan nueva información sobre la compleja regulación del sistema Notch en el riñón.
Introduction: The Notch signalling pathway is activated in a wide variety of human renal diseases. We have recently demonstrated that the activation of this pathway is not involved in experimental renal fibrosis induced by angiotensin II or hypertension. Objectives: To assess whether the Notch pathway is activated in renal fibrosis related to hypertensive nephrosclerosis. To test the hypothesis, various glomerular diseases characterised by tubulointerstitial fibrosis were analysed. Method: Renal biopsies were performed on patients with hypertensive nephrosclerosis, in comparison with diabetic nephropathy and membranous nephropathy at various stages. Gene and protein expression were evaluated by in-situ hybridisation and immunohistochemistry respectively. Results: In hypertensive nephrosclerosis low renal expression of notch-related proteins was observed. There was no link between tubulointerstitial fibrosis and the levels of these proteins. By contrast, in the glomerular diseases studied we observed high expression of the transcripts Jagged-1, HES-1 and TGF-β and the proteins Jagged-1 y Notch-1, localised primarily in tubuloepithelial cells. The levels of expression of the components of the Notch pathway correlate to the degree of tubulointerstitial fibrosis, which confirms the activation of this pathway in progressive nephropathies. Conclusions: Our data demonstrate that the Notch pathway is not activated in the kidneys of patients with hypertensive nephropathy, which extends the results of experimental models of kidney damage related to hypertension to the realm of human pathology. Our studies provide new information on the complex regulation of the Notch pathway in the kidney.
INTRODUCCIÓN
La vía de señalización Notch está implicada en procesos de proliferación celular, diferenciación y apoptosis1,2. Los miembros de esta vía incluyen los receptores Notch 1/2/3/4, que presentan dos subunidades asociadas no covalentemente, y los ligandos Jagged 1,2 y delta-like 1,3,43. La activación de la vía Notch se produce tras la interacción entre el receptor Notch y su ligando, que da lugar al corte proteolítico de la porción transmembrana del receptor Notch, a través de la enzima γ-secretasa, dando lugar a la liberación de la porción intracelular del receptor, denominada dominio intracelular de Notch (NICD). Este dominio activo migra al núcleo, se une al factor de transcripción RBP-Jκ (recombination signal-binding protein 1 for J-kappa)1 y activa genes diana, entre los cuales se encuentran HES (hairy/enhancer of split) y HERP (HES-related transcription factor-1), que son represores transcripcionales que actúan como efectores negativos de la vía1.
La ruta Notch es utilizada por organismos multicelulares para especificar las decisiones del destino celular durante la formación de estructuras complejas, incluido el riñón4, y participa en procesos fisiológicos y patológicos, como el cáncer5, la función y regeneración de la vasculatura1, la diferenciación celular endotelial6 y la angiogénesis7. En el riñón, se ha descrito activación de la vía Notch en podocitos y progenitores renales asociada a procesos patológicos en glomerulonefritis8. Además, estudios en modelos experimentales demuestran que la sobreexpresión de Notch en podocitos se asocia a albuminuria y glomeruloesclerosis9,10. En biopsias renales de pacientes con nefropatía diabética (ND) hemos descrito un aumento de la expresión génica de Jagged-1 y HES-111. En un amplio estudio realizado por el grupo de Suztak et al., se ha observado aumento de diversos componentes de la ruta Notch en nefropatías progresivas12. Sin embargo, el efecto beneficioso de la modulación de la vía Notch en la progresión de la enfermedad renal es todavía controvertido9,13,14.
Recientemente hemos demostrado que la activación de la ruta Notch no está implicada en la fibrosis renal experimental inducida por angiotensina II (Ang II) o por hipertensión15. Nuestro objetivo ha sido intentar trasladar los resultados obtenidos en modelos experimentales a la patología humana, evaluando si la vía Notch está activada en pacientes con nefropatía hipertensiva (NH), comparándolos con nefropatías progresivas con distintos grados de fibrosis túbulo-intersticial.
MATERIAL Y MÉTODOS
Muestras de pacientes
El estudio se basó en el análisis retrospectivo de biopsias renales estudiadas en la Unidad de Nefrología perteneciente al Instituto de Medicina de la Universidad Austral de Chile, Valdivia (Chile). Las biopsias renales obtenidas por punción percutánea se realizaron como un procedimiento diagnóstico y/o pronóstico, y con consentimiento informado del paciente. No existieron diferencias significativas en los datos clínicos más relevantes entre el grupo de NH y los grupos de ND y nefropatía membranosa (NM). Los datos concretos de pacientes de los cuales se tuvo información clínica fueron los siguientes: NH: 4 varones/6 mujeres; edad promedio: 49,2 años; filtrado glomerular estimado (FGe): < 60 ml/min/1,73 m2 = 4/8; fibrosis túbulo-intersticial score 1. Datos de los pacientes ND + NM = 15 varones/9 mujeres; edad promedio: 53,5 años; FGe < 60 ml/min/1,73 m2 = 11/19; fibrosis túbulo-intersticial score 1,69. Respecto al tratamiento farmacológico, la mayoría de los pacientes estaban recibiendo inhibidores de la enzima convertidora de la angiotensina (IECA) en todos los grupos estudiados.
Las biopsias renales corresponden a pacientes con diagnóstico histopatológico de NH (n = 10), con ND (n = 8) y con NM; estos casos se dividieron en pacientes con NM no progresiva (NM-np; n = 8, fibrosis túbulo-intersticial ausente o leve) y con NM progresiva (NM-p; n = 8, fibrosis túbulo-intersticial moderada o severa). Como tejido control se utilizaron biopsias de pacientes con lesión glomerular mínima (LGM; n = 5), patología que no cursa con fibrosis túbulo-intersticial. La fibrosis intersticial, definida por la técnica de tricrómico de Masson (que detecta la presencia de colágeno intersticial) y la infiltración celular túbulo-intersticial fueron clasificadas en cuatro grupos, de acuerdo a la extensión y presencia de atrofia y degeneración tubular: (0) normal, (1) compromiso hasta el 25 % de la corteza, (2) compromiso del 25 % al 50 % de la corteza, y (3) daño extenso superior a más del 50 % de la corteza, según hemos descrito previamente en otros estudios16. Todas las biopsias fueron evaluadas por dos patólogos con concordancia en su lectura, sin conocimiento previo de los otros estudios efectuados en dichas biopsias.
El tejido renal obtenido fue fijado en formalina 4 % en tampón fosfato y/o Bouin. A continuación fueron deshidratadas e incluidas en parafina de acuerdo a la técnica histológica convencional. Para el desarrollo de las técnicas descritas a continuación se realizaron cortes seriados de 5 μm de espesor, que fueron montados en portaobjetos previamente tratados con aminopropiltrietoxisilano 2 %.
Hibridación in situ
Para evaluar los niveles de expresión génica se utilizó la técnica de hibridación in situ, como se ha descrito previamente17. La reacción de hibridación fue realizada durante toda la noche a 37 ºC con sondas marcadas con biotina (200 ng/ml). La detección se realizó con el conjugado avidina-fosfatasa alcalina, usando NBT/BCIP (nitro bluetetrazolium/5-bromo-4-chloro-3-indolyl phosphate) como el sustrato de la enzima. La especificidad de la reacción fue confirmada por el tratamiento con RNasa (100 mg/ml) o por ausencia de la sonda.
Sondas utilizadas para la detección de Jagged-1 (Sigma):
5’-CCTGACAGTATTATTGAAAAGGCT-3’, 5’-GTACGGCTGGCAAGGCTTGTACTG-3’, 5’-CACGCCTGCCTCTCTGATCCCTGT-3’.
Sondas utilizadas para la detección de HES-1 (Sigma): 5’-CTTCTCTCCTTGGTCCTGGAACAG-3’, 5’-AGCTCGCGGCATTCCAAGCTGGAG-3’, 5’-CTGCGCTGAGCACAGACCCAAGTG-3’.
Sonda utilizada para la detección de TGF-β (MaxinBiotechInc): sonda biotinilada de 163 pb, fabricada por PCR utilizando un cDNA humano y dNTPs biotinilados.
Inmunohistoquímica
Para evaluar los niveles de expresión proteica se utilizó la técnica de inmunohistoquímica, utilizando los siguientes anticuerpos primarios: anti-Jagged-1 (1:50, Santa Cruz), anti-Notch-1 activo (1:300, Abcam) y anti-α-SMA (1:50, Dako). Para ello, en secciones renales se bloqueó la peroxidasa endógena con H2O2 al 3 % durante 20 minutos. El tejido fue tratado en microondas con una solución de tampón citrato 0,1 mM pH 6,0 a 94 ºC por 10 minutos. Se usaron anticuerpos secundarios biotinilados, seguido de conjugado-HRP y revelado con diaminobenzidina. La especificidad de la reacción fue determinada por omisión de anticuerpo primario o el uso de un suero no inmune.
Análisis estadístico
Fue realizado con el software GraphPadInstant (GraphPadSoftware, San Diego, CA). La valoración de la intensidad y distribución de la tinción para inmunohistoquímica e hibridación in situ fue determinada mediante análisis computacional de imágenes sin conocimiento del grupo al que pertenece la muestra y expresada como la media ± EEM. Se utilizó el test Mann-Whitney para determinar diferencias significativas entre los grupos analizados y se consideró significativo un valor de p < 0,05. La correlación de Spearman fue utilizada para relacionar la expresión de Jagged-1, HES-1 y TGF-β y fibrosis túbulo-intersticial. Un valor de p < 0,01 fue considerado significativo.
RESULTADOS
La vía Notch en nefroesclerosis hipertensiva
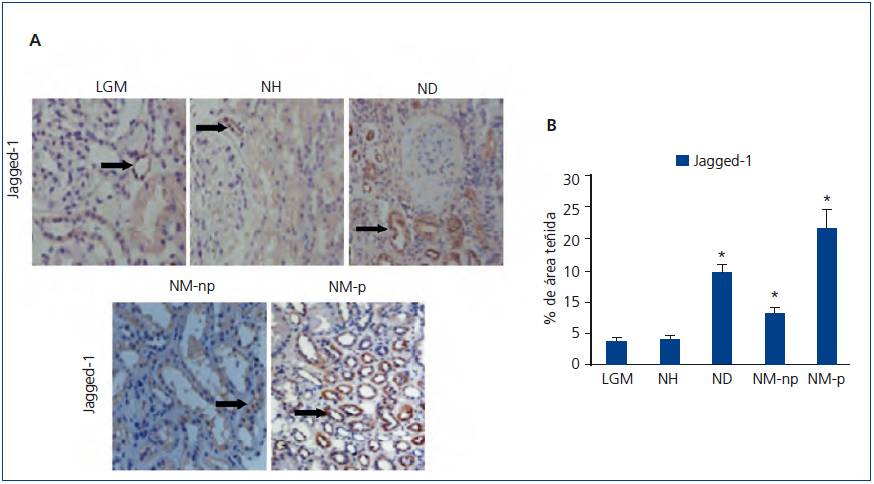
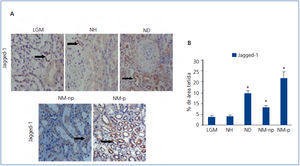
Se evaluó por inmunohistoquímica la presencia del ligando de Notch, Jagged-1, en pacientes con NH. En ellos se observaron niveles bajos de expresión de Jagged-1 (figura 1 A). Para validar los resultados y la técnica empleada, estudiamos en paralelo muestras de pacientes con ND y NM-np y NM-p, donde previamente se ha descrito activación renal de la ruta Notch13. En estas muestras se observó un aumento significativo en la expresión de Jagged-1 a nivel citoplásmatico de células tubulares (figura 1 A). Cabe destacar que en pacientes con LGM apenas observamos tinción positiva de Jagged-1, presentado valores similares a los de NH (figura 1 B).
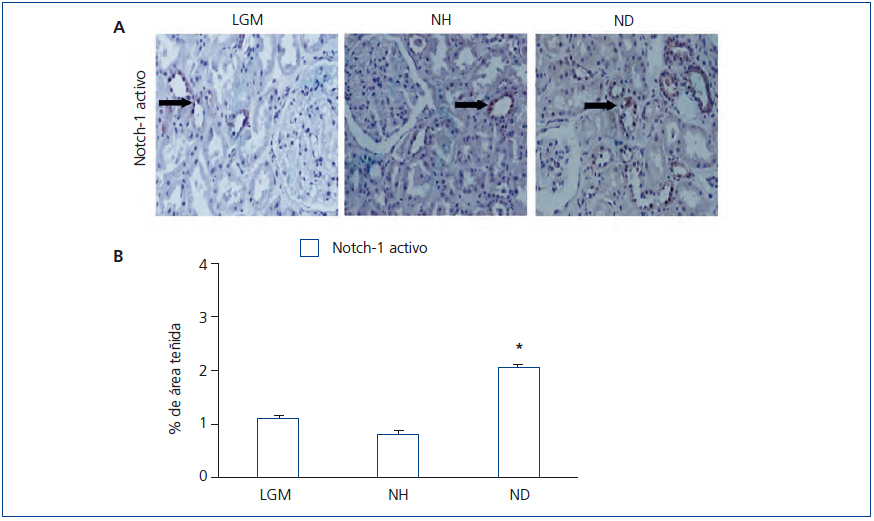
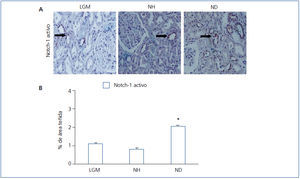
Tras la unión del ligando (Jagged-1) al receptor Notch se produce la liberación del NICD, que se trasloca al núcleo y actúa como un factor de transcripción. En pacientes con NH, detectamos niveles muy bajos de NICD, en comparación con aquellos con ND (figura 2 A y figura 2 B). Estos resultados indican que la vía Notch no se activa en la NH, al menos en el grupo de los pacientes estudiados.
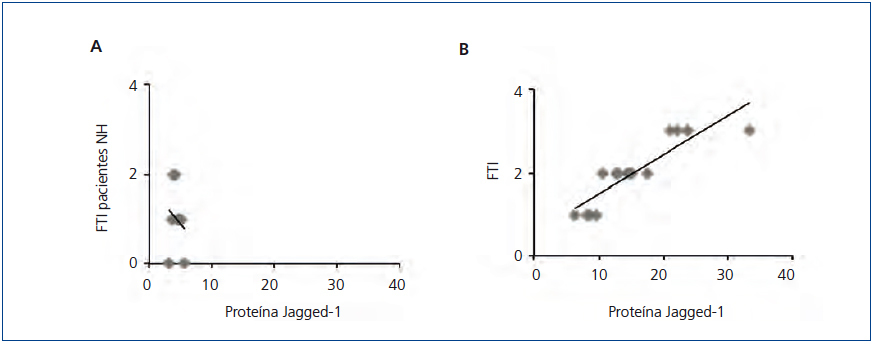
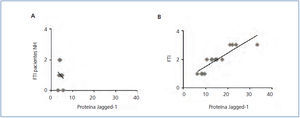
Estudios previos han demostrado que la activación de la vía Notch se relaciona con la progresión de la enfermedad renal en un gran número de patologías, incluida la ND11,12, pero no hay datos claros en la NH. Para ello, estudiamos la posible correlación entre la fibrosis renal y la activación de la vía Notch, analizando biopsias seriadas del conjunto de pacientes. En las muestras de NH no se encontró una correlación entre el grado de fibrosis túbulo-intersticial y la intensidad de expresión de la proteína Jagged-1 (figura 3 A), presentando valores de Jagged-1 similares a la LGM, nefropatía que no cursa con fibrosis túbulo-intersticial. Por el contrario, sí existió correlación positiva y significativa al evaluar el resto de las muestras del estudio (figura 3 B). Estos datos sugieren que la activación de la vía Notch en la NH no se relaciona con la progresión de la enfermedad.
La vía Notch está activada en la nefropatía membranosa progresiva asociada a fibrosis
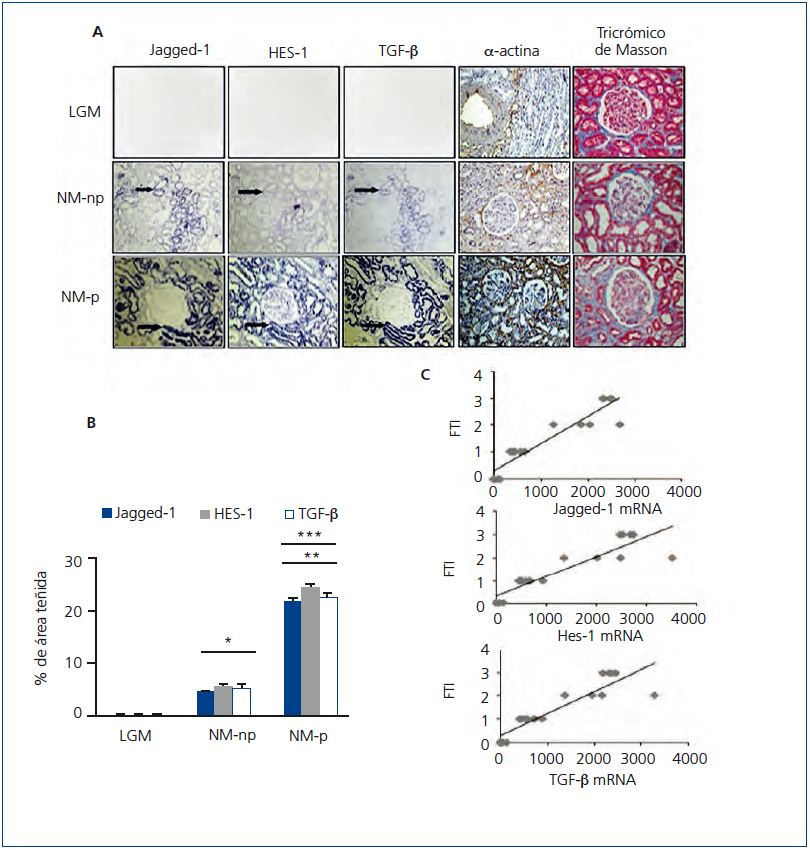
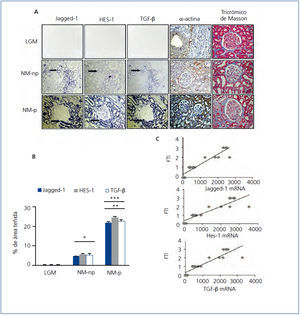
Con el objetivo de determinar la relación entra la vía Notch y la fibrosis en la enfermedad renal crónica y ampliar los estudios previos11,12, evaluamos la expresión génica de Jagged-1 y HES-1 en pacientes con NM-p y NM-np, y comparamos su expresión con el tejido control. En las muestras de NM-np y NM-p hay una marcada inducción del mRNA Jagged-1 y mRNA HES-1 a nivel tubular; en contraste, en los pacientes con LGM, utilizados como controles al no presentar fibrosis, su expresión es baja o ausente (figura 4 A).
Estudios experimentales han demostrado que TGF-β es un factor de crecimiento clave en la fibrosis renal. En pacientes con enfermedad renal progresiva hemos descrito previamente que la expresión del transcrito TGF-β está incrementada18. En la figura 4 A se observa la co-localización de mRNA de Jagged-1, HES-1 y TGF-β en todos los casos analizados de NM. Los casos progresivos muestran mayor aumento en la expresión del mRNA de Jagged-1, HES-1 y TGF-β, comparados con los casos no progresivos (figura 4 B). Además, se encontró una correlación positiva y significativa entre el grado de fibrosis túbulo-intersticial y cada transcrito analizado (figura 4 C). Asimismo, evaluamos la expresión del marcador mesenquimático α-actina de músculo liso (α-SMA) y la presencia de colágeno intersticial en las muestras de tejido. En el tejido control α-SMA solo se encuentra presente en arteriolas y no se evidencia presencia de colágeno. En NM-np se observa un aumento en la expresión de α-SMA y de colágeno en el área túbulo-intersticial, y en mayor extensión en NM-p (figura 4 A). Nuestros hallazgos en biopsias renales de pacientes con NM-p y NM-np muestran una relación entre inducción de Jagged-1 y fibrosis túbulo-intersticial, lo que sugiere que Jagged-1 podría participar en la regulación de la fibrosis humana en el riñón.
DISCUSIÓN
En biopsias de pacientes con NH, con diferentes grados de fibrosis túbulo-intersticial, hemos demostrado que la vía Notch no está activada en el riñón, ampliando y confirmando nuestros estudios previos in vitro y en modelos animales de hipertensión y de daño mediado por Ang II15, trasladando a la patología humana la hipótesis de que Ang II no regula la ruta Notch en el riñón adulto.
La Ang II participa de forma activa en la progresión del daño renal, al ser capaz de regular diversos procesos patológicos, como inflamación y fibrosis. Los fármacos que bloquean las acciones de Ang II, IECA y antagonistas de los receptores de la Ang II, son una de las mejores estrategias terapéuticas para el tratamiento de las enfermedades renales progresivas, debido a sus acciones más allá del control de la presión sanguínea, presentando efectos órgano-protectores18. Recientemente hemos descrito que la ruta Notch no está activada en respuesta a Ang II en células renales en cultivo, incluidos podocitos, células tubulares epiteliales y fibroblastos, demostrando una diferencia clave entre los mecanismos activados por TGF-β y Ang II en el riñón15. Estudios previos sugieren interacciones funcionales entre TGF-β y la vía de señalización Notch19. Ambas vías de señalización son importantes para el control de la diferenciación celular durante el desarrollo y se ha descrito que la expresión de Jagged-1 es dependiente de TGF-β en células epiteliales20,21. Varios estudios han demostrado que la vía Notch es esencial para la función epitelial y además contribuye en la transición epitelio-mesenquimal (TEM) en embriogénesis y cáncer22,23. Estudios en células túbulo-epiteliales en cultivo han demostrado que el bloqueo farmacológico de esta vía, inhibiendo la enzima γ-secretasa, restauró los cambios en marcadores de TEM inducidos por TGF-β20,24. Sin embargo, no modula la TEM causada por Ang II15. La contribución de la TEM en fibrogénesis renal es un tema de intenso debate24. Así, la sobreexpresión renal de Notch en modelos de daño renal no moduló marcadores de TEM, aunque sí indujo fibrosis túbulo-intersticial13. En este trabajo hemos demostrado que la vía Notch no está activada en el riñón de pacientes con NH, ampliando los resultados observados en los modelos experimentales de ratas espontáneamente hipertensas y de daño por administración sistémica de Ang II15 a la patología humana.
Varios estudios experimentales han observado que el uso de inhibidores farmacológicos o ligandos solubles de Notch mitiga el fallo renal9,25. Además, estudios en ratones transgénicos con deleción de Notch a nivel de podocitos han demostrado la implicación de esta vía en fibrosis túbulo-intersticial13. Los experimentos realizados en muestras de pacientes con NM-p muestran que la activación de Jagged-1 y HES-1 se relaciona con el grado de fibrosis túbulo-intersticial y con el aumento de TGF-β, confirmando el amplio estudio previo que ha demostrado activación de Jagged-1, Jagged-2 y Notch-1 en nefropatías progresivas humanas12, así como los datos previos de nuestro grupo en ND11.
En conjunto, nuestros resultados muestran la compleja regulación de la vía Notch en el riñón, confirmando que en patologías progresivas humanas la activación de la vía Notch se asocia a fibrosis renal. Actualmente hay estudios clínicos utilizando inhibidores de la γ-secretasa en enfermedades diversas como Alzheimer y leucemia25, por lo que también podría ser una nueva diana terapéutica para la enfermedad renal crónica. Sin embargo, el hecho de que la Ang II no regule esta ruta y que no está activada en pacientes con hipertensión aporta nueva información que muestra la complejidad de la regulación del sistema Notch en el riñón adulto.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Agradecimientos
Este trabajo ha sido financiado por el Instituto de Salud Carlos III (ISCIII-RETIC REDINREN RD06/0016, RD12/0021, PI081564, PI11/01854 y PI10/00072) Comunidad de Madrid (S2010/BMD-2321), Sociedad Española de Nefrología, Agencia Española de Cooperación Internacional (PCI Iberoamerica; A/9571/07), FONDECYT Chile 1080083 y 1120480 y Fundación Lilly. C.L es fellow del ISCIII. Programa Intensificación Actividad Investigadora (ISCIII/Agencia Laín-Entralgo/CM) a A.O.
Figura 1. Inmunodetección de Jagged-1 en biopsias de pacientes con lesión glomerular mínima (n = 5), nefroesclerosis hipertensiva (n = 10), nefropatía diabética (n = 8), nefropatía membranosa no progresiva (n = 8) y progresiva (n = 8).
Figura 2. Inmunodetección de Notch-1 activado en biopsias de pacientes con lesión glomerular mínima, nefroesclerosis hipertensiva y nefropatía diabética.
Figura 3. La activación de la vía Notch no se relaciona con la fibrosis renal en la nefroesclerosis hipertensiva.
Figura 4. La activación de la vía Notch se asocia con la fibrosis renal en la nefropatía membranosa.