Actualmente las personas que padecen enfermedad renal crónica (ERC) y diabetes mellitus tipo-2 (DMT2) presentan un riesgo residual renal y cardiovascular (CV) persistente, a pesar de recibir el estándar de tratamiento. Por ello, el objetivo fue evaluar el grado de consenso multidisciplinar sobre el riesgo residual persistente en estos pacientes y su posible abordaje terapéutico.
Materiales y métodosUn comité científico de 4 expertos habituados al manejo de la ERC y DMT2 propuso el contenido de un cuestionario Delphi y el perfil de panelistas y validó el cuestionario final. Un panel compuesto por 60 especialistas en Nefrología (n=20), Endocrinología (n=20) y Atención Primaria (n=20) completó el cuestionario diseñado específicamente para el estudio, que contenía 76 afirmaciones generadas tras una revisión dirigida de la literatura, a las que se añadieron 2 afirmaciones más para la segunda ronda. Utilizando metodología Delphi adaptada entre mayo y junio de 2024, el panel valoró en 2 rondas las afirmaciones incluidas en el cuestionario. Cada afirmación debía valorarse en una escala ordinal de tipo Likert de 1 a 9 puntos.
ResultadosSe obtuvo respuesta de 60 especialistas en las 2 rondas del estudio. El 72% de los panelistas contaba con más de 15 años de experiencia, el 70,0% seguía a más de 25 pacientes con ERC y DMT2 mensualmente y todos pertenecían a alguna sociedad científica. En la primera ronda Delphi se alcanzó el nivel de acuerdo definido para 43 afirmaciones y en la segunda ronda en 10 afirmaciones adicionales (53/78 [68%] afirmaciones consensuadas). La sección con consenso en un mayor número de afirmaciones fue la de riesgo residual (86,4%). En este bloque se alcanzó el nivel predefinido de acuerdo en aspectos como el riesgo elevado de complicaciones renales (mediana; rango intercuartílico: 9 [8-9]), CV (9 [8-9]) o de muerte prematura (9 [8-9]) a pesar de recibir tratamiento estándar, la acción complementaria de diferentes fármacos con distinto mecanismo de acción (9 [9-9]), la instauración simultánea de 3 pilares de tratamiento (bloqueo del sistema renina-angiotensina+inhibidores de SGLT2 [iSGLT2]+antagonistas no esteroideos del receptor mineralocorticoide [ARMns]) (8 [7-9]), el avance que han supuesto iSGLT2 (9 [9-9]) y ARMn (8 [7-9]) en protección renal y CV, y la necesidad de evitar la inercia terapéutica (9 [8-9]), utilizar los tratamientos de forma temprana e intensiva (9 [8-9]) y coordinación entre niveles asistenciales (9 [9-9]).
ConclusionesSe obtuvo consenso multidisciplinar en que los pacientes con DMT2 y ERC presentan un riesgo residual elevado de progresión de la enfermedad, muerte prematura, complicaciones renales y CV. La instauración simultánea de los 3 pilares de tratamiento, evitar la inercia terapéutica y la coordinación entre niveles asistenciales son medidas consideradas relevantes para contribuir a reducir el riesgo residual en estos pacientes.
Currently, patients with chronic kidney disease (CKD) and type-2 diabetes mellitus (T2DM) present a persistent residual renal and cardiovascular (CV) risk despite receiving standard treatment. Therefore, the aim was to assess the degree of multidisciplinary consensus on the persistent residual risk in these patients and its possible therapeutic approach.
Materials and methodsA Scientific Committee of 4 experts accustomed to the management of CKD and T2DM proposed the content of a Delphi questionnaire and the profile of panelists and validated the final questionnaire. A panel composed of 60 specialists in Nephrology (n=20), Endocrinology (n=20) and Primary Care (n=20) completed the questionnaire specifically designed for the study, which contained 76 statements generated after a targeted literature review, to which 2 more statements were added for the second round. Using Delphi methodology adapted between May and June 2024, the panel assessed the statements included in the questionnaire in 2 rounds. Each statement was to be rated on an ordinal Likert-type scale from 1 to 9 points.
ResultsA response was obtained from 60 specialists in the 2 rounds of the study. Seventy-two percent of the panelists had more than 15 years of experience, 70.0% followed more than 25 patients with CKD and T2DM monthly, and all belonged to a scientific society. In the first Delphi round, the defined level of agreement was reached for 43 statements and in the second round for 10 additional statements [53/78 (68%) consensus statements]. The section with consensus on the largest number of statements was residual risk (86.4%). In this block, the predefined level of agreement was reached in aspects such as elevated risk of renal complications (median; interquartile range: 9 [8-9]), CV (9 [8-9]) or premature death (9 [8-9]) despite receiving standard treatment, the complementary action of different drugs with different mechanism of action (9 [9-9]), the simultaneous establishment of 3 pillars of treatment [renin-angiotensin system blockade+SGLT2 inhibitors (iSGLT2)+Non-steroidal Mineralocorticoid Receptor Antagonists (mRNAs)] (8 [7-9]), the progress made by iSGLT2 (9 [9-9]) and ARMn (8 [7-9]) in renal and CV protection, and the need to avoid therapeutic inertia (9 [8-9]), use treatments early and intensively (9 [8-9]) and coordination between levels of care (9 [9-9]).
ConclusionsMultidisciplinary consensus was obtained that patients with T2DM and CKD present a high residual risk of disease progression, premature death, renal and CV complications. The simultaneous implementation of the 3 pillars of treatment, the avoidance of therapeutic inertia, and coordination between levels of care are considered relevant measures to contribute to reducing the residual risk in these patients.
La enfermedad renal crónica (ERC) se define como la presencia durante más de 3 meses de alteraciones de la estructura o función renal que tiene un impacto negativo sobre la salud. La combinación de la tasa de filtrado glomerular (TFG) y el grado de albuminuria permiten estratificar el riesgo de diversos desenlaces adversos, entre los que destacan la progresión a fallo renal que requiere tratamiento sustitutivo de la función renal y la muerte prematura de causa cardiovascular (CV) y no CV1–4. De hecho, el aumento del riesgo de muerte prematura es la principal consecuencia de la ERC y no se corrige con la diálisis o el trasplante, que se asocian a pérdidas de esperanza de vida de hasta 44 años en comparación con la población general5. Como consecuencia, se prevé que la ERC se convierta en la tercera causa de muerte en España antes de 2050, debido en gran parte al envejecimiento de la población6. La diabetes mellitus tipo 2 (DMT2) es un factor de riesgo significativo para el desarrollo de la ERC, que afecta a un tercio de los pacientes con DMT27. A la patogenia de la ERC contribuyen múltiples factores, principalmente alteraciones metabólicas, hemodinámicas e inflamatorias/fibróticas1,8–10.
En España la prevalencia de la DMT2 se ha estimado en el 7,8% en la población adulta, aumentando al 13,8% al incluir a los pacientes no diagnosticados11. Entre los adultos con DMT2, el 33,8% padece ERC y el 21,2% presenta albuminuria (categoría A2-A3)7.
A pesar de los tratamientos actuales muchos pacientes con DMT2 desarrollan formas graves de ERC y mantienen un alto riesgo residual de muerte CV y progresión de la enfermedad, incluso a pesar de recibir inhibidores del sistema renina-angiotensina (SRA) e inhibidores del cotransportador sodio-glucosa tipo 2 (iSGLT2)8,12,13. Esto puede estar influenciado por el control glucémico, la presión arterial y el estilo de vida del paciente14. Además, el riesgo residual absoluto es superior a mayor albuminuria o menor TFG basal15. La naturaleza dinámica del riesgo residual depende de la duración de la enfermedad y la efectividad de las intervenciones terapéuticas. Es crucial incluir factores como la duración de la enfermedad, el control glucémico, la presión arterial, la proteinuria y la función renal en los ensayos clínicos para identificar y manejar adecuadamente el riesgo residual en pacientes con ERC y DMT216.
El abordaje farmacológico del riesgo residual se fundamenta en un enfoque integral basado en el control farmacológico glucémico, lipídico, de la hipertensión, así como el control de la inflamación y la fibrosis. Las guías clínicas sugieren el uso de inhibidores del iSGLT2, agonistas del receptor del péptido similar al glucagón tipo 1 (arGLP1), inhibición del SRA aldosterona (iSRAA) mediante inhibidores de la enzima convertidora de angiotensina (IECA), o antagonistas del receptor de angiotensina ii (ARA-II)1,17,18. Además, los antagonistas del receptor de mineralocorticoides no esteroideos (ARMns) han demostrado beneficios en la protección renal y CV19, y se recomiendan por parte de guías de práctica clínica como la Kidney Disease Improving Global Outcomes (KDIGO), la American Diabetes Association (ADA) y las guías de la Sociedad Europea de Cardiología4,17,20–22.
No obstante, en la actualidad no se ha establecido una definición consensuada de riesgo residual en los pacientes con ERC y DMT2. En este sentido, aún hay áreas de riesgo residual asociado a la ERC que no se conocen, como la interacción de factores genéticos con el ambiente, los mecanismos moleculares completos y la efectividad a largo plazo de los nuevos tratamientos.
Dada la incertidumbre en torno al riesgo residual en los pacientes con ERC y DMT2, el objetivo del estudio fue evaluar el grado de consenso multidisciplinar, desde la perspectiva de nefrología, endocrinología y medicina de familia, sobre el riesgo residual persistente a pesar del estándar de tratamiento en España en estos pacientes y su posible abordaje terapéutico.
MétodosDiseño del estudioEl estudio se realizó utilizando la metodología Delphi adaptada en 2 rondas, con el objetivo de alcanzar consenso sobre el manejo del riesgo residual que persiste en pacientes con ERC y DMT2. El método Delphi es una técnica de investigación social que tiene como objetivo la obtención de una opinión grupal fidedigna a partir de un grupo de expertos23,24. Este método de investigación se caracteriza por ser un proceso iterativo en el que los panelistas deben ser consultados al menos 2 veces sobre la misma cuestión, de forma que puedan volver a emitir su opinión una vez que reciben las opiniones del resto de panelistas. Se mantiene el anonimato de las respuestas y los panelistas no coinciden temporal ni físicamente, evitando la influencia de otras personas. El intercambio de información se realiza a través del comité científico del estudio, quien decide qué información facilita a los panelistas23,24. La decisión de establecer 2 rondas se basa en la literatura existente, donde se ha demostrado que 2 rondas pueden ser suficientes para alcanzar un consenso entre los expertos.
El estudio se realizó en España entre febrero de 2024 y junio de 2024. No se requirió la aprobación del comité de ética porque no se usaron datos de pacientes.
Un comité científico, compuesto por 4 expertos con experiencia en el manejo de la ERC y DMT2 (2 nefrólogos, un endocrinólogo y una médico de familia) diseñó el contenido del cuestionario Delphi, validó el cuestionario y determinó el perfil de panelistas.
Para el desarrollo del estudio desde el diseño, la fase de campo y el análisis de resultados, se contó con una empresa externa, IQVIA.
Cuestionario del estudioEl cuestionario se diseñó a partir de una búsqueda de literatura dirigida, realizada en PubMed y en fuentes no convencionales de información, como informes de investigación y documentos técnicos, para identificar aspectos relevantes para el estudio. A partir de esta información se desarrolló el cuestionario, que contenía 76 afirmaciones, a las que se añadieron 2 afirmaciones adicionales para la segunda ronda (78 afirmaciones en total).
Cada afirmación debía valorarse en una escala ordinal de tipo Likert de 1 a 9 puntos, en general siendo 1 completamente en desacuerdo y 9 completamente de acuerdo. Las afirmaciones se organizaron en 3 apartados: a) manejo clínico (33 afirmaciones); b) estrategia terapéutica (23 afirmaciones); y c) riesgo residual (22 afirmaciones). Se programó el cuestionario a través de formularios de Google.
El cuestionario Delphi está disponible en el material suplementario, incluyendo los resultados para las diferentes rondas.
Selección del panel de expertosEl comité científico del estudio Delphi definió el perfil de los panelistas y colaboró en la selección de los posibles participantes. Esta selección se realizó en función de la experiencia con este tipo de pacientes y la pertenencia a sociedades científicas. El panel de expertos se componía de 60 profesionales implicados en el manejo de la ERC y DMT2 en España, con la siguiente distribución: 20 expertos en nefrología, 20 en endocrinología y 20 en medicina de familia. El estudio Delphi fue doble ciego para los panelistas.
Filtros de captación para formar parte del estudio como panelista y contestar el cuestionario: 1) al menos 5 años de experiencia en el manejo de pacientes con ERC y DMT2; 2) al menos 20 pacientes para nefrología y al menos 10 pacientes para endocrinología y medicina de familia visitados con ERC y DMT2 mensualmente; 3) trabajador/a en activo con pacientes en el departamento de salud correspondiente a nivel nacional; 4) disponibilidad para participar en el estudio a lo largo de toda la duración del mismo (mayo y junio); 5) pertenencia a alguna sociedad científica o miembro de ella.
Se envió una invitación que describía el objetivo del estudio y el proceso Delphi. Tras aceptar participar, los expertos recibieron un enlace para acceder al cuestionario Delphi, con la opción de retirarse en cualquier momento.
Rondas del DelphiLa primera ronda tuvo lugar en mayo de 2024, del 10 al 21 de mayo de 2024, y la segunda ronda en junio del 2024, del 7 al 17 de junio de 2024, con 3 recordatorios enviados a los panelistas para fomentar la participación. El cuestionario se respondió virtualmente de forma anónima, basado en los conocimientos y experiencia de los panelistas.
Tras analizar los datos de la primera ronda se eliminaron los ítems que alcanzaron el consenso. El cuestionario Delphi actualizado y un resumen de los resultados de la primera ronda se enviaron solo a los encuestados de la primera ronda Delphi, permitiéndoles modificar sus respuestas de acuerdo con el juicio general del panel de expertos.
El comité científico revisó en diferentes reuniones virtuales los resultados de la ronda 1 y la ronda 2 del estudio Delphi, tras el desarrollo de las mismas (fig. 1).
Análisis de los datosPara el análisis estadístico se calcularon la mediana y el rango intercuartílico para evaluar el grado de consenso, utilizando el paquete estadístico de Microsoft Excel. Se consideró que, para alcanzar el consenso, la mediana de la puntuación y el rango intercuartílico deberían situarse en un mismo rango de la escala: 1-3, 4-6 o 7-9.
ResultadosSe obtuvo una tasa de respuesta del 100% por parte de los 60 especialistas en las 2 rondas del estudio Delphi. El 72% de los panelistas contaba con más de 15 años de experiencia laboral, el 70,0% visitaba a más de 25 pacientes con ERC asociada a DMT2 mensualmente y todos pertenecían a alguna sociedad científica (tabla 1 del material suplementario).
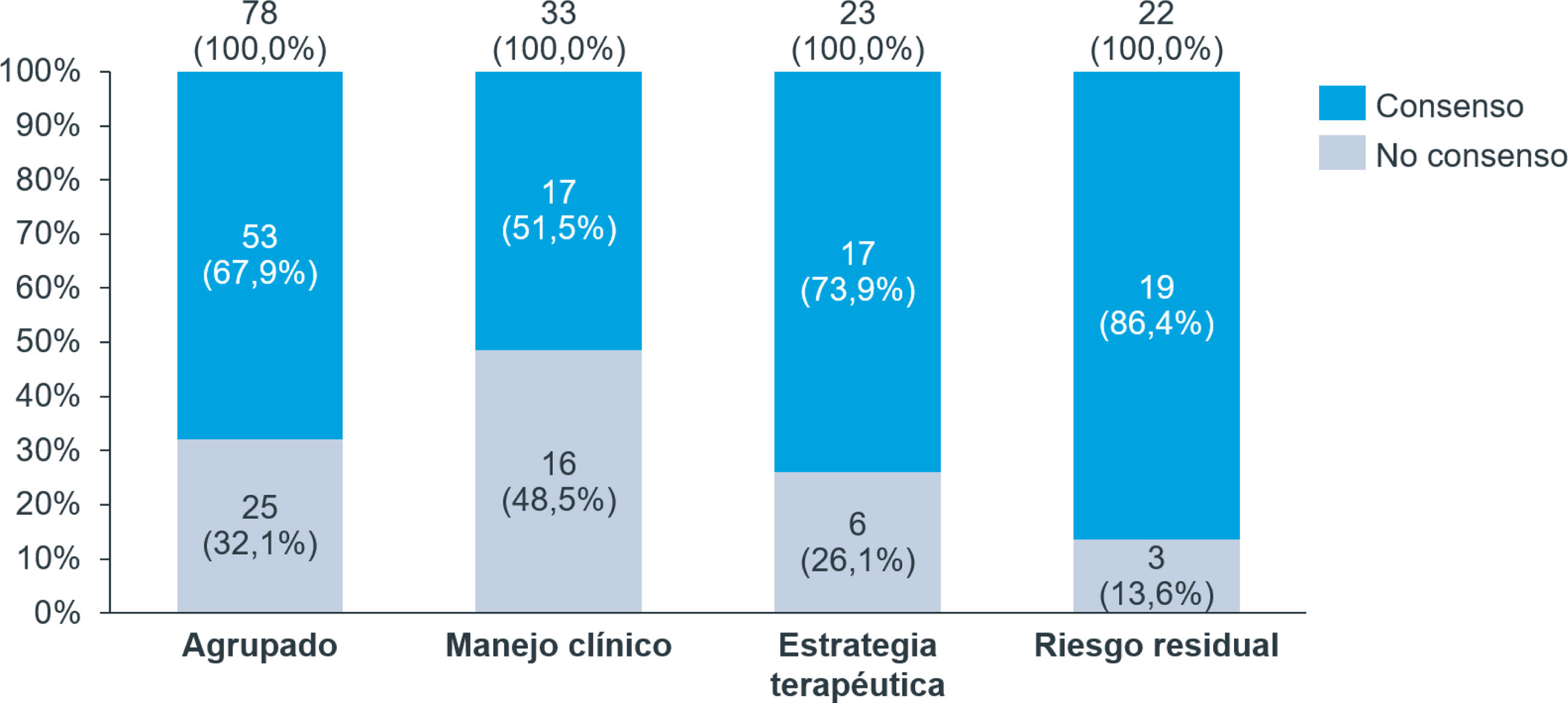
En la primera ronda del Delphi se alcanzó el nivel de acuerdo definido para 43 afirmaciones sobre las 76 afirmaciones incluidas inicialmente (56,6%). Las afirmaciones consensuadas se excluyeron para la siguiente ronda, pero se añadieron 2 afirmaciones nuevas y se reformuló otra. En la segunda ronda se alcanzó el nivel de acuerdo definido para 10 afirmaciones sobre un total de 35 afirmaciones (28,6%). Globalmente tras las 2 rondas se alcanzó el nivel de acuerdo definido en 53 de las 78 afirmaciones incluidas en el cuestionario (67,9%).
La sección con consenso en un mayor número de afirmaciones fue la sección de riesgo residual (86,4%), seguida de la de estrategia terapéutica (73,9%) y la de manejo terapéutico (51,5%) (fig. 2tabla 1 del material suplementario). En la tabla 2 del material suplementario se presentan las afirmaciones y los resultados (mediana, percentil 25 y percentil 75) de la primera y la segunda ronda.
Manejo de los pacientesEn cuanto a las guías de práctica clínica que deberían utilizarse como referencia, se alcanzó consenso en que las guías de la KDIGO (8,5 [8-9]), la ADA (8 [7-9]) y el documento de consenso de las 10 sociedades científicas (8 [7-9]) deberían ser los documentos de referencia principales.
No se alcanzó consenso sobre las barreras que limitan la aplicación de las guías en la práctica clínica, como la limitación de tiempo, la falta de formación y la variabilidad en el acceso a pruebas diagnósticas.
Asimismo, hubo consenso en el acuerdo de que médicos de atención primaria, endocrinólogos y nefrólogos deberían conocer y aplicar la clasificación KDIGO de estratificación del riesgo de eventos adversos dependientes de la ERC como muerte prematura, progresión de la ERC, fracaso renal agudo y eventos CV como ictus, infarto de miocardio y fibrilación auricular (9 [8-9]), y en desacuerdo respecto a que solo los nefrólogos deberían conocer y aplicar la clasificación KDIGO (1 [1-3]).
Respecto al diagnóstico de estas enfermedades hubo consenso en que el diagnóstico de la DMT2 se realiza principalmente desde medicina de familia (8 [7,75-9]). Sin embargo, no se alcanzó consenso respecto al cribado y nivel de detección de la ERC. En las afirmaciones sobre el grado de seguimiento del riesgo CV, de ERC y de otras complicaciones y su manejo, hubo consenso en la franja intermedia de 4 a 6 en la escala Likert, indicando desconocimiento sobre estos aspectos.
Estrategia terapéuticaSe alcanzó consenso en el acuerdo de los panelistas sobre la mayoría de los objetivos del tratamiento. La afirmación con un mayor grado de acuerdo fue respecto a las recomendaciones sobre el estilo de vida de forma consensuada con el paciente (9 [9-9]).
Respecto a los tratamientos farmacológicos, no hubo consenso respecto a que la mayoría de los pacientes que se beneficiarían del tratamiento estuviesen recibiéndolo de forma habitual, independientemente del tipo de tratamiento.
Riesgo residualLos factores clave para el abordaje del riesgo residual que fueron consensuados por los panelistas se resumen en la tabla 1 (para más información revisar el material suplementario).
Factores clave para abordar el riesgo residual consensuado por los panelistas
| Carga de la enfermedad en los pacientes con ERC y DMT2 | |
| 1 | Cuando concurren DMT2 y ERC el efecto sobre la esperanza de vida es mayor que el esperado por el efecto independiente de ambas enfermedades |
| 2 | En pacientes con ERC categoría G3, la albuminuria influye más que el filtrado glomerular en el riesgo de muerte prematura |
| Existencia de riesgo residual en los pacientes con ERC y DMT2 | |
| 3 | A pesar de recibir tratamiento, los pacientes con DMT2 y ERC pueden continuar expuestos a un riesgo elevado de progresión de la enfermedad o complicaciones renales |
| 4 | A pesar de recibir tratamiento, los pacientes con DMT2 y ERC pueden continuar expuestos a un riesgo elevado de complicaciones cardiovasculares (CV) |
| 5 | A pesar de recibir tratamiento, los pacientes con DMT2 y ERC pueden continuar expuestos a un riesgo elevado de muerte prematura |
| 6 | Este elevado riesgo de muerte prematura no se corrige completamente con la diálisis o el trasplante: la esperanza de vida de estos pacientes está reducida en hasta 40 y 15 años, respectivamente, en comparación con la población general |
| Estrategias farmacológicas | |
| 7 | La gestión del riesgo residual de complicaciones renales y CV en pacientes que ya están recibiendo tratamiento estándar puede mejorarse mediante el empleo de fármacos nefroprotectores y cardioprotectores con mecanismos de acción complementaria |
| 8 | La reducción del riesgo residual de complicaciones renales, CV y muerte prematura puede lograrse mediante la utilización de tratamientos que tengan efecto adicional en pacientes que ya están recibiendo tratamiento estándar |
| 9 | La instauración de los 3 pilares de tratamiento de manera simultánea (IECA/ARAII+iSGLT2+ARMns) es la estrategia óptima para abordar el riesgo residual en contraposición al tratamiento secuencial |
| 10 | Los iSGLT2 han supuesto un avance en la protección renal y CV del paciente con DMT2 y ERC ya tratado con inhibidores del SRA |
| 11 | Los ARM no esteroideos han supuesto un avance en la protección renal y CV del paciente con DMT2 y ERC ya tratado con SRA e independiente del beneficio obtenido con los inhibidores de SGLT2 |
| 12 | Dado los diferentes mecanismos de acción de los inhibidores SGLT2 y los ARM no esteroideos, podrían tener una acción complementaria |
| 13 | Para mitigar el riesgo residual de pacientes que ya están recibiendo tratamiento estándar, es fundamental aplicar tratamientos nefroprotectores de manera temprana e intensiva |
| Estrategias no farmacológicas | |
| 14 | Los pacientes con riesgo residual renal precisan un control más frecuente del cociente albúmina/creatinina en orina y del filtrado glomerular estimado para valorar el efecto de los tratamientos aplicados |
| 15 | No obstante, si el filtrado glomerular estimado es bajo y la albuminuria elevada (casillas rojas del mapa de calor KDIGO) el riesgo CV ya es altísimo y no es necesario usar SCORE2 |
| 16 | Para mitigar el riesgo residual se debería evitar la inercia terapéutica mediante la monitorización de FGe y albuminuria al menos una vez al año, independientemente del tratamiento |
| 17 | La coordinación entre niveles asistenciales también permitiría disminuir el riesgo residual de pacientes que ya están recibiendo tratamiento estándar mediante la implementación de un abordaje óptimo a los pacientes con DMT2 y ERC |
| 18 | Los sistemas de comunicación bidireccionales entre especialidades y niveles asistenciales, tales como la teleconsulta, facilitarían la prescripción de tratamientos nefroprotectores de manera temprana |
| 19 | El tabaquismo es un factor clave para mitigar el riesgo residual de pacientes que ya están recibiendo tratamiento estándar |
ARAII: antagonistas de los receptores de la angiotensina ii; ARMns: antagonistas del receptor de mineralocorticoides no esteroideos; CV: cardiovascular; DM: diabetes mellitus; DMT2: diabetes mellitus tipo 2; ERC: enfermedad renal crónica; FG: filtrado glomerular; IECA: inhibidores de la enzima convertidora de la angiotensina; RM: receptor mineralocorticoide; SGLT2: inhibidores del cotransportador de sodio-glucosa tipo 2; SRA: sistema renina-angiotensina.
Se alcanzó consenso en que la concurrencia de ERC y DMT2 reduce la esperanza de vida más de lo esperado por el efecto independiente de cada enfermedad (9 [8-9]). Se acordó también que, en los pacientes con ERC categoría G3, la albuminuria influye más que la TFG en el riesgo de muerte prematura (7 [7-8]).
Los panelistas estuvieron de acuerdo en que los pacientes con DMT2 y ERC presentan un riesgo residual elevado de progresión de la enfermedad o complicaciones renales (9 [8-9]), complicaciones CV (9 [8-9]) y muerte prematura (9 [8-9]), a pesar del tratamiento estándar.
En cuanto a las estrategias farmacológicas se consensuó también la necesidad de implementar simultáneamente el bloqueo del SRAA, iSGLT2 y ARMns (8 [7-9]) y aplicar los tratamientos nefroprotectores de manera temprana e intensiva (9 [8-9]). Se consensuó que se puede reducir el riesgo residual mediante el empleo de fármacos nefroprotectores y cardioprotectores con mecanismos de acción complementaria (9 [9-9]). También se acordó que los iSGLT2 y ARMns han supuesto un avance significativo (9 [9-9] y 8 [7-9], respectivamente) y podrían tener efectos complementarios (9 [8-9]).
Respecto a las estrategias no farmacológicas se acordó que los pacientes con riesgo residual renal necesitan un control más frecuente del cociente albúmina/creatinina en orina y del filtrado glomerular estimado para evaluar el efecto de los tratamientos (8 [7-9]), así como la recomendación de evitar el tabaquismo (9 [8-9]). Se debería evitar la inercia terapéutica mediante la monitorización del filtrado glomerular y la albuminuria al menos una vez al año, independientemente del tratamiento (9 [8-9]). Una mejora de la coordinación entre niveles asistenciales (9 [9-9]), y el uso de sistemas de comunicación bidireccionales (9 [8-9]), fueron otras de las estrategias clave para mitigar el riesgo residual.
No se alcanzó el consenso en relación con la evaluación del riesgo CV en práctica clínica habitual (6 [5-7]), el riesgo de fallo renal respecto al de muerte CV en pacientes con ERC categoría G3 (3 [2-4]) y la importancia del cálculo del cociente fósforo/proteínas en plasma (6 [5-7]).
DiscusiónEste estudio recoge la opinión basada en la experiencia de diferentes especialistas, nefrólogos, endocrinólogos y médicos de familia, aportando diferentes visiones sobre el riesgo residual y su abordaje en los pacientes con ERC y DMT2.
Los resultados del estudio Delphi indicaron que los pacientes con ERC asociada a DMT2 presentan un riesgo residual elevado de progresión de la enfermedad, complicaciones renales y CV y muerte prematura. Además, los panelistas consideraron que este riesgo residual persiste a pesar de las intervenciones terapéuticas actuales y subrayaron la necesidad urgente de enfoques más efectivos.
Se identificaron numerosos estudios en la literatura evidenciando que, a pesar de recibir tratamiento estándar, muchos pacientes con ERC asociada a DMT2 continúan teniendo un alto riesgo de complicaciones, lo que destaca la importancia de contar con enfoques más integrales y personalizados1. No obstante, la identificación y manejo del riesgo residual son complejos, ya que requieren una evaluación continua y un enfoque personalizado en el tratamiento. Esto implica no solo el control de los factores de riesgo tradicionales, sino también la consideración de otros factores que pueden contribuir a la progresión de la enfermedad25.
Frente a esta problemática, el panel consideró que el manejo del riesgo residual debe ser integral y dinámico para abordar adecuadamente las necesidades de estos pacientes. Las estrategias para abordar el riesgo residual en pacientes con DMT2 y ERC, respaldadas por el consenso del estudio Delphi, incluyen la implementación simultánea, temprana e intensiva de los 3 pilares del tratamiento: iSRAA, iSGLT2 y ARMns. Estos fármacos, con mecanismos de acción complementarios, ofrecen beneficios significativos en el manejo del riesgo residual para este tipo de pacientes.
Por un lado, los iSRAA han mostrado reducir la progresión renal en diabéticos26,27 y no diabéticos28, pero de forma modesta, quedando mucho riesgo residual por resolver. Por otro lado, los iSGLT2 mejoran el control glucémico, reducen la presión intraglomerular y la proteinuria y ofrecen beneficios CV y en insuficiencia cardiaca. No obstante, un 10% o más de los pacientes con ERC tratados con iSGLT2 e iSRAA presentaron progresión de la enfermedad durante un seguimiento relativamente corto de 2-3 años29,30. Las cifras de presión arterial son más elevadas para pacientes con ERC más avanzada, hasta el 15% en aquellos con mayor albuminuria. Estos tratamientos no atacan de manera directa las vías de inflamación, estrés oxidativo y fibrosis, por lo que se necesitan opciones terapéuticas para bloquear estos mecanismos patogénicos31. En tercer lugar, los ARMns reducen significativamente la proteinuria y enlentecen la progresión de la ERC, mejorando así la función renal y reduciendo el riesgo CV de manera complementaria a los 2 ejes mencionados anteriormente8,32. Además, la triple asociación fue más segura que combinaciones duales33. Por ello, la combinación de estos tratamientos aborda múltiples vías patogénicas de la ERC y DMT2, proporcionando una estrategia terapéutica robusta y multidimensional.
Las guías de práctica clínica internacionales que fueron consideradas como guías de referencia por parte del consenso de los panelistas, que son la guía KDIGO y la de la ADA17,20, también refuerzan este abordaje cubriendo los 3 pilares de tratamiento. Los algoritmos terapéuticos de las sociedades científicas españolas, entre ellos el documento de consenso de García-Maset et al.1, de 2022, recomiendan un abordaje holístico de la enfermedad, aunque en el momento de la publicación finerenona todavía no estaba comercializada. En otras guías de diabetes y ERC, como la de la fundación redGDPS, elaborada en 2023, se recomienda el abordaje de las 3 vías de manera alineada a las guías KDIGO y de la ADA34, así como las guías para el manejo del paciente con ERC y DM publicadas por la Sociedad Española de Nefrología y el Grupo Español de Estudio de Nefropatía Diabética (GEENDIAB)22.
Asimismo, el panel consensuó una serie de estrategias no farmacológicas que podrían ser beneficiosas para un abordaje efectivo del riesgo residual, como la modificación de los hábitos de vida y un seguimiento más estrecho del cociente albúmina/creatinina en orina y de la TFG. Por otro lado, se consideró fundamental mitigar la inercia terapéutica, por lo que sería recomendable establecer una vigilancia continua y ajustes proactivos en el tratamiento para responder a la evolución de la enfermedad y las necesidades individuales del paciente.
Otra de las estrategias consensuadas fue la coordinación eficaz de diferentes niveles asistenciales para el manejo integral del riesgo residual. De hecho, la comunicación fluida y la colaboración entre atención primaria, especializada y otros servicios de salud asegurarían un enfoque cohesivo y continuo en el cuidado del paciente, optimizando los resultados clínicos.
Finalmente, fomentar la telemedicina podría facilitar el seguimiento de los pacientes, permitiendo un acceso más fácil a la atención y una monitorización continua de su salud35. La telemedicina en el manejo de la ERC permite a los pacientes acceder a consultas y monitorización remota, facilitando el seguimiento de su salud sin necesidad de desplazamientos35. Además, fomentaría la educación del paciente y la colaboración multidisciplinaria, mejorando así la calidad de la atención y la adherencia al tratamiento35. Implementar estas estrategias puede ayudar a mitigar el riesgo residual y mejorar la calidad de vida de los pacientes con ERC.
Sin embargo, es importante resaltar que los panelistas no lograron alcanzar un consenso o, en su defecto, lo hicieron con puntuaciones intermedias (de 4 a 6 en la escala) en relación con las afirmaciones sobre el manejo y seguimiento de los pacientes, así como en lo que respecta a la administración de tratamientos en la práctica clínica. Esto refleja que persiste la necesidad de avanzar en este ámbito y optimizar la gestión de estos pacientes, ya que actualmente hay una gran variabilidad en el manejo de los mismos en la práctica clínica.
Por lo tanto, es fundamental adoptar un enfoque integral y multidisciplinar que permita minimizar el riesgo residual y optimizar los resultados a largo plazo en pacientes con ERC asociada a DMT2.
La metodología Delphi permite a los participantes expresarse libremente sin la influencia de líderes de grupo. Sin embargo, el estudio presenta las limitaciones propias del método Delphi, como el sesgo de selección de los expertos, porque los criterios para la selección de los panelistas puede que no hayan identificado adecuadamente a los que cuenten con mayor experiencia en este campo. No obstante, los miembros del comité científico sí que contaban con una amplia experiencia con el trato de pacientes en este ámbito. Por otro lado, el uso de un cuestionario estructurado podría restringir los resultados del estudio.
ConclusionesSe obtuvo consenso multidisciplinar en que los pacientes con ERC y DMT2 tienen un riesgo residual elevado de progresión de la enfermedad, muerte prematura, complicaciones renales y CV. Las medidas consideradas relevantes para contribuir a reducir el riesgo residual en estos pacientes sobre las que hay consenso multidisciplinar son la instauración simultánea, temprana e intensiva de los 3 pilares de tratamiento (IECA/ARAII+iSGLT2+ ARMns), evitar la inercia terapéutica y fomentar la coordinación entre niveles asistenciales.
FinanciaciónEl presente trabajo ha sido financiado por Bayer. Bayer participó en el diseño, análisis de datos y redacción del manuscrito. Los autores no han recibido honorarios por la autoría.
Conflicto de interesesAlberto Ortiz ha recibido becas de Sanofi y honorarios por consultoría o ponencias o apoyo en viajes de Adviccene, Alexion, Astellas, Astrazeneca, Amicus, Amgen, Bioporto, Boehringer Ingelheim, Esteve, Fresenius Medical Care, GSK, Bayer, Sanofi-Genzyme, Sobi, Menarini, Mundipharma, Kyowa Kirin, Lilly, Freeline, Idorsia, Chiesi, Otsuka, Novo-Nordisk, Sysmex y Vifor Fresenius Medical Care Renal Pharma y Spafarma y es Director de la Cátedra UAM-Astrazeneca de Enfermedad Renal Crónica y Electrolitos. Tiene acciones en Telara Farma.
Ana Cebrián declara haber recibido financiación para realizar ensayos clínicos de MSD y Sanofi (toda en el instituto IMIB); honorarios por consultoría de AstraZeneca, Bayer, Eli Lilly, MSD, Novo Nordisk y Sanofi; pago de honorarios por conferencias de AstraZeneca, Bayer, Boehringer-Ingelheim, Eli Lilly, Menarini, MSD, Sanofi y Novo Nordisk.
Alfonso Soto declara no tener ningún conflicto de intereses.
Andrés Reyes es empleado de Bayer.
José Luis Górriz declara haber recibido financiación para realizar ensayos clínicos de AstraZeneca, Bayer, Boehringer Ingelheim y Novo Nordisk (todos para el Instituto de Investigación INCLIVA); honorarios por consultoría de AstraZeneca, Bayer, Boehringer-Ingelheim y Novo Nordisk y pago de honorarios por conferencias de AstraZeneca, Novo Nordisk, Bayer, Menarini, Boehringer-Ingelheim y Eli Lilly.
Los autores agradecen a María Lloret, Daniel Callejo y Aaron Aires, trabajadores de IQVIA, su apoyo en el diseño del estudio, análisis de los datos y en la redacción del manuscrito. Estos servicios fueron financiados por Bayer.