ESTEROIDES NATURALES Y SINTÉTICOS
La corteza suprarrenal produce tres tipos de hormonas esteroides (corticoides):
- Glucocorticoides (GC), cortisol y corticosterona en la zona fasciculada.
- Mineralocorticoides, aldosterona y desoxicorticosteronaen la zona glomerulosa.
- Hormonas gonadales, dehidroepiandrosterona, androstenodiona y testosterona en la zona reticular. En este artículo nos ocuparemos básicamente de los que poseen efecto antiinflamatorio e inmunosupresor: de los GC.
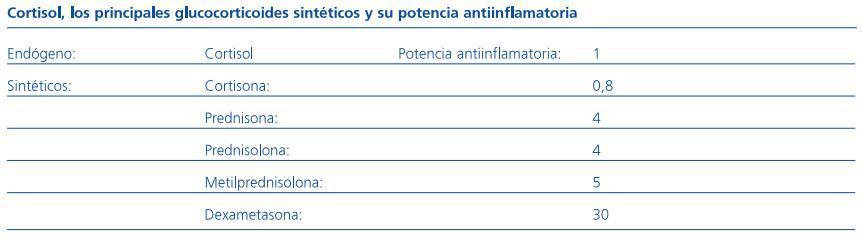
A partir del esteroide natural cortisol, se han obtenido numerosos derivados sintéticos, siendo la cortisona el primero de ellos (1948). La acción glucocorticoide de los derivados sintéticos muestra diversidad de potencias antiinflamatorias, en relación con la del cortisol endógeno, estimada en la unidad (tabla 1).
ACCIONES FISIOLÓGICAS/EFECTOS FARMACOLÓGICOS DE LOS GLUCOCORTICOIDES
Las concentraciones de cortisol endógeno siguen un ritmo circadiano, liberándose más por la mañana y también tras cada comida. Del mismo modo, se segregan, y de manera rápida, en respuesta al estrés, sea físico (traumatismo, cirugía, ejercicio), psicológico (ansiedad, depresión) o fisiológico (hipoglucemia, fiebre) y es precisamente en enfermos con déficit suprarrenal que tales situaciones pueden ser graves, lo que hace conveniente aumentar las dosis previas de hormonas de sustitución.
La acción de los esteroides se ejerce por su interacción con proteínas receptoras específicas situadas en los sistemas y órganos de prácticamente toda la economía (receptores de GC).
Aunque la utilización de los GC en patología renal se basa en su acción antiinflamatoria/inmunosupresora, de la que luego trataremos, poseen otras acciones que es importante conocer para comprender los efectos adversos que pueden darse en el curso de su administración.
Sobre el metabolismo de los hidratos de carbono y proteínas
Desde el punto de vista teleológico, los GC pueden considerarse como protectores contra la inanición de los tejidos dependientes de glucosa (básicamente cerebro y corazón). Ello se logra al estimular al hígado para que forme glucosaa partir de aminoácidos movilizados de las proteínas tisulares (neoglucogénesis) y propiciar su depósito hepático en forma de glucógeno. La disminución que los GC inducen en la penetración de la glucosa en otros tejidos como la piel, el músculo o la grasa contribuye a que, en caso de tratamientos intensos, pueda darse hiperglucemia y como resultado de la acción sobre las proteínas, un aumento de la eliminación urinaria de nitrógeno no proteico o retención nitrogenada en caso de insuficiencia renal.
Sobre el sistema cardiovascular
Aunque en menor medida que la aldosterona, los GC poseen cierta acción mineralocorticoide, y pueden producir retención hidrosalina e hipertensión arterial, como es evidente en el caso de la enfermedad de Cushing o de tratamientos prolongados con dosis suprafisiológicas de fármacos GC.
Se admite que los GC pueden ejercer un efecto inotropo directo o una acción antitóxica sobre el miocardio. También pueden aumentar la reactividad vascular a las catecolaminas y a otras sustancias presoras, siendo posible que la inhibición de la NO sintasa vascular, que los GC inducen, contribuya a reducir factores endógenos vasodilatadores que pueden ser liberados en algunos casos de shock.
Sobre el músculo estriado
En pacientes con enfermedad de Addison, la debilidad muscular es un síntoma frecuente y también en caso de hipercorticismo endógeno o tras tratamiento prolongado con GC, situaciones en las que es característica la emanciación del tejido muscular estriado. El cuadro de miopatía por esteroides tiene un mecanismo desconocido.
Sobre el metabolismo óseo
Los GC afectan al metabolismo óseo por varios mecanismos:
- Inhiben la formación de hueso al suprimir la proliferación y activación de los osteoblastos.
- Reducen la absorción de calcio en el intestino y facilitan su eliminación por el riñón, con lo que se produce una hiperactividad paratiroidea y la consiguiente estimulación osteoclástica.
- Facilitan la apoptosis de osteoblastos y osteocitos.
- Inhiben la liberación de la hormona del crecimiento que, como se sabe, se ve mermada en niños tratados con GC. También actúan en los condrocitos del cartílago de crecimiento.
Sobre el sistema nervioso central
Se sabe que el tejido nervioso es rico en receptores para la acción de los esteroides, por lo que su acción a ese nivel se cree que es importante. Se han reconocido acciones sobre el estado de ánimo, la conducta y la excitabilidad del cerebro. Los pacientes con enfermedad de Addison pueden mostrar apatía, depresión e irritabilidad, que se corrigen con tratamiento sustitutivo. En casos de hipercorticismo o tratamiento con fármacos con acción GC, suelen darse euforia, intranquilidad y a veces reacciones psicóticas.
Sobre elementos formes de la sangre
Aunque poco notables, los GC pueden tener efecto sobre las células de la serie roja, y se han descrito casos de anemia en la enfermedad de Addison y de policitemia en la enfermedad de Cushing.
Sobre la serie blanca, se ha observado un incremento de la masa linfoide en la enfermedad de Addison y linfocitopenia en caso de hipercorticismo.
El uso de GC origina un menor número de linfocitos, eosinófilos, monocitos y basófilos en la circulación como un efecto más de la redistribución de los mismos que de su destrucción. No obstante, el efecto terapéutico de los GC en ciertos tumores linfáticos puede relacionarse con su capacidad para activar la apoptosis en algunos tejidos linfoides. En contraste, aumenta la cifra de polimorfonucleares circulantes como resultado no sólo de la conocida desmarginación en las paredes vasculares sino también por incremento de su liberación desde la médula ósea y por disminución de la velocidad con la que se eliminan de la circulación.
Acciones antiinflamatorias e inmunosupresoras
Estas acciones son las que nos interesan para el tratamiento de las enfermedades glomerulares. Los GC endógenos y/o dosis farmacológicas de los sintéticos protegen al organismo de las consecuencias letales que podría tener una respuesta inflamatoria plenamente activada. La acción antiinflamatoria se produce sea cual fuere la causa de la inflamación, pudiendo inhibir tanto sus manifestaciones inmediatas (dolor, rubor, tumefacción), como las intermedias (proliferación celular) o las tardías (fibrosis).
Los mecanismos por los que los GC atenúan las reacciones inflamatorias son múltiples: inhiben la producción por parte de diversas células de citoquinas, factores vasoactivos y quimioatrayentes, bradicininas, enzimas proteolíticas y también la extravasación de leucocitos en zonas de lesión y su consiguiente acceso al foco inflamatorio.
Analizaremos a continuación los mecanismos lesionales modificados por los GC en función del tipo celular implicado. La relación no es exhaustiva y hay que considerar que algunos mediadores de lesión pueden tener un origen multifocal e interaccionar entre ellos:
Sobre el linfocito
Los GC activan la apoptosis de linfos inmaduros y en menor intensidad de los activados:
- Inhibición de IL-1: es un pirógeno endógeno, de ahí el efecto antipirético de GC.
- IL-2: factor de crecimiento celular de linfocitos T.
- IL-3: activadora de los linfocitos T.
- IL-6: activadora de los linfocitos T.
- TNF alfa.
- GM-CSF
- Interferón gamma.
A dosis altas, los GC disminuyen la síntesis de anticuerpos y aumentan su catabolismo.
Sobre los macrófagos y monocitos
Inhibición de: ácido araquidónico y sus metabolitos (prostaglandinas y leucotrienos).
- IL-1.
- IL-6.
- TNF alfa.
Reactivos de fase aguda (incluyen el tercer factor del complemento).
Contrarrestan la acción del MIF (Migration Inhibiting Factor)que propicia la adhesiónmacrófago-célula endotelial.
Sobre las células endoteliales
Inhibición de moléculas de adhesión leucocito-endotelio (ELAM-1).
- Moléculas de adhesión intracelular (ICAM-1).
- Reactantes de fase aguda.
- Citoquinas, tales como IL-1.
- Derivados del ácido araquidónico.
- Expresión de antígenos de histocompatibilidad de clase II.
Sobre los basófilos
- Inhibición de secreción de histamina.
- Leucotrieno C4.
Sobre los fibroblastos
- Inhibición de metabolitos del ácido araquidónico.
- Proliferación de fibroblastos y consiguiente síntesis de colágeno.
EFECTOS ADVERSOS
Estos efectos pueden darse en prácticamente todo el organismo. Son más frecuentes en caso de tratamientos a dosis altas y/o prolongados.
Se refieren a continuación los más citados en la literatura. Cabe decir que las referencias bibliográficas consultadas sobre efectos secundarios corresponden a algún GC en concreto (prednisolona, 6-metilprednisolona u otros) y que en la relación que sigue se atribuyen a todo el grupo GC en un intento de simplificación.
Trastornos endocrinos
- Presentación o empeoramiento de diabetes.
- Distribución anormal de grasas: cara de luna llena/cuello de búfalo/obesidad troncal.
- Apetito excesivo. Ganancia de peso.
- Cambios en las fracciones lipídicas. Aumento de colesterol total o triglicéridos.
- Lipomatosis.
- Amenorrea. Hirsutismo.
- Atrofia de corteza suprarrenal. Enfermedad de Cushing yatrogénica.
- Retraso del crecimiento en niños. Se estudia tratamiento paliativo con GH.
- Anomalías del ciclo menstrual.
Trastornos cardiovasculares
Aldosteronismo. Retención hidrosalina. Hipopotasemia. Hipertensión arterial. Entrada en ICCV en cardiópatas.
Aparato digestivo
- Es debatida la producción de ulcus gastrointestinal. Alteran la barrera mucosa, la regeneración del epitelio y disminuyen el pH del jugo gástrico.
- Perforaciones gastrointestinales.
- Pancreatitis.
Sistema nervioso
- Aumento de la presión intracraneal. Papiledema. Seudotumor cerebral.
- Cefaleas, vértigo, insomnio.
- Desarrollo de cambios de personalidad, euforia, depresión o psicosis.
- Convulsiones.
- Extrapiramidalismo.
- Afectación del nervio óptico.
Piel
- Atrofia cutánea, estrias, acné, equimosis, petequias, paniculitis, diaforesis.
- Enlentecimiento de la cicatrización.
- Sarcoma de Kaposi.
Sangre
- Granulocitosis.
- Linfopenia
- Trombocitosis.
- Reacción leucemoide.
Musculosquelético
- Debilidad muscular. Crisis miasténica.
- Osteoporosis, fracturas patológicas. Aplastamiento vertebral.
- Necrosis aséptica de la cabeza del fémur o húmero.Ruptura de tendones.
OCULARES
- Cataratas, glaucoma.
- Coriorretinopatía central serosa.
- Exoftalmos.
Infecciones
Predisponen a infecciones de todo tipo. A veces sin signos de alarma como la fiebre.
A destacar: tuberculosis, herpes/varicela o fúngicas.
Síndrome de deprivación de esteroides.
Suele presentarse al disminuir/retirar el tratamiento de manera excesivamente rápida y se caracteriza por artralgias, fiebre, dolores musculares/alteración del estado general.
PRECAUCIONES DE USO
Han de adoptarse en pacientes con patologías subyacentes como:
- Colitis ulcerosa grave y diverticulitis (riesgo de perforación).
- Anastomosis intestinales recientes.
- Infecciones latentes o manifiestas.
- Pacientes con reactividad a la tuberculina. Valorar la asociación de quimioprofilaxis.
- Miastenia grave. Se recomienda iniciar el tratamiento con dosis bajas de GC, de otra manera puede presentarse una crisis miasténica.
- Diabetes. Posible necesidad de modificar pauta antidiabética.
- Hipotiroidismo: posible incremento del efecto de GC.
- Cardiopatía. Valorar la retención hidrosalina.
- Controles de opacidades en cristalino y de presión intraocular.
- Evitar la supresión brusca del tratamiento con GC.
CONTRAINDICACIONES RELATIVAS/ABSOLUTAS
- Hipersensibilidad a los GC.
- Úlcera gastroduodenal activa.
- Alteraciones psiquiátricas graves.
- Glaucoma.
- Queratitis herpética.
- Amebiasis, micosis sistémicas, varicela, herpes simple o fase virémica del zóster.
- Tuberculosis.
INTERACCIONES CON OTROS FÁRMACOS O SUSTANCIAS
Relación no exhaustiva:
- Con anfotericina: hipopotasemia.
- Anticoagulantes orales: aumento o disminución de su acción.
- Anticolinesterasas: depresión muscular.
- AINE: aumento del riesgo de ulcus gastroduodenal.
- Ciclosporina: aumento de concentraciones plasmáticas de CsA y del propio GC.
- Claritromicina, eritromicina: aumentan concentraciones y posible toxicidad de GC.
- Diltiazem: aumentan concentraciones y posible toxicidadde GC.
- Estrógenos, anticonceptivos orales: aumentan concentraciones y posible toxicidad de GC.
- Inductores enzimáticos (fenitoína, fenobarbital, etc.): disminución de los niveles plasmáticos de GC.
- Inhibidores enzimáticos (ketoconazol): aumento de los niveles plasmáticos de GC.
- Diuréticos eliminadores de potasio: hipopotasemia.
- Resinas de intercambio iónico (colestiramina, colestipol): menor absorción de GC.
- Salicilatos: ven disminuida su concentración sanguínea.
- Vacunas: los GC pueden inhibir la inmunización y favorecer la replicación de gérmenes vivos.
- Zumo de pomelo: ingerido en gran cantidad, aumenta las concentraciones de algunos GC.
INDICACIONES DE LOS ESTEROIDES EN GLOMERULOPATÍAS
Un poco de historia
En 1849, Thomas Addison (1793-1860), médico adjunto de Richard Bright en el Guy¿s Hospital de Londres, resaltó por primera vez la importancia de las glándulas suprarrenales, describiendo resultados letales en sujetos con destrucción de las mismas y en 1855 publicó «On the constitutional and local effects of disease of the suprarrenal capsules». Estos estudios fueron ampliados poco después por Brown-Séquard al demostrar que la suprarrenalectomía bilateral era letal en animales de laboratorio.
En 1912, Harvey William Cushing (1869-1939), profesor de la Harvard Medical School y Jefe de Neurocirugía del Peter Brigham Hospital de Boston, publicó «The pituitary body and its disorders». Las manifestaciones clínicas del adenoma basófilo de hipófisis recibieron el nombre de síndrome de Cushing, epónimo también utilizado para otros tipos de hipercorticismo, sea endógeno o inducido por esteroides sintéticos.
En 1948, la producción sintética de cortisona, GC con acción similar al cortisol endógeno (dotado también de cierta actividad mineralocorticoide), supuso un hito en el tratamiento sustitutivo de los déficits hormonales suprarrenales y también la posibilidad de aprovechar sus cualidades antiinflamatorias e inmunosupresoras, siendo en 1949 que comenzó a usarse en el tratamiento de la artritis reumatoide.
Al año siguiente, se publica el primer artículo en lengua inglesa que sobre el uso de esteroides en glomerulonefritis ha podido localizar el autor del presente artículo (Luetscher JA Jr., Deming QB, Harvey J, Lew W, Pool LJ. Treatment of nephrosis with cortisone. J Clin Invest 1950;29:576).
Lógicamente, esta publicación fue seguida de otras en años sucesivos4-9 que se publicaron en revistas de la categoría de The Lancet, Am J Med, JAMA o Quart J of Med, siendo este último artículo10, fechado en 1967, el primer estudio controlado realizado en este terreno.
Además del síndrome nefrótico, básicamente del tipo idiopático, otras entidades de tipo glomerular que históricamente han sido tributarias de tratamiento esteroideo por su clara corticosensibilidad son la nefritis lúpica y la afectación renal de las vasculitis primarias (tabla 2).
En el tratamiento de la nefritis lúpica, la introducción de los corticoides supuso también un cambio histórico. Solamente hay que decir que antes de su introducción en los inicios de los años cincuenta del pasado siglo, la supervivencia de las pacientes con enfermedades lúpicas solía ser inferior a los 3 años. Carey et al. firman la primera cita, también en 1950, encontrada sobre este tema11 (Carey RA, Harvey AM, Howard JE. The effect of ACTH and cortisone on the course of disseminated lupus erythematosus and periarteritis nodosa. Bull John Hopkins Hosp 1950;87:425).
En años sucesivos, fue progresando el conocimiento sobre el uso de GC en la nefritis lúpica y en 1974 hacen historia los trabajos controlados del NIH12, en los que se valora la combinación de esteroides más fármacos inmunosupresores.
En el terreno de la vasculitis renal, la primera cita sobre utilización de esteroides corresponde a la misma referida anteriormente para la nefritis lúpica (Carey et al.,195011). La introducción de CS supuso un descenso muy importante de la mortalidad por vasculitis, como puso de manifiesto la histórica serie de la Clínica Mayo, publicada por Frohnert y Sheps en 196713 que, aunque retrospectiva, mostró que sólo un 13% de los pacientes no tratados seguían vivos a los 5 años y que la introducción de GC aumentó tal proporción al 48%. El mismo año, Hollander y Manning refirieron sus resultados con agentes alquilantes en la enfermedad de Wegener14, pauta refrendada a partir de entonces, también en la periarteritis y en la poliarteritis, destacando los conocidos trabajos de Fauci para el NIH15.
En la actualidad, la utilización de GC en enfermedades glomerulares tiende a disminuir. El conocimiento de sus importantes efectos secundarios hace que su uso se limite a los procesos en los que está bien contrastada su eficacia y, aun así, en tales cuadros se intenta minimizar las dosis y la duración de la terapia.
El ahorro de esteroides
La pauta estándar inicial para un tratamiento convencional con GC es de 1 mg/kg/día (prednisona), aunque las megadosis endovenosas de GC (habitualmente 500 o 1.000 mg de 6-metilprednisolona) se siguen utilizando como «choques de esteroides» en situaciones, sobre todo, de GN rápidamente progresiva. Pero la minimización de las dosis de GC, en fase de inducción (corto plazo) y de mantenimiento (largo plazo) es un objetivo importante y se está consiguiendo gracias al empleo de fármacos inmunosupresores asociados a los propios GC o de recambios plasmáticos en lugar de los pulsos de esteroides.
Los inmunosupresores que asociados a dosis decrecientes de GC facilitan su ahorro son:
Ciclofosfamida. Comenzó a asociarse muy pronto en algunas nefropatías glomerulares16,17 y ha desempeñado un papel importante, sobre todo en nefritis lúpica y vasculitis renal, como se ha mencionado anteriormente, pero tiene la limitación de su toxicidad a corto y largo plazo, factor a considerar cuando, como en las dos enfermedades descritas, existe un alto riesgo de recaídas que hacen aconsejable pautas de mantenimiento.
Azatioprina y ciclosporina o tacrolimus. Tienen su papel en determinados cuadros, pero es el micofenolato el que se está estudiando en la actualidad como «ahorrador» de esteroides en los cuadros glomerulares corticosensibles. Su escasa toxicidad permitiría aplicarlo en pautas prolongadas.
Otra situación susceptible de tratamiento esteroideo son las glomerulonefritis con proliferación extracapilar como forma inicial o como brote extracapilar añadido a cualquier glomerulonefritis primaria o secundaria. El triplete terapéutico GC más inmunosupresión más plasmaféresis puede ser adecuado en cualquier caso cuya biopsia renal muestre un porcentaje significativo de semilunas.
En otras situaciones puede resultar dudosa la utilidad de los esteroides y no claramente favorable la relación beneficio/riesgo. Tal puede ser el caso de las nefropatías no claramente corticosensibles y con historia natural habitualmente prolongada como la nefropatía IgA, o GN membranoproliferativa, en las que el beneficio no parece inmediato y por tanto de difícil valoración en cuanto a resultado terapéutico.
En todo caso, es conveniente no emplear los GC de manera indiscriminada, sino basándose en un diagnóstico histológico, como ya en los primeros años de su utilización fue claramente expuesto en la literatura18,19, con el importante matiz de que en el diagnóstico histológico no importa sólo el tipo de glomerulopatía sino también el balance entre lesiones activas/lesiones esclerosas, pues estas últimas pueden considerarse irreversibles y no deben motivar el inicio o la continuidad de un tratamiento esteroideo, al menos, de cierta intensidad.
Tabla 1. Cortisol, los principales glucocorticoides sintéticos y su potencia antiinflamatoria
Tabla 2. Principales aplicaciones de los glucocorticoides en patología glomerular