La obesidad se ha convertido en una pandemia mundial1 y se considera un factor de riesgo cardiovascular (RCV) independiente para el desarrollo y progresión de la enfermedad renal crónica (ERC)2. Además, el tejido adiposo visceral es en sí, también un factor de RCV. Recientes estudios han observado que la acumulación de grasa renal ectópica (GRE) en tejido no adiposo, denominada «fatty kidney» o «riñón graso», se encuentra relacionado con la enfermedad renal asociada a la obesidad, y presenta una mejor correlación con la grasa total y visceral que aquellas mediciones como el perímetro de cintura o el índice de masa corporal2,3.
La distribución anatómica de la GRE se divide en: a) grasa del seno renal (GSR), tejido adiposo situado en la cara medial del riñón, que comparte espacio con estructuras vasculares, nerviosas, linfáticas, cálices mayor y menor, pelvis renal y uréter proximal; b) grasa perirrenal (GPeR) que se encuentra entre la cápsula renal y la fascia de Gerota (FG); c) grasa pararrenal (GPaR) que rodea al riñón fuera de la FG y d) grasa parenquimatosa renal (GPR), es el tejido adiposo dentro de la corteza y la médula renal. El impacto de la toxicidad lipídica a nivel renal se produce por una acumulación de gotas lipídicas en el parénquima renal (podocitos, mesangio y células tubulares proximales), contribuyendo a la disfunción renal a través de mecanismos de inflamación crónica por liberación de adipocinas y citocinas que pueden exacerbar la aterosclerosis y otros procesos patológicos cardiovasculares, el estrés oxidativo, la disfunción mitocondrial, la autofagia, además de la compresión mecánica directa por el depósito de grasa que conduce a la hipoperfusión4,5.
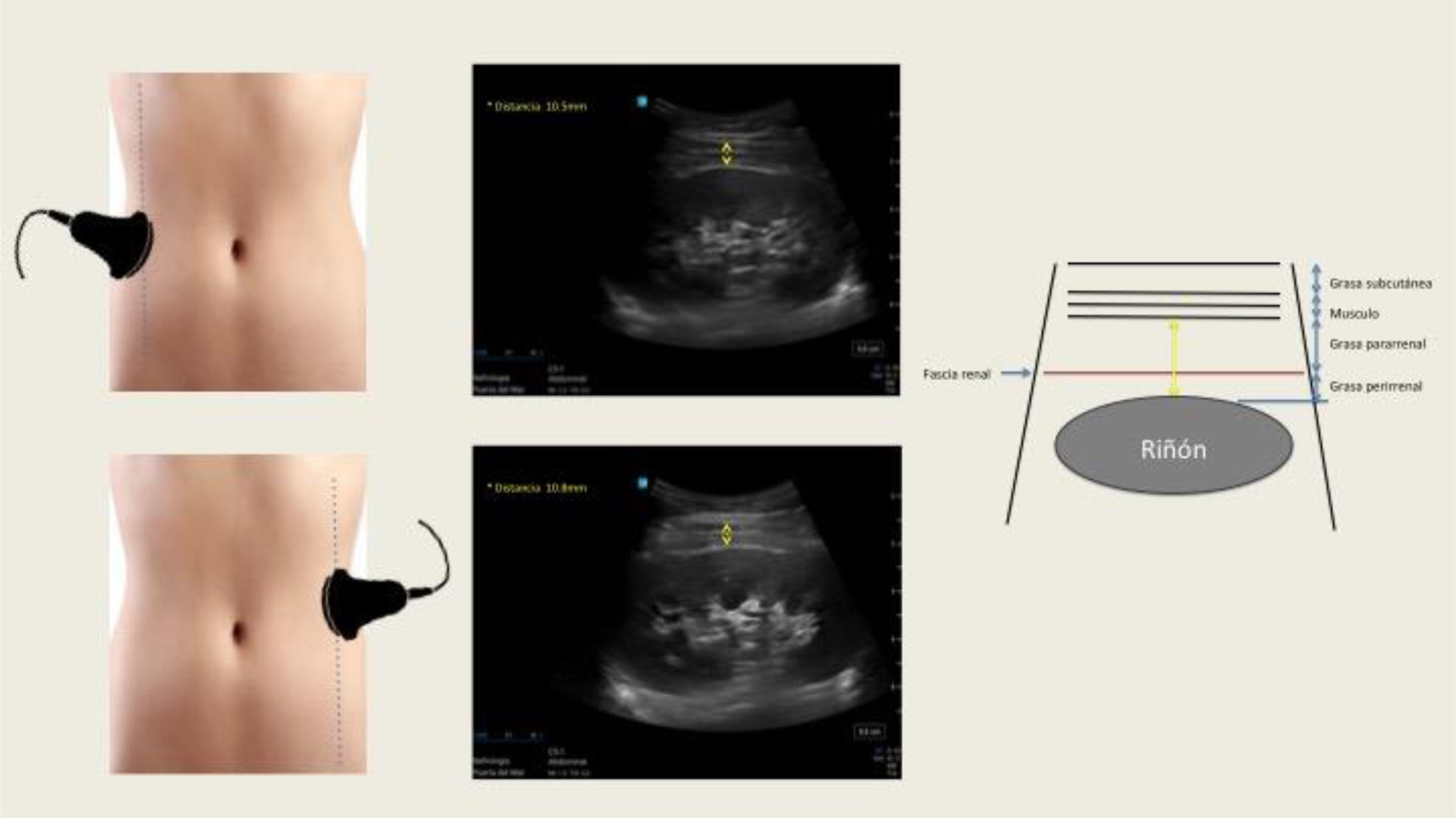
Múltiples técnicas de imagen como la ultrasonografía (US), tomografía axial computarizada (TAC) y resonancia magnética (RM) han sido utilizadas para cuantificar el grosor de la grasa peri-pararrenal (GGPPR), la GSR y la GPR, respectivamente4. Estas medidas ofrecen una perspectiva directa sobre la distribución ectópica de la grasa visceral. Sin embargo, la RM y la TAC son costosas, y esta última, además, emplea radiaciones ionizantes, por lo que dificulta su uso a gran escala. El grosor de la grasa intraabdominal medida por US es una técnica de imagen no invasiva, accesible, coste-efectiva y fiable que se correlaciona significativamente con la TAC6. Kawasaki et al.7, fueron pioneros en medir el GGPPR mediante US, demostrando que la exploración era sencilla, reproducible técnicamente y que se obtenían imágenes satisfactorias sin interferencias del gas intestinal. La exploración se realiza con el paciente en posición supina, con la sonda convexa colocada perpendicular a la piel en la cara lateral del abdomen. Se efectúa un barrido longitudinal y la sonda se desplaza lateralmente con lentitud hasta encontrar la posición óptima, en la que la superficie del riñón sea casi paralela a la piel. La presión ejercida sobre la sonda es la mínima posible para no comprimir las capas de grasa. La medición del GGPPR se lleva a cabo desde la cara interna de la musculatura abdominal hasta la superficie del riñón y se registra la media de la medida US de los valores máximos de grosor en ambos riñones (fig. 1). La validación de la técnica se realizó comparándola con mediciones de TAC, obteniendo un buen grado de correlación (r=0,760; p=0,003)7.
Medición ecográfica del grosor de la grasa para-perirrenal derecha e izquierda. La ecografía renal longitudinal muestra la distancia entre la musculatura de la pared abdominal y la superficie del riñón (flecha amarilla). A la derecha, se muestra el diagrama correspondiente a la ecografía. Imagen propia de los autores.
Diversos estudios han demostrado una correlación positivamente significativa entre el GGPPR por separado y en conjunto (GPaR, GPeR) con los marcadores tradicionales de RCV, como la hipertensión arterial (HTA)8–10, resistencia a la insulina9, albuminuria10,11, síndrome metabólico9,12–15 y daño endotelial12,13 (tabla 1). Además, en pacientes con y sin obesidad, diabéticos y diferentes estadios de ERC, las medidas del GGPPR16 y GGPeR17 por US presentan una correlación negativa con la caída de la tasa de filtrado glomerular estimado con las ecuaciones de Chronic Kidney Disease Epidemiology Collaboration, creatinine equation-2009 (CKD-EPI) y Modification of Diet in Renal Disease-4 (MDRD-4), resultando esta asociación particularmente relevante, ya que la inflamación crónica y la disfunción metabólica son factores prominentes que contribuyen a la progresión de la ERC y al desarrollo de complicaciones CV2,14. Incluso en pacientes obesos sin HTA ni diabetes, el GGPPR presenta una correlación positiva con el cociente albúmina-creatinina (CAC), lo que lleva a ser considerado como un factor predictivo de daño renal precoz10. No se conocen valores de cortes establecidos de normalidad del GGPPR por US, sin embargo, algunos estudios han observado valores en controles sanos que van de los 4,3±2,3 a los 7,95±1,57mm9,10.
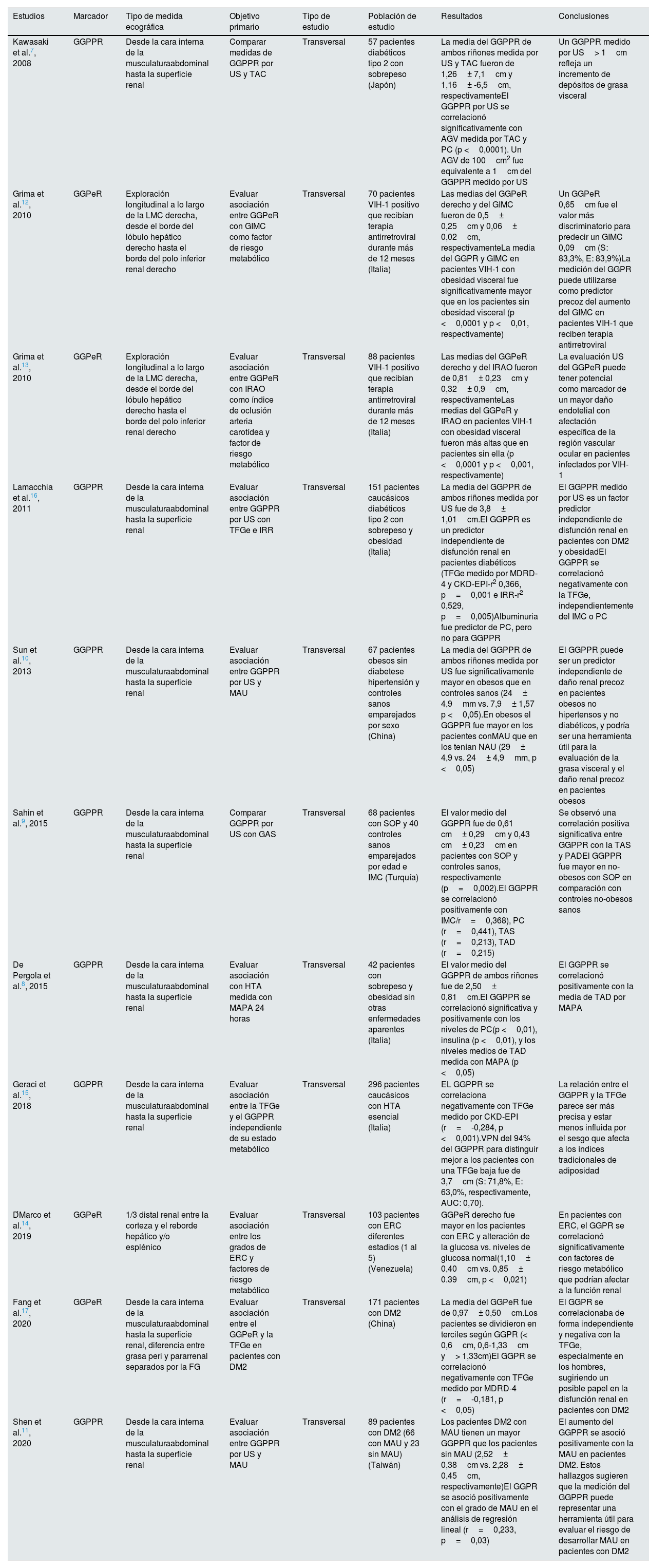
Estudios que demuestran la asociación entre el grosor de la grasa renal ectópica y los factores de riesgo cardiovascular
| Estudios | Marcador | Tipo de medida ecográfica | Objetivo primario | Tipo de estudio | Población de estudio | Resultados | Conclusiones |
|---|---|---|---|---|---|---|---|
| Kawasaki et al.7, 2008 | GGPPR | Desde la cara interna de la musculaturaabdominal hasta la superficie renal | Comparar medidas de GGPPR por US y TAC | Transversal | 57 pacientes diabéticos tipo 2 con sobrepeso (Japón) | La media del GGPPR de ambos riñones medida por US y TAC fueron de 1,26± 7,1cm y 1,16± -6,5cm, respectivamenteEl GGPPR por US se correlacionó significativamente con AGV medida por TAC y PC (p <0,0001). Un AGV de 100cm2 fue equivalente a 1cm del GGPPR medido por US | Un GGPPR medido por US> 1cm refleja un incremento de depósitos de grasa visceral |
| Grima et al.12, 2010 | GGPeR | Exploración longitudinal a lo largo de la LMC derecha, desde el borde del lóbulo hepático derecho hasta el borde del polo inferior renal derecho | Evaluar asociación entre GGPeR con GIMC como factor de riesgo metabólico | Transversal | 70 pacientes VIH-1 positivo que recibían terapia antirretroviral durante más de 12 meses (Italia) | Las medias del GGPeR derecho y del GIMC fueron de 0,5± 0,25cm y 0,06± 0,02cm, respectivamenteLa media del GGPR y GIMC en pacientes VIH-1 con obesidad visceral fue significativamente mayor que en los pacientes sin obesidad visceral (p <0,0001 y p <0,01, respectivamente) | Un GGPeR 0,65cm fue el valor más discriminatorio para predecir un GIMC 0,09cm (S: 83,3%, E: 83,9%)La medición del GGPR puede utilizarse como predictor precoz del aumento del GIMC en pacientes VIH-1 que reciben terapia antirretroviral |
| Grima et al.13, 2010 | GGPeR | Exploración longitudinal a lo largo de la LMC derecha, desde el borde del lóbulo hepático derecho hasta el borde del polo inferior renal derecho | Evaluar asociación entre GGPeR con IRAO como índice de oclusión arteria carotídea y factor de riesgo metabólico | Transversal | 88 pacientes VIH-1 positivo que recibían terapia antirretroviral durante más de 12 meses (Italia) | Las medias del GGPeR derecho y del IRAO fueron de 0,81± 0,23cm y 0,32± 0,9cm, respectivamenteLas medias del GGPeR y IRAO en pacientes VIH-1 con obesidad visceral fueron más altas que en pacientes sin ella (p <0,0001 y p <0,001, respectivamente) | La evaluación US del GGPeR puede tener potencial como marcador de un mayor daño endotelial con afectación específica de la región vascular ocular en pacientes infectados por VIH-1 |
| Lamacchia et al.16, 2011 | GGPPR | Desde la cara interna de la musculaturaabdominal hasta la superficie renal | Evaluar asociación entre GGPPR por US con TFGe e IRR | Transversal | 151 pacientes caucásicos diabéticos tipo 2 con sobrepeso y obesidad (Italia) | La media del GGPPR de ambos riñones medida por US fue de 3,8± 1,01cm.El GGPPR es un predictor independiente de disfunción renal en pacientes diabéticos (TFGe medido por MDRD-4 y CKD-EPI-r2 0,366, p=0,001 e IRR-r2 0,529, p=0,005)Albuminuria fue predictor de PC, pero no para GGPPR | El GGPPR medido por US es un factor predictor independiente de disfunción renal en pacientes con DM2 y obesidadEl GGPPR se correlacionó negativamente con la TFGe, independientemente del IMC o PC |
| Sun et al.10, 2013 | GGPPR | Desde la cara interna de la musculaturaabdominal hasta la superficie renal | Evaluar asociación entre GGPPR por US y MAU | Transversal | 67 pacientes obesos sin diabetese hipertensión y controles sanos emparejados por sexo (China) | La media del GGPPR de ambos riñones medida por US fue significativamente mayor en obesos que en controles sanos (24± 4,9mm vs. 7,9± 1,57 p <0,05).En obesos el GGPPR fue mayor en los pacientes conMAU que en los tenían NAU (29± 4,9 vs. 24± 4,9mm, p <0,05) | El GGPPR puede ser un predictor independiente de daño renal precoz en pacientes obesos no hipertensos y no diabéticos, y podría ser una herramienta útil para la evaluación de la grasa visceral y el daño renal precoz en pacientes obesos |
| Sahin et al.9, 2015 | GGPPR | Desde la cara interna de la musculaturaabdominal hasta la superficie renal | Comparar GGPPR por US con GAS | Transversal | 68 pacientes con SOP y 40 controles sanos emparejados por edad e IMC (Turquía) | El valor medio del GGPPR fue de 0,61 cm± 0,29cm y 0,43 cm± 0,23cm en pacientes con SOP y controles sanos, respectivamente (p=0,002).El GGPPR se correlacionó positivamente con IMC/r=0,368), PC (r=0,441), TAS (r=0,213), TAD (r=0,215) | Se observó una correlación positiva significativa entre GGPPR con la TAS y PADEl GGPPR fue mayor en no-obesos con SOP en comparación con controles no-obesos sanos |
| De Pergola et al.8, 2015 | GGPPR | Desde la cara interna de la musculaturaabdominal hasta la superficie renal | Evaluar asociación con HTA medida con MAPA 24 horas | Transversal | 42 pacientes con sobrepeso y obesidad sin otras enfermedades aparentes (Italia) | El valor medio del GGPPR de ambos riñones fue de 2,50± 0,81cm.El GGPPR se correlacionó significativa y positivamente con los niveles de PC(p <0,01), insulina (p <0,01), y los niveles medios de TAD medida con MAPA (p <0,05) | El GGPPR se correlacionó positivamente con la media de TAD por MAPA |
| Geraci et al.15, 2018 | GGPPR | Desde la cara interna de la musculaturaabdominal hasta la superficie renal | Evaluar asociación entre la TFGe y el GGPPR independiente de su estado metabólico | Transversal | 296 pacientes caucásicos con HTA esencial (Italia) | EL GGPPR se correlaciona negativamente con TFGe medido por CKD-EPI (r=-0,284, p <0,001).VPN del 94% del GGPPR para distinguir mejor a los pacientes con una TFGe baja fue de 3,7cm (S: 71,8%, E: 63,0%, respectivamente, AUC: 0,70). | La relación entre el GGPPR y la TFGe parece ser más precisa y estar menos influida por el sesgo que afecta a los índices tradicionales de adiposidad |
| D́Marco et al.14, 2019 | GGPeR | 1/3 distal renal entre la corteza y el reborde hepático y/o esplénico | Evaluar asociación entre los grados de ERC y factores de riesgo metabólico | Transversal | 103 pacientes con ERC diferentes estadios (1 al 5) (Venezuela) | GGPeR derecho fue mayor en los pacientes con ERC y alteración de la glucosa vs. niveles de glucosa normal(1,10± 0,40cm vs. 0,85± 0.39cm, p <0,021) | En pacientes con ERC, el GGPR se correlacionó significativamente con factores de riesgo metabólico que podrían afectar a la función renal |
| Fang et al.17, 2020 | GGPeR | Desde la cara interna de la musculaturaabdominal hasta la superficie renal, diferencia entre grasa peri y pararrenal separados por la FG | Evaluar asociación entre el GGPeR y la TFGe en pacientes con DM2 | Transversal | 171 pacientes con DM2 (China) | La media del GGPeR fue de 0,97± 0,50cm.Los pacientes se dividieron en terciles según GGPR (< 0,6cm, 0,6-1,33cm y> 1,33cm)El GGPR se correlacionó negativamente con TFGe medido por MDRD-4 (r=-0,181, p <0,05) | El GGPR se correlacionaba de forma independiente y negativa con la TFGe, especialmente en los hombres, sugiriendo un posible papel en la disfunción renal en pacientes con DM2 |
| Shen et al.11, 2020 | GGPPR | Desde la cara interna de la musculaturaabdominal hasta la superficie renal | Evaluar asociación entre GGPPR por US y MAU | Transversal | 89 pacientes con DM2 (66 con MAU y 23 sin MAU) (Taiwán) | Los pacientes DM2 con MAU tienen un mayor GGPPR que los pacientes sin MAU (2,52± 0,38cm vs. 2,28± 0,45cm, respectivamente)El GGPR se asoció positivamente con el grado de MAU en el análisis de regresión lineal (r=0,233, p=0,03) | El aumento del GGPPR se asoció positivamente con la MAU en pacientes DM2. Estos hallazgos sugieren que la medición del GGPPR puede representar una herramienta útil para evaluar el riesgo de desarrollar MAU en pacientes con DM2 |
AGV: área de grasa visceral; AUC: área baja la curva; CKD-EPI: Chronic Kidney Disease Epidemiology Collaboration; DM2: diabetes mellitus tipo 2; E: especificidad; FG: fascia de Gerota; FRCV: factor de riesgo cardiovascular; GAS: grasa abdominal subcutánea; GGPPR: grosor de la grasa para-perirrenal; GGPeR: grosor de la grasa perirrenal; GIMC: grosor íntima-media carotídeo; HTA: hipertensión arterial; IMC: índice de masa corporal; IRAO: índice de resistencia de la arteria oftálmica; IRR: índice de resistencia renal; LMC: línea media clavicular; MAPA: Monitoreo Ambulatorio de Presión Arterial; MAU: microalbuminuria; MDRD-4: Modification of Diet in Renal Disease; NAU: normoalbuminuria; PC: perímetro de cintura; S: sensibilidad; SOP: síndrome de ovario poliquístico; TAC: tomografía axial computarizada; TAD: tensión arterial diastólica; TAS: tensión arterial sistólica; TFGe: tasa de filtrado glomerular estimado; US: ultrasonografía; VIH-1: virus de la inmunodeficiencia humana tipo 1; VPN: valor predictivo negativo.
En conclusión, el uso de la US para medir el GGPPR es una herramienta prometedora para identificar a los pacientes obesos con riesgo de desarrollo de ERC secundaria a lipotoxicidad, y puede integrarse fácilmente en la práctica clínica diaria. Sin embargo, es importante mencionar que se necesita más investigación para establecer protocolos clínicos estandarizados, puntos de cortes poblacionales y para comprender completamente los mecanismos biológicos que subyacen a esta asociación.
Declaración de la IA generativaLos autores declaran no haber utilizado la IA y tecnologías asistidas por IA en el proceso de redacción del manuscrito.
Responsabilidades éticasEl estudio cumplió con los principios enunciados en la declaración de Helsinki. Para esta investigación no se realizaron experimentos en seres humanos ni en animales.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.