Las enfermedades renales que cursan con hipomagnesemia son un grupo complejo y variopinto de tubulopatías producidas por mutaciones en genes que codifican proteínas que se expresan en la rama gruesa ascendente del asa de Henle y en el túbulo contorneado distal. En el presente artículo revisamos la descripción inicial, la expresividad clínica y la etiología de cuatro de las primeras causas de tubulopatías hipomagnesémicas que se describieron: las enfermedades de Bartter tipo 3 y Gitelman, la hipomagnesemia con hipocalcemia secundaria autosómica recesiva y la hipomagnesemia familiar con hipercalciuria y nefrocalcinosis. A continuación, se describen los patrones bioquímicos básicos que se observan en las hipomagnesemias tubulares renales y las modalidades de transporte e interacción que concurren entre los transportadores implicados en la reabsorción de magnesio en el túbulo contorneado distal. Finalmente, se comunica la reciente descripción de una nueva tubulopatía hipomagnesémica, la hipomagnesemia con hipocalcemia secundaria tipo 2 causada por una reducción de la actividad del canal TRPM7.
Renal diseases associated with hypomagnesemia are a complex and diverse group of tubulopathies caused by mutations in genes encoding proteins that are expressed in the thick ascending limb of the loop of Henle and in the distal convoluted tubule. In this paper, we review the initial description, the clinical expressiveness and etiology of four of the first hypomagnesemic tubulopathies described: Type 3 Bartter and Gitelman diseases,Autosomal recessive hypomagnesemia with secondary hypocalcemia and Familial hypomagnesemia with hypercalciuria and nephrocalcinosis. The basic biochemical patterns observed in renal tubular hypomagnesemias and the modalities of transport and interaction that occur between the transporters involved in the reabsorption of magnesium in the distal convoluted tubule are described below. Finally, the recent report of a new renal disease with hypomagnesemia, Type 2 hypomagnesemia with secondary hypocalcemia caused by reduced TRPM7 channel activity is described.
Los túbulos renales seleccionan los solutos filtrados, de tal modo que son absolutamente necesarios para mantener la homeostasis corporal. La mayoría de los solutos son reabsorbidos y retornados a la sangre; los que no son necesarios se eliminan por la orina.
En las primeras regiones tubulares la reabsorción es muy intensa (por ejemplo, 65% del sodio filtrado en el túbulo proximal y 25% en la rama ascendente del asa de Henle). Por eso, las tubulopatías que cursan con un daño intenso en esos segmentos (síndrome de Toni-Debré-Fanconi y síndrome de Bartter, por ejemplo) pueden ser muy graves y difíciles de tratar por la dificultad de compensar las pérdidas de solutos inherentes a las mismas.
Por tanto, corresponde al túbulo distal y al ducto colector «afinar», dar los últimos «retoques» en la recuperación de los solutos necesarios para el organismo y que no deben perderse por la orina. Esta tarea es muy compleja para lo que se necesita una especialización adecuada.
El túbulo contorneado distalPara resaltar su importancia, baste recordar el interés funcional de la mácula densa como sensor de la concentración del sodio intratubular dentro de la estructura del aparato yuxtaglomerular. Baste insistir, asimismo, que en el túbulo distal existe el único canal específico renal destinado a la reabsorción de calcio (ECaC) cuya función está modulada por diversas hormonas y que la regulación del transportador de cloruro de sodio (NaCl) sensible a tiazidas es muy compleja, como se advierte al estudiar la fisiopatología del síndrome de Gordon. Además, el túbulo distal tiene un compromiso funcional importante en la reabsorción de calcio y magnesio (Mg2+) y tiene la actividad más elevada de Na+, K+-ATPasa de la nefrona que se sitúa en la membrana basolateral y suministra la energía necesaria para el transporte iónico en este segmento. La complejidad de la regulación de la reabsorción tubular de Mg2+ se manifiesta en el gran número y diversidad de las tubulopatías hipomagnesémicas.
Fisiología del manejo tubular renal del Mg2+El Mg2+ se filtra en el glomérulo. En el túbulo proximal, entre 10 y 25% de la carga inicialmente filtrada se reabsorbe a través de una ruta paracelular pasiva que es poco conocida. La rama gruesa ascendente del asa de Henle reabsorbe aproximadamente entre 50 y 70% de la carga filtrada de Mg2+ mediante un transporte paracelular pasivo. El 5 a 10% restante del Mg2+ filtrado se reabsorbe en el túbulo contorneado distal a través de una ruta transcelular activa. Por ello, las causas de hipomagnesemia de origen renal se localizan en el asa de Henle y en el túbulo distal. Al final, más de 96% del Mg2+ filtrado se reabsorbe a lo largo de la nefrona.
Descripción histórica de las principales causas de hipomagnesemia- a)
En 1962, Bartter et al. comunicaron los datos clínicos y bioquímicos observados en dos pacientes varones de cinco y 25 años, respectivamente, afectos de una nueva enfermedad caracterizada por retraso del crecimiento, hiperplasia del aparato yuxtaglomerular, hiperaldosteronismo, presión arterial normal, alcalosis metabólica hipopotasémica e hipoclorémica y defecto en la capacidad de concentración renal resistente a la acción de la pitresina1. Con el tiempo se ha sabido que dentro del término síndrome de Bartter se incluyen hasta cinco enfermedades que tienen en común una reabsorción defectuosa de sal, potasio, calcio y agua en la rama ascendente del asa de Henle. Se establecieron dos patrones clínicos que permiten distinguir entre una forma grave de presentación antenatal (Bartter neonatal que corresponde a los tipos I y II) y una forma de aparición más tardía durante los primeros años de la vida (Bartter clásico o tipo III).
- b)
En 1966, Gitelman, et al. publicaron los datos clínicos de tres pacientes adultos, dos de ellos hermanos, afectos de hipopotasemia, hipomagnesemia y alcalosis metabólica2. Durante muchos años, los pacientes con estas características fueron diagnosticados erróneamente de una variante de síndrome de Bartter. La presencia de hiperreninemia e hiperaldosteronismo, contribuyó a esa confusión. El inicio de la clínica suele aparecer en la adolescencia, generalmente, con síntomas neuromusculares leves. El espectro de manifestaciones, no obstante, es amplio. Así, la enfermedad puede ser asintomática o expresarse con síntomas leves y, a veces, intermitentes (debilidad muscular, calambres, fatiga, poliuria, nicturia o dolor articular) o más graves (tetania, convulsiones). Frecuentemente, ocurren parestesias, especialmente en la cara. La avidez por la sal es habitual y los valores de presión arterial están más reducidos que en la población general. El crecimiento no suele verse afectado, aunque se ha descrito fallo de medro y talla baja en una minoría de casos. La hipomagnesemia y la hipopotasemia prolongan la repolarización ventricular que predispone a que surjan arritmias graves.
- c)
En 1968, Paunier et al. comunicaron el caso de un lactante varón que a las seis semanas de edad debutó con convulsiones generalizadas y tetania asociadas a hipomagnesemia e hipocalcemia3. La hipomagnesemia se relacionó con una excreción fraccional de Mg2+ elevada. El tratamiento con Mg2+ corregía la tetania y normalizaba la calcemia. En la biopsia renal se observó hialinización de algunos glomérulos, fibrosis intersticial y depósito de sales de calcio. Fue el primer caso de lo que más tarde se conoció con el nombre de hipomagnesemia con hipocalcemia secundaria. Poco después, se publicó otro caso en un lactante de cinco meses con tetania debida a hipomagnesemia e hipocalcemia secundarias4. El tratamiento con vitamina D corrigió la hipocalcemia sin modificar la situación clínica. El niño falleció poco después; la anatomía patológica mostró calcinosis del miocardio, de los riñones y de una de las arterias cerebrales4. Más tarde, en otra familia se describió la asociación con acidosis tubular renal distal incompleta5. En los casos descritos posteriormente coincidieron calambres musculares y convulsiones.
- d)
Aunque previamente se habian informado algunos casos que combinaban hipomagnesemia y nefrocalcinosis6–8, en 1979 se publicó el primer artículo en el que se relacionó la presencia de hipomagnesemia y nefrocalcinosis con hipercalciuria y coloboma macular bilateral9. Los autores creyeron que el cuadro que padecían los dos hermanos afectos podría encuadrarse en una nueva variante del síndrome óculo-renal por tener algunas concordancias con el síndrome de Lowe9.
Posteriormente, se fueron publicando algunos casos de hipomagnesemia tubular aislada de causa desconocida. Así, las hipomagnesemias de origen tubular renal estaban sin sistematizar bien entrados los años 80. El nefrólogo pediátrico español Juan Rodríguez Soriano y sus colaboradores describieron en 1987 en un artículo antológico que, al menos, debían considerarse tres enfermedades hereditarias que cursaban con hipomagnesemia y que estaban causadas por sendos defectos en la reabsorción tubular renal de Mg2+, a saber, la hipomagnesemia aislada familiar, la hipomagnesemia-hipopotasemia familiar o enfermedad de Gitelman y la hipomagnesemia-hipercalciuria familiar10. De esta última se habían descrito, al menos, 15 pacientes, a los que los autores añadieron tres nuevos casos. Sobre esa última entidad, los autores escribieron que «la hipomagnesemia se acompañaba siempre de hipercalciuria y nefrocalcinosis y de anomalías oculares tales como la miopía y el nistagmus horizontal que estaban, a menudo, presentes. La hipermagnesiuria era de una mayor relevancia que en las entidades previas y reflejaba un transporte máximo (Tm) de reabsorción de Mg2+reducido». Además, destacaron que «el defecto debía estar situado en la rama ascendente del asa de Henle y debía implicar el transporte tubular tanto de calcio como de Mg2+»10.
En 1995, Manuel Praga et al., miembros del Hospital 12 de octubre de Madrid, publicaron los datos clínicos y bioquímicos correspondientes a ocho pacientes pertenecientes a cinco familias con hipomagnesemia-hipercalciuria familiar. Los autores comprobaron que, en esta tubulopatía de herencia autosómica recesiva, existe un deterioro progresivo de la función glomerular renal y que el daño tubular no recidivaba tras el trasplante. El título de su artículo es el que ha pasado a la posteridad dando el nombre definitivo a la enfermedad, es decir, hipomagnesemia familiar con hipercalciuria y nefrocalcinosis11.
La genética molecular describe la etiología de las cuatro tubulopatías mencionadasDesde mediados de los años 90 y en un plazo de siete años se conoció la etiología de las cuatro causas de hipomagnesemia antes mencionadas. Después, se descubrirían otras variantes que han sido revisadas recientemente por nuestro grupo12.
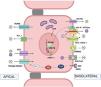
a) La enfermedad de Bartter tipo III está causada por mutaciones recesivas que originan una pérdida de función del gen CLCNKB que codifica un canal de Cl− (ClC-Kb) que se expresa en la membrana basolateral de las células de la rama gruesa ascendente del asa de Henle y en el túbulo contorneado distal13 (fig. 1). La pérdida de función de ClC-Kb altera la regulación intracelular de la concentración de Cl− lo que, posteriormente, interfiere con la generación del potencial lumen-positivo que da lugar a pérdida de sal y, posiblemente, a hipomagnesemia. Los pacientes afectos de este subtipo desarrollan reducción de los niveles de Mg2+ durante la infancia o más adelante en el tiempo14.
Mecanismos fisiológicos de transporte en el túbulo contorneado distal. Na+ y Cl− pasan desde la luz tubular al interior de la célula mediante el cotransportador de NaCl sensible a tiazidas (NCC) (mutaciones en el gen codificante producen la enfermedad de Gitelman). El Cl− sale de la célula mediante el canal de cloro ClC-Kb (mutaciones en el gen producen la enfermedad de Bartter tipo III). El Na+ sale de la célula mediante la Na+, K+-ATPasa (mutaciones en el gen que codifica la subunidad ɣ de la Na+, K+-ATPasa producen la hipomagnesemia autosómica dominante con hipocalciuria y las que codifican la subunidad α producen la hipomagnesemia con convulsiones y discapacidad intelectual tipo 2). El factor de transcripción nuclear 1 del hepatocito (HNF1β) regula la transcripción del gen que codifica la subunidad ɣ de la Na+, K+-ATPasa (mutaciones en el gen codificante producen la nefropatíaHNF1β). El coactivador pterin-4-alpha-carbinolamine dehydratase 1 (PCBD1) es un cofactor de HNF1β e incrementa la actividad transcripcional de la subunidad γ de la Na+, K+-ATPasa (mutaciones en el gen codificante producen la hiperfenilalaninemia neonatal transitoria con primapterinuria). FAM111A es un regulador de determinados factores de transcripción nucleares (mutaciones heterocigotas missense en el gen codificante son causa del síndrome de Kenny-Caffey tipo 2 que puede cursar con hipomagnesemia). En el túbulo distal, la reabsorción de Mg2+ es un proceso de transporte activo por rutas transcelulares, impulsado por la diferencia de potencial existente entre la luz tubular y el interior de la célula. Los iones Mg2+ pasan desde la luz tubular al citosol mediante el canal apical TRPM6/TRPM7 (mutaciones en los genes codificantes de TRPM6 y TRPM7 producen la hipomagnesemia con hipocalcemia secundaria autosómica recesiva tipo 1 y tipo 2, respectivamente). Posiblemente salen de la célula mediante CNNM2 (mutaciones en el gen codificante producen la hipomagnesemia con convulsiones y discapacidad intelectual tipo 1) y el intercambiador de Mg2+/Na+ SLC41A1 (mutaciones en el gen codificante producen un fenotipo tipo nefronoptisis). Epidermal growth factor (EGF) es un activador del canal TRPM6 (mutaciones en el gen codificante producen la hipomagnesemia autosómica recesiva; mutaciones en el receptor de EGF [EGFR] produce la enfermedad inflamatoria neonatal de la piel y el intestino tipo 2). La fuerza apical necesaria para el transporte de Mg2+ es creada por la acción cooperativa de la Na+,K+-ATPasa basolateral, el canal de cloro ClC-Kb, el canal heteromérico Kir4.1/Kir5.1 que recicla K+ (mutaciones en el gen que codifica Kir 4.1 producen el síndrome EAST/SeSAME), el NCC y los canales extrusores de K+, ROMK (Kir1.1) (mutaciones en el gen codificante producen la enfermedad de Bartter tipo II) y Kv1.1 (mutaciones en el gen codificante producen la hipomagnesemia autosómica dominante o ataxia episódica tipo 1). Nota: No se incluyen los nombres de los genes codificantes ya que figuran en el texto.
b) En pacientes con enfermedad de Gitelman la observación tanto de que las anomalías electrolíticas se asemejaban a los efectos producidos por la administración crónica de tiazidas15, como los resultados obtenidos en los estudios de aclaramientos16, apuntaron a que el defecto debía residir en el transporte tubular distal de sodio y cloro sensible a tiazidas. En efecto, en 1996, se estableció que la enfermedad de Gitelman es producida por una reducción en el transporte de NaCl en el túbulo contorneado distal debido a la existencia de mutaciones en el gen SLC12A3 que codifica el cotransportador de NaCl sensible a tiazidas (NCC) que se localiza en la membrana luminal de las células del túbulo contorneado distal17 (fig. 1). Se ha sugerido que la hipomagnesemia en esta enfermedad es secundaria a una reducción de la actividad del canal epitelial de Mg2+ TRPM6 localizado, asimismo, en la membrana apical del túbulo contorneado distal18 (fig. 1).
c) En 2002, dos grupos independientes demostraron que la hipomagnesemia con hipocalcemia secundaria es una entidad de herencia autosómica recesiva causada por mutaciones en el gen Transient receptor potential melastatin type6 (TRPM6)19,20. Poco después, se describieron nuevas mutaciones en ese gen21,22. La proteína TRPM6 es un canal permeable al Ca2+ y al Mg2+que se expresa en las membranas luminales del epitelio intestinal y de las células del túbulo contorneado distal y del ducto colector (fig. 1). Las mutaciones inactivantes de TRPM6 combinan un impedimento en la absorción intestinal del Mg2+y una excesiva pérdida renal del mismo23.
La hipocalcemia que está asociada a la hipomagnesemia se debe fundamentalmente a una disminución de la síntesis y liberación de parathormona como consecuencia de una disminución de la actividad del receptor sensible a calcio (CaSR), así como a un incremento de la resistencia del receptor de la parathormona en el tejido óseo. Por ello, los niveles de parathormona están inapropiadamente descendidos para los valores de calcemia. El tratamiento requiere altas dosis de Mg2+oral si son toleradas, ya que el transporte paracelular pasivo y no saturable de Mg2+a nivel del intestino es normal.
d) En 1999, Simon et al. describieron la existencia de una proteína, la paracelina-1, que es necesaria para la reabsorción tubular paracelular de Mg2+24. Esta proteína está localizada en las zonas de unión estrechas (tight junction) de las células de la rama gruesa ascendente del asa de Henle. En ese trabajo se estableció que mutaciones en el gen PCLN-1 que codifica la paracelina-1 eran las causantes de la hipomagnesemia familiar con hipercalciuria y nefrocalcinosis24. Al comprobarse que la paracelina-1 es un miembro de la familia de las claudinas, pasó a denominarse claudina-16 (gen CLDN16). Poco después se observó que existían sujetos con la enfermedad que no portaban mutaciones en el gen CLDN16. En este sentido, fue llamativo el hecho de que los pacientes españoles, excepto muy pocos25, no tenían mutaciones en dicho gen26. En 2006, Konrad et al. resolvieron la cuestión al identificar sujetos portadores de mutaciones en un nuevo gen, CLDN19, otro miembro de la familia multigénica de las claudinas, que padecían hipomagnesemia, enfermedad renal crónica y anomalías oculares graves27. El producto del gen, la claudina-19, realiza su función, como la claudina-16, en las uniones estrechas del túbulo renal y la retina. En condiciones fisiológicas, la claudina-19 actúa como una barrera selectiva a los cationes en las tight junction y regula la permeabilidad a los cationes monovalentes y divalentes28. En 2008, Hou et al. demostraron que la claudina-16 interactúa con la claudina-1929, de tal modo que esta asociación confiere a las uniones estrechas la capacidad de contener un mecanismo selectivo en la reabsorción de cationes30. Nuestro grupo demostró que la mayoría de los pacientes españoles son portadores de la misma mutación (p.G20D) localizada en el gen CLDN19, lo que facilita el diagnóstico molecular de la enfermedad en nuestro país31–33.
Patrones bioquímicos básicos en las hipomagnesemias tubulares renales (figura 1)En la actualidad se conocen mas de 15 causas genéticas de hipomagnesemia tubular renal. Según criterios bioquimicos pueden clasificarse en tres subtipos12:
Tubulopatías con hipopotasemia y alcalosis metabólica. La proteína anómala puede radicarse en la rama gruesa ascendente del asa de Henle y/o el túbulo contorneado distal. En este subgrupo se incluyen, entre otras, el síndrome de Bartter tipo III1,13,14, la enfermedad de Gitelman2,15–18, el síndrome convulsiones, sordera neurosensorial, ataxia, discapacidad intelectual, tubulopatía (EAST/SeSAME)34–36 y la nefropatía HFN1β (malformaciones de los tractos urinario y genital, quistes renales, gota, pérdida urinaria de Mg2+, elevación de las enzimas hepáticas y diabetes juvenil tipo MODY)37–39. Los datos bioquímicos renales del síndrome EAST/SeSAME y de la nefropatía HFN1β son similares a los de la enfermedad de Gitelman, incluida la hipocalciuria.
Tubulopatías con hipercalciuria. En este subgrupo se incluyen entidades en las que las proteínas anómalas se expresan en la rama gruesa ascendente del asa de Henle. Nos referimos a las dos variantes de hipomagnesemia familiar con hipercalciuria y nefrocalcinosis6–11,24–33 y a las mutaciones heterocigotas «de ganancia de función» en el gen CASR que codifica el receptor sensible a calcio CaSR y que producen la hipocalcemia autosómica dominante con hipercalciuria40,41. En este caso, el CaSR ubicado en la paratiroides se vuelve más sensible y detectará la hipocalcemia como una calcemia normal y no estimulará la secreción de hormona paratiroidea. La hipocalcemia es leve a moderada y puede ser sintomática en aproximadamente la mitad de casos (parestesias, espasmo carpopedal y convulsiones). La activación de CaSR que está presente en la membrana basolateral de la rama ascendente del asa de Henle inhibe la actividad del canal ROMK luminal (Kir 1.1) y produce un cuadro de pseudo-Bartter. Secundariamente, se reduce la reabsorción de NaCl y la permeabilidad catiónica del canal claudina-16/claudina-19 con la consecuencia de pérdida salina, hipercalciuria, hipermagnesuria y activación del sistema renina-angiotensina-aldosterona. Puede existir alcalosis hipopotasémica.
Tubulopatías sin hipercalciuria ni alcalosis metabólica hipopotasémica. En este subgrupo, las proteínas anómalas se expresan en el túbulo contorneado distal. Son hipomagnesemias aisladas poco frecuentes que, en algunos casos, cursan con síntomas neurológicos42–46. Además de la hipomagnesemia con hipocalcemia secundaria3–5,19–23 en este subgrupo se incluyen, entre otras, la hipomagnesemia autosómica dominante con hipocalciuria caracterizada por una disfunción de la subunidad ɣ de la Na+,K+-ATPasa causada por mutaciones en el gen FXYD242,43, la hipomagnesemia autosómica recesiva causada por mutaciones en el gen epidermal growth factor o factor de crecimiento epidérmico (EGF)44,45 y la hipomagnesemia con convulsiones y discapacidad intelectual tipo 1 causada por mutaciones en el gen CNNM2 que codifica la ciclina M246.
Tubulopatías multisistémicas. En este subgrupo se incluyen algunas enfermedades producidas por mutaciones en genes mitocondriales en las que puede existir, también, pérdida urinaria de Mg2+. Tales son los casos del síndrome de Kearns-Sayre (oftalmoplejía externa progresiva, retinosis pigmentaria, pérdida auditiva, ataxia cerebelosa y bloqueo cardiaco con debut clínico antes de los 20 años de edad) y el síndrome HUPRA definido por un acrónimo: Hiperuricemia (HU), hipertensión pulmonar (P), fallo renal (R) y alcalosis metabólica (A) (gen SARS2).
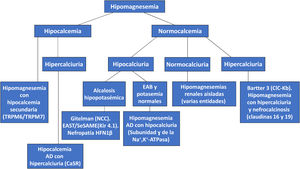
En la figura 2 se muestra un algoritmo diagnóstico de las hipomagnesemias que se ha configurado a partir de los niveles de calcemia y de calciuria.
Modalidades de transporte e interacción entre los transportadores implicados en la reabsorción de Mg2+en el túbulo contorneado distal (fig. 1).
Transportadores de Mg2+. El principal es el canal epitelial de Mg2+TRPM6 que, como se ha indicado, se localiza en la membrana apical del túbulo contorneado distal e introduce Mg2+ desde la luz tubular hacia el citosol19–23. El Mg2+ se cree que sale de la célula gracias a la acción del intercambiador de Mg2+/sodio solute carrier family 41, member 1 (SLC41A1) que está localizado en la membrana basolateral. Las mutaciones en el gen SLC41A1 dan como resultado un cuadro nephronophthisis-like47–49. La pérdida de actividad de la Na+, K+-ATPasa dificulta la actividad del intercambiador Mg2+-Na+ ya que la extrusión de Mg2+ en el lado basolateral depende del gradiente de Na+. La ciclina M2 (CNNM2) es un candidato a la salida basolateral de Mg2+ o un regulador del transporte de Mg2+, pero aún no se ha confirmado experimentalmente46.
Un regulador de la actividad del canal de Mg2+TRPM6. El EGF codificado por el gen EGF44,45 se une con gran afinidad a su receptor EGFR (codificado por el gen EGFR) que se encuentra en la membrana basolateral del túbulo contorneado distal con lo que se inicia una cascada de señalización para la activación de Rac1 mediada por Akt, lo que se traduce en un aumento de los canales TRPM6.
Canales y proteínas implicados en el transporte de Mg2+al favorecer la reabsorción de NaCl. La reabsorción de Mg2+ se beneficia al generarse un gradiente en la membrana apical que hace posible que el cotransportador NCC transporte sodio al citosol. A la inversa, en condiciones patológicas, si se reduce la salida de sodio en la membrana basolateral, se eleva la concentración intracelular de Na+ y se inhibe la actividad del transportador NCC y, secundariamente, se reduce la del canal de Mg2+ TRPM6. En la membrana basolateral intervienen conjuntamente la bomba Na+, K+-ATPasa, el canal de Cl− ClC-Kb y el canal heteromérico Kir4.1/Kir5.1 (Kir: inwardly rectifying potassium). La función adecuada de las subunidades α50 y ɣ42,43 de la bomba Na+, K+-ATPasa es necesaria para la reabsorción de Mg2+. Kir4.1/Kir5.1 es un canal rectificador de la concentración intracelular de potasio que participa en un mecanismo de reciclado de K+ junto a la Na+-K+-ATPasa («pump-leak coupling»: «acoplamiento bomba-fuga»). Una alteración de la función de Kir4.1 favorece que el mecanismo de reciclado de K+ se desacople y se reduzca la actividad de la Na+, K+-ATPasa, con la consiguiente inhibición de la actividad del cotransportador NCC34–36. Es lo que ocurre en síndrome EAST/SeSAME. Se han descrito mutaciones en el gen que codifica Kir 5.1 que originan la asociación de una tubulopatía distal (hipopotasemia, pérdida salina) y proximal (acidosis tubular renal proximal) con sordera sensorineural; solo uno de los pacientes estudiados tenía hipomagnesemia51,52.
Canales secretores de K+dirigidos hacia la luz tubular que están localizados en la membrana apical. En condiciones fisiológicas, el potasio que entra en la célula por medio de la Na+, K+-ATPasa basolateral y que escapa del mecanismo de reciclado de K+ mencionado más arriba, sale hacia la luz tubular mediante la acción de los canales Kv1.1 y ROMK (Kir 1.1). El canal de K+ activado por voltaje Kv1.1 y codificado por el gen KCNA1 regula directamente la actividad del canal de Mg2+ TRPM6. Así, cuando Kv1.1 no es funcionante se pierde el potencial de membrana luminal y se reduce la actividad de TRPM653,54.
Un factor de transcripción, un cofactor de dimerización y un regulador transcripcional. El factor de transcripción nuclear 1 del hepatocito (HNF1β) codificado por el gen hepatocyte nuclear factor-1β (TCF2)37,38 regula la transcripción del gen FXYD2 que codifica la subunidad ɣ de la Na+, K+-ATPasa que, en el lado basolateral, extrae Na+ de la célula en intercambio con K+. Se trata de una subunidad que adapta las propiedades funcionales de dicha bomba a los requerimientos celulares42,43.
El coactivador pterin-4-alpha-carbinolamine dehydratase 1 (PCBD1) es un cofactor de dimerización de HNF1β que incrementa la actividad transcripcional de la subunidad γ de la Na+, K+-ATPasa. Varias mutaciones en el gen PCBD1 causan una actividad reducida del promotor del gen FXYD2 y originan una pérdida renal de Mg2+ e hipomagnesemia55. Se ha descrito su asociación con hiperfenilalaninemia transitoria neonatal y primapterinuria en un cuadro neonatal benigno sin secuelas a largo plazo.
FAM111A, serina proteasa nuclear similar a la tripsina, está implicada en la regulación de la producción de la PTH, la homeostasis del calcio y el desarrollo y el crecimiento de los huesos. Su localización nuclear sugiere que podría estar involucrado en la regulación transcripcional. Mutaciones heterocigotas missense en el gen FAM111A que son causa del síndrome de Kenny-Caffey tipo 2 producen una hiperactivación de su actividad proteásica intrínseca que podría causar una degradación anormal de las proteínas de unión al ADN56,57. El síndrome de Kenny-Caffey es un cuadro dismorfológico raro caracterizado por baja estatura proporcionada con tallas inferiores a 150 cm. al llegar a la edad adulta, engrosamiento cortical y estenosis medular de los huesos tubulares, retraso en el cierre de la fontanela anterior, anomalías oculares, hipomagnesemia, hipoparatiroidismo e hipocalcemia58. La hipomagnesemia en pacientes con síndrome de Kenny-Caffey tipo 2 podría atribuirse a la degradación de los factores de transcripción implicados en la homeostasis del Mg2+12.
La descripción de una nueva tubulopatía hipomagnesémicaTRPM6 interactúa específicamente con su homólogo más cercano, el canal de cationes permeable a Mg2+Transient receptor potential melastatin 7 (TRPM7), lo que da como resultado el ensamblaje de complejos funcionales TRPM6/TRPM7 formando heterotetrámeros en la membrana celular luminal59. Hasta ahora, se había comunicado que el canal TRPM7 favorece la muerte neuronal por sobrecarga de calcio no dependiente de glutamato durante la lesión isquémica por hipoxia. Además, en animales de experimentación se ha establecido la relación entre el canal TRPM7 y una lesión tisular en un modelo de isquemia cerebral60.
Como se ha indicado, la hipomagnesemia con hipocalcemia secundaria de herencia autosómica recesiva está relacionada con mutaciones en el gen TRPM6, pero, hasta ahora, no se habían descrito variantes en el gen TRPM7 en pacientes con hipomagnesemia.
En un trabajo colaborativo internacional, nuestro grupo ha participado en el estudio de dos familias afectas de hipomagnesemia e hipocalcemia que no eran portadoras de mutaciones en TRPM6 en las que se demostró por primera vez que tenían mutaciones en el gen TRPM7. Los pacientes sufrían convulsiones y calambres musculares asociados a hipomagnesemia (0,25-0,51 mmol/L; normal: 0,70-1 mmol/L) e hipocalcemia (0,94-1,1 mmol/L; normal: 2,13-2,55 milimol/L). En la primera familia, una variante en el sitio de empalme indujo la incorporación de secuencias del intrón 1 en el ARN mensajero (ARNm) de TRPM7 y generó un codón de parada prematuro. Los fibroblastos procedentes de uno de los pacientes mostraron un crecimiento celular reducido. En la segunda familia, una variante heterocigota missense en el dominio del poro condujo a una disminución de la actividad del canal TRPM761.
Unas semanas después, Lei et al. confirmaron nuestros hallazgos. Esos autores estudiaron un paciente con ataques de migraña recurrente hemipléjica que se acompañaban de «hipomagnesemia intratable» (0,41-0,54 mmol/L). El valor de excreción fraccional de Mg2+ era de 9,7% (normal:<4%) y los niveles de calcemia de 1,1 mmol/L. Los autores localizaron una mutación heterocigota en el gen TRPM7 que produce una variante en la región transmembrana de la proteína TRPM7 que, posiblemente, sea crucial para el funcionamiento normal del canal iónico62. Tanto en este caso como en la segunda familia incluida en nuestra publicación se trataba de mutaciones de novo. Al ser en ambos casos variantes heterocigotas es por lo que creemos que es una nueva tubulopatía, a saber, la hipomagnesemia con hipocalcemia secundariatipo 2 posiblemente de herencia autosómica dominante.
FinanciaciónEste trabajo fue financiado por el proyecto PI20/00652, integrado en el Plan Nacional de I+D+I 2013-2016 y cofinanciado por el ISCIII-Subdirección General de Evaluación y Fomento de la Investigación y el Fondo Europeo de Desarrollo Regional «Una manera de hacer Europa».
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.



![Mecanismos fisiológicos de transporte en el túbulo contorneado distal. Na+ y Cl− pasan desde la luz tubular al interior de la célula mediante el cotransportador de NaCl sensible a tiazidas (NCC) (mutaciones en el gen codificante producen la enfermedad de Gitelman). El Cl− sale de la célula mediante el canal de cloro ClC-Kb (mutaciones en el gen producen la enfermedad de Bartter tipo III). El Na+ sale de la célula mediante la Na+, K+-ATPasa (mutaciones en el gen que codifica la subunidad ɣ de la Na+, K+-ATPasa producen la hipomagnesemia autosómica dominante con hipocalciuria y las que codifican la subunidad α producen la hipomagnesemia con convulsiones y discapacidad intelectual tipo 2). El factor de transcripción nuclear 1 del hepatocito (HNF1β) regula la transcripción del gen que codifica la subunidad ɣ de la Na+, K+-ATPasa (mutaciones en el gen codificante producen la nefropatíaHNF1β). El coactivador pterin-4-alpha-carbinolamine dehydratase 1 (PCBD1) es un cofactor de HNF1β e incrementa la actividad transcripcional de la subunidad γ de la Na+, K+-ATPasa (mutaciones en el gen codificante producen la hiperfenilalaninemia neonatal transitoria con primapterinuria). FAM111A es un regulador de determinados factores de transcripción nucleares (mutaciones heterocigotas missense en el gen codificante son causa del síndrome de Kenny-Caffey tipo 2 que puede cursar con hipomagnesemia). En el túbulo distal, la reabsorción de Mg2+ es un proceso de transporte activo por rutas transcelulares, impulsado por la diferencia de potencial existente entre la luz tubular y el interior de la célula. Los iones Mg2+ pasan desde la luz tubular al citosol mediante el canal apical TRPM6/TRPM7 (mutaciones en los genes codificantes de TRPM6 y TRPM7 producen la hipomagnesemia con hipocalcemia secundaria autosómica recesiva tipo 1 y tipo 2, respectivamente). Posiblemente salen de la célula mediante CNNM2 (mutaciones en el gen codificante producen la hipomagnesemia con convulsiones y discapacidad intelectual tipo 1) y el intercambiador de Mg2+/Na+ SLC41A1 (mutaciones en el gen codificante producen un fenotipo tipo nefronoptisis). Epidermal growth factor (EGF) es un activador del canal TRPM6 (mutaciones en el gen codificante producen la hipomagnesemia autosómica recesiva; mutaciones en el receptor de EGF [EGFR] produce la enfermedad inflamatoria neonatal de la piel y el intestino tipo 2). La fuerza apical necesaria para el transporte de Mg2+ es creada por la acción cooperativa de la Na+,K+-ATPasa basolateral, el canal de cloro ClC-Kb, el canal heteromérico Kir4.1/Kir5.1 que recicla K+ (mutaciones en el gen que codifica Kir 4.1 producen el síndrome EAST/SeSAME), el NCC y los canales extrusores de K+, ROMK (Kir1.1) (mutaciones en el gen codificante producen la enfermedad de Bartter tipo II) y Kv1.1 (mutaciones en el gen codificante producen la hipomagnesemia autosómica dominante o ataxia episódica tipo 1). Nota: No se incluyen los nombres de los genes codificantes ya que figuran en el texto. Mecanismos fisiológicos de transporte en el túbulo contorneado distal. Na+ y Cl− pasan desde la luz tubular al interior de la célula mediante el cotransportador de NaCl sensible a tiazidas (NCC) (mutaciones en el gen codificante producen la enfermedad de Gitelman). El Cl− sale de la célula mediante el canal de cloro ClC-Kb (mutaciones en el gen producen la enfermedad de Bartter tipo III). El Na+ sale de la célula mediante la Na+, K+-ATPasa (mutaciones en el gen que codifica la subunidad ɣ de la Na+, K+-ATPasa producen la hipomagnesemia autosómica dominante con hipocalciuria y las que codifican la subunidad α producen la hipomagnesemia con convulsiones y discapacidad intelectual tipo 2). El factor de transcripción nuclear 1 del hepatocito (HNF1β) regula la transcripción del gen que codifica la subunidad ɣ de la Na+, K+-ATPasa (mutaciones en el gen codificante producen la nefropatíaHNF1β). El coactivador pterin-4-alpha-carbinolamine dehydratase 1 (PCBD1) es un cofactor de HNF1β e incrementa la actividad transcripcional de la subunidad γ de la Na+, K+-ATPasa (mutaciones en el gen codificante producen la hiperfenilalaninemia neonatal transitoria con primapterinuria). FAM111A es un regulador de determinados factores de transcripción nucleares (mutaciones heterocigotas missense en el gen codificante son causa del síndrome de Kenny-Caffey tipo 2 que puede cursar con hipomagnesemia). En el túbulo distal, la reabsorción de Mg2+ es un proceso de transporte activo por rutas transcelulares, impulsado por la diferencia de potencial existente entre la luz tubular y el interior de la célula. Los iones Mg2+ pasan desde la luz tubular al citosol mediante el canal apical TRPM6/TRPM7 (mutaciones en los genes codificantes de TRPM6 y TRPM7 producen la hipomagnesemia con hipocalcemia secundaria autosómica recesiva tipo 1 y tipo 2, respectivamente). Posiblemente salen de la célula mediante CNNM2 (mutaciones en el gen codificante producen la hipomagnesemia con convulsiones y discapacidad intelectual tipo 1) y el intercambiador de Mg2+/Na+ SLC41A1 (mutaciones en el gen codificante producen un fenotipo tipo nefronoptisis). Epidermal growth factor (EGF) es un activador del canal TRPM6 (mutaciones en el gen codificante producen la hipomagnesemia autosómica recesiva; mutaciones en el receptor de EGF [EGFR] produce la enfermedad inflamatoria neonatal de la piel y el intestino tipo 2). La fuerza apical necesaria para el transporte de Mg2+ es creada por la acción cooperativa de la Na+,K+-ATPasa basolateral, el canal de cloro ClC-Kb, el canal heteromérico Kir4.1/Kir5.1 que recicla K+ (mutaciones en el gen que codifica Kir 4.1 producen el síndrome EAST/SeSAME), el NCC y los canales extrusores de K+, ROMK (Kir1.1) (mutaciones en el gen codificante producen la enfermedad de Bartter tipo II) y Kv1.1 (mutaciones en el gen codificante producen la hipomagnesemia autosómica dominante o ataxia episódica tipo 1). Nota: No se incluyen los nombres de los genes codificantes ya que figuran en el texto.](https://static.elsevier.es/multimedia/02116995/0000004400000001/v1_202401141155/S0211699523000310/v1_202401141155/es/main.assets/thumbnail/gr1.jpeg?xkr=ue/ImdikoIMrsJoerZ+w94GCRvdQBB6xyQjMrWMzrts=)