Debido a los movimientos poblacionales que se desarrollan actualmente, existe un incremento en el número de individuos con enfermedad de Chagas (EC) que viven en regiones no endémicas; por tanto, existe una gran probabilidad de que nos enfrentemos a un aumento de casos de EC, tanto en pacientes que requieren tratamiento renal sustitutivo como en potenciales donantes. Presentamos el caso de un donante de órganos con serología Trypanosoma cruzi positiva, cuyos riñones se implantaron en sendos receptores. Se realizó profilaxis con benznidazol durante 3 semanas. En dos años de seguimiento serológico y clínico no se ha objetivado ninguna evidencia de transmisión ni afectación chagásica. La buena evolución sugiere que el trasplante de riñones procedentes de donantes con serología positiva sin signos de enfermedad aguda o crónica puede ser aceptable. Revisamos las evidencias que lo sustentan y las recomendaciones disponibles en la literatura.
Due to current trends in human population movements, there has been an increase in the number of individuals with Chagas’ disease (CD) living in non-endemic regions; as such, there is a high probability that we will face an increase in cases of CD, both in patients requiring renal replacement therapy and in potential donors. We present the case of an organ donor with positive serology for Trypanosoma cruzi, whose kidneys were implanted into two different recipients. Prophylaxis was administered with benznidazole for 3 weeks. Over the course of two years of serological and clinical follow-up, no evidence of Chagas’ transmission or infection was observed. This positive evolution suggests that renal transplants derived from donors with positive serology results and no signs of acute or chronic disease may be acceptable. We also provide a review of the evidence supporting this conclusion and the available recommendations in the medical literature.
INTRODUCCIÓN
La enfermedad de Chagas (EC) es poco frecuente en nuestro medio, pero tiene una elevada prevalencia en Sudamérica. Está causada por la infección por Trypanosoma cruzi, parásito intracelular que se transmite al ser humano por la picadura de insectos hematófagos, por transfusión sanguínea, transmisión vertical y, menos frecuentemente, por el trasplante de órganos. El parásito, tras la transmisión, se localiza a nivel intracelular, donde se multiplica (amastigote). Posteriormente, tras la ruptura celular, se disemina por el torrente sanguíneo en forma de tripoamastigote. Una vez en la circulación puede infectar cualquier célula corporal, excepto las neuronas1. Clínicamente presenta una primera fase aguda con elevada parasitemia, en el 95 % de los casos asintomática. En los casos sintomáticos, la presentación habitual consiste en un síndrome febril inespecífico. Dos tercios de los pacientes infectados entran en la denominada fase indeterminada, en la que pueden permanecer durante décadas. Se caracteriza por ser asintomática, pero con positividad en las pruebas serológicas. El resto de los pacientes desarrolla síntomas de EC crónica, caracterizada habitualmente por la aparición de miocardiopatía, que constituye la principal causa de muerte2. Otra forma frecuente de presentación clínica son los «megasíndromes», que incluyen megacolon y megaesófago1.
El diagnóstico de la EC se realiza mediante la detección del parásito en sangre durante la fase aguda, o mediante test serológicos (principalmente ELISA) en fases aguda, indeterminada y enfermedad crónica. El diagnóstico mediante PCR se estandarizó en 2010, pero la Organización mundial de la Salud (OMS) recomienda la realización de al menos 2 test serológicos para el diagnóstico3 y utilizar la PCR como confirmación en caso de positividad o discrepancia en los anteriores. El nifurtimox y el benznidazol son los fármacos utilizados habitualmente para el tratamiento de la EC, con un índice de curación parasitológica de alrededor del 60 % en los casos de infección aguda4. Las indicaciones actuales de tratamiento son las formas agudas o de reactivación de la enfermedad, la EC congénita y la EC crónica en menores de 18 años. El tratamiento en adultos parece que puede retrasar la progresión de la miocardiopatía chagásica, pero no curarla5. Por tanto, en adultos con EC sin miocardiopatía evolucionada, la indicación de tratamiento farmacológico debe ser individualizada y valorarse en mujeres en etapa reproductiva o futura inmunosupresión.
Debido a los movimientos poblacionales que se desarrollan actualmente, existe un incremento en el número de individuos con EC que viven en regiones no endémicas; por tanto, existe una gran probabilidad de que nos enfrentemos a un aumento de casos de EC, tanto en pacientes que requieren tratamiento renal sustitutivo como en potenciales donantes6.
EXPERIENCIA CLÍNICA
Donante
Se estableció el diagnóstico de muerte cerebral en una mujer de 40 años, natural de Paraguay, con antecedentes de hipertensión arterial (HTA) recientemente diagnosticada y con correcto control. La causa de la muerte fue una hemorragia en ganglios basales. Presentaba serología de EC positiva, sin haber mostrado sintomatología clínica aguda ni manifestaciones crónicas. La ausencia de signos y síntomas de EC llevó a tomar la decisión de utilizar ambos riñones para trasplante.
Receptor 1
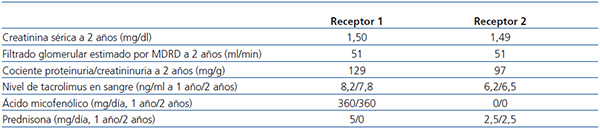
Varón de 51 años con nefropatía IgA diagnosticada por hallazgo casual de microhematuria y proteinuria. Inició diálisis peritoneal 2 años tras el diagnóstico. Recibió trasplante renal (TR) de la donante referida un año tras el inicio de diálisis. Compartía con la donante un HLA-B y un DR, la prueba cruzada fue negativa y la inmunosupresión se basó en inducción con basiliximab y mantenimiento con tacrolimus retard, prednisona y ácido micofenólico. Presentó diuresis inmediata y se fue de alta sin complicaciones. En el postrasplante inmediato recibió benznidazol con intención profiláctica a dosis de 175 mg cada 12 horas durante 3 semanas. No se detectaron efectos secundarios del fármaco: hemoglobina estable, ausencia de leuco-plaquetopenia, sin alteraciones cutáneas, digestivas ni neurológicas. La evolución de la función renal y la terapia inmunosupresora se muestran en la tabla 1. Al mes del TR, presentó un cuadro obstructivo secundario a un linfocele que se resolvió con su marsupialización. A los 6 meses del TR, durante el estudio de HTA mal controlada, se detectó una estenosis significativa de la arteria renal del injerto que requirió angioplastia con dilatación y colocación de un stent. Ninguna de estas complicaciones se relaciona con EC. La vigilancia de posible transmisión de la EC se ha realizado con test serológicos mediante ELISA e inmunofluorescencia indirecta cada 15 días durante el primer mes, mensualmente durante el primer año y posteriormente cada 6 meses hasta los 2 años. Todas las determinaciones han resultado negativas. Durante estos 2 años tampoco se han detectado alteraciones clínicas compatibles con EC, ni aguda ni crónica.
Receptor 2
El segundo receptor fue un varón de 58 años con antecedentes de HTA correctamente controlada y sin complicaciones. Monorreno congénito. Durante un estudio de proteinuria en rango nefrótico, se le diagnosticó una glomerulonefritis focal y segmentaria que le condujo a la necesidad de hemodiálisis. A los 8 meses recibió un TR de la donante referida. Compartía un HLA-B, y presentó prueba cruzada negativa. Recibió inmunosupresión convencional con inducción con basiliximab y mantenimiento con tacrolimus retard, prednisona y ácido micofenólico. Presentó función retardada del injerto requiriendo una única sesión de hemodiálisis. La evolución de la función renal y la inmunosupresión al año y los 2 años se muestran en la tabla 1. Presentó una neumonía por gripe A 3 semanas pos-TR; en este contexto se retiró el ácido micofenólico, que no se reintrodujo. A los 6 meses del TR se diagnosticó una infección fúngica cutánea en pierna izquierda por Alternaria alternata. Realizó tratamiento con voriconazol oral, con resolución del cuadro. A los 2 años pos-TR, a raíz de un estudio por alteraciones en la bioquímica hepática, se le diagnosticó un carcinoma hepatocelular sobre un hígado con cirrosis secundaria a esteatohepatitis no alcohólica. En este momento se está completando su estudio con vistas a tratamiento curativo de este carcinoma. No existe ninguna evidencia en la literatura que relacione la EC con el desarrollo de cuadros neoplásicos. La actitud respecto al seguimiento y la profilaxis de la EC ha sido igual que en el caso del paciente anterior. La profilaxis aplicada fue bien tolerada, tanto clínicamente como a nivel analítico. En todo momento los test serológicos han resultado negativos. No ha presentado clínica relacionada con la EC, ni se han detectado alteraciones ecocardiográficas o electrocardiográficas.
REVISIÓN
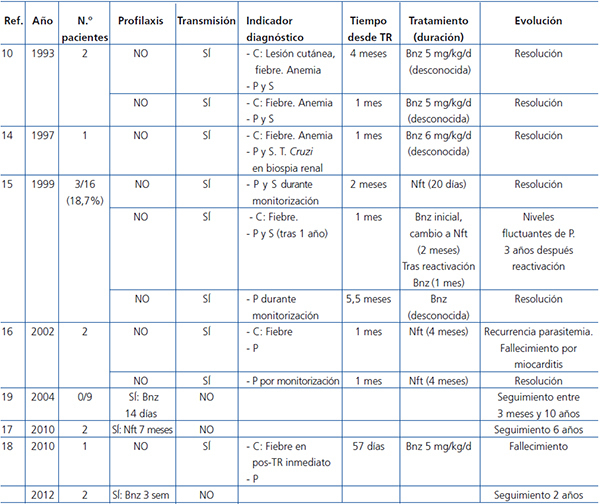
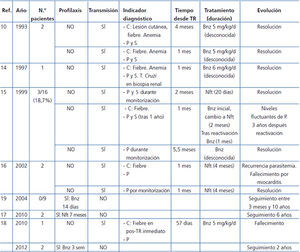
Los primeros artículos sobre la experiencia en TR y EC se publicaron a finales de la década de los setenta7, y posteriormente se describió la transmisión de EC a través del injerto renal8-13, incluso la presencia de amastigotes del T. cruzi en biopsias de injertos renales14 (tabla 2). Riarte et al. publicaron una serie de 16 receptores negativos que recibieron riñones de donantes con EC indeterminada. Ninguno recibió profilaxis en el postrasplante y realizaron una pauta de inmunosupresión convencional. Se detectó transmisión de la enfermedad en 3 de ellos (18,7 %), diagnosticada entre 1 y 6 meses pos-TR por la aparición de parasitemia; en dos de los casos, con un síndrome febril detectado precozmente. Recibieron tratamiento con benznidazol con variable tolerancia, pero buena respuesta en todos los casos. Durante el período de seguimiento (1,5-5 años), solo uno de ellos presentó una nueva reactivación, 3 años pos-TR, en contexto de tratamiento por rechazo crónico15.
El Centro de Control de Enfermedades (CDC) de EE. UU. publicó en 2002 la transmisión de T. cruzi en 2 receptores de TR de un mismo donante. Uno de los receptores desarrolló clínica de EC en forma de miocardiopatía chagásica; el otro receptor únicamente presentó serología positiva16. También se ha publicado la experiencia en un caso de TR de donante vivo en el que no se detectó transmisión de la enfermedad en el tiempo de seguimiento (6 años)17. Más recientemente, se publicó un caso clínico de TR de donante cadáver, con detección tardía de la transmisión de la enfermedad tras la aparición de un síndrome febril y, finalmente, fallecimiento del paciente18. La mayor serie reciente publicada es de 9 casos de receptores negativos que recibieron riñones de donantes positivos. Realizaron una pauta de profilaxis con benznidazol (5 mg/kg/día durante 14 días desde el día 0) e inmunosupresión convencional. Ninguno de los pacientes presentó transmisión de la enfermedad durante el período de seguimiento (3 meses-10 años)19.
Actualmente, las recomendaciones de seguimiento en el caso de receptores de TR que reciben órganos de donante con EC consisten en realizar pruebas parasitológicas o serológicas (según posibilidades de cada centro) con la siguiente frecuencia: pre-TR, semanalmente durante los 2 primeros meses; pos-TR, quincenalmente hasta los 6 meses pos-TR, y posteriormente cada año20. Este estricto seguimiento permite detectar precozmente la transmisión de la enfermedad e iniciar tratamiento específico.
La realización o no de profilaxis primaria es un tema en discusión desde los primeros casos de trasplante de órgano sólido con donantes con EC. En algunos de los casos y series publicadas en TR no se realiza profilaxis3,10,15,16,18, mientras que en otras sí se recoge su realización, mayoritariamente con benznidazol17,19 (tabla 2). En los casos sin profilaxis, se observó la transmisión del parásito en algunos o todos los pacientes presentados en los artículos. Mayoritariamente son casos aislados, no series de casos, lo que impide comparar con posibles parejas de donante Chagas positivo y receptor que no hubiesen presentado transmisión. En la serie de Riarte et al., a pesar de que la no realización de profilaxis se acompañó de la transmisión del T. cruzi en un 18 % de los casos, este grupo no recomienda la profilaxis primaria justificando su postura por la ausencia de casos graves gracias a la detección precoz y la correcta respuesta al tratamiento dirigido14. En los casos publicados que realizaban profilaxis, destaca que no presentaron ningún caso de transmisión de la enfermedad sin referir ninguna complicación relacionada con el tratamiento17,19.
Un grupo de trabajo formado por la Sociedad Española de Medicina Tropical y Salud Internacional, el Centro de Investigación en Salud Internacional de Barcelona (CRESIB) y varios expertos internacionales han publicado recientemente un documento de recomendaciones para el manejo de estos casos20. Este grupo argumenta que, dado que el tratamiento precoz de la infecciones es altamente efectivo, no existe una clara evidencia con estudios específicos acerca del beneficio de usar profilaxis y, dada la experiencia del grupo, recomiendan el tratamiento cuando hay evidencia de transmisión (pruebas parasitológiccas o serológicas). Por tanto, no existe un criterio único y claro sobre su uso. No obstante, dados los resultados observados en la literatura con ausencia de transmisión con el uso de profilaxis, y hasta que se generen evidencias más contundentes, esta parece aconsejable en la mayor parte de los pacientes. Si se decide realizar profilaxis, debería utilizarse benznidazol durante 1 mes a dosis de 5 mg/kg/día20.
En caso de aparición de parasitemia y/o seroconversión se debería realizar tratamiento, independientemente de la presencia de síntomas asociados15,20. Existen 2 opciones terapéuticas: benznidazol (5 mg/kg/24 h) o nifurtimox (8 mg/kg/24 h), ambos durante 60 días20. El benznidazol, fármaco activo frente a las diferentes formas de T. cruzi, es la primera opción terapéutica, dada la mejor tolerancia que presenta y la ausencia de interacción con los fármacos inmunosupresores. Los efectos secundarios más frecuentes de este fármaco son la aparición de rash cutáneo asociado a fotosensibilidad (30 %) y neuropatía periférica (12-30 %). Aunque menos frecuente, es también importante controlar la mielotoxicidad con aparición de leuco-plaquetopenia5,21. El consumo simultáneo de alcohol puede desencadenar cuadros antabús-like5.
No existen en la literatura estudios clínicos aleatorizados que evalúen la relación entre el tratamiento inmunosupresor en TR y la transmisión o reactivación de EC. Sí existen, en cambio, abundantes publicaciones que analizan la relación entre ese tratamiento y la reactivación de la EC en trasplante de órganos sólido en receptores con miocardiopatía chagásica, por lo que muchas de las recomendaciones actuales se extrapolan de estos estudios. El uso de inmunoglobulina antitimocítica en trasplante cardíaco de receptores chagásicos ha demostrado un incremento en las reactivaciones de la EC, principalmente en contexto de tratamiento por rechazo agudo. Estos datos hacen que, en casos de donantes positivos y receptores negativos, se recomiende evitar su uso y utilizar anticuerpos monoclonales, como basiliximab3,22.
En un estudio retrospectivo, se observó que el número de reactivaciones de EC era significativamente menor en los pacientes que recibían menores dosis de ciclosporina (5-10 mg/kg de peso vs. 3-5 mg/kg de peso)23. Uno de los inmunosupresores más analizados en su relación con la EC es el micofenolato de mofetilo (MMF). Un trabajo retrospectivo en receptores con miocardiopatía chagásica que recibieron un trasplante cardíaco comparó la incidencia de reactivación de EC en pacientes que recibían como tercer fármaco inmunosupresor, junto con ciclosporina y prednisona, azatioprina o MMF. Se observó una mayor incidencia y precocidad en la reactivación de la EC en los pacientes que recibían MMF (86,6 %) comparado con los que recibían azatioprina (37,5 %) en un seguimiento a 2 años. El tratamiento con MMF resultó ser un predictor independiente de reactivación24. Otros estudios retrospectivos realizados en trasplante cardíaco demostraron la misma relación22,25. Parece que la rapamicina inhibe el crecimiento de Trypanosoma brucei26, con lo que los inhibidores de mTOR podrían ser una buena alternativa al uso de MMF. No existe, por tanto, suficiente evidencia para recomendar pautas de inmunosupresión específicas en estos casos, aunque sí se sugiere que se debería evitar el uso de inmunoglobulina antitimocítica y minimizar el uso de MMF, así como mantener globalmente la inmunosupresión en las dosis más bajas toleradas3,20.
En resumen, la EC es una patología poco frecuente en nuestro medio, pero por los movimientos poblaciones actuales encontraremos, cada vez con mayor frecuencia, posibles donantes renales con antecedentes de EC. El índice de transmisión de EC en los receptores de TR es bajo y el tratamiento en casos de transmisión es efectivo. Es necesario un seguimiento exhaustivo clínico y serológico de los pacientes para detectar precozmente posibles transmisiones e iniciar el tratamiento correspondiente, ya que la evolución de los pacientes en estos casos es mucho más favorable. A pesar de estas recomendaciones generales, son necesarios estudios prospectivos que ayuden a establecer protocolos de actuación de tratamiento y seguimiento.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
CONCEPTOS CLAVE
1. Es necesario el cribado de serología para Trypanosoma cruzi en donantes de riesgo: nacidos en zonas endémicas (países latinoamericanos), que hayan vivido más de un mes en estas zonas, o que hayan recibido una transfusión sanguínea en una de estas zonas.
2. La presencia de serología positiva en un donante, en ausencia de clínica, no contraindica la donación renal.
3. Es recomendable evitar el uso de globulina antitimocítica y minimizar la inmunosupresión.
4. Parece aconsejable realizar profilaxis con benznidazol en los receptores, aunque es necesario realizar una valoración individualizada teniendo en cuenta principalmente la situación inmunológica basal y la inmunosupresión que se va a prescribir.
5. Es necesario un seguimiento serológico exhaustivo para detectar precozmente la transmisión.
6. En caso de aparición de parasitemia y/o seroconversión, debe instaurarse tratamiento específico con benznidazol.
Tabla 1. Evolución de función renal e inmunosupresión a 1 y 2 años en dos receptores de riñones procedentes de un donante con serología a Trypanosoma cruzi positiva
Tabla 2. Experiencia publicada en las dos últimas décadas en la literatura acerca de donantes con enfermedad de Chagas y trasplante renal