Un número creciente de adultos jóvenes que iniciaron tratamiento renal sustitutivo (TRS) en la infancia están siendo trasladados a unidades de adultos, la mayor parte de ellos con un trasplante renal (TR) funcionante. Los avances en las técnicas de diálisis y en los cuidados médicos de la enfermedad renal crónica están permitiendo a niños muy pequeños alcanzar un TR. Pese a ello, la corta edad de inicio del TRS y la comorbilidad no renal incrementan la mortalidad.
El TR anticipado es la mejor opción terapéutica de TRS: ofrece mejor supervivencia, calidad de vida y crecimiento. Cuando este objetivo no es posible, los períodos de diálisis se contemplan como transitorios. Siempre que sea posible se ofrecen las dos modalidades: diálisis peritoneal y hemodiálisis. Ambas deberían ser realizadas en centros pediátricos que dispongan de un equipo multidisciplinario integrado por nefrólogos y cirujanos pediátricos, enfermería cualificada y el apoyo de dietistas, psicólogos, trabajadores sociales, terapeutas de juego y maestros.
CRITERIOS DE REVISIÓN: Se ha realizado mediante búsqueda bibliográfica en PubMed y Up to Date utilizando los términos: tratamiento sustitutivo de la enfermedad renal crónica en niños, diálisis peritoneal, hemodiálisis y trasplante renal.
_______________________________________________________________________________________________________________________________________________________
INTRODUCCIÓN
Los avances en la diálisis y el trasplante renal (TR) en las cuatro últimas décadas han permitido mejorar la supervivencia de niños con enfermedad renal crónica (ERC). Como consecuencia, un número superior de adultos jóvenes con historia de tratamiento renal sustitutivo (TRS) son trasladados a servicios de nefrología de adultos con una organización diferente y un personal sanitario que habitualmente espera de ellos una mayor responsabilidad por sus cuidados. Tras años de esfuerzo atendiendo a estos pacientes crónicos, los pediatras debemos transmitir no sólo toda la información clínica, sino también las peculiaridades personales de adolescentes o adultos jóvenes que, sin duda, pueden condicionar su tratamiento posterior. Sólo así los nefrólogos tendrán un conocimiento integral de unos pacientes en momentos de cambios físicos y emocionales.
Revisaremos en este artículo datos de incidencia, supervivencia y calidad de vida de la población pediátrica en TRS, el TR como mejor opción terapéutica y los aspectos diferenciales de la diálisis peritoneal (DP) y la hemodiálisis (HD).
INCIDENCIA Y PREVALENCIA DEL TRATAMIENTO RENAL SUSTITUTIVO
Según datos del registro europeo ERA-EDTA, en el que están incluidos pacientes españoles (andaluces y catalanes), existe un incremento en el número de pacientes por millón de habitantes que alcanzan los 18 años y que comenzaron TRS en la infancia, de 71 en 1985 a 116 en 2004, a expensas de aquellos que iniciaron dicha terapia antes de los 10 años1. El avance de las técnicas de diálisis y de otros cuidados de la ERC está permitiendo a niños muy pequeños alcanzar el crecimiento necesario para recibir un trasplante2-5. En España, la prevalencia global de pacientes con TRS es de 111 pacientes por millón de población (pmp), y la incidencia en los últimos años, de 6,1/pmp menores de 18 años6.
TIPOS DE TRATAMIENTO RENAL SUSTITUTIVO. TRASLADO A UNIDADES DE ADULTOS
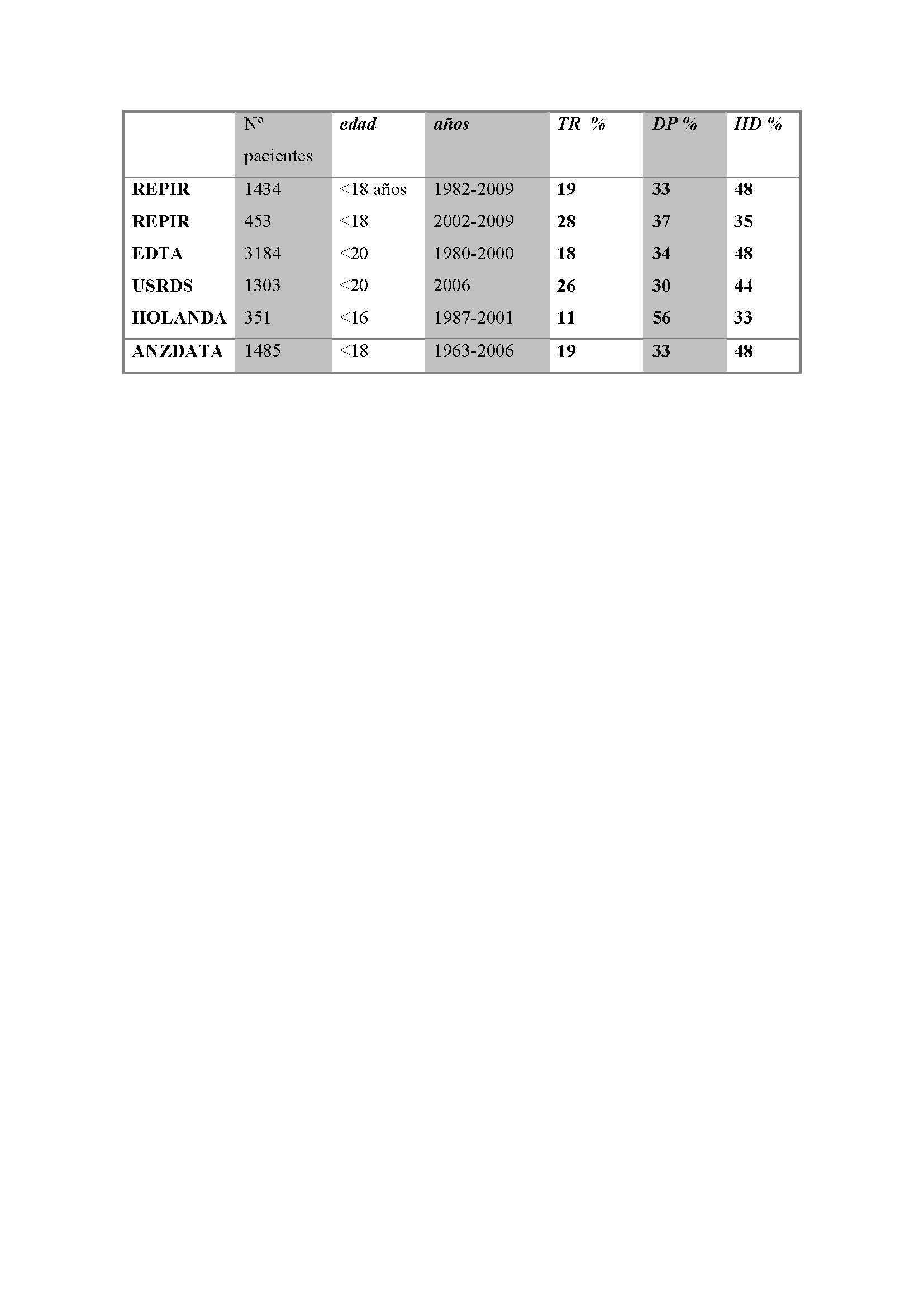
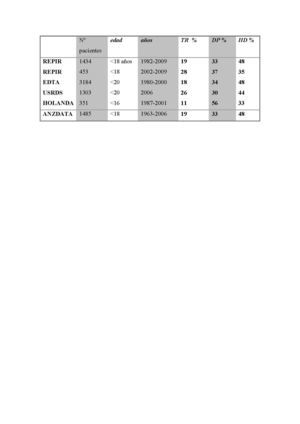
Analizando los datos del registro europeo por quinquenios desde 1985 a 2004, tanto la DP como el TR anticipado han crecido como primer TRS en pacientes menores de 18 años. El REPIR (Registro Español Pediátrico de Insuficiencia Renal) revela cómo en la década de los años ochenta el primer TRS era la HD en el 60-70% de los pacientes, incrementándose posteriormente la DP y el TR anticipado como primer TRS. En los últimos años corresponde la tercera parte a cada modalidad (tabla 1). En el momento del traslado a unidades de adultos, la mayor parte de los pacientes se encuentran disfrutando de un TR: el 60,4% según datos europeos, el 29% en HD y el 9,7% en DP. En España logramos que un número superior de pacientes alcancen la mayoría de edad disfrutando de un TR funcionante, de modo que el 82% ya han sido sometidos al trasplante en el momento del traslado, el 13,8% están en HD y el 3,8% se encuentran en DP6.
SUPERVIVENCIA DE PACIENTES INFANTILES CON TRATAMIENTO RENAL SUSTITUTIVO Y ADULTOS QUE INICIARON DICHO TRATAMIENTO EN LA INFANCIA
Edad de comienzo de la diálisis
La tasa de supervivencia a largo plazo de niños con TRS mejoró de manera sustancial desde la década de los años sesentasetenta a la de los ochenta-noventa, con una desaceleración en ese progreso en los últimos 25 años. Esto podría explicarse por la tendencia creciente a incluir en programas de TRS a pacientes muy pequeños, lactantes y neonatos, así como a niños con comorbilidad no renal (síndromes multisistémicos, enfermedades metabólicas o neoplasias). Podríamos, por tanto, estar subestimando la continua mejoría de la supervivencia en el paciente promedio. Todos los registros comunican una tasa de mortalidad significativamente mayor en niños muy pequeños, identificando claramente la edad como factor de riesgo. Los límites para iniciar TRS pueden variar en diferentes centros, reflejando la opinión desigual de los nefrólogos pediátricos acerca de ofrecer dicho tratamiento a lactantes, con severa comorbilidad extrarrenal, factor que también incrementa el riesgo de morir7,8. La mortalidad puede llegar a ser elevada en los pacientes que precisan DP en el período neonatal. Así, Rheault4 comunica un 48% de mortalidad al año de inicio de la DP en neonatos menores de 28 días. Sin embargo, la supervivencia del 52% que sobrevivió y alcanzó un TR fue equiparable a la de los niños de mayor edad. Por otro lado, Wedekin3 concluye que los neonatos y lactantes sin comorbilidad que comienzan TRS antes del año tienen buena supervivencia y, por tanto, se les puede ofrecer dicho tratamiento de manera sistemática. Si muestran afectación de otros órganos, la supervivencia es peor, y la decisión de iniciar TRS debe consensuarse entre nefrólogos, neonatólogos, padres y un comité ético.
Modalidad de tratamiento renal sustitutivo
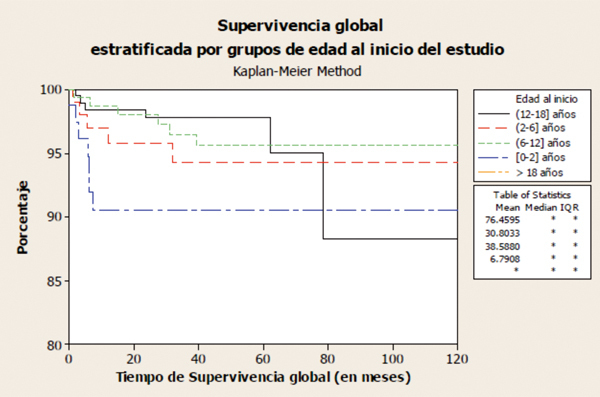
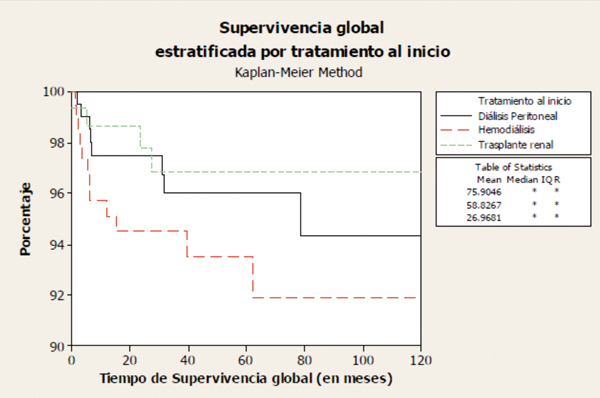
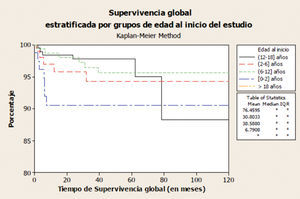
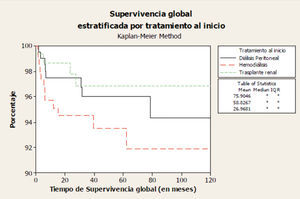
Si consideramos globalmente a todos los pacientes que inician TRS por debajo de 18 años, la tasa de supervivencia oscila entre el 79-82% a los 10 años y el 66-76% a los 20 años9. Según datos de 1.434 pacientes tratados en España, que iniciaron TRS de 1982 hasta 2009 y que se encuentran recogidos en el informe del REPIR, la peor supervivencia corresponde al grupo de menor edad (figura 1) y a aquéllos en quienes su primer TRS fue la HD, siendo del 93,5% para HD, del 96% para DP y del 97% para el TR a los 5 años (figura 2). Estas cifras son mejores que las comunicadas en el registro inglés de 2009, del 91,2% a los 5 años de todos los pacientes que inician TRS menores de 16 años10.
El estudio de Kramer1 revela que, una vez que alcanzan la mayoría de edad, la supervivencia no depende de la edad de comienzo de la ERC ni de las modalidades previas de TRS, y está determinada por el hecho de tener o no un trasplante a la edad de 18 años. Los pacientes que iniciaron TRS en la infancia y alcanzan los 18 años en diálisis tienen un riesgo de muerte cinco veces superior a los que tienen un órgano funcionante. Expresado de otro modo, la esperanza de vida es de 63,2 años para los que alcanzan la mayoría de edad con TR y de 38 para los que permanecen en diálisis. Estos datos subrayan la importancia del TR precoz como TRS de elección en la infancia.
Es necesario destacar la elevada mortalidad que acarrea la diálisis en niños, que es 30 veces superior a la esperada por grupos de edad en niños sin enfermedad renal. El registro italiano pediátrico no encuentra diferencias en la supervivencia según la modalidad de diálisis, si bien estos datos deben ser interpretados con cautela, pues la HD acoge a pacientes que han presentado complicaciones en la DP, constituyendo un grupo de mayor edad y considerable comorbilidad, por lo que resulta difícil realizar comparaciones2,8. Por otro lado, el tratamiento mediante diálisis confiere una mortalidad de 4 a 10 veces superior a la encontrada en niños que han recibido un TR8,9,11. Aunque considerablemente más corto en niños que en adultos, la prolongación del tiempo en diálisis se asocia con incremento en la tasa de mortalidad.
Riesgo cardiovascular
Los avances en el TRS han permitido identificar cada vez más y mejor la enfermedad cardiovascular en niños. Un paciente pediátrico con ERC tiene un riesgo de muerte por evento cardiovascular 1.000 veces mayor que la población sana de su edad, siendo ésta la causa de muerte más común en los pacientes con TRS. Le siguen los accidentes cerebrovasculares por hipertensión arterial (HTA) maligna, las infecciones, las neoplasias y el abandono de tratamiento por parte de los adolescentes.
La enfermedad cardiovascular es, además, muy prevalente en niños y jóvenes con TRS. Entre el 30 y el 50% puede presentar hipertrofia ventricular izquierda y remodelamiento miocárdico, calcificaciones vasculares y rigidez de la pared arterial. Estos cambios están ya presentes desde la primera década de la vida y se encuentran en adultos con ERC desde la infancia, secundarios a la sobrecarga crónica de volumen, a la HTA, al desequilibrio metabólico-mineral del hiperparatiroidismo, a la hipoalbuminemia y a la anemia8,12. El tiempo en diálisis es un potente predictor de daño vascular y calcificación.
El 50% de los pacientes pediátricos con una permanencia prolongada en diálisis presentan HTA, definida como una presión arterial por encima del percentil 95 para su edad, sexo y talla. La monitorización ambulatoria de la presión arterial en 24 horas es de gran ayuda para su diagnóstico y tratamiento13. La HTA prolongada se asocia con un incremento de la mortalidad7.
Neoplasias
Las neoplasias asociadas con la inmunosupresión (IS) se describen en estudios de seguimiento largo y varían del 2,6 al 12% de los pacientes. Las más prevalentes son los linfomas y el cáncer de piel. Las medidas de protección solar y las exploraciones de cribado van encaminadas a la detección precoz de esta patología que puede aumentar en un futuro próximo, dada la tendencia al uso de fármacos inmunosupresores con mejor perfil antirrechazo pero con mayor potencial carcinogénico.
CALIDAD DE VIDA
Al comparar a adultos jóvenes en TRS desde la infancia con otros con TRS desde la edad adulta, para conocer datos sobre calidad de vida y efectos tardíos físicos, sociales y psicológicos de la ERC en niños, se ha comprobado que los trasplantados con ERC desde la infancia alcanzan una calidad de vida normal. El TR puede reparar las alteraciones del desarrollo cognitivo e intelectual detectadas en pacientes en prediálisis. La duración del período de diálisis superior a 4 años y del TRS durante más de 18 años se asocian con un mayor deterioro de actividad física. No obstante, la salud mental, vinculada habitualmente con las expectativas de vida, se encuentra mejor preservada en aquellos casos con ERC desde la infancia. Se especula que, al crecer conviviendo con la enfermedad, pueden cumplir mejor sus perspectivas7.
Ya que la corta edad de inicio y la presencia de comorbilidad son factores de riesgo ineludibles, es esencial conocer y reparar los factores susceptibles que podrían mejorar la supervivencia y la calidad de vida, pues aunque la meta es alcanzar un TR por sus probados e incuestionables beneficios, los períodos de diálisis en ocasiones son inevitables. Será, por lo tanto, fundamental, preservar los accesos vasculares, mantener y cuidar la función de la membrana peritoneal, proporcionar una diálisis adecuada, prevenir complicaciones metabólicas e infecciosas, asegurar la nutrición y el crecimiento, y minimizar el riesgo cardiovascular8.
TRASPLANTE RENAL
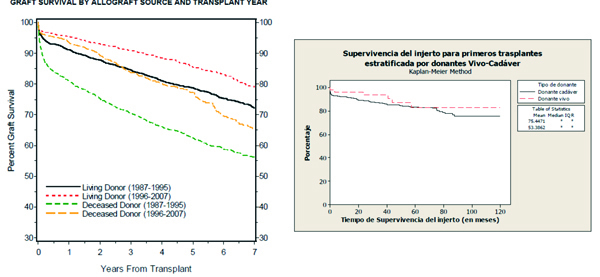
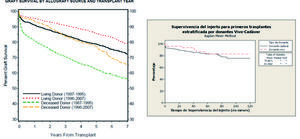
El TR anticipado de donante vivo (DV) es la mejor opción terapéutica de la ERC en la infancia: evita la diálisis, aporta una buena masa renal con mínimo tiempo de isquemia fría, ofrece mejor supervivencia del injerto (figura 3), calidad de vida, la posibilidad de reducir la inmunosupresión (IS) y mejora el crecimiento. En la edad pediátrica contamos con buena predisposición familiar para la donación y compatibilidad de los padres. Actualmente es posible ampliarla a progenitores ABO incompatibles y a donantes no emparentados a través del programa de donante renal cruzado. Cuando el filtrado glomerular descienda a 30 ml/min/1,73 m2, es el momento para comenzar los preparativos del paciente y de su familia para el inicio de TRS. Se debe informar de las diferentes opciones y sus ventajas en función de las circunstancias de cada niño y su entorno14,15.
Medidas pretrasplante
Los preparativos para el trasplante incluyen la corrección de las anomalías urológicas, inmunizaciones, estudio vascular e inmunológico. Es preceptivo completar las inmunizaciones sistemáticas, en particular las de virus vivos como la varicela, que deben administrarse entre uno y dos meses antes del TR. Las peculiaridades pediátricas del árbol vascular obligan a realizar un riguroso estudio del territorio de la vena cava inferior e ilíacas, e indagar si el niño, en algún momento de su vida, tuvo implantado un catéter en dicho territorio.
Cuidados quirúrgicos y postoperatorios
Cabe destacar la importancia de monitorizar la presión venosa central en la intervención quirúrgica y transfundir en el momento del desclampaje para evitar una caída brusca de la volemia secundaria al secuestro por parte del injerto. El aporte de líquidos en el postrasplante inmediato será especialmente cuidadoso en la población pediátrica, con mayor riesgo de trombosis arterial y venosa. En los pacientes con hipercoagulabilidad, muy pequeños y en DP, es recomendable la profilaxis con heparina, así como en los injertos con vasos múltiples. Las pérdidas de injertos en el postoperatorio inmediato por complicaciones quirúrgicas son más frecuentes en lactantes.
Inmunosupresión
No existe unanimidad en los protocolos de inmunosupresión (IS), pero en general se utiliza una pauta enérgica, ya que los niños tienen mayor incidencia de rechazo. La tendencia en los últimos años es a inducir con antagonistas de los receptores de interleucina 2 (IL-2) y continuar con triple terapia: anticalcineurínico, micofenolato mofetil y dosis bajas de esteroides. Los pacientes con alto riesgo inmunológico suelen ser inducidos con anticuerpos policlonales antilinfocitos o antitimocitos. La condición de seronegatividad frente a citomegalovirus (CMV) en el receptor, habitual en la población pediátrica, le confiere un riesgo elevado de primoinfección si el donante es seropositivo.
Seguimiento
El seguimiento debe incluir la monitorización de niveles plasmáticos de los fármacos empleados en la IS por su rápida metabolización. Se informará a la familia y al médico de atención primaria sobre la importancia de evitar episodios de deshidratación, los fármacos potencialmente nefrotóxicos como el ibuprofeno, muy utilizado en pediatría y (siempre que sea posible) aquellos medicamentos que puedan interaccionar con el metabolismo de los IS16.
La recidiva de GESF es la causa más frecuente de pérdida de injerto por recurrencia, siendo este riesgo mayor en niños que en adultos. Los pacientes con GESF debida a mutaciones genéticas tienen menor tasa de recurrencia después del trasplante17. En el caso de la hiperoxaluria primaria tipo 1 (HOP 1), el TR aislado tiene unos resultados decepcionantes, puesto que los depósitos de oxalatos movilizados y producidos de nuevo acaban con la pérdida del injerto. El trasplante hepatorrenal que aportará la enzima deficitaria será el tratamiento de elección en el paciente con HOP 1 y ERC, y el trasplante hepático anticipado en aquellos casos sin fracaso renal18. En casos de SHU atípico, es obligado el estudio exhaustivo de las proteínas del complemento antes de intentar un TR aislado. La elevada incidencia de recidivas obliga a plantear, según los casos, el trasplante hepatorrenal, TR con eculizumab y/o plasmaféresis19,20.
Los pacientes trasplantados adolescentes precisan de una atención muy cercana. En esta edad de conflictos y cambios, tanto físicos como anímicos, se describe un porcentaje muy elevado de pérdidas de injertos por descuidos en el tratamiento. Varios trabajos describen una peor supervivencia del injerto respecto a otros grupos de edad, atribuible al incumplimiento terapéutico21.
DIÁLISIS PERITONEAL Y HEMODIÁLISIS PEDIÁTRICA
Elección de la técnica
Un paciente pediátrico debe tener siempre expectativas de TR cuando inicia cualquier modalidad de diálisis. Siendo la mejor opción terapéutica, el TR anticipado no puede realizarse en la ERC de comienzo súbito, en pacientes hiperinmunizados ni en aquéllos con necesidad de reparación quirúrgica de la vía urinaria, de la cumplimentación del calendario de vacunas o del control clínico de una enfermedad subyacente. También la edad puede constituir una contraindicación relativa de TR. En la mayoría de los centros trasplantadores se demora hasta la adquisición de un tamaño adecuado para minimizar el riesgo quirúrgico de fracaso precoz por complicaciones vasculares. En estos pacientes es necesario un período de diálisis más
o menos prolongado. Siempre que sea posible, debemos ofrecer ambas técnicas: HD y DP.
Las ventajas intrínsecas de la DP, como la inexistencia de acceso vascular, la ultrafiltración constante, la mayor estabilidad hemodinámica, así como su contribución a mantener la función renal residual, la convierten en una técnica idónea para cualquier niño que la elija y especialmente para lactantes que comportan dificultades técnicas en el acceso vascular, niños con domicilio alejado del hospital, permitiendo una mejor integración escolar, social y familiar del paciente.
La HD está indicada en la HOP 1, que precisa un aclaramiento adicional de oxalato no eliminable por DP, y en casos de cirugía abdominal extensa o complicaciones de la DP. También en ausencia de un entorno familiar idóneo o cuidador motivado que asuma la técnica de DP domiciliaria. Los adolescentes pueden rechazar esta técnica por la distensión abdominal que origina la solución de diálisis, con la consiguiente distorsión de la autoimagen y las repercusiones emocionales o sexuales.
Debido a las necesidades específicas de los niños y a las peculiaridades de la diálisis en este grupo de edad, tanto la DP como la HD en pacientes menores de 18 años deberían ser realizadas en centros pediátricos, con la implicación de un equipo multidisciplinario22.
Diálisis peritoneal
En España, la DP constituye la modalidad de tratamiento inicial más común en menores de 6 años y en una tercera parte de todos los menores de 18 años6. En general, es una técnica muy extendida en la población pediátrica en todos los países del mundo (tabla 1)23,24.
A los criterios de inicio de TRS habituales en adultos hay que añadir los datos clínicos y/o analíticos de desnutrición y retraso de crecimiento que no mejoren con una estrategia nutritiva enérgica y la corrección de otros factores metabólicos. La realización de gastrostomía, indicada en niños en ERC con necesidades nutritivas elevadas e incapacidad de ingestión oral debe realizarse con anterioridad a la implantación del catéter de DP, para evitar la extravasación del contenido gástrico y el riesgo de peritonitis25,26.
El catéter más utilizado es el Tenckhoff, existiendo catéteres de 31 cm para neonatos y lactantes, y de 37 y 39 cm para niños mayores. La implantación del catéter bien planificada y meticulosa, realizada por un equipo bien entrenado, es más crítica que el tipo de catéter elegido. En niños se recomienda la implantación quirúrgica con anestesia general, programada para permitir un reposo de 2-3 semanas. El volumen de la infusión se realiza según la superficie corporal del paciente, el tipo de membrana conocido mediante el TEP y la medida de la presión intraperitoneal, ajustando dicha prescripción evolutivamente y de manera personalizada según los conocidos criterios de adecuación, que en pediatría incluyen una adecuada velocidad de crecimiento. La DP automática es de primera elección en pediatría. Aunque en niños no hay datos a largo plazo, el uso de soluciones biocompatibles puede ofrecer ventajas, teniendo en cuenta que tendrán una vida por delante con TRS27,28.
Se recomienda prescribir dieta hipercalórica, normoproteica con suplementos proteicos por las pérdidas peritoneales, utilizando sondas nasogástricas o gastrostomías, para garantizar aportes adecuados.
Los episodios de peritonitis son más frecuentes en la población pediátrica, de manera que todos los esfuerzos deben ir dirigidos a la prevención y al diagnóstico precoz para preservar la membrana peritoneal. Las peculiaridades del tratamiento de peritonitis se pueden consultar en las guías nacionales e internacionales29-31.
Hemodiálisis
Además de la gran variabilidad de los pacientes que pueden precisar HD (menos de 5 kg a 80-90 kg), los niños muestran características particulares por su composición corporal y estabilidad hemodinámica. Se requieren, por tanto, materiales, parámetros, formación y consideraciones específicas, que la diferencian en gran medida de la HD realizada en adultos.
En niños, la HD se entiende como un proceso transitorio, como puente hacia el trasplante o hasta el inicio de la DP. Este hecho, unido a las dificultades técnicas que plantean para la creación de una fístula arteriovenosa (FAV), hacen que el catéter venoso central tunelizado sea el acceso vascular empleado más frecuentemente. El lugar de inserción de elección es la vena yugular interna derecha. Es imprescindible contar con una gama de catéteres de diferentes tamaños, adecuados a pacientes de diferente peso y talla. No obstante, estudios en niños mayores han demostrado una mayor supervivencia y menor tasa de complicaciones a favor de la FAV32. Evitaremos implantar catéteres en el territorio de las ilíacas para prevenir anomalías que dificulten futuros trasplantes.
Aunque el esquema de prescripción estándar es de tres sesiones semanales de cuatro horas de duración, la prescripción de la HD debe ser personalizada. En menores de 10 kg, la mayor ganancia hídrica motivada por una nutrición basada en alimentos líquidos condiciona con frecuencia la necesidad de realizar cuatro o cinco sesiones semanales25,26. En los últimos años, diferentes grupos pediátricos han demostrado las ventajas de las pautas de HD intensivas33, asociadas o no al empleo de modalidades convectivas34, si bien aún no son pautas muy extendidas.
Los dializadores deben ser acordes a la superficie corporal del niño, con una gama que abarca desde 0,2-0,3 m2 hasta 1,7 m2 de superficie de membrana. Los flujos sanguíneos utilizados en función del peso del paciente oscilan de 6-8 mL/kg /min, hasta 250-300 ml/min en niños mayores de 40 kg.
Para asegurar una buena tolerancia de la HD, el volumen total del circuito extracorpóreo (suma de agujas o catéter, líneas y dializador) debe ser menor del 10% del volumen sanguíneo del niño (estimado en 70-80 ml/kg). Para ello es imprescindible contar con líneas adecuadas a cada rango de edad: neonatales (con volumen de cebado 30-40 ml), pediátricas (7080 ml) y de adulto (>130 ml). Si el volumen del circuito extracorpóreo supera el límite indicado, es aconsejable infundir al paciente, al inicio de la sesión, el cebado del sistema con solución salina, albúmina o concentrado hemático, conforme a la situación clínica35.
Un aspecto de gran importancia es la correcta estimación del peso seco. El crecimiento provoca en los niños continuas variaciones en la composición corporal que precisan ajustes frecuentes de este parámetro, en ocasiones semanales, en situaciones de intenso anabolismo (tratamiento con hormona de crecimiento) o catabolismo (infecciones intercurrentes, reducción de la ingestión de alimentos). La monitorización no invasiva del volumen sanguíneo es un instrumento de probada utilidad en la valoración del peso seco25,26. La HD secuencial puede ser mal tolerada en niños pequeños por hipotermia. No se debe programar una ultrafiltración superior al 5% del peso corporal del paciente en una sesión35.
La adecuación de la HD en niños se define no sólo en función de parámetros de aclaramiento de urea (objetivo Kt/V >1,4 por sesión), sino en función de criterios del estado nutricional (correlacionado con los valores de nPCR), crecimiento, función cardíaca y calidad de vida25,26,35.
Entre las complicaciones de la HD en niños, destaca, por su frecuencia, la hipotensión intradialítica. La incapacidad para verbalizar los síntomas dificulta su diagnóstico precoz, y los episodios repetidos podrían provocar cuadros de isquemia cerebral. Las infusiones de suero salino se administran a ritmo de 5 ml/kg. La HTA interdiálisis es muy prevalente en pediatría. Un reciente estudio realizado en 624 pacientes menores de 18 años en HD crónica describe unas cifras del 79%36. La sobrecarga de volumen mantenida es responsable de este fenómeno en la mayoría de los casos. Es imprescindible la utilización de un manguito adecuado a cada edad, valorar los límites de tensión arterial normales en pediatría37 y la ansiedad que ocasiona el inicio de la sesión de HD.
CONCLUSIONES
Dos generaciones de pacientes pediátricos han recibido TRS. Avances en inmunosupresión, cuidados médicos, técnicas quirúrgicas, material pediátrico de diálisis, aspectos nutricionales y tratamiento con hormona de crecimiento han permitido mejorar la supervivencia y la calidad de vida de estos niños. Continúa siendo un objetivo del TRS alcanzar un TR anticipado, siempre que sea posible de DV. En los períodos de necesidad de diálisis, estamos obligados a identificar y corregir meticulosamente todos los factores susceptibles que coloquen lo antes posible al paciente en las mejores condiciones de recibir un injerto renal.
PUNTOS CLAVE
1. El TRS de elección en la edad pediátrica es el TR anticipado de DV.
2. Mejoras en el TR y la diálisis han permitido incrementar la supervivencia de niños con ERC.
3. La corta edad de inicio del TRS, la comorbilidad no renal, el prolongado tiempo en diálisis y la enfermedad cardiovascular se asocian con mayor mortalidad.
4. Lactantes y neonatos con ERC sin patología añadida y tratados en unidades con experiencia tienen buen pronóstico.
5. La DP es una técnica idónea para cualquier niño. Permite una mejor integración escolar, social y familiar. Es especialmente útil en lactantes y pacientes con su domicilio alejado del hospital.
6. La HD pediátrica requiere un equipo facultativo experto y diversidad de material adaptado a la variabilidad de tamaño de los pacientes.
Figura 1. Supervivencia del paciente estratificada por grupos de edad al inicio del tratamiento renal sustitutivo (REPIR).
Figura 2. Supervivencia del paciente estratificada por modalidad de tratamiento de inicio (REPIR).
Figura 3. Comparación de la supervivencia del injerto según la procedencia del órgano y año de 10.762 trasplantes renales en <21 años naprtcs 2008 con la supervivencia para trasplantes renales en niños españoles <18 años 1998-2008 repir
Tabla 1. Comparación de los tipos de tratamiento renal sustitutivo inicial en los distintos registros