- Tipo de diseño y seguimiento
Ensayo clínico aleatorizado, controlado con placebo, simple ciego, multicéntrico, de 24 meses de seguimiento.
- Asignación
Los pacientes se estratificaron de acuerdo a la presencia de diabetes mellitus tipo 2 (DM2) o ser portadores de trasplante renal, y después fueron aleatorizados 1:1 para recibir tratamiento con activador continuo del receptor de la eritropoyetina (CERA) o placebo. La asignación fue enmascarada para los pacientes.
- Enmascaramiento
Simple ciego, con seguimiento enmascarado para el paciente.
- Ámbito
Estudio multicéntrico realizado en 30 centros de nefrología y de trasplante en Alemania.
- Pacientes
Criterios de inclusión
Filtrado glomerular estimado (FGe) mediante fórmula MDRD (modification of diet in renal disease) entre 30 y 59 ml/min/1,73 m2; ratio albúminacreatinina (Cr) en orina < 3.000 mg/g o proteinuria < 3.000 mg/24 h; diagnóstico de DM2 o ser portador de trasplante renal al menos 6 meses antes de la inclusión en el estudio. Por dificultades para el reclutamiento se modificaron los criterios de inclusión, retirándose algunas limitaciones que se habían considerado inicialmente: ratio albúminaCr en orina > 50 y < 3.000 mg/g o proteinuria < 3.000 mg/24 h y trasplante renal realizado en los 10 últimos años.
Criterios de exclusión
Hemoglobina (Hb) < 11 o > 14 g/dl; presión arterial sistólica (PAS) media > 140 mmHg o presión arterial diastólica (PAD) media > 90 mmHg; inicio de tratamiento con bloqueadores del sistema reninaangiotensinaaldosterona (SRAA) en los 3 meses previos al cribado; déficit de hierro evaluado por ferritina sérica e índice de saturación de transferrina; trasplante no renal; infarto agudo de miocardio o accidente cerebrovascular (ACVA) en los 6 meses previos a la inclusión; cardiopatía isquémica grave o inestable; insuficiencia cardíaca crónica clase III o IV de la New York Heart Association; enfermedad inflamatoria sintomática o no controlada; infección aguda o sepsis; proteína C reactiva > 15 mg/l; deficiencia de vitamina B12 o ácido fólico.
- Intervención
De los 426 pacientes cribados, 241 fueron aleatorizados, 235 formaron el grupo de intención de tratar y 159 finalizaron el período de seguimiento de 24 meses.
Grupo de tratamiento
N = 115, 64 DM2 y 51 trasplantados. Dosis inicial de CERA 30 µg/mes, pudiendo aumentarse a 50 o 75 µg/mes para mantener concentración de Hb ± 1,5 g/dl del valor basal, con incremento de dosis si Hb desciende más de 1 g/dl y descenso de dosis si Hb aumenta más de 1 g/dl.
Grupo placebo
N = 120, 71 pacientes con DM2 y 49 trasplantados.
- Variables de resultado
Variable principal
Cambio anual del FGe mediante fórmula MDRD durante el período de seguimiento.
Variables secundarias
Cambio anual del FGe mediante fórmula CKDEPI, cambios en Cr sérica, ratio albúminaCr y cistatina C sérica respecto al valor basal.
- Tamaño muestral
Inicialmente se consideró que debían incluirse 400 pacientes en el estudio, 200 con DM2 y 200 trasplantados, con el fin de conseguir una potencia estadística del 90% para detectar diferencias clínicamente relevantes de 1,5 ml/min/1,73 m2 en la reducción anual del FGe entre los grupos de tratamiento, asumiendo que en el grupo placebo se esperaba encontrar una disminución del FGe de 23 ml/min/1,73 m2 anual. Por dificultades en el reclutamiento, el tamaño muestral tuvo que reducirse a 240 pacientes, limitándose la potencia estadística a un 80%.
- Promoción
D.F. es miembro del consejo asesor de Roche y Amgen. A.W. es empleado de Roche. Varios autores reconocen haber recibido apoyo económico de Jansen, Amgen, Celgene, Hexal, Otsuka y Roche.
- RESULTADOS PRINCIPALES
Análisis basal de los grupos
Los 2 grupos de tratamieto (CERA o placebo) fueron homogéneos en cuanto a sus características basales. También lo fueron los subgrupos de pacientes diabéticos o previamente trasplantados. La edad media en los 2 grupos fue de 63 años, con predominio de varones (el 61,7% en el grupo CERA y el 63,3% en el grupo de placebo). No hubo diferencias entre grupos respecto a la comorbilidad (hipertensión arterial [HTA], hiperuricemia, hiperparatiroidismo secundario, enfermedad arterial coronaria, nefropatía diabética, anemia de origen renal, insuficiencia renal, obesidad). Recibieron tratamiento con bloqueadores del SRAA el 81,7% de los pacientes en el grupo CERA y el 83,3% en el grupo placebo y suplementos de hierro el 9,6% en el grupo CERA y el 9,2% en el grupo placebo. La Hb basal fue de 12,7 g/dl en el grupo CERA y de 13 g/dl en el grupo placebo. El FGe por fórmula MDRD fue de 39,2 ml/min/1,73 m2 en el grupo CERA y de 39,3 ml/min/1,73 m2 en el grupo placebo.
Variable principal
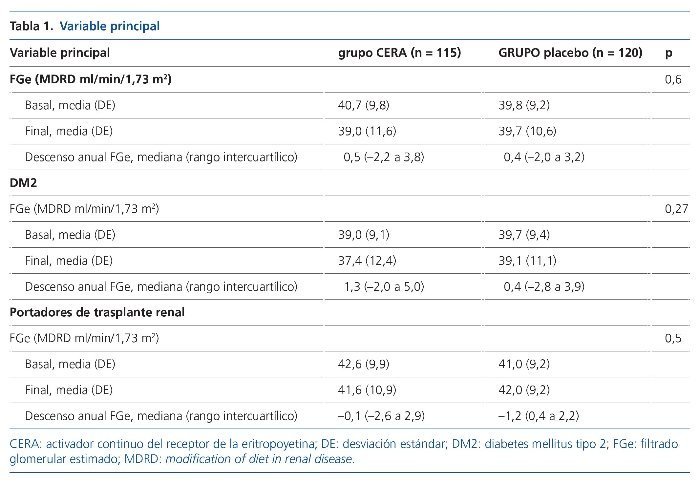
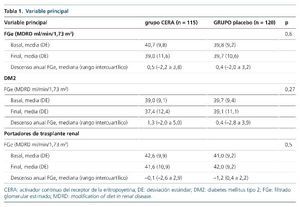
Como viene reflejado en la tabla 1, no se encontraron diferencias en la variable principal del estudio, consistente en el descenso anual del FGe medido mediante fórmula MDRD en el grupo de tratamiento y en el grupo control. Cuando se analizaron los subgrupos de pacientes con DM2 y trasplantados renales, tampoco se observaron diferencias.
Variables secundarias
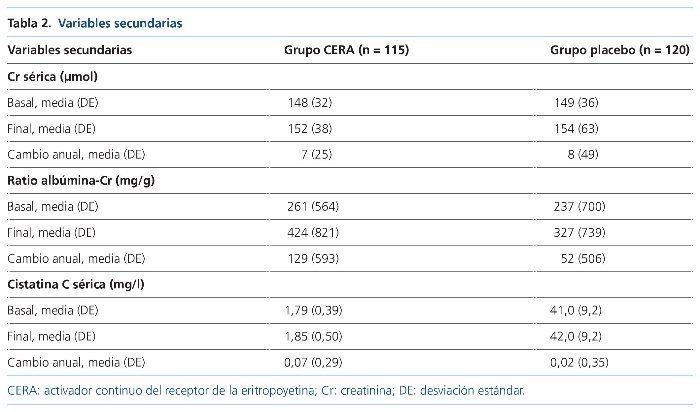
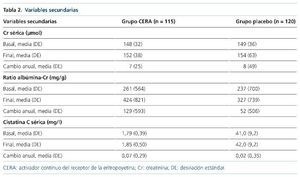
No hubo diferencias en el descenso anual del FGe mediante fórmula CKDEPI, con un descenso de 0,5 (–2,6 a 3,8) en el grupo CERA y de 0,3 (–2,4 a 3,7) en el grupo control (p = 0,7). Tampoco hubo cambios significativos en la Cr sérica, la ratio albúminaCr y la cistatina C en el grupo de tratamiento ni en el grupo control a lo largo del seguimiento (tabla 2).
Efectos secundarios
Se refirieron efectos adversos en un 84,7 % de pacientes en el grupo CERA y en un 86,3% en el grupo placebo, siendo los más frecuentes nasofaringitis, tos, infección del tracto urinario, diarrea, edemas periféricos e HTA. El 22% de los pacientes tratados con CERA y el 16,2% de los pacientes tratados con placebo presentaron efectos adversos que podrían tener relación con el fármaco del estudio. De estos, los más frecuentes en el grupo CERA fueron aumento de Hb (n = 3) e HTA (n = 5). Se produjeron efectos adversos serios que pudieran tener relación con el fármaco en estudio en el 6,8% de pacientes en el grupo CERA (disnea, parada cardíaca, dolor torácico, muerte súbita, amnesia global transitoria, descenso de Hb e insuficiencia renal) y en el 5,1% de pacientes en el grupo placebo (fibrilación auricular, gripe, infección del tracto urinario, adenocarcinoma, lipoma, ACVA y DM2). Los efectos adversos obligaron a abandonar el estudio al 11% de los pacientes en el grupo CERA y al 8,5% de los pacientes en el grupo placebo. La causa más frecuente de abandono fue el aumento de la Hb (2 pacientes en el grupo CERA) y la anemia (3 pacientes en el grupo placebo).
- CONCLUSIONES DE LOS AUTORES
Los pacientes con enfermedad renal crónica (ERC) moderada debida a DM2 o con trasplante renal mostraron una función renal estable durante el período de seguimiento, sin diferencias en la progresión de microalbuminuria entre los grupos. Debido a la ausencia de deterioro de la función renal en el grupo control, no se pueden extraer conclusiones respecto a la existencia o no de un posible efecto renoprotector de los agentes estimuladores de la eritropoyesis (AEE).
- COMENTARIOS DE LOS REVISORES
Se trata de un ensayo clínico con un diseño metodológico correcto, salvo por ciertos sesgos y limitaciones, que se explican a continuación, y que tienen graves consecuencias, ya que no es posible encontrar una respuesta a la pregunta planteada en el estudio, referida a si el tratamiento precoz con AEE podría enlentecer la progresión de la ERC.
En primer lugar, el estudio presenta un sesgo en la selección de los pacientes. Los autores, basándose en estudios publicados13 acerca de los factores que predicen la progresión de la ERC, esperaban encontrar en la muestra obtenida, consistente en pacientes portadores de trasplante renal y en pacientes con DM2, con FGe entre 30 y 59 ml/min/1,73 m2, un descenso en el FGe de 23 ml/ min/1,73 m2 anual. Sin embargo, esta predicción no fue cierta, manteniéndose sin cambios el FGe en el grupo placebo durante el seguimiento, lo que hace imposible poder demostrar un beneficio con la utilización de AEE sobre la progresión de la ERC.
Por otro lado, el tamaño muestral del estudio fue inferior al estimado para conseguir encontrar una diferencia clínicamente significativa de 1,5 ml/min/1,73 m2 en la progresión anual de la ERC entre el grupo de tratamiento y el grupo placebo, con una potencia estadística del 90%. Para conseguir este resultado se consideró que el tamaño muestral debía ser de 400 pacientes, pero debido a dificultades para el reclutamiento, tuvo que reducirse a 240 pacientes, limitándose la potencia estadística del estudio al 80%. Para intentar aumentar el número de pacientes también tuvieron que ampliarse los criterios de inclusión, lo que hizo que la muestra fuese más heterogénea.
Para poder responder a la pregunta planteada en el estudio, los autores proponen en un futuro identificar a los pacientes con un descenso progresivo en el FGe antes de la aleatorización. También sería necesario reclutar un mayor número de pacientes para conseguir una mayor potencia estadística.
- CONCLUSIONES DE LOS REVISORES
Este estudio no permite conocer si el tratamiento precoz con AEE enlentece la progresión de la ERC, debido fundamentalmente a un sesgo en la selección de los pacientes. Para poder responder a la pregunta planteada, sería necesario realizar un nuevo diseño en el que se asegure que los pacientes estudiados presentan un descenso progresivo del FGe, con el fin de analizar el efecto de la intervención en estos pacientes.
- CLASIFICACIÓN
Tema: Progresión de la enfermedad renal crónica
Subespecialidad: Nefrología clínica
Tipo de artículo: Tratamiento
Palabras clave: Ensayo clínico. Progresión de la enfermedad renal crónica. Anemia. Agentes estimuladores de la eritropoyesis
NIVEL DE EVIDENCIA: Bajo
GRADO De RECOMENDACIÓN: Débil —GRADE (www.gradeworkinggroup.org) divide la calidad de la evidencia en 4 grupos: alta, moderada, baja y muy baja, y divide el grado de recomendación en 2 grupos: fuerte y débil—