Las guías KDIGO recomiendan como criterio de remisión a las consultas de ERCA un riesgo >10% de precisar tratamiento renal sustitutivo (TRS) antes de 2años. Este riesgo se debe evaluar con modelos de predicción validados externamente. El modelo de predicción KFRE y el modelo de Grams cumplen estos requisitos. En una unidad de ERCA con un criterio de remisión de FGe <30ml/min, planteamos un estudio de cohortes retrospectivo para evaluar si la aplicación de un KFRE >10% como criterio de remisión permite diferenciar a los pacientes según sus características clínicas y analíticas y su evolución
Pacientes y métodosEstudiamos 573 pacientes seguidos en la consulta de ERCA al menos durante 4años. En la primera consulta los clasificamos en dos grupos según su KFRE a 2años: <10% o ≥10%. Comparamos sus características clínicas y analíticas y si los pronósticos efectuados por el modelo de Grams al inicio se ajustan a la evolución observada. Ambos grupos se han analizado según dos rangos de edad: mayores y menores de 75años.
ResultadosLos pacientes con KFRE ≥10% (53,4%), con respecto a los que tenían KFRE <10%, eran significativamente más jóvenes y su pérdida anual de FGe fue mayor. Tuvieron diferente evolución: a los 2años iniciaron TRS el 38,9% vs el 3% (p<0,05) y permanecieron en la consulta el 45,8% vs el 79,8% (p<0,05), a los 4años iniciaron TRS el 60,7% vs el 15,6% (p<0,05), permanecieron en la consulta el 16,7% vs el 52,3% (p<0,05). En el grupo con KFRE<10% los ≥ 75años frente a los <75años iniciaron TRS y fallecieron previamente en una proporción significativamente diferente a los 2años: 1,2 vs 6,1% y 23,7 vs 6,1%, respectivamente (p<0,05). En el grupo con KFRE ≥10% los ≥75años y los <75años iniciaron TRS y fallecieron previamente en una proporción significativamente diferente a los 2años: 25,9 vs 46,4% y 32,1 vs 5,7%, respectivamente (p<0,05). Los modelos de predicción pronosticaron todas estas diferencias con bastante exactitud.
ConclusionesUn KFRE ≥10% a 2años sería un adecuado criterio de remisión a las consultas de ERCA, ya que seleccionaría un grupo de pacientes que realmente van a precisar TRS a medio plazo, independientemente de su edad, y evitaría la remisión de enfermos con escaso riesgo de precisar TRS, fundamentalmente pacientes de edad avanzada.
The KDIGO guidelines recommend as a criterion for referral to ACKD consultations a risk >10% of requiring renal replacement therapy (RRT) before 2years. This risk should be assessed with externally validated prediction models. The prediction model KFRE and the Grams model meet these requirements. In an ACKD unit with a remission criterion of eGFR <30mL/min, we proposed a retrospective cohort study to evaluate whether the application of a KFRE >10% as a remission criterion allows differentiation of patients according to their clinical and analytical characteristics and their evolution.
Patients and methodsWe studied 573 patients followed in the ACKD clinic for at least 4years. In the first consultation we classified them into two groups according to their 2-year KFRE: <10% or ≥10%. We compared their clinical and analytical characteristics and whether the prognoses made by Grams’ model at baseline matched the observed evolution. Both groups were analysed according to two age ranges: older and younger than 75years.
ResultsPatients with KFRE ≥10% (53.4%), with respect to those with KFRE <10%, were significantly younger and their annual eGFR loss was greater. They had different evolution: at 2years, 38.9% vs 3% (P<.05) started RRT and 45.8% vs 79.8% (P<.05) remained in the clinic; at 4years, 60.7% vs 15.6% (P<.05) started RRT and 16.7% vs 52.3% (P<.05) remained in the clinic. In the group with KFRE<10% those ≥75years vs <75years initiated RRT and died previously in a significantly different proportion at 2years: 1.2 vs 6.1% and 23.7 vs 6.1% respectively (P<.05). In the group with KFRE ≥10% those ≥75years and those <75years initiated RRT and previously died in a significantly different proportion at 2years: 25.9 vs 46.4% and 32.1 vs 5.7%, respectively (P<.05). Prediction models predicted all these differences quite accurately.
ConclusionsA KFRE ≥10% at 2years would be an appropriate criterion for referral to ACKD consultations, since it would select a group of patients who are really going to require RRT in the medium term, regardless of their age, and would avoid the referral of patients at low risk of requiring RRT, mainly elderly patients.
Las guías Kidney Disease Improving Global Outcomes (KDIGO) de 2012 sobre la evaluación y el manejo de la enfermedad renal crónica (ERC) recomendaban clasificar la ERC en diferentes grados, según el filtrado glomerular estimado (FGe) y el cociente microalbuminuria/creatina en orina1. Esta clasificación ha permitido asignar a un grado concreto de ERC un riesgo relativo de desarrollar las diferentes complicaciones que la acompañan. Sin embargo, aunque conozcamos el riesgo relativo de iniciar tratamiento renal sustitutivo (TRS) para un grado concreto de ERC, el riesgo absoluto de iniciar TRS de cada paciente, incluido en ese grado de ERC, oscila entre valores muy amplios.
Por este motivo, la nueva edición de las guías KDIGO de 2024 hace hincapié en la necesidad de individualizar el manejo de los pacientes, no solo por su grado de ERC, sino también por la determinación de su riesgo absoluto de precisar TRS2. En pacientes con ERCG3-G5 se propone, con un grado de recomendación1A, que el riesgo absoluto de precisar TRS sea estimado a través de ecuaciones que hayan sido validadas externamente.
El Kidney Failure Risk Equation (KFRE)3 es el modelo de predicción de inicio de TRS más ampliamente utilizado, debido a su elevada precisión y a su extensa validación en diferentes poblaciones4-6.
La utilización del KFRE como una herramienta válida para pronosticar el inicio del TRS ha permitido que las guías KDIGO recomienden como criterio de remisión a las consultas multidisciplinares de enfermedad renal crónica avanzada (ERCA) un riesgo de iniciar TRS a 2años superior al 10%2. De esta manera se seleccionaría un grupo ideal de pacientes que obtendrían el máximo beneficio de estas consultas altamente especializadas y evitaría la remisión de pacientes con bajo riesgo de progresión que no se beneficiarían de su inclusión precoz en las consultas de ERCA.
El KFRE ha sido validado también en diferentes grupos de edad7, aunque en pacientes de edad avanzada y con elevada mortalidad puede sobreestimar la necesidad de iniciar TRS8.
En las consultas de ERCA los pacientes ancianos son cada vez más prevalentes y su manejo constituye un importante reto, ya que a medida que aumenta la edad, el riesgo de fallecer supera al de precisar TRS, incluso en grados de ERC muy avanzados9. Se ha descrito que, por encima de 75años, la mayoría de los pacientes con ERC en estadioIV tienen más riesgo de fallecer que de iniciar TRS10,11.
El modelo de predicción de Grams12 también es un modelo validado que, además de predecir la entrada en TRS, nos aporta una estimación del riesgo de mortalidad que puede ser útil para orientar el manejo en poblaciones con elevada mortalidad como son los pacientes con ERC G4+ de avanzada edad y elevada comorbilidad6,13,14.
El objetivo de este estudio es evaluar las consecuencias de utilizar como criterio de derivación a la consulta de ERCA un umbral de riesgo del 10% de precisar TRS a 2años estimado por KFRE. Para ello, se comparó la evolución de los pacientes con un KFRE superior e inferior al 10%, considerando sus grupos etarios. Asimismo, se analizó si las predicciones pronósticas del modelo de Grams se cumplían en cada uno de estos grupos.
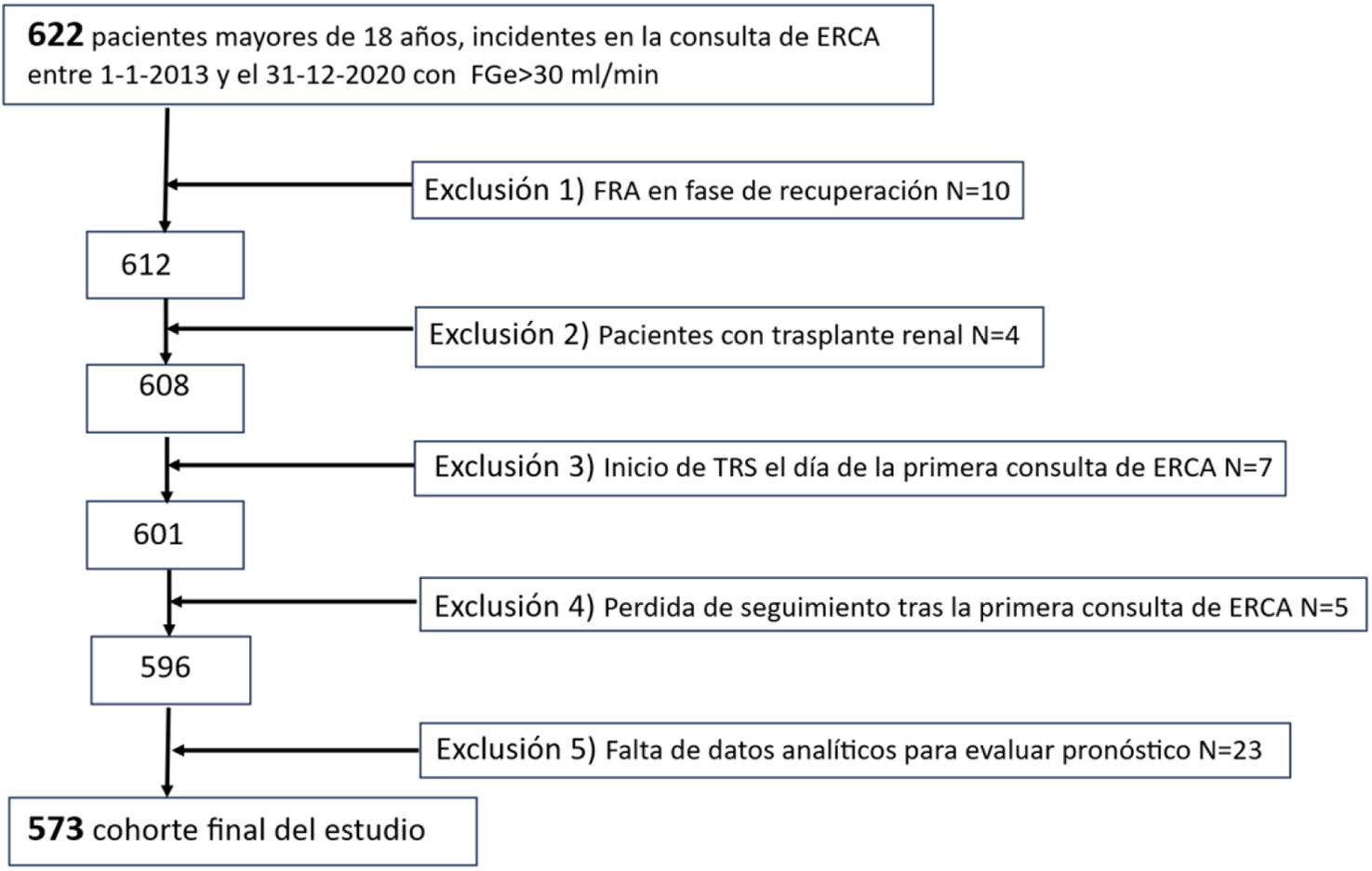
Población y métodosPoblacionSe realizó un estudio de cohortes retrospectivo en pacientes adultos (mayores de 18años) remitidos a la consulta de ERCA del Hospital Universitario Fundación Alcorcón entre el 1 de enero de 2013 y el 31 de diciembre de 2020. El seguimiento de los pacientes se prolongó hasta el 31 de diciembre de 2024, garantizando un tiempo mínimo de seguimiento de 4años.
Criterios de inclusiónSe incluyeron todos los pacientes incidentes en la consulta de ERCA durante el periodo mencionado, mayores de 18años, que presentaban un FGe <30ml/min.
Criterios de exclusiónSe excluyeron del estudio los siguientes casos:
- 1.
Pacientes remitidos tras un episodio de fracaso renal agudo que recuperaron la función renal hasta alcanzar un FGe >30ml/min.
- 2.
Pacientes trasplantados con disfunción renal, derivados para iniciar TRS.
- 3.
Pacientes que iniciaron TRS el mismo día de su primera consulta en ERCA.
- 4.
Pacientes con pérdida de seguimiento tras la primera consulta.
- 5.
Pacientes sin datos analíticos suficientes para realizar cálculos pronósticos sobre su evolución.
Cumplieron los criterios de inclusión 622 pacientes; de ellos, 49 fueron excluidos por cumplir alguno de los criterios mencionados. Por tanto, la población final del estudio quedó constituida por 573 pacientes. El diagrama de flujo de la población se presenta en la figura 1.
Diseño del estudioSe trata de un estudio de cohortes retrospectivo en el que se analizan diferentes variables clínicas, analíticas y evolutivas de las revisiones efectuadas en las consultas de ERCA y que son recogidas en una base de datos en cada revisión.
Recogida de datos clínicos y seguimientoEn la primera consulta se registraron los datos de filiación y las características clínicas de los pacientes, incluyendo edad, sexo, etiología de la ERC, antecedentes de patología cardiovascular (ictus, cardiopatía isquémica, insuficiencia cardiaca y enfermedad vascular periférica), diabetes mellitus, antecedentes de tabaquismo y otras comorbilidades necesarias para el cálculo del índice de Charlson. Asimismo, se tomaron las cifras de presión arterial en consulta, el índice de masa corporal (IMC) y los parámetros analíticos básicos, clasificando a los pacientes según el estadio de ERC.
La frecuencia de las consultas se ajustó principalmente en función de la evolución clínica del paciente, los cambios en los síntomas y los valores de FGe, a criterio del médico responsable. En los pacientes con ERC estadio G4A1 se aseguró un mínimo de tres visitas al año, conforme a las recomendaciones de las guías KDIGO1.
En las consultas de seguimiento se recogieron de forma sistemática los resultados analíticos, las cifras de presión arterial, el IMC y los eventos clínicos relevantes. La seriación de los valores de FGe en cada revisión permitió calcular la velocidad de progresión del deterioro renal en cada paciente, mediante una regresión lineal simple utilizando el método de mínimos cuadrado
Eventos evolutivosSe consideraron los siguientes desenlaces clínicos en la evolución de los pacientes atendidos en la consulta de ERCA:
Fracaso renal, definido como el inicio de TRS, ya sea mediante hemodiálisis, diálisis peritoneal o la realización de un trasplante renal preventivo.
Fallecimiento, tanto si se produjo antes como después del inicio del TRS.
Permanencia en la consulta de ERCA, sin requerir TRS ni haber fallecido antes de iniciar el TRS.
Estos eventos evolutivos se registraron a los 2, 4 y 5años desde la fecha de ingreso en la consulta de ERCA, con el objetivo de evaluar los distintos modelos predictivos de evolución.
Modelos predictivos de evoluciónEn la primera consulta se aplicaron dos modelos de predicción pronóstica para estimar la evolución clínica de los pacientes: el modelo KFRE con 4 variables, calibrado para población no norteamericana, a 2 y 5años, y el modelo de Grams, aplicado a 2 y 4años.
El modelo KFRE estima la probabilidad de requerir TRS en un plazo de 2 o 5años en pacientes con un FGe <60ml/min. Se utilizó la versión ajustada para poblaciones no norteamericanas, desarrollada por el grupo de Tangri3, que emplea cuatro variables: edad (en años), sexo, FGe (calculado mediante la fórmula CKD-EPI, en ml/min) y el cociente albúmina/creatinina en orina (mg/g).
El modelo de Grams se aplica a pacientes con FGe <30ml/min y ofrece una predicción más detallada, estimando las probabilidades de iniciar TRS, fallecer antes de iniciar TRS, permanecer con ERC sin iniciar TRS ni fallecer o fallecer tras el inicio del TRS. El pronóstico se calcula para horizontes temporales de 2 y 4años. Las variables incluidas en el modelo son: edad, sexo, raza, FGe, presión arterial sistólica, antecedentes de enfermedad cardiovascular, diabetes mellitus, cociente albúmina/creatinina en orina y antecedentes de tabaquismo. Las probabilidades individuales se calcularon mediante las fórmulas multinomiales proporcionadas por el grupo de Grams12.
Según el resultado del KFRE a 2años, los pacientes incidentes se clasificaron en dos grupos según su riesgo de requerir TRS: bajo riesgo (KFRE <10%) y alto riesgo (KFRE ≥10%).
Posteriormente, se compararon sus características clínicas y analíticas, el pronóstico inicial y la evolución observada, con el objetivo de valorar si este umbral de riesgo es adecuado como criterio de derivación a la consulta de ERCA. Además, ambos grupos se subdividieron según la edad (<75años y ≥75años), para analizar si la edad modifica la evolución o la precisión del modelo predictivo.
Aprobación éticaEl estudio se llevó a cabo conforme a los principios éticos establecidos en la Declaración de Helsinki y fue aprobado por el Comité de Ética de la Investigación Clínica del Hospital Universitario Fundación Alcorcón (Alcorcón, Madrid, España) con el número de referencia 22/157. Dado el carácter retrospectivo del estudio y la elevada proporción de pacientes que ya no se encontraban en seguimiento, ya fuera por fallecimiento o por haber iniciado TRS (diálisis o trasplante) en otros centros, el comité ético eximió de la obtención de consentimiento informado.
Análisis estadísticoLas variables continuas se expresaron como media ±desviación estándar cuando presentaban una distribución normal, o como mediana y rango intercuartílico en caso de distribución no normal. Las variables categóricas se presentaron como frecuencias absolutas y porcentajes. La normalidad de las variables continuas se comprobó mediante el test de Kolmogorov-Smirnov. Para la comparación de medias se utilizó la prueba t de Student en caso de distribución normal, y la prueba de Mann-Whitney cuando la distribución no era normal. Las variables categóricas se compararon mediante la prueba de chi-cuadrado. Se consideró estadísticamente significativo un valor de p<0,05.
Para evaluar el rendimiento de los modelos predictivos se realizó un análisis de discriminación tanto del modelo KFRE (a 2 y 5años) como del modelo de Grams (a 2 y 4años), considerando como eventos el inicio de TRS, la permanencia en la consulta de ERCA sin TRS ni fallecimiento, y el fallecimiento antes del inicio de TRS. La capacidad discriminativa de cada modelo se evaluó mediante el área bajo la curva ROC (AUC o C-statistic), con su correspondiente intervalo de confianza del 95%. Se consideró una discriminación aceptable si el AUC era ≥0,70, y excelente si era ≥0,80. La calibración de los modelos, es decir, el grado de concordancia entre las probabilidades pronosticadas y los eventos observados, se analizó mediante el test de Hosmer-Lemeshow15.
El análisis estadístico se realizó utilizando el software IBM SPSS Statistics para Windows, versión 22.0 (IBM Corp., Armonk, NY, EE.UU.).
Para estimar la pérdida anual de función renal, se calculó la pendiente de la regresión lineal del FGe en función del tiempo de seguimiento en la consulta de ERCA. Esta pendiente representa el cambio anual estimado del FGe, obtenido mediante un modelo de regresión lineal por mínimos cuadrados, incluyendo todas las determinaciones de FGe realizadas durante el seguimiento ambulatorio, siguiendo las recomendaciones de diversos autores16-18.
Se excluyeron del análisis las determinaciones realizadas durante ingresos hospitalarios. Asimismo, no se incluyeron en el análisis siete pacientes que contaban con menos de cuatro determinaciones válidas de FGe. En total, se analizaron 566 pendientes de regresión, con un número medio de determinaciones por paciente de 12,64±6,45. De ellas, 502 (88,7%) mostraron una pendiente negativa, lo que indica pérdida de función renal durante el periodo de seguimiento.
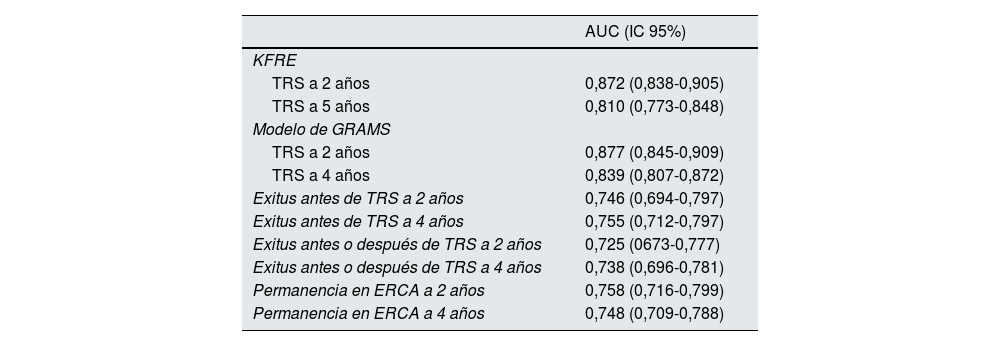
ResultadosEvaluación del rendimiento de los modelos predictivosEn la tabla 1 se muestra la discriminación de los dos modelos predictivos calculando el área bajo la curva ROC con un intervalo de confianza del 95%. La predicción del inicio de TRS a 2años por los dos modelos presenta una discriminación excelente con AUC de 0,87, la discriminación a 4 y 5años disminuye, aunque sigue siendo >0,8. En la predicción de la muerte antes de iniciar TRS y de la permanencia en ERCA realizadas por el modelo de Grams se mantiene un AUC aceptable, en torno a 0,75. Estos valores son similares a los reportados en la literatura8,13,14.
Discriminación del KFRE con 4 variables a 2 y 5años y del modelo de Grams a 2 y 4años
| AUC (IC 95%) | |
|---|---|
| KFRE | |
| TRS a 2 años | 0,872 (0,838-0,905) |
| TRS a 5 años | 0,810 (0,773-0,848) |
| Modelo de GRAMS | |
| TRS a 2 años | 0,877 (0,845-0,909) |
| TRS a 4 años | 0,839 (0,807-0,872) |
| Exitus antes de TRS a 2 años | 0,746 (0,694-0,797) |
| Exitus antes de TRS a 4 años | 0,755 (0,712-0,797) |
| Exitus antes o después de TRS a 2 años | 0,725 (0673-0,777) |
| Exitus antes o después de TRS a 4 años | 0,738 (0,696-0,781) |
| Permanencia en ERCA a 2 años | 0,758 (0,716-0,799) |
| Permanencia en ERCA a 4 años | 0,748 (0,709-0,788) |
TRS: tratamiento renal sustitutivo; ERCA: enfermedad renal crónica avanzada.
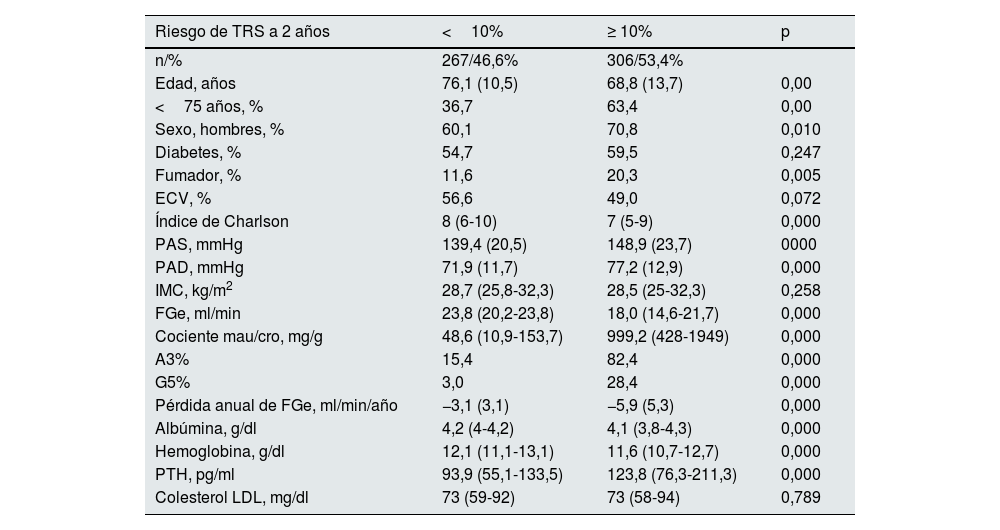
Al llegar a la consulta de ERCA, 267 pacientes (46,6%) tenían un KFRE <10% y fueron clasificados como pacientes con bajo riesgo de iniciar TRS; los otros 306 (53,4%) tenían un KFRE ≥10% y se les clasificó como pacientes con alto riesgo de iniciar TRS. Los pacientes con bajo riesgo comparados con los de alto riesgo eran significativamente más ancianos, con un Índice de Charlson mayor, eran menos fumadores y menos hipertensos; su FGe era mayor, mientras que su proteinuria y el deterioro anual de su FGe eran significativamente menores (tabla 2).
Comparación de las características clínicas y analíticas al inicio del seguimiento en la consulta de ERCA de los pacientes con un riego de iniciar TRS en 2años (estimado por KFRE con cuatro variables) menor al 10% frente a los que tiene un riesgo igual o superior al 10%
| Riesgo de TRS a 2 años | <10% | ≥ 10% | p |
|---|---|---|---|
| n/% | 267/46,6% | 306/53,4% | |
| Edad, años | 76,1 (10,5) | 68,8 (13,7) | 0,00 |
| <75 años, % | 36,7 | 63,4 | 0,00 |
| Sexo, hombres, % | 60,1 | 70,8 | 0,010 |
| Diabetes, % | 54,7 | 59,5 | 0,247 |
| Fumador, % | 11,6 | 20,3 | 0,005 |
| ECV, % | 56,6 | 49,0 | 0,072 |
| Índice de Charlson | 8 (6-10) | 7 (5-9) | 0,000 |
| PAS, mmHg | 139,4 (20,5) | 148,9 (23,7) | 0000 |
| PAD, mmHg | 71,9 (11,7) | 77,2 (12,9) | 0,000 |
| IMC, kg/m2 | 28,7 (25,8-32,3) | 28,5 (25-32,3) | 0,258 |
| FGe, ml/min | 23,8 (20,2-23,8) | 18,0 (14,6-21,7) | 0,000 |
| Cociente mau/cro, mg/g | 48,6 (10,9-153,7) | 999,2 (428-1949) | 0,000 |
| A3% | 15,4 | 82,4 | 0,000 |
| G5% | 3,0 | 28,4 | 0,000 |
| Pérdida anual de FGe, ml/min/año | −3,1 (3,1) | −5,9 (5,3) | 0,000 |
| Albúmina, g/dl | 4,2 (4-4,2) | 4,1 (3,8-4,3) | 0,000 |
| Hemoglobina, g/dl | 12,1 (11,1-13,1) | 11,6 (10,7-12,7) | 0,000 |
| PTH, pg/ml | 93,9 (55,1-133,5) | 123,8 (76,3-211,3) | 0,000 |
| Colesterol LDL, mg/dl | 73 (59-92) | 73 (58-94) | 0,789 |
A3: pacientes con cociente microalbuminuria/creatina en orina (mau/cro) >300mg/g; EVC: enfermedad cardiovascular; G5 pacientes con FGe por CKD-EPI <15ml/min; PAS: presión arterial sistólica; PAD: presión arterial diastólica; IMC: índice de masa corporal; FGe: filtrado glomerular estimado; PTH: paratohormona.
Los datos se muestran como media (desviación estándar), mediana (rango intercuartílico) o número y porcentaje.
Pérdida anual de FGe expresada como la media de la pérdida de FGe en los enfermos que perdieron FGe durante el seguimiento (en el grupo con bajo riesgo el 81,2% perdieron FGe durante el seguimiento, y en el grupo de alto riesgo lo perdieron el 95% de los pacientes).
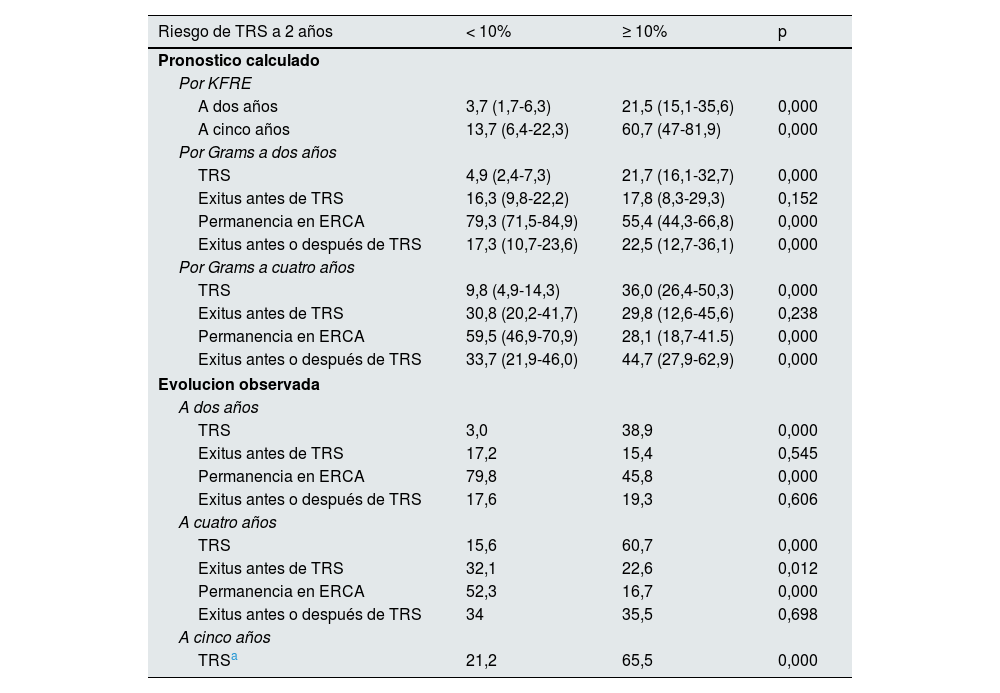
La evolución observada a los 2, 4 y 5años de los pacientes con bajo riesgo frente a los de alto riesgo es significativamente diferente (tabla 3): a los 2años iniciaron TRS el 3% vs el 38,9% (p<0,05), mientras que a los 4años permanecían en la consulta de ERCA el 52,3% vs el 16,7% (p<0,05) y habían fallecido antes de iniciar TRS el 32,1% vs el 22,6% (p<0,05).
Comparación del pronóstico que tenían al inicio del seguimiento en la consulta de ERCA los pacientes con un riego de iniciar TRS en 2años menor al 10% frente a los que tenían un riesgo igual o superior al 10%. También comparamos la evolución observada a 2, 4 y 5años de los pacientes de ambos grupos
| Riesgo de TRS a 2 años | < 10% | ≥ 10% | p |
|---|---|---|---|
| Pronostico calculado | |||
| Por KFRE | |||
| A dos años | 3,7 (1,7-6,3) | 21,5 (15,1-35,6) | 0,000 |
| A cinco años | 13,7 (6,4-22,3) | 60,7 (47-81,9) | 0,000 |
| Por Grams a dos años | |||
| TRS | 4,9 (2,4-7,3) | 21,7 (16,1-32,7) | 0,000 |
| Exitus antes de TRS | 16,3 (9,8-22,2) | 17,8 (8,3-29,3) | 0,152 |
| Permanencia en ERCA | 79,3 (71,5-84,9) | 55,4 (44,3-66,8) | 0,000 |
| Exitus antes o después de TRS | 17,3 (10,7-23,6) | 22,5 (12,7-36,1) | 0,000 |
| Por Grams a cuatro años | |||
| TRS | 9,8 (4,9-14,3) | 36,0 (26,4-50,3) | 0,000 |
| Exitus antes de TRS | 30,8 (20,2-41,7) | 29,8 (12,6-45,6) | 0,238 |
| Permanencia en ERCA | 59,5 (46,9-70,9) | 28,1 (18,7-41.5) | 0,000 |
| Exitus antes o después de TRS | 33,7 (21,9-46,0) | 44,7 (27,9-62,9) | 0,000 |
| Evolucion observada | |||
| A dos años | |||
| TRS | 3,0 | 38,9 | 0,000 |
| Exitus antes de TRS | 17,2 | 15,4 | 0,545 |
| Permanencia en ERCA | 79,8 | 45,8 | 0,000 |
| Exitus antes o después de TRS | 17,6 | 19,3 | 0,606 |
| A cuatro años | |||
| TRS | 15,6 | 60,7 | 0,000 |
| Exitus antes de TRS | 32,1 | 22,6 | 0,012 |
| Permanencia en ERCA | 52,3 | 16,7 | 0,000 |
| Exitus antes o después de TRS | 34 | 35,5 | 0,698 |
| A cinco años | |||
| TRSa | 21,2 | 65,5 | 0,000 |
TRS: tratamiento renal sustitutivo; ERCA: enfermedad renal crónica avanzada.
Se excluyen los pacientes que no han llegado a 5años de seguimiento (los incidentes en la consulta de ERCA en 2020). Por tanto, se efectúa el cálculo en 498 pacientes, 231 con riesgo <10 y 267 con riesgo ≥10.
Las estimaciones pronósticas se presentan como mediana (rango intercuartílico), y las evoluciones observadas, como porcentajes.
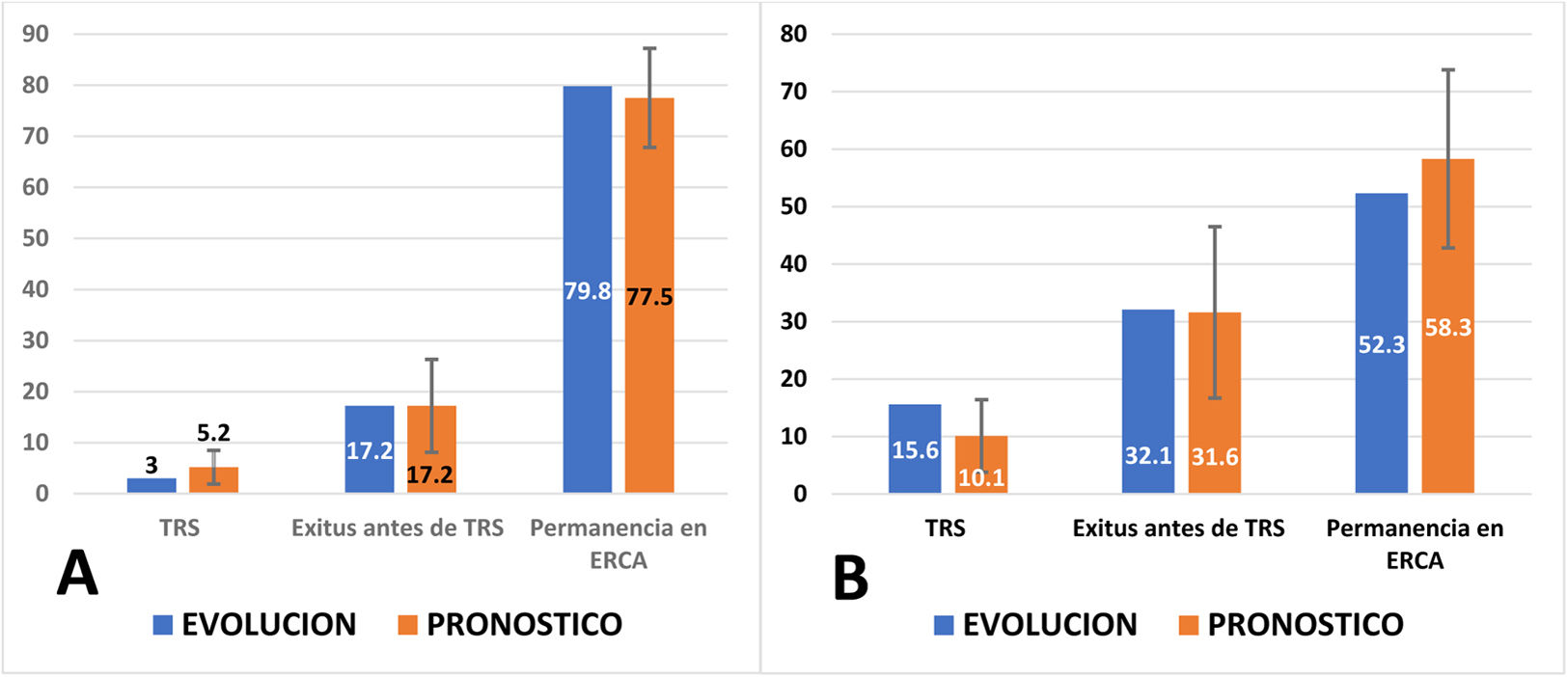
Esta diferente evolución había sido pronosticada por los modelos de predicción, de una forma bastante precisa (tabla 3). En la figura 2 se representa, en los enfermos con bajo riesgo, la evolución observada a 2 y 4años, con el pronóstico efectuado por el modelo de Grams al llegar a la consulta de ERCA para los mismos periodos. El modelo muestra una buena capacidad predictiva para el inicio de TRS, la permanencia en ERCA o la muerte antes de iniciar TRS. La principal discrepancia se aprecia en el inicio de TRS a los 4años, posiblemente atribuible a la inclusión en el grupo de bajo riesgo de pacientes con poliquistosis renal autosómica dominante (PQRAD). Estos pacientes, al presentar una nefropatía no proteinúrica, son clasificados de bajo riesgo por el modelo, aunque en la práctica requieren TRS en un elevado porcentaje. Si excluyéramos a estos pacientes, la relación de inicio de TRS a los 4años sería del 11,3% observado frente al 9,6% pronosticado.
Evolución observada y pronóstico inicial según el modelo de Grams a 2años (A) y a los 4años (B) en los pacientes con riesgo <10% de iniciar TRS.
El pronóstico calculado (variable cuantitativa) se expresa como una media y se ha representado su desviación estándar. La evolución observada (variable cualitativa) representa el porcentaje de pacientes en cada categoría.
Test de Hosmer-Lemeshow para comparar la bondad del ajuste entre pronóstico calculado y evolución observada (cuanto más próximo a 1 sea la p, mejor es el ajuste; si p<0,05, el ajuste no es significativo). A)TRS: p=0,523; exitus antes de TRS: p=0,933; permanencia en ERCA: p=0,189. B)TRS: p=0,516; exitus antes de TRS: p=0,392; permanencia en ERCA: p=0,023.
TRS: tratamiento renal sustitutivo; ERCA: enfermedad renal crónica avanzada.
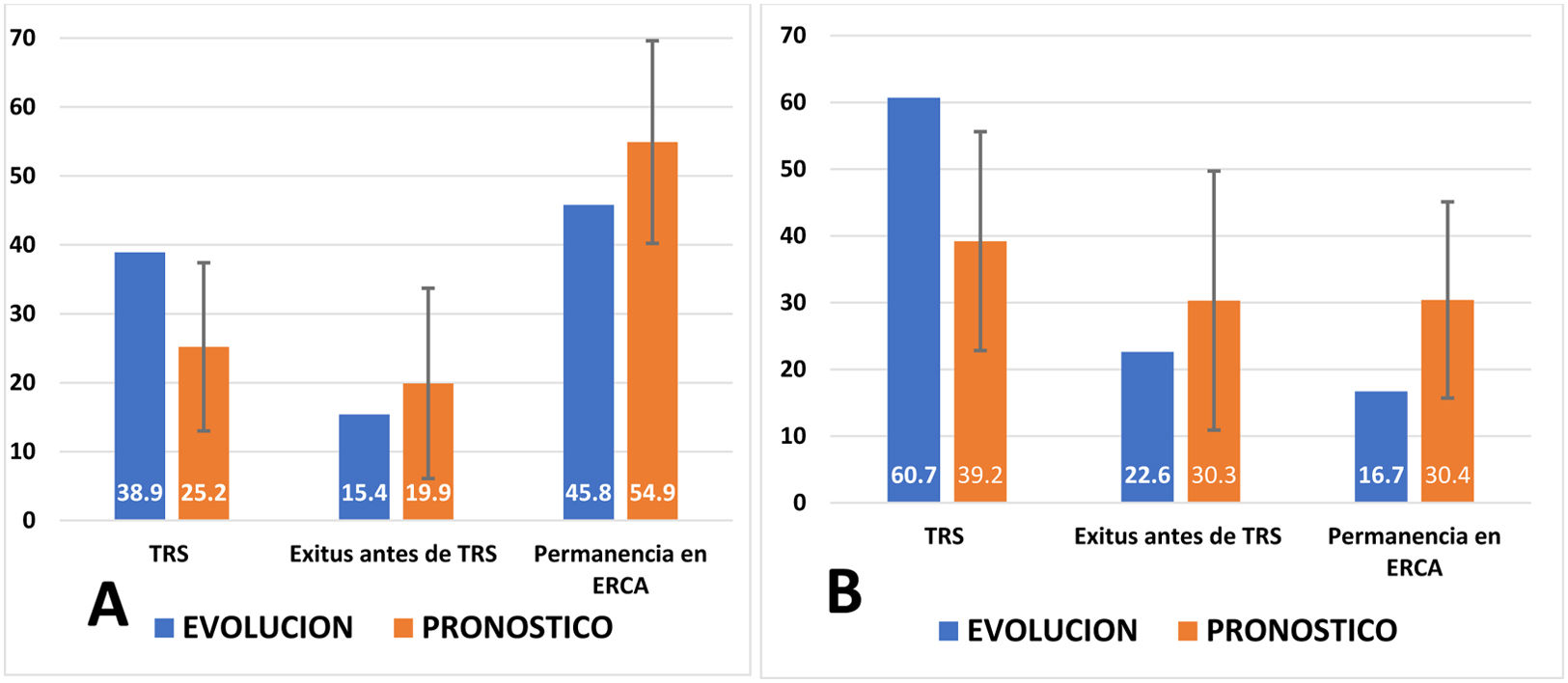
Cuando el riesgo de iniciar TRS es elevado, la concordancia entre pronóstico estimado y la evolución observada no es tan precisa (fig. 3). El porcentaje que inicia TRS es muy superior al pronosticado por el modelo de Grams y aumenta con los años. A los 2años la predicción de iniciar TRS era del 25,2%; sin embargo, iniciaron TRS el 38,9%. A los 4años aumento la diferencia: 39,2% pronosticado frente al 60,7% observado. La mortalidad observada fue siempre inferior a la pronosticada.
Evolución observada y pronóstico inicial según el modelo de Grams a 2años (A) y a los 4años (B) en los pacientes con riesgo ≥10% de iniciar TRS.
El pronóstico calculado (variable cuantitativa) se expresa como una media y se ha representado su desviación estándar. La evolución observada (variable cualitativa) representa el porcentaje de pacientes en cada categoría.
Test de Hosmer-Lemeshow para comparar la bondad del ajuste entre pronóstico calculado y evolución observada (cuanto más próximo a 1 sea la p, mejor es el ajuste; si p<0,05, el ajuste no es significativo). A)TRS: p=0,813; exitus antes de TRS: p=0,620; permanencia en ERCA: p=0,207. B)TRS: p=0,703; exitus antes de TRS: p=0556; permanencia en ERCA: p=0,047.
TRS: tratamiento renal sustitutivo; ERCA: enfermedad renal crónica avanzada.
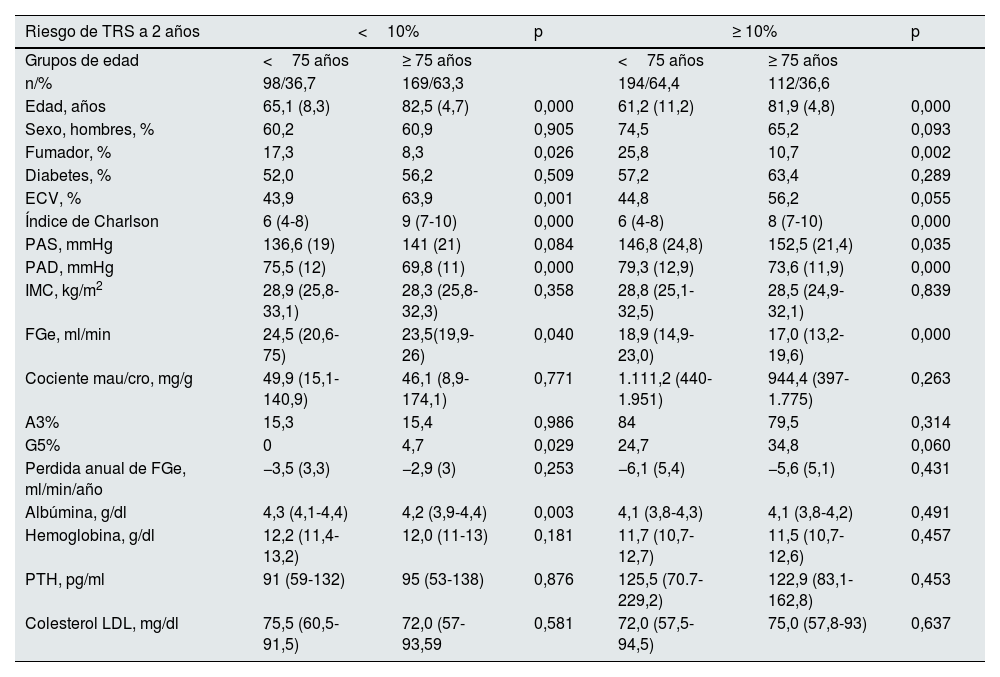
Entre los pacientes con bajo riesgo de iniciar TRS, los ≥75años tienen más comorbilidad cardiovascular, mayor índice de Charlson y son menos fumadores, su situación analítica es similar a la de los pacientes <75 años, con una velocidad de deterioro del FGe parecida, y fueron remitidos a ERCA con FGe menores (tabla 4). En cuanto a su evolución (tabla 5), su mortalidad antes de llegar a precisar TRS es elevada (23,7% a los 2años), con escasa necesidad de iniciar TRS (1,2% a 2 años), mientras que los pacientes <75años tienen una mortalidad y necesidad de TRS significativamente diferente (mortalidad pre TRS a 2años 6,1% y TRS 6,1%). Esta evolución había sido pronosticada de forma bastante aproximada por los modelos de predicción (tabla 5).
Comparación de las características clínicas y analíticas al inicio del seguimiento en la consulta de ERCA de los pacientes con un riego de iniciar TRS en 2años menor o mayor del 10%, calculado por KFRE con cuatro variables, según el grupo de edad al que pertenezcan: menores o mayores de 75años
| Riesgo de TRS a 2 años | <10% | p | ≥ 10% | p | ||
|---|---|---|---|---|---|---|
| Grupos de edad | <75 años | ≥ 75 años | <75 años | ≥ 75 años | ||
| n/% | 98/36,7 | 169/63,3 | 194/64,4 | 112/36,6 | ||
| Edad, años | 65,1 (8,3) | 82,5 (4,7) | 0,000 | 61,2 (11,2) | 81,9 (4,8) | 0,000 |
| Sexo, hombres, % | 60,2 | 60,9 | 0,905 | 74,5 | 65,2 | 0,093 |
| Fumador, % | 17,3 | 8,3 | 0,026 | 25,8 | 10,7 | 0,002 |
| Diabetes, % | 52,0 | 56,2 | 0,509 | 57,2 | 63,4 | 0,289 |
| ECV, % | 43,9 | 63,9 | 0,001 | 44,8 | 56,2 | 0,055 |
| Índice de Charlson | 6 (4-8) | 9 (7-10) | 0,000 | 6 (4-8) | 8 (7-10) | 0,000 |
| PAS, mmHg | 136,6 (19) | 141 (21) | 0,084 | 146,8 (24,8) | 152,5 (21,4) | 0,035 |
| PAD, mmHg | 75,5 (12) | 69,8 (11) | 0,000 | 79,3 (12,9) | 73,6 (11,9) | 0,000 |
| IMC, kg/m2 | 28,9 (25,8-33,1) | 28,3 (25,8-32,3) | 0,358 | 28,8 (25,1-32,5) | 28,5 (24,9-32,1) | 0,839 |
| FGe, ml/min | 24,5 (20,6-75) | 23,5(19,9-26) | 0,040 | 18,9 (14,9-23,0) | 17,0 (13,2-19,6) | 0,000 |
| Cociente mau/cro, mg/g | 49,9 (15,1-140,9) | 46,1 (8,9-174,1) | 0,771 | 1.111,2 (440-1.951) | 944,4 (397-1.775) | 0,263 |
| A3% | 15,3 | 15,4 | 0,986 | 84 | 79,5 | 0,314 |
| G5% | 0 | 4,7 | 0,029 | 24,7 | 34,8 | 0,060 |
| Perdida anual de FGe, ml/min/año | −3,5 (3,3) | −2,9 (3) | 0,253 | −6,1 (5,4) | −5,6 (5,1) | 0,431 |
| Albúmina, g/dl | 4,3 (4,1-4,4) | 4,2 (3,9-4,4) | 0,003 | 4,1 (3,8-4,3) | 4,1 (3,8-4,2) | 0,491 |
| Hemoglobina, g/dl | 12,2 (11,4-13,2) | 12,0 (11-13) | 0,181 | 11,7 (10,7-12,7) | 11,5 (10,7-12,6) | 0,457 |
| PTH, pg/ml | 91 (59-132) | 95 (53-138) | 0,876 | 125,5 (70.7-229,2) | 122,9 (83,1-162,8) | 0,453 |
| Colesterol LDL, mg/dl | 75,5 (60,5-91,5) | 72,0 (57-93,59 | 0,581 | 72,0 (57,5-94,5) | 75,0 (57,8-93) | 0,637 |
Los datos se muestran como media (desviación estándar), mediana (rango intercuartílico), o número y porcentaje.
A3: pacientes con cociente microalbuminuria/creatina en orina (mau/cro) >300mg/g; EVC: enfermedad cardiovascular; G5 pacientes con FGe por CKD-EPI <15ml/min; PAS: presión arterial sistólica; PAD: presión arterial diastólica; IMC: índice de masa corporal; FGe: filtrado glomerular estimado; PTH: paratohormona.
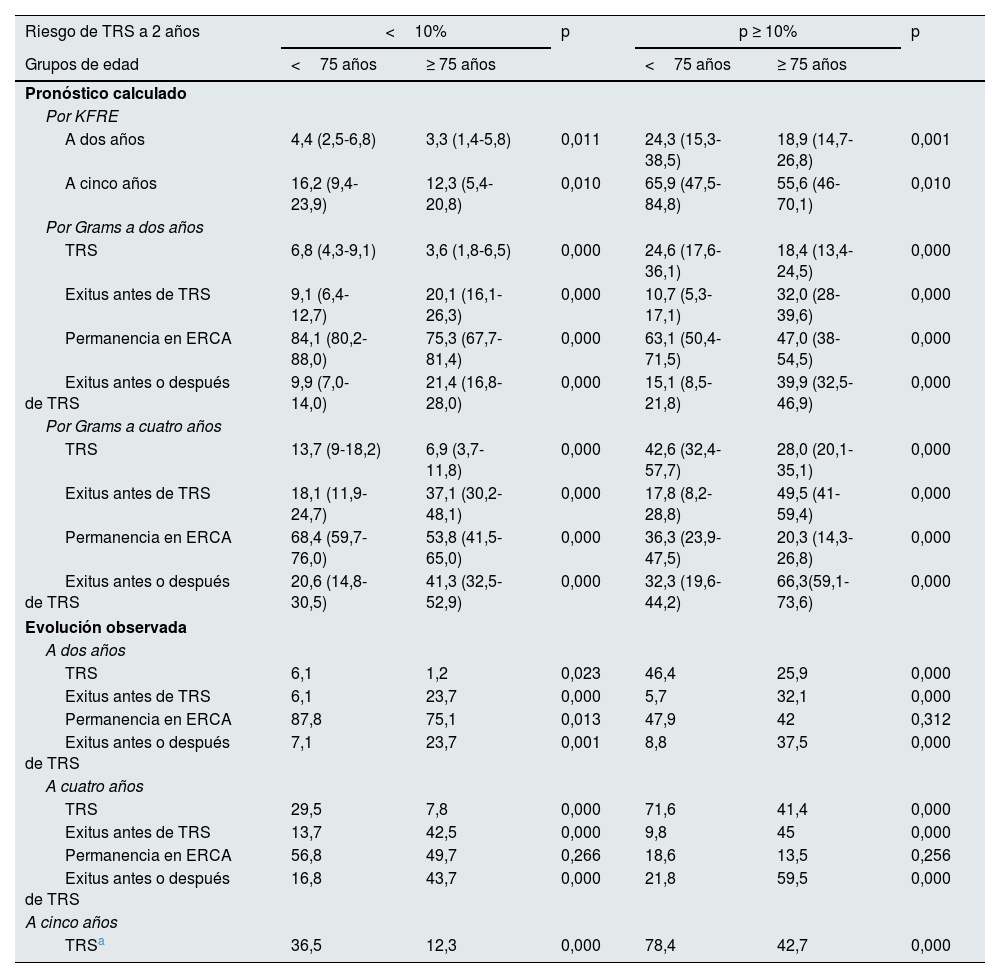
Comparamos el pronóstico que tenían al inicio del seguimiento en la consulta de ERCA los pacientes menores o mayores de 75años, según el grupo de riesgo al que pertenecían, de iniciar TRS en 2años estimados por KFRE con cuatro variables. También comparamos la evolución observada a 2, 4 y 5años de los pacientes de los respectivos grupos
| Riesgo de TRS a 2 años | <10% | p | p ≥ 10% | p | ||
|---|---|---|---|---|---|---|
| Grupos de edad | <75 años | ≥ 75 años | <75 años | ≥ 75 años | ||
| Pronóstico calculado | ||||||
| Por KFRE | ||||||
| A dos años | 4,4 (2,5-6,8) | 3,3 (1,4-5,8) | 0,011 | 24,3 (15,3-38,5) | 18,9 (14,7-26,8) | 0,001 |
| A cinco años | 16,2 (9,4-23,9) | 12,3 (5,4-20,8) | 0,010 | 65,9 (47,5-84,8) | 55,6 (46-70,1) | 0,010 |
| Por Grams a dos años | ||||||
| TRS | 6,8 (4,3-9,1) | 3,6 (1,8-6,5) | 0,000 | 24,6 (17,6-36,1) | 18,4 (13,4-24,5) | 0,000 |
| Exitus antes de TRS | 9,1 (6,4-12,7) | 20,1 (16,1-26,3) | 0,000 | 10,7 (5,3-17,1) | 32,0 (28-39,6) | 0,000 |
| Permanencia en ERCA | 84,1 (80,2-88,0) | 75,3 (67,7-81,4) | 0,000 | 63,1 (50,4-71,5) | 47,0 (38-54,5) | 0,000 |
| Exitus antes o después de TRS | 9,9 (7,0-14,0) | 21,4 (16,8-28,0) | 0,000 | 15,1 (8,5-21,8) | 39,9 (32,5-46,9) | 0,000 |
| Por Grams a cuatro años | ||||||
| TRS | 13,7 (9-18,2) | 6,9 (3,7-11,8) | 0,000 | 42,6 (32,4-57,7) | 28,0 (20,1-35,1) | 0,000 |
| Exitus antes de TRS | 18,1 (11,9-24,7) | 37,1 (30,2-48,1) | 0,000 | 17,8 (8,2-28,8) | 49,5 (41-59,4) | 0,000 |
| Permanencia en ERCA | 68,4 (59,7-76,0) | 53,8 (41,5-65,0) | 0,000 | 36,3 (23,9-47,5) | 20,3 (14,3-26,8) | 0,000 |
| Exitus antes o después de TRS | 20,6 (14,8-30,5) | 41,3 (32,5-52,9) | 0,000 | 32,3 (19,6-44,2) | 66,3(59,1-73,6) | 0,000 |
| Evolución observada | ||||||
| A dos años | ||||||
| TRS | 6,1 | 1,2 | 0,023 | 46,4 | 25,9 | 0,000 |
| Exitus antes de TRS | 6,1 | 23,7 | 0,000 | 5,7 | 32,1 | 0,000 |
| Permanencia en ERCA | 87,8 | 75,1 | 0,013 | 47,9 | 42 | 0,312 |
| Exitus antes o después de TRS | 7,1 | 23,7 | 0,001 | 8,8 | 37,5 | 0,000 |
| A cuatro años | ||||||
| TRS | 29,5 | 7,8 | 0,000 | 71,6 | 41,4 | 0,000 |
| Exitus antes de TRS | 13,7 | 42,5 | 0,000 | 9,8 | 45 | 0,000 |
| Permanencia en ERCA | 56,8 | 49,7 | 0,266 | 18,6 | 13,5 | 0,256 |
| Exitus antes o después de TRS | 16,8 | 43,7 | 0,000 | 21,8 | 59,5 | 0,000 |
| A cinco años | ||||||
| TRSa | 36,5 | 12,3 | 0,000 | 78,4 | 42,7 | 0,000 |
TRS: tratamiento renal sustitutivo; ERCA: enfermedad renal crónica avanzada.
Se excluyen los pacientes que no han llegado a 5años de seguimiento (los incidentes en la consulta de ERCA en 2020). Por tanto, se efectúa el cálculo en 498 pacientes: 231 con riesgo <10 y 267 con riesgo ≥10.
Las estimaciones pronósticas se presentan como mediana (rango intercuartílico), y las evoluciones observadas, como porcentajes.
Si comparamos la evolución observada a 2 y 4 años con la pronosticada por el modelo de Grams en los mismos periodos, en los dos grupos de edad (tabla 5 y figuras 1 y 2 del suplemento) comprobamos que en ambos casos la predicción y la evolución son muy aproximadas, aunque en los <75años la entrada en TRS sea mayor de lo estimado, sobre todo a largo plazo (29,5% vs 13,7% a 4años, probablemente condicionada por la inclusión en este grupo de enfermos con PQRAD, ya que si los excluimos, las diferencias se reducen: 19,2% vs 13,04%).
Comparación de los pacientes con KFRE ≥10% según grupos de edad (<75años frente a ≥75años)Entre los pacientes con KFRE ≥10%, los ≥75años tienen con respecto a los <75años significativamente más hipertensión, un mayor índice de Charlson y son menos fumadores; su situación analítica es similar, con una velocidad de deterioro del FG parecida, aunque llegan a ERCA con FGe menores (tabla 4).
En su evolución ambos grupos inician TRS en porcentajes muy elevados tanto a 2 como a 4años, aunque los pacientes <75años en una proporción significativamente mayor (46,4 vs 25,9% a 2años y 71,6 vs 41,4% a 4años, respectivamente; p<0,05) (tabla 5). Los pacientes ≥75años tienen una mortalidad previa al inicio de TRS significativamente más alta que los <75años (32,1 vs 5,7% a 2años y 45 vs 9,8% a 4años; p<0,05). La permanencia en las consultas de ERCA a los 4años fue solo del 18,6% en los <75años y del 13,5% en los ≥75años (p=0,26). Los modelos de predicción detectaban las mismas diferencias en cuanto a mortalidad e inicio de TRS entre ambos grupos.
La evolución observada a 2 y 4años y la pronosticada por el modelo de Grams en los mismos periodos, en los dos grupos de edad, se describen en la tabla 5 y se representa en las figuras 3 y 4 del suplemento. Comprobamos que en los mayores de 75años la evolución observada es bastante similar a la pronosticada, aunque inician TRS en mayor porcentaje de lo pronosticado, sobre todo a los 4años (41,4% vs 28%). Sin embargo, en los pacientes <75años con elevado riesgo el modelo de predicción no es muy certero en su predicción con respecto a la evolución observada, ya que en ambos periodos las diferencias son importantes en las tres posibles evoluciones (inicio de TRS, exitus antes de iniciar TRS y permanencias en consulta de ERCA), siendo en el inicio del TRS donde la diferencia es mayor (71,6% a los 4años frente al 42,6% pronosticado).
DiscusiónEn este estudio describimos cómo un riesgo estimado de precisar TRS a 2años del 10%, calculado mediante el modelo KFRE en pacientes con enfermedad ERC estadio G4 o superior, funciona como un umbral adecuado para la derivación a consultas de ERCA. Los pacientes con un riesgo inferior al 10% no se benefician de esta remisión, dado que tienen una probabilidad muy baja de requerir TRS y presentan, en cambio, un elevado riesgo de mortalidad, especialmente en pacientes ancianos, tal y como predice el modelo de Grams. Por el contrario, los pacientes con riesgo igual o superior al 10% son los que realmente se benefician de la remisión a consultas ERCA, independientemente de su edad, debido a su alta probabilidad de iniciar TRS en un corto o medio plazo.
La ERC se asocia con un incremento significativo en el riesgo de eventos cardiovasculares, mortalidad y progresión a insuficiencia renal terminal que requiere TRS19. La velocidad de progresión y la incidencia de estos eventos aumentan a medida que la función renal se deteriora, aunque existe una considerable variabilidad interindividual20. Por ello, la identificación precisa de los pacientes con mayor riesgo de progresión es fundamental para planificar adecuadamente su seguimiento y preparar el inicio de TRS (diálisis o trasplante). En este contexto, el uso de modelos predictivos en pacientes con alto riesgo, como aquellos con ERC G4 o superior, ha ganado especial interés21.
Entre los múltiples modelos disponibles, el KFRE y el modelo de Grams son los más utilizados debido a su facilidad de cálculo, buena precisión pronóstica y amplia validación en distintas poblaciones4,22. El KFRE predice exclusivamente la probabilidad de inicio de TRS en pacientes con FGe <60ml/min, pero no contempla la muerte como evento competitivo, lo que puede conducir a sobreestimaciones del riesgo de TRS en poblaciones con alta mortalidad23. Por su parte, el modelo de Grams está diseñado específicamente para ERC G4+, considerando el inicio de TRS y la muerte como eventos competitivos, y proporcionando así un pronóstico más completo sobre la mortalidad, el inicio de TRS y la permanencia en consulta.
Ambos modelos han sido evaluados simultáneamente en pacientes con ERC G4+8,14, y específicamente el modelo de Grams se ha estudiado en ancianos con ERC G4+13, al igual que el KFRE evaluado en función de la edad en esta población5,7. En ERC estadio G5 en ancianos también se han comparado ambos modelos simultáneamente24,25. A diferencia de estos estudios, nuestra investigación abarca una población más amplia, desde ERC G4A1 hasta G5A3, generando dos grupos comparables en cuanto a clínica y evolución, clasificados según un riesgo de TRS a 2años mayor o menor al 10%, umbral sugerido por las guías KDIGO2. Además, hemos estratificado ambos grupos por edad (<75 y ≥75años), análisis no realizado previamente con ambos modelos en conjunto.
Gracias a este diseño, confirmamos que un umbral de riesgo del 10% a 2años es adecuado para la remisión a ERCA. La inclusión de pacientes con KFRE <10% implica remitir a un número considerable de individuos con muy baja probabilidad de requerir TRS en el corto o medio plazo. Estos pacientes, con FGe<30ml/min, pero baja proteinuria y una pérdida anual de función renal moderada, permanecen prolongadamente en consulta. Entre ellos predominan los ancianos con alta carga comórbida, con una mortalidad significativa previa al inicio de TRS. En este grupo, la predicción del modelo de Grams ha demostrado buena precisión, en consonancia con estudios previos que reportan adecuada calibración para riesgos inferiores al 20%8,14.
Por otro lado, los pacientes con un KFRE ≥10% muestran una pérdida anual de FGe considerable, lo que se traduce en una alta probabilidad de requerir TRS a corto o medio plazo. En general son los pacientes con menores FGe, con más proteinuria e hipertensión y con mayor pérdida de FGe, y entre ellos predominan los varones y los fumadores activos. Dentro de este grupo, los pacientes de edad avanzada presentan características clínicas y analíticas similares a las de los más jóvenes, y también alcanzan una alta tasa de inicio de TRS. Por tanto, la edad no debería ser un criterio excluyente para su remisión precoz a consultas ERCA, aunque debe tenerse en cuenta la elevada comorbilidad y mortalidad asociadas en este subgrupo.
Al aplicar el modelo de Grams en esta población de alto riesgo se observan algunas limitaciones, como se ha reportado previamente13,14,25. En nuestro estudio, este modelo tiende a subestimar el riesgo de inicio de TRS, especialmente en pacientes ancianos con alta mortalidad y en pronósticos a más largo plazo. Resultados similares fueron obtenidos por Prouvot et al.25 en ancianos con ERCG5, mostrando calibración y discriminación subóptimas. Respecto a la mortalidad, la calibración en nuestra cohorte es algo mejor que la descrita en la literatura13,14,24, aunque, al igual que otros estudios, encontramos que la mortalidad predicha se sobreestima en comparación con la observada.
Nuestro estudio presenta fortalezas importantes, como el seguimiento homogéneo realizado por un grupo reducido de nefrólogos durante todo el periodo, con mínima pérdida de pacientes. La aplicación simultánea de ambos modelos permite una valoración integral del riesgo y ha permitido validar nuevamente estos modelos en una población española más amplia que la que usamos previamente en 20236. Sin embargo, también tiene limitaciones: es un estudio unicéntrico y retrospectivo; la subdivisión por edad y riesgo genera subgrupos con tamaño reducido, lo que limita la potencia estadística. Además, el grupo de alto riesgo (KFRE ≥10%) incluye pacientes con rangos amplios de riesgo, lo que puede explicar discrepancias entre riesgos observados y calculados. La definición de inicio de TRS se basó en los criterios originales de los modelos, aunque en la práctica clínica actual la indicación de tratamiento conservador en ancianos es cada vez más frecuente. Finalmente, los pacientes no recibieron de forma significativa los tratamientos actuales como iSGLT2, aGLP1 o ARMns, por lo que la generalización a poblaciones con estas terapias debe hacerse con cautela.
ConclusionesEn nuestra población, adoptar un KFRE ≥10% a 2años como criterio de remisión a consultas ERCA es apropiado.
Remitir pacientes con KFRE <10% implica incluir un gran número de enfermos que no requerirán TRS a corto y a medio plazo. En este grupo, el modelo de Grams proporciona pronósticos precisos, especialmente en ancianos, que predicen baja probabilidad de TRS y alta probabilidad de permanecer en consulta o fallecer antes de precisar TRS, indicando escaso beneficio de la remisión.
Por el contrario, pacientes con KFRE ≥10% tienen una alta probabilidad de iniciar TRS en el corto-medio plazo, aunque el modelo de Grams tiende a subestimar esta necesidad y sobrestima la mortalidad y la permanencia en consulta. Independientemente de la edad, estos pacientes se benefician claramente de la remisión a consultas ERCA debido a su alto riesgo de requerir TRS.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Consideraciones éticasEl presente estudio ha sido aprobado por el CEIm del Hospital Universitario Fundación Alcorcón (N.° 22/157) y se ha realizado de acuerdo con la Declaración de Helsinki, el International Council for Harmonization guidelines for Good Clinical Practice y las leyes españolas.
Contribución de los autoresEGV diseño el estudio. EGV, ARC, SLSR recogieron los datos. EGV realizó el análisis. EGV, ARC, ELM, AMTR, DR, AMA, CCC, EG analizaron e interpretaron los datos. EGV escribió el artículo y tiene la responsabilidad final de su contenido. Todos los autores contribuyeron a la revisión y aprobación final del manuscrito.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.