El enfoque más utilizado en el tratamiento inmunoterápico del cáncer es la administración de anticuerpos monoclonales dirigidos contra moléculas reguladoras del control inmunitario que inhiben la activación de las células T, los llamados inhibidores del check-point (ICP). La epidemiología y patología de la nefrotoxicidad por los ICP, su diagnóstico con o sin biopsia renal, el tipo y la duración del tratamiento, la posibilidad de retratar después del daño renal, y su indicación en pacientes con cáncer y trasplante renal son ciertamente controvertidas. En ausencia de estudios definitivos, este documento está destinado a concretar unas recomendaciones consensuadas por el grupo de expertos de Onconefrología de la SEN en aquellas áreas relacionadas con la nefrotoxicidad por los ICP, con la finalidad de ayudar en la toma de decisiones en la práctica clínica diaria de las consultas de Onconefrología.
The most widely used approach in the immunotherapy treatment of cancer is the administration of monoclonal antibodies directed against regulatory molecules of immune control that inhibit the activation of T cells, the so-called check point inhibitors (ICI). ICI nephrotoxicity epidemiology and pathology; its diagnosis with or without kidney biopsy; the type and duration of treatment; the possibility of rechallenging after kidney damage; and its indication in patients with cancer and renal transplantation are certainly controversial. In the absence of definitive studies, this document is intended to specify some recommendations agreed by the group of onconephrology experts of the Spanish Society of Nephrology in those areas related to ICI nephrotoxicity, in order to help decision-making in daily clinical practice in onconephrology consultations.
El grupo de Onconefrología de la Sociedad Española de Nefrología (SEN) se constituyó con varias finalidades: proporcionar educación médica; realizar estudios clínicos, terapéuticos y epidemiológicos y organizar registros en el área cáncer-riñón. Un objetivo importante era clarificar con recomendaciones ciertas controversias sobre aspectos que carecen de resultados precisos que estuvieran basados en estudios aleatorizados y prospectivos1. El daño renal asociado a inhibidores del check-point (ICP), su diagnóstico con o sin biopsia renal, el tipo y la duración del tratamiento, la posibilidad de reiniciar la inmunoterapia después del evento renal y su indicación en pacientes con cáncer y trasplante renal son ciertamente controvertidas. La finalidad de este artículo es precisamente esa: en ausencia de evidencia científica sólida, concretar unas recomendaciones basadas en la experiencia clínica y consensuadas por el grupo de expertos de Onconefrología de la SEN a la hora de abordar el daño renal asociado al uso de ICP.
Este documento no pretende pues representar un conjunto de nuevas guías, ya que no es el resultado de una revisión sistemática de la evidencia, sino que está destinado a ser de utilidad para el especialista en Nefrología en el manejo de las complicaciones renales aparecidas en el tratamiento con IPC en la práctica clínica diaria de las consultas de Onconefrología.
Inhibidores del check-point (ICP)Los ICP o inhibidores de puntos de control inmunitarios2 son anticuerpos monoclonales dirigidos contra moléculas reguladoras del control inmunitario que inhiben la activación de las células T. Estos fármacos pueden prolongar la supervivencia general en pacientes con diferentes tipos de cáncer como melanoma, cáncer de pulmón de células no pequeñas, cáncer urotelial, cáncer de células renales y muchos otros3.
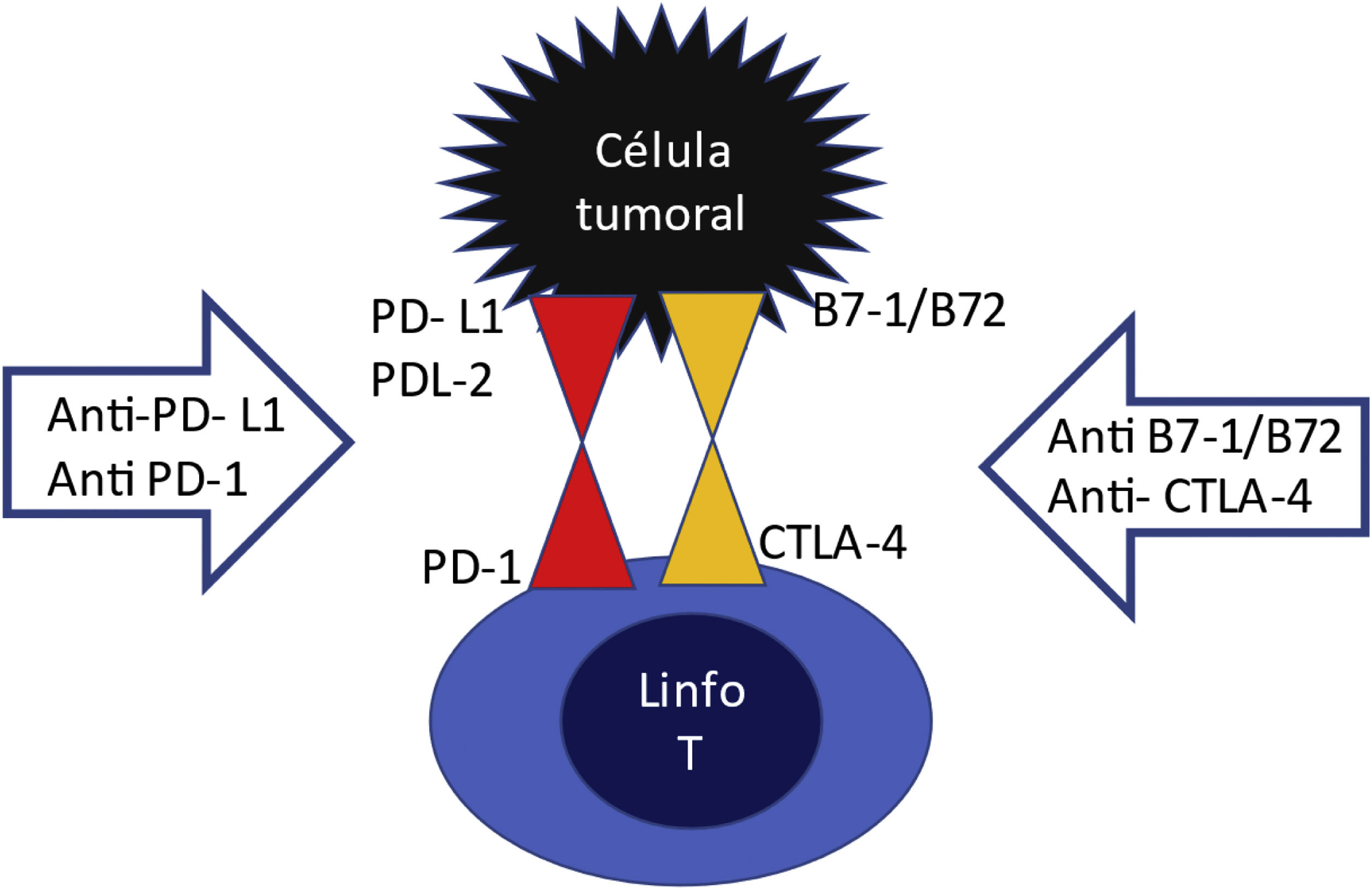
Los linfocitos T tienen en su superficie receptores de inhibición PD1 (receptor de muerte programada) y el CTLA4 (cytotoxic T lymphocyte associated antigen) que son como «frenos de mano» que impiden la activación en exceso de la célula T (fig. 1). Esos receptores de inhibición se activan tras la unión a su ligando PDL1 o PDL2, o B7-1/B7-2 que normalmente se expresan en la superficie de células dendríticas y macrófagos. Y es precisamente este mecanismo el que han integrado multitud de tumores mediante la expresión en su superficie de los ligandos PDL1 y PDL2 o B7-1B7-2, logrando escapar así de la acción del sistema inmunitario. Es decir, la célula tumoral aprende a activar el «freno de mano». Los ICP son agentes contra PD1, PDL1 y CTLA4. Bloquean el receptor del linfocito o bloquean el ligando del tumor, de manera que estos dos no se encuentren y si no lo hacen el linfocito va a continuar activado para destruir el tumor, pero no obstante, al mantener esa sobreactivación del linfocito T, estos fármacos ICP pueden producir efectos adversos relacionados con la respuesta inmune y entre ellos daño renal4.
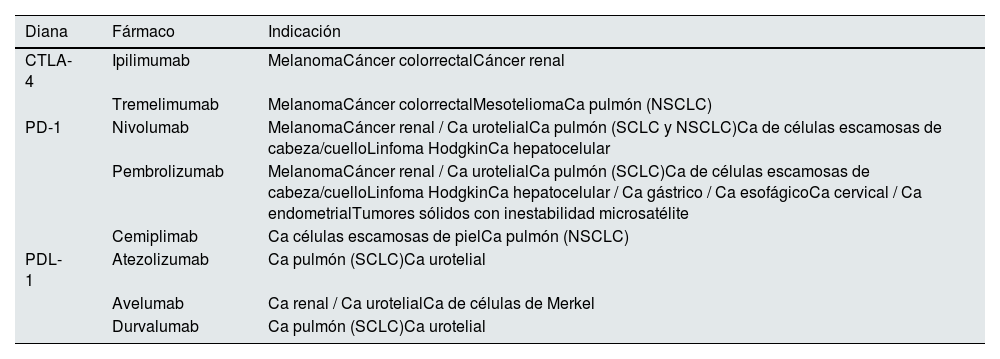
En la tabla 1 pueden observarse un inhibidor CTLA-4, 3 antiPD-1 y 3 antiPD-L1 aprobados para el tratamiento de varios tipos de tumores malignos, así como sus indicaciones5. Los ICP tienen vidas medias largas (6-27 días) y ya que se eliminan principalmente por degradación proteolítica dentro del hígado, la disminución de la función renal no afecta a la eliminación6.
ICP aprobados por la FDA y EMA
| Diana | Fármaco | Indicación |
|---|---|---|
| CTLA-4 | Ipilimumab | MelanomaCáncer colorrectalCáncer renal |
| Tremelimumab | MelanomaCáncer colorrectalMesoteliomaCa pulmón (NSCLC) | |
| PD-1 | Nivolumab | MelanomaCáncer renal / Ca urotelialCa pulmón (SCLC y NSCLC)Ca de células escamosas de cabeza/cuelloLinfoma HodgkinCa hepatocelular |
| Pembrolizumab | MelanomaCáncer renal / Ca urotelialCa pulmón (SCLC)Ca de células escamosas de cabeza/cuelloLinfoma HodgkinCa hepatocelular / Ca gástrico / Ca esofágicoCa cervical / Ca endometrialTumores sólidos con inestabilidad microsatélite | |
| Cemiplimab | Ca células escamosas de pielCa pulmón (NSCLC) | |
| PDL-1 | Atezolizumab | Ca pulmón (SCLC)Ca urotelial |
| Avelumab | Ca renal / Ca urotelialCa de células de Merkel | |
| Durvalumab | Ca pulmón (SCLC)Ca urotelial |
Ca: carcinoma; ICP: inhibidores del check-point; NSCLC: cáncer de pulmón de células no pequeñas; SCLC: cáncer de pulmón de células pequeñas
Fuente: Gupta et al.5.
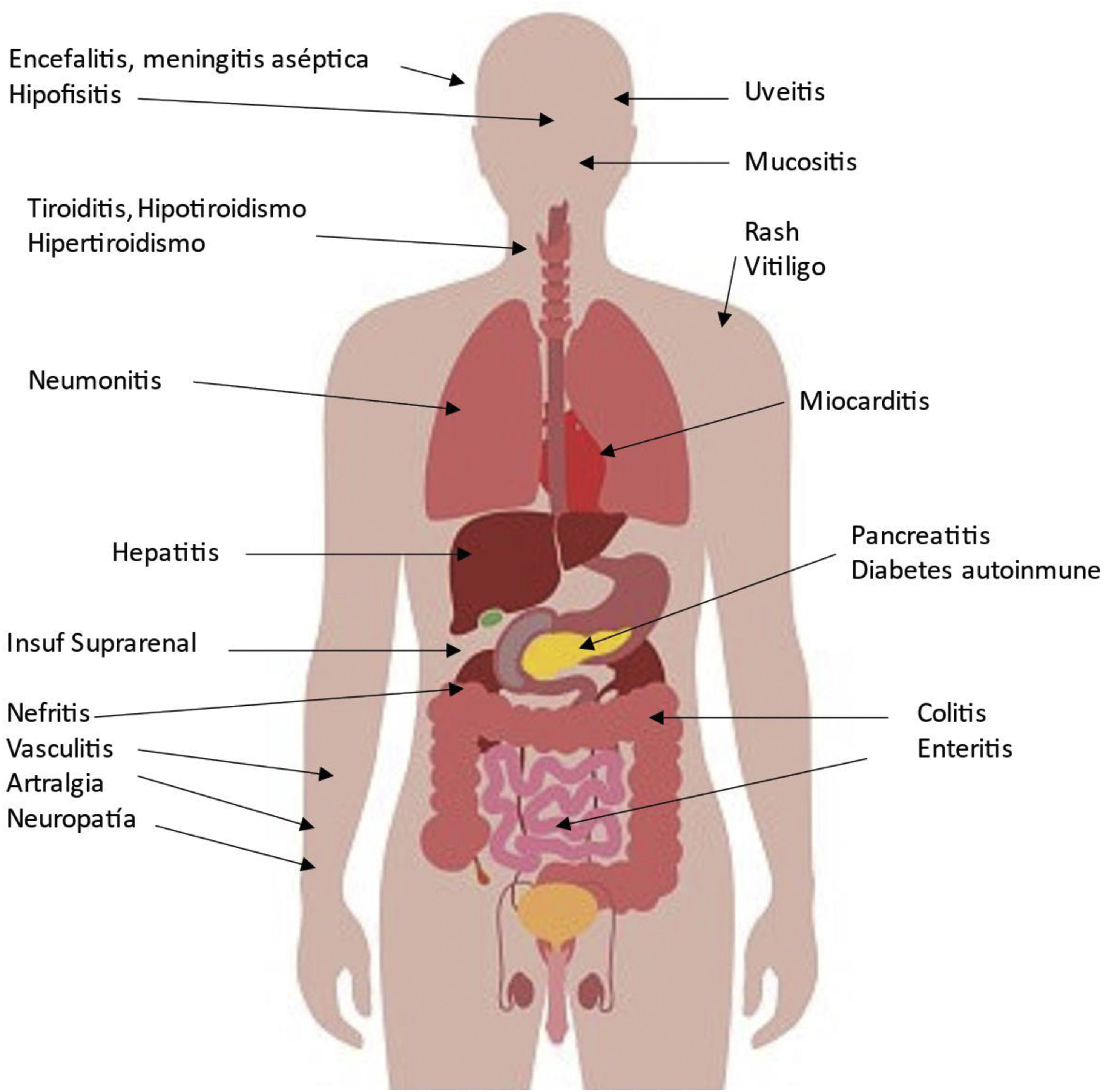
En la figura 2 podemos observar los eventuales efectos secundarios en diversos órganos asociados a los ICP al aumentar la actividad del sistema inmunitario, algo que es especialmente importante en pacientes con enfermedad autoinmune preexistente o antecedentes de trasplante de órgano como veremos. La incidencia puede ser tan alta como del 59 al 85%, dependiendo del agente, del uso de un agente único o un tratamiento combinado con varios ICP. Estos eventos adversos generalmente se desarrollan dentro de las primeras semanas o meses después del inicio del tratamiento, pero pueden presentarse en cualquier momento, incluso después del cese del tratamiento con ICP y disminuir con el tiempo7. Por su eventual gravedad requieren una detección temprana y un manejo adecuado. Aunque se pueden controlar con corticosteroides y otros inmunosupresores, pueden ocurrir complicaciones secundarias importantes e incluso fatales en una pequeña proporción de pacientes.
Entre los mecanismos que pueden influir en la aparición de efectos adversos relacionados con el sistema inmunitario tras el tratamiento con ICP se describen los siguientes7:
- -
Aumento de la actividad de las células T contra los antígenos que están presentes en los tumores y el tejido sano.
- -
Aumento de los niveles de autoanticuerpos preexistentes (anticuerpos antitiroideos, por ejemplo) o a fármacos (haptenos) que habían sido tolerados previamente.
- -
Aumento en el nivel de citocinas inflamatorias.
- -
Inflamación mediada por el complemento debida a la unión directa de un anticuerpo anti-CLA 4 con CTLA-4 que tiene lugar a nivel hipofisario.
La complicación renal más comúnmente asociada al tratamiento con ICP es el fracaso renal agudo. Según las series publicadas disponibles, el patrón histológico más frecuente es la nefritis tubulointersticial aguda inmunomediada (NTIA) que representa más del 90% de los casos, si bien los ICP pueden asociarse también con patología glomerular. Se han documentado casos de necrosis tubular aguda (NTA) en pacientes bajo ICP, si bien esta lesión no parece guardar una relación fisiopatológica con la inmunoterapia.
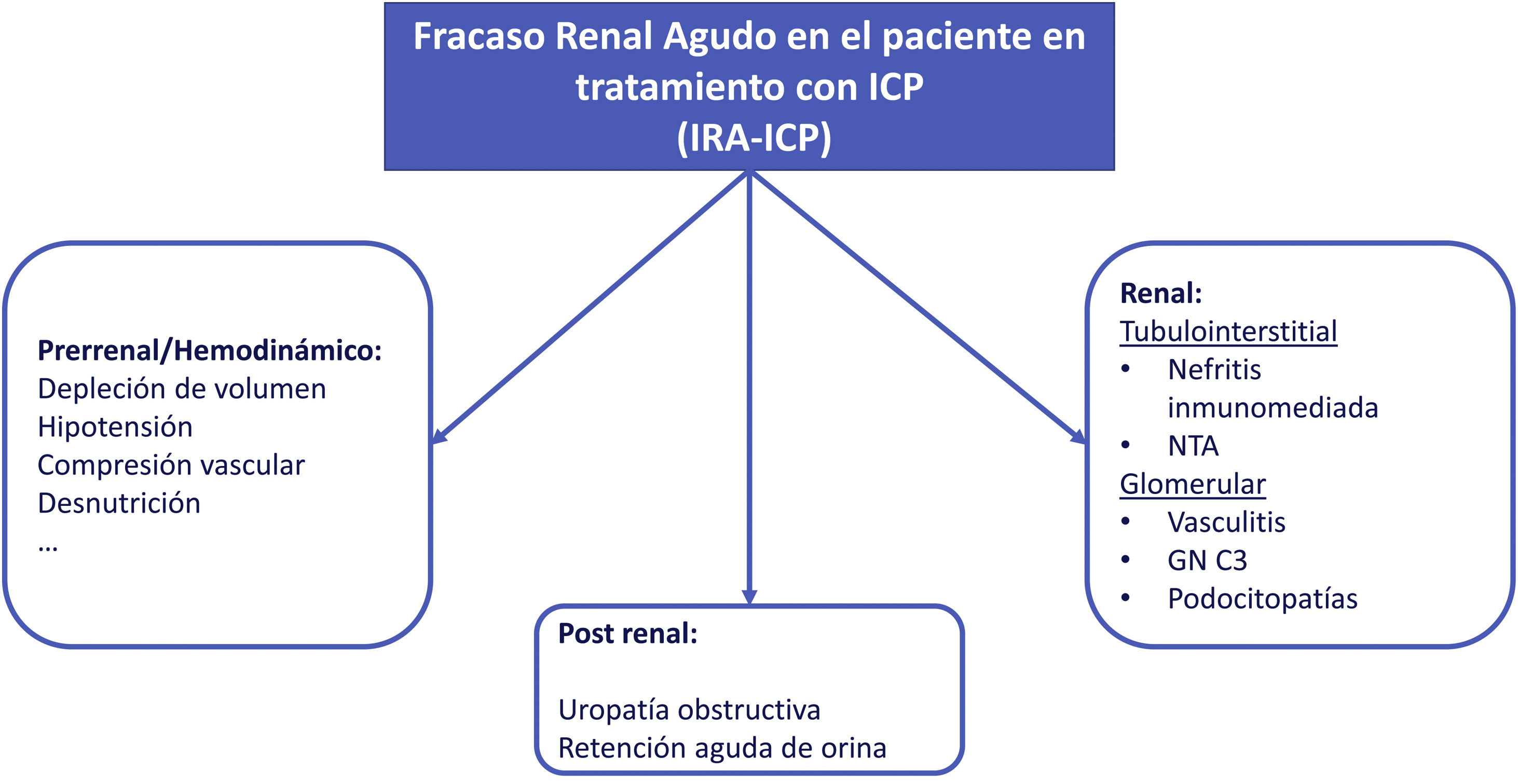
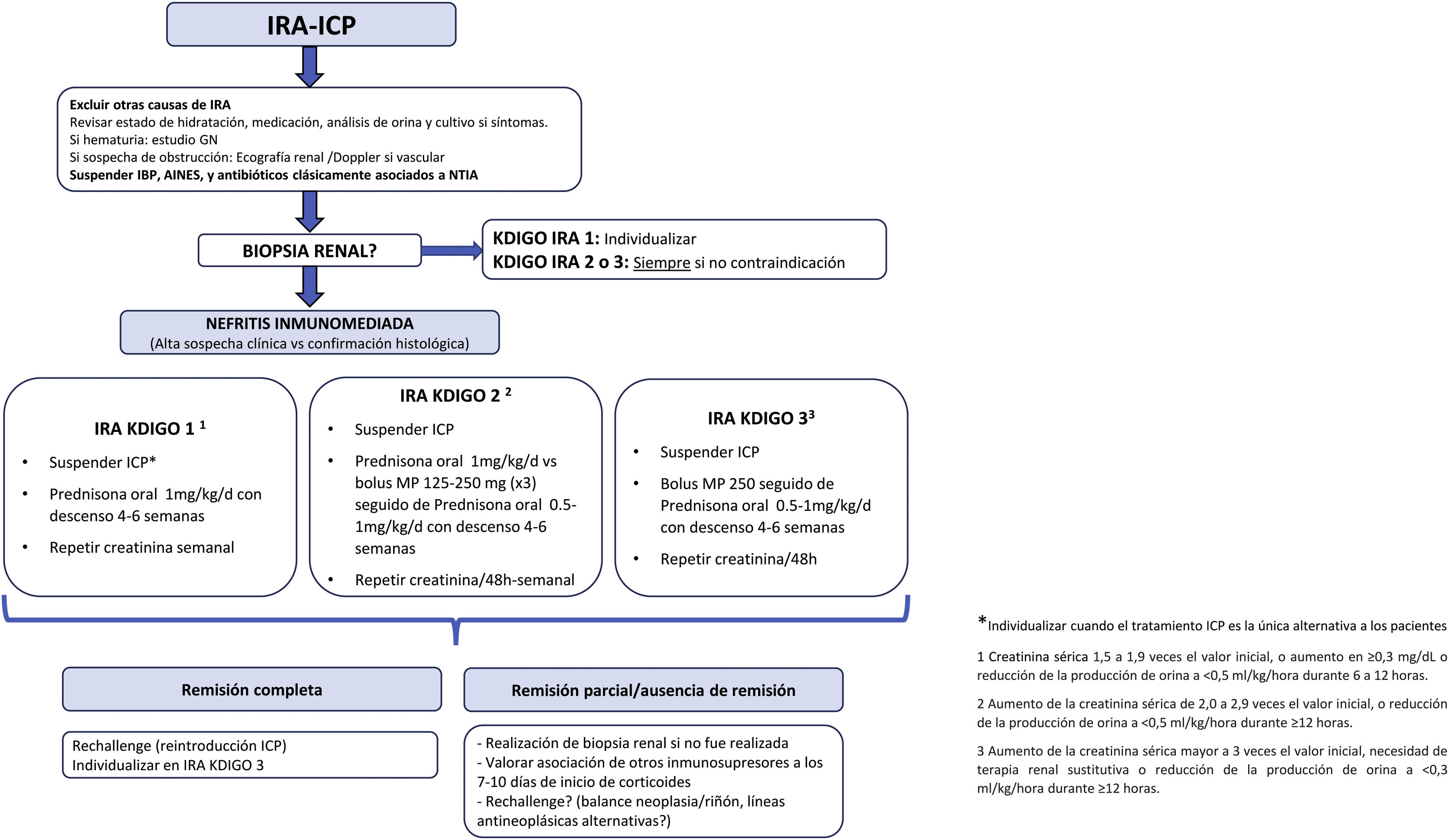
Fracaso renal agudo (IRA)La IRA en el paciente en tratamiento con ICP puede ser de etiología multifactorial (fig. 3). En una de las series más largas publicadas hasta la fecha, menos del 40% de los IRA en pacientes bajo tratamiento con ICP se asociaban directamente a estos fármacos8. Dado que asociar la IRA al tratamiento oncoespecífico requiere la retirada de este y el inicio de tratamiento corticoideo si hay sospecha de NTIA, con el consecuente posible perjuicio en la evolución de la neoplasia, se recomienda encarecidamente la valoración y exclusión de otras etiologías.
La incidencia atribuida a los ICP en presencia de IRA se estima en un 2-3%, con una media de aparición de 15 semanas después de iniciar tratamiento9–11. En general la asociación de inhibidores CTLA-4 y PD-1 parece condicionar una cifra algo más alta (5%)12.
Los factores de riesgo conocidos para el desarrollo de ICP-IRA son: la función renal basal, el uso de inhibidores de la bomba de protones (IBP), la presencia previa de otros IRAES y el uso de dos o más ICP, así como la edad del paciente9–13.
Los IBP junto con otros medicamentos causantes de NTIA, como los medicamentos antiinflamatorios no esteroideos (AINE) o cierto tipo de antibióticos, deben usarse con precaución en pacientes que reciben ICP y deben suspenderse en aquellos que desarrollan insuficiencia renal aguda asociada a ICP (IRA-ICP)5. Se ha visto que en aquellos pacientes en los que se produce IRA-ICP que estaban recibiendo medicación que se ha asociado a NTIA, la interrupción de estos tratamientos facilita la recuperación completa de la función renal9. Dado que el uso de IBP es un factor de riesgo para el desarrollo de IRA en estos pacientes, los autores de este artículo recomiendan evitar su uso indiscriminado, principalmente en aquellos pacientes con otros factores de riesgo.
Si bien la existencia de un efecto inmune adverso previo (miocarditis, tiroiditis, colitis…) apoya la posibilidad de IRA-ICP, solo un 43% de pacientes con ICP-IRA presentan esta complicación previamente, de manera que su ausencia no la descarta9.
Nefritis tubulointersticial aguda (NTIA)En la tabla 2 resumimos los aspectos más característicos de la NTIA asociada a ICP. La NTIA es con mucho (>90%) el más frecuente hallazgo histopatológico encontrado en las biopsias renales de pacientes con ICP-IRA. Cortazar et al., en un estudio multicéntrico con 138 pacientes, encontraron NTIA como lesión dominante en el 93%9.
Aspectos más característicos de la NTIA asociada a ICP
| La IRA directamente relacionada con ICP es poco común y varía del 2,2 al 5% |
| La NTIA explica cerca del 90% de los casos de IRA-ICP |
| Puede coexistir con antecedentes previos o concomitantes de eventos adversos relacionados con la inmunidad extrarrenal 40-87% (dermatitis, colitis, tiroiditis…) |
| La NTIA generalmente ocurre entre las semanas 12 y 14 después del inicio de ICI, pero puede aparecer más tarde (hasta un año) después de la suspensión de ICI |
| Factores de riesgo asociados: combinación de ICP, uso de IBP y FG inferior a 30mL/min |
| La NTIA (infiltración de linfocitos, células plasmáticas, eosinófilos) se presenta con piuria estéril o proteinuria en rango subnefrótico concurrente con enfermedad glomerular |
IBP: inhibidores de la bomba de protones; ICP: inhibidores de los check-point; ICP-IRA: insuficiencia renal aguda asociada a inhibidores de los check-point; IRA: insuficiencia renal aguda; NTIA: nefritis túbulo intersticial aguda.
La nefritis intersticial inmunomediada se produce bien por la pérdida de tolerancia a autoantígenos renales mediada por la hiperactivación linfocitaria o por la reactivación de células T exhaustas específicas para ciertos fármacos (IBP, AINE…) previamente suprimidas por las señales PD1/CTLA48,14,15.
La nefritis inmunomediada tiene una presentación clínica diferente de la nefritis intersticial clásica: Draibe et al. estudiaron las diferencias de la NTIA inmunomediada y la NTA clásica asociada a otros fármacos. Encontraron un mayor período de latencia desde la introducción del fármaco al desarrollo de la IRA, así como una mayor lentitud en la recuperación de la misma en el grupo de pacientes que presentaron NTIA mediada por inmunoterapia16. Es decir, que con la misma histología parecen ser dos entidades con mecanismos fisiopatológicos diferentes.
Necrosis tubular aguda (NTA)No es una lesión predominante en la IRA asociada a ICP, pero hay algunas publicaciones que han observado esta lesión con más frecuencia de la habitual. Izzedine et al.17 estudiaron 12 pacientes tratados con pembrolizumab y la biopsia mostró que 4 pacientes tenían NTIA, mientras que 5 tenían lesión tubular aguda (NTA) aislada. En estos casos, el tratamiento con esteroides no estaría indicado y, probablemente, tampoco la retirada del ICP, lo cual enmarca la discusión que veremos más adelante de la necesidad de biopsia renal o no antes del tratamiento con corticoides en pacientes con IRA y tratamiento con ICP.
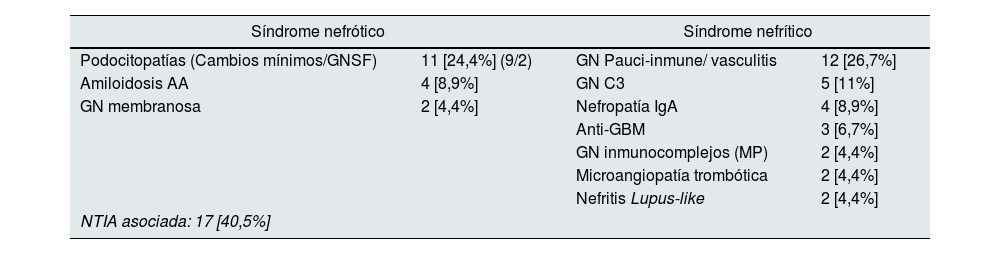
Alteraciones glomerulares asociadas a ICPSe han descrito diferentes enfermedades glomerulares asociadas al tratamiento con ICP. Kitchlu et al.18 realizaron una revisión sistemática y metaanálisis de 27 artículos con 45 casos biopsiados de enfermedad glomerular y encontraron unos resultados que clarifican esta patología: glomerulonefritis paucinmune y vasculitis renal (27%); podocitopatías (lesiones glomerulares mínimas 9 y hialinosis segmentaria focal 2) (24%); y glomerulopatía C3 (11%). Los resultados se resumen en la tabla 3.
Nefropatías glomerulares asociadas a ICP
| Síndrome nefrótico | Síndrome nefrítico | ||
|---|---|---|---|
| Podocitopatías (Cambios mínimos/GNSF) | 11 [24,4%] (9/2) | GN Pauci-inmune/ vasculitis | 12 [26,7%] |
| Amiloidosis AA | 4 [8,9%] | GN C3 | 5 [11%] |
| GN membranosa | 2 [4,4%] | Nefropatía IgA | 4 [8,9%] |
| Anti-GBM | 3 [6,7%] | ||
| GN inmunocomplejos (MP) | 2 [4,4%] | ||
| Microangiopatía trombótica | 2 [4,4%] | ||
| Nefritis Lupus-like | 2 [4,4%] | ||
| NTIA asociada: 17 [40,5%] | |||
AA: amiloide sérico A; GN: glomerulonefritis; GN C3: glomerulonefritis C3; GBM: membrana basal glomerular; GNSF: glomerulopatía con patrón segmentaria y focal; ICP: inhibidores de los check-point; NTIA: nefritis túbulo intersticial aguda.
Fuente: Kitchlu et al.18.
Es importante resaltar que en un 41% de los casos había una NTIA y que tan solo 2 de los pacientes con vasculitis fueron ANCA positivos. La mortalidad fue alta en este grupo a pesar de tratamiento con corticoides. Más del 60% de pacientes con podocitopatías remitieron total o parcialmente con suspensión del fármaco y corticoides y la mayoría de los pacientes C3 remitieron con esteroides únicamente. Ello hace posible que en algunos pacientes con daño glomerular pudiera reanudarse el tratamiento con ICP, particularmente en aquellos con podocitopatías aunque no tenemos datos sólidos para afirmarlo. Pero la evolución de los casos con enfermedad glomerular inducida «de novo» por ICP es mala. A la mayoría de los pacientes se les interrumpió el ICP (88%) y casi todos recibieron tratamiento con corticoides (98%). Se requirió diálisis en el 25%. La mayoría de los pacientes se recuperaron total (31%) o parcialmente (42%) de la IRA; no obstante, un 19% permaneció dependiente de diálisis, y aproximadamente un tercio murió. La remisión completa o parcial de la proteinuria se logró en el 45% y 38%, respectivamente.
Los mecanismos por los cuales los ICP inducen enfermedad glomerular son aún poco conocidos. Se han propuesto diferentes hipótesis, todas ellas ya discutidas con anterioridad en los eventos adversos relacionados con los ICP. Un aumento de los procesos inflamatorios por hiperactividad de las células T, producción de autoanticuerpos, o por la inflamación relacionada con la producción de C5a que se ha visto aumentada cuando se bloquea el PDL-119.
Cuándo indicar una biopsia renal a pacientes tratados con ICP con daño renalLa discusión se basa en que, como la mayoría de las lesiones renales producidas por los ICP son NTIA, se pueden disminuir los riesgos de la biopsia renal si han sido descartadas otras causas, y no se sospecha enfermedad glomerular, tratando inicialmente con esteroides y, según la respuesta, decidir más adelante. Muchos especialistas creen que la sospecha clínica junto con datos de laboratorio que lo apoyen (por ejemplo, eosinofilia, piuria estéril, etc.) son suficientes para hacer un diagnóstico.
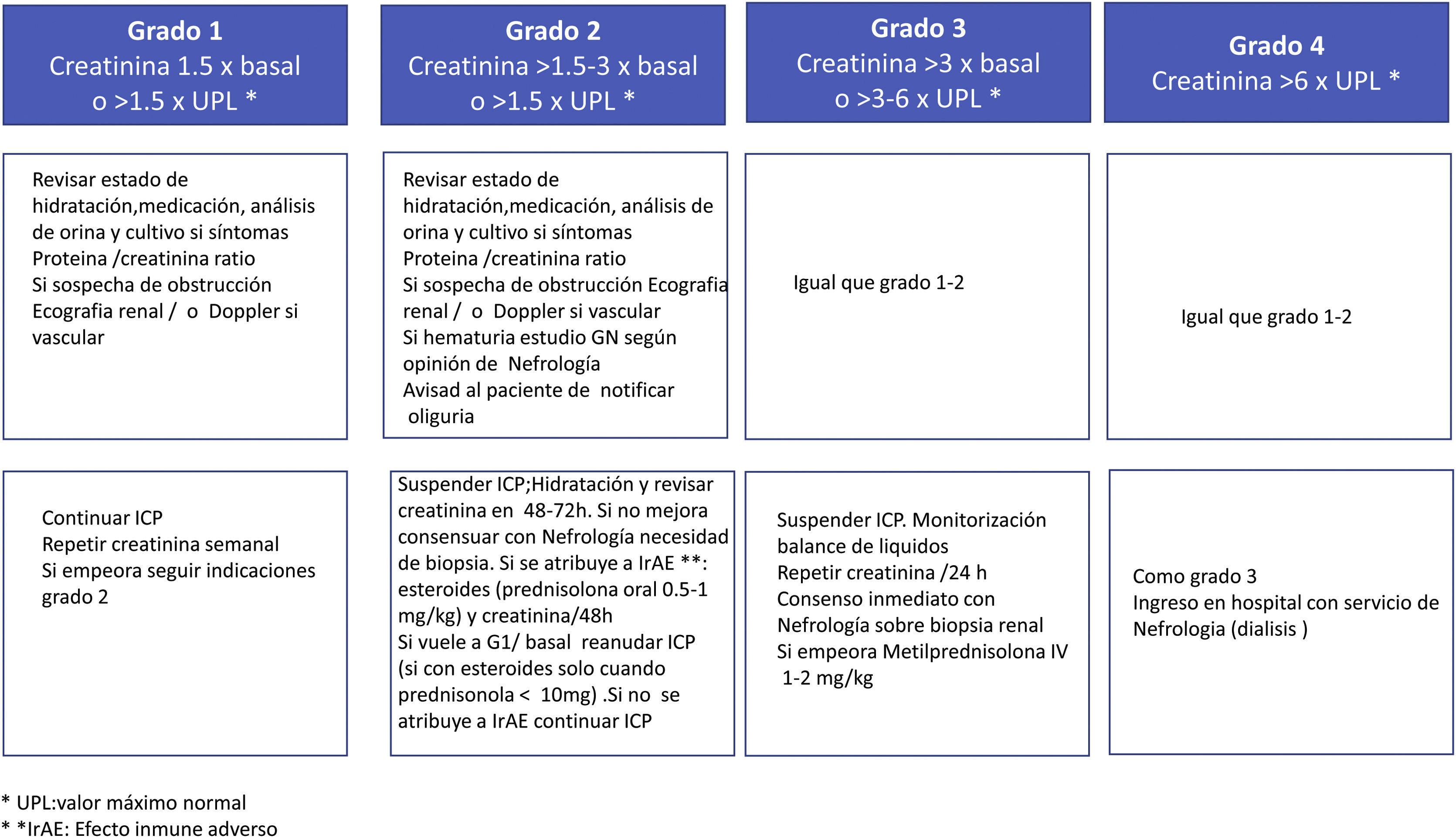
De hecho, las guías de la American Society of Clinical Oncology (ASCO) y National Comprehensive Cáncer Network (NCCN) recomiendan que si no se identifica una causa alternativa de IRA, los médicos deben proceder directamente con tratamiento inmunosupresor con corticoides sin una muestra de biopsia renal a menos que se trate de una IRA renal moderada/grave potencialmente mortal (fig. 4)20,21 En cambio, otros creen que, en la mayoría de los pacientes, la NTIA sólo se puede diagnosticar con una biopsia renal ya que muchos de esos datos clínicos están ausentes en pacientes biopsiados y solo un 50% presentan manifestaciones extrarrenales6. Los razonamientos en favor o en contra de una biopsia renal en pacientes con IRA tratados con ICP son algunos de los siguientes22:
A favor de biopsia renal
- •
Los pacientes con cáncer tratados con ICP que desarrollan IRA pueden tener NTA (frecuente causa de IRA en pacientes oncológicos) u otras lesiones renales en lugar de NTIA.
- •
La identificación de lesiones renales que no son NTIA, como NTA, permite evitar la exposición a corticosteroides y la posible continuación del tratamiento con ICP. Asumir que los pacientes tienen NTIA puede exponerlos a corticosteroides innecesarios (con sus complicaciones asociadas) y dar lugar a una interrupción desacertada del tratamiento con ICP. En última instancia, este enfoque puede conducir a resultados inferiores en el tratamiento del cáncer.
- •
La confirmación histológica del tipo de lesión renal es fundamental de cara a poder reintroducir la inmunoterapia en caso necesario. Asumir una NTIA puede implicar la suspensión definitiva del ICP, especialmente en casos de IRA grado>1 y en aquellos pacientes que reciben el fármaco dentro de un ensayo clínico.
- •
El patrón histológico observado guiará el tratamiento (uso de otros inmunosupresores en patología glomerular).
- •
La cuantificación de la fibrosis intersticial permite realizar un pronóstico renal.
En contra de biopsia renal
- •
La forma de IRA más frecuentemente asociada al uso de ICP es la NTIA, por lo que puede asumirse un tratamiento con corticoides.
- •
La biopsia renal es un método con eventuales complicaciones serias.
- •
Con el tratamiento con corticoides en un alto porcentaje puede alcanzarse remisión completa o incompleta.
El grupo ha concretado su posición respecto a realizar biopsia renal en pacientes con IRA-ICP basado en su experiencia y en diferentes publicaciones5,6,9,10,13,17,18,20–22 y considera que la biopsia renal es una herramienta fundamental para el manejo de estos pacientes, dado que permite confirmar el diagnóstico (evitando tratamientos con corticoides o la retirada de los ICP en casos en los que la biopsia no confirme la presencia de NTIA) y ayuda a establecer el pronóstico según el grado de fibrosis.
Es importante recordar que los pacientes oncológicos tienen a menudo otros factores de riesgo para daño renal (episodios de hipoperfusión, contrastes iodados, tóxicos tubulares como platino) y que la recuperación de IRA en los pacientes no biopsiados y tratados con corticosteroides puede reflejar el curso natural de la recuperación de NTA y no tener nada que ver con el tratamiento los corticosteroides, lo que hace que el argumento de que la recuperación renal en pacientes que reciben corticosteroides sea confuso. Muchos oncólogos consideran que un curso empírico de corticosteroides es de bajo riesgo para estos pacientes, y actualmente recomiendan este enfoque en sus guías20. Se podría argumentar que este enfoque es razonable en pacientes que tienen otra lesión orgánica inmunomediada, evitando las posibles complicaciones de la biopsia renal. Nosotros coincidimos con Gupta et al.5 en que el tratamiento empírico con esteroides sólo debe debería considerarse para pacientes con ausencia de una etiología plausible alternativa para IRA y en aquellos con una contraindicación absoluta para la biopsia renal debido a problemas de seguridad (p. ej., hipertensión no controlada o anticoagulación). La presencia de un riñón único (p. ej., por nefrectomía en cáncer renal) no supone una contraindicación absoluta para la biopsia, aunque por supuesto sí debe valorarse con cuidado el riesgo-beneficio. Conocer el tipo de lesión renal es importante porque los corticoides y/o la suspensión del fármaco pueden ser necesarios para pacientes con NTIA, pero no se requieren para NTA y otras lesiones no mediadas por respuesta inmunitaria.
Así pues, consideramos que la biopsia renal estaría indicada (salvo contraindicación absoluta) en todos los pacientes para el diagnóstico de daño renal asociado a ICP, y preferentemente antes de 48-72h. En determinadas circunstancias con IRA leve en los que la respuesta a esteroides sea excelente y la sospecha clínica de nefritis inmunomediada muy alta, podemos evitar la biopsia y plantearla si hay deterioro de función renal tras la bajada/retirada rápida de esteroides.
Las circunstancias que podrían justificar una prueba empírica recortada con corticoides antes de la biopsia y aquellas en las que consideramos necesaria la biopsia renal desde el primer momento se exponen en la figura 5.
Si la biopsia renal se demora por características del paciente o intrínsecas al funcionamiento del servicio hospitalario y la sospecha de nefritis inmunomediada es alta, en ningún caso ha de demorarse el inicio de corticoides a la realización de esta.
Los autores proponen las siguientes indicaciones de biopsia renal en paciente con daño renal asociado a ICP- 1.
Paciente que presenta IRA persistente grado 1 o IRA importante grado ≥2 antes de iniciar tratamiento con corticoides.
- 2.
Ausencia de contraindicaciones (p. ej.: riesgo de sangrado, HTA no controlada, trombocitopenia severa).
- 3.
Ausencia de otras posibles etiologías (contraste intravenoso reciente, medicamentos, optimización del estado de hidratación).
- 4.
Ausencia de medicación que produzca NTIA (IBP, AINE, antibióticos).
- 5.
Ausencia de otros efectos inmunitarios adversos que requieran tratamiento con esteroides (posponer la biopsia renal si está bajo esteroides y verificar la creatinina sérica).
- 6.
Sospecha de nefropatía glomerular: albuminuria de nueva aparición (>1g/día), sedimento urinario atípico para NTIA (cilindros hemáticos, dismorfia glomerular), síndrome nefrótico, insuficiencia renal rápidamente progresiva.
- 7.
Agentes quimioterápicos nefrotóxicos concurrentes.
- 8.
No respuesta a la terapia típica de corticosteroides indicados en NTIA.
Una vez excluidas otras causas de IRA, y realizado el diagnóstico, el manejo de la NTIA incluye evaluar la suspensión del tratamiento con ICP y tratar con corticosteroides, si no existe contraindicación. El objetivo es encontrar un equilibrio entre la prevención del fallo renal y mantener controlada la evolución del cáncer.
Los corticoides son la base del tratamiento de NTIA en pacientes que reciben ICP. Es cierto que no hay estudios aleatorizados, pero los datos de estudios observacionales lo apoyan. En el estudio de Cortázar et al.9 la mayoría de los pacientes fueron tratados con corticoides (86%) y un 45% tuvieron recuperación completa o parcial, respectivamente. Gupta et al.10 en un estudio multicéntrico sobre 429 pacientes con IRA asociada a tratamiento con ICP encontraron que la recuperación renal ocurre en aproximadamente dos tercios de los pacientes, y que el inicio temprano de corticosteroides se asocia con una mayor probabilidad de recuperación renal. Otros estudios coinciden con un 85% de recuperación parcial o completa de la función renal11,23,24. El tratamiento temprano con corticoides es esencial. En el estudio multicéntrico de Gupta et al.10 el inicio temprano de corticosteroides (dentro de los 3 días de IRA-ICP) se asoció con una mayor probabilidad de recuperación renal en comparación con el inicio tardío (más de 3 días después de IRA-ICP). Los ICP tienen una larga vida, se desconoce el tiempo de tratamiento que se requiere para mantener la respuesta inflamatoria dado que en la actualidad hay una ausencia de ensayos clínicos aleatorizados en este sentido. El mismo consorcio liderado por Gupta et al. analizó las pautas de esteroides de 165 pacientes con IRA asociado a ICP en un estudio retrospectivo, concluyendo que una pauta de esteroides corta (<28 días) en estos pacientes presenta resultados similares a una pauta larga (29-84 días) en cuanto a recuperación de la función renal25.
También se han investigado otros agentes inmunosupresores en el contexto de ICP-IRA. Cortázar et al.9 utilizaron micofenolato de mofetilo en 7 pacientes con recuperación renal completa en un paciente, con una recuperación parcial en los 6 restantes. Otros agentes que se han estudiado incluyen rituximab, ciclofosfamida e infliximab, pero se trata de casos excepcionales sin respuesta a corticoides26.
Posicionamiento del grupo de Onconefrología de la SEN sobre el tratamiento de pacientes con IRA-ICPLas recomendaciones de tratamiento por el grupo de Onconefrología de la SEN son las que mencionamos a continuación (fig. 6).
En principio se debe parar la inmunoterapia al menos uno o dos ciclos para comprobar que efectivamente los corticoides hacen efecto. Hay casos excepcionales cuando el tratamiento ICP es la única alternativa para los pacientes, en los que se debe considerar el cotratamiento con inmunosupresión e ICP en los pacientes con IRA grado 1 y plantearse la disyuntiva: cáncer o riñón. Tal esquema de tratamiento personalizado es principalmente una opinión de expertos basada en recomendaciones y actualmente hay poca evidencia que lo respalde.
En pacientes con IRA grado 2-3 es necesario suspender el tratamiento con ICP al menos hasta evaluar la respuesta a esteroides. En caso de mejoría rápida de la función renal y ausencia de otros efectos colaterales graves de la inmunoterapia se podría continuar con el tratamiento.
Las recomendaciones del grupo respecto al tratamiento con esteroides son las siguientes:- 1.
Descartar otras causas de IRA. Si proteinuria de nueva aparición (>1g/día) y/o sedimento urinario atípico para NTIA: biopsia renal.
- 2.
Suspender IBP, AINE, y antibióticos asociados a NTIA.
- 3.
El pilar del tratamiento en la NTIA asociada a ICP son los glucocorticoides (GC), aunque la evidencia científica es todavía escasa. Se indican dos tipos de tratamiento que resumimos:
Los GC se utilizan como pauta inicial de tratamiento IV para maximizar la exposición al inicio del tratamiento y reducir los efectos adversos del uso de altas dosis de forma prolongada. Planteamos el tratamiento con bolus metilprednisolona 125-250mg por 3 días tras continuación con prednisona a 0,5-1mg/kg/d si el paciente ha presentado IRA-ICP KDIGO 3 o KDIGO 2.
La pauta descendente de corticoides se realizará en 4-6 semanas (en algunos casos podría considerarse hasta 8 semanas), con la siguiente propuesta:
Prednisona oral
Semana 0 a 1: 30-40 mg*
Semana 1 a 2: 20-30mg
Semana 2 a 3: 10-20mg
Semana 3 a 4: 5-10mg
Semana 4 a 5: 0-5mg
*Semana 5 a 6: SUSPENDER*0,5mg/kg/d con un máximo de 40mg/d de inicio y continuar según la pauta adjunta
Pauta B: oralDebe existir una reevaluación analítica estrecha. Planteamos el tratamiento con prednisona a 1mg/kg/d si el paciente ha presentado IRA-ICP KDIGO 1 o 2, con la siguiente pauta:
Semana 0 a 1: 60-80 mg*
Semana 1 a 2: 40-60mg
Semana 2 a 3: 20-40mg
Semana 3 a 4: 10-20mg
Semana 4 a 5: 5-10mg
Semana 5 a 6: SUSPENDER
*1mg/kg/d con un máximo de 80mg/d de inicio y continuar según la pauta adjunta.
El beneficio de añadir otro inmunosupresor (MMF o infliximab) es ahorrar esteroides en el paciente que responde de forma parcial o presenta intolerancia y/o efectos colaterales asociados, o recae al reducir esteroides. Estos tratamientos deben consensuarse, nunca se han de administrar sin consenso previo con Oncología dado que pueden tener efectos nocivos sobre la evolución de la patología neoplásica.
Reanudación del tratamiento después de efectos adversos con inhibidores del check-point(Rechallenge)Dado que la mayoría de los eventos adversos relacionados con el sistema inmunitario se resuelven en semanas o meses después del tratamiento con inmunosupresores (corticoides generalmente), uno de los temas más importantes en la práctica clínica es la seguridad de reanudar el tratamiento después de que se haya resuelto el evento adverso.
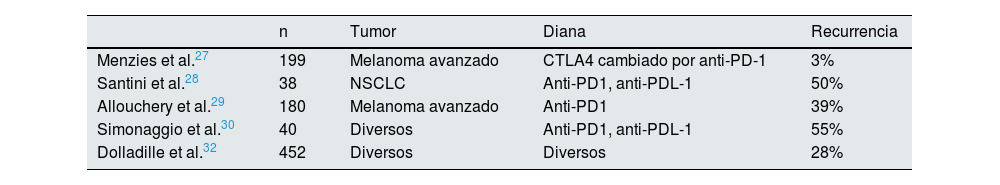
Reanudación después de efectos inmunológicos adversos no renales-ICP: recurrencia de los efectosTan solo contamos con estudios observacionales retrospectivos que analizan la incidencia de efectos inmunes adversos generales al reanudar el tratamiento con diferentes resultados según los fármacos y su sustitución, pudiendo observarse efectos adversos recurrentes o nuevos. Un gran estudio de cohorte de farmacovigilancia de casos individuales de la base de datos de la OMS refiere la tasa de recurrencia de efectos inmunes adversos en pacientes tras intentar de nuevo el tratamiento con ICP y encontraron un 29% de recurrencias del efecto adverso, con mayor frecuencia colitis, hepatitis y neumonitis27-32 (tabla 4).
Reanudación ICP después de efectos inmunológicos adversos no renales-ICP: recurrencia de los efectos adversos
| n | Tumor | Diana | Recurrencia | |
|---|---|---|---|---|
| Menzies et al.27 | 199 | Melanoma avanzado | CTLA4 cambiado por anti-PD-1 | 3% |
| Santini et al.28 | 38 | NSCLC | Anti-PD1, anti-PDL-1 | 50% |
| Allouchery et al.29 | 180 | Melanoma avanzado | Anti-PD1 | 39% |
| Simonaggio et al.30 | 40 | Diversos | Anti-PD1, anti-PDL-1 | 55% |
| Dolladille et al.32 | 452 | Diversos | Diversos | 28% |
ICP: inhibidores de los check-point; NSCLC: cáncer de pulmón de células no pequeñas.
Cuando un paciente ha tenido un episodio de IRA-ICP, especialmente de grado 2-3, y es necesario ese tratamiento para la remisión del cáncer, es compleja la decisión de reanudar el ICP pues podría conducir a nuevos episodios de IRA y empeorar gravemente el pronóstico. De acuerdo con las guías de la ASCO (fig. 4), el tratamiento con ICP debe interrumpirse de forma permanente en todos los pacientes que desarrollen IRA de grado 2 si no mejora en días con esteroides y en grado 320. El problema de esta opinión es que este enfoque puede privar a los pacientes de una terapia que podría salvarles la vida.
La recurrencia de la IRA-ICP después de retratamiento ha sido evaluada en varias publicaciones con resultados variables, pero en general se estima alrededor del 20% y estando la mayoría aun recibiendo esteroides en el momento de la reexposición10,32–37 (tabla 5). Dada la baja incidencia de IRA-ICP recurrente, parece razonable considerar la reexposición en pacientes para quienes los ICP son el tratamiento óptimo27, probablemente bajo tratamiento con esteroides a bajas dosis concomitante.
Reanudación ICP después de IRA-ICP: recurrencia de IRA
| n ICP-IRA | n retratados | % con IS en el momento de la reanudación | RecurrenciaICP-IRA | |
|---|---|---|---|---|
| Isik et al.34 | 37 | 16 | 81% | 3 (19%) |
| Cortazar et al.33 | 138 | 31 | 39% | 7 (23%) |
| Dolladille et al.32 | 276 | 78 | NA | 4 (5%) |
| Hultin et al.36 | 23 | 5 | 60% | 0% |
| Espi et al.37 | 13 | 5 | 20% | 20% |
| Gupta et al.10 | 429 | 121 | 49% | 17% |
ICP-IRA: insuficiencia renal aguda asociada a inhibidores de los check-point.
La decisión de reiniciar el tratamiento con ICP depende de la gravedad del evento anterior y el grado de recuperación de este, la disponibilidad de opciones terapéuticas alternativas y del estado general del cáncer. Hemos de considerar tres aspectos importantes. En primer lugar, la gravedad del evento adverso, pues si hay toxicidad potencialmente mortal, en particular la toxicidad cardíaca o neurológica, o liberación masiva de citocinas, no debemos reiniciar ICP. También la presencia de fármacos que puedan producir NTIA-IRA y que puedan ser retirados (IBP, AINE…) y la combinación de tratamientos ICP. Con estas consideraciones y tras tratamiento inmunosupresor (corticoides preferentemente) y una vez alcanzada la remisión completa o parcial, Hermann35 propone varias posibilidades:
- 1.
Cambiar la clase de ICP si Oncología lo considera adecuado y plausible. Por ejemplo, la incidencia de ICI-AKI es menor del 1% con bloqueo de PDL1 en comparación con una incidencia del 2-5% con otras clases38.
- 2.
Seguir con el mismo ICP o en caso de doble tratamiento suprimir CTLA-4 y continuar con monoterapia anti-PD-1.
- 3.
Prevención secundaria en el que se reanuda la ICP concomitantemente con la terapia inmunosupresora: después del episodio inicial de ICP-IRA, la inmunoterapia es reanudada una vez resuelto la IRA, concomitantemente con dosis bajas de esteroides (generalmente 10mg diarios) dependiendo de otros factores como la gravedad de la IRA y otros efectos adversos concomitantes. No obstante, si a la reanudación del tratamiento con ICP el paciente ya no está con esteroides no hay evidencia para recomendar reiniciar esteroides. Esta prevención secundaria se puede mantener durante varios ciclos o de forma continua, pero no hay experiencia publicada.
Por lo tanto, los oncólogos, nefrólogos y los equipos multidisciplinares hemos de equilibrar el beneficio clínico y el peligro de las toxicidades relacionadas con el tratamiento para cada paciente39.
Posicionamiento del grupo de Onconefrología de la SEN sobre el retratamiento (Rechallenge) con IRA-ICPSe puede considerar el retratamiento con ICP en pacientes con IRA-ICP
- 1.
Si el cáncer no respondió todavía por escaso tiempo de tratamiento o la respuesta fue inadecuada.
- 2.
Si el tiempo de la resolución con corticoides del ICP-IRA es corto, con descenso de la creatinina a la semana (>25%).
- 3.
Si el paciente está con tratamientos inductores de NTIA (AINE, IBP, antibióticos) que hayan sido retirados al diagnóstico de la nefritis.
- 4.
En aquellos que reciben una combinación de tratamientos que puedan ser reducidos a uno.
- 5.
Una vez alcanzada respuesta renal, se aconseja reintroducir el ICP cuando el paciente esté con una dosis de prednisona <20-10mg/día y continuar concomitantemente la pauta descendente de esteroides.
Hay que explicar siempre al paciente el riesgo renal que existe al reiniciar ICP y balancearlo con el riesgo de progresión de la neoplasia. Se aconseja de antemano, previamente a tomar decisiones terapéuticas, plantear si se trata de un paciente tributario a TRS (terapia renal sustitutiva) mediante diálisis en caso de mala evolución, teniendo en cuenta el pronóstico global.
No se debe considerar el retratamiento con ICP en pacientes con IRA-ICP
- 1.
Antecedentes de efectos inmunológicos adversos graves que ponen en peligro la vida: neurológicos, pulmonar, miocarditis, síndrome de liberación de citocinas.
- 2.
Disponibilidad de tratamientos alternativos y situación grave del paciente.
- 3.
Si el tiempo de la resolución con corticoides de la IRA-ICP es lento con descenso de la creatinina a la semana (<25%) (dependiendo del tipo de tumor) o la recuperación renal es escasa, quedando el paciente con una mala función renal «residual». Si el tratamiento con ICP es ineludible por la situación oncológica del paciente, se debe priorizar la TRS cuando esté indicado de manera consensuada con el paciente y reiniciar la inmunoterapia.
- 4.
Sospecha de nefropatía glomerular: No retratar sin biopsia a aquellos con proteinuria de recién comienzo (>1g/día) y sedimento no compatible con NTIA.
- 5.
Respuesta tumoral previa. Si se alcanzó el objetivo es razonable que la respuesta sea duradera y no se debe considerar retratamiento.
El cáncer es una de las mayores causas de mortalidad en la población trasplantada de órgano sólido40. La inmunosupresión puede predisponer al cáncer al inhibir la vigilancia inmunológica, suprimir la reparación del ADN y predisponer a infecciones virales oncogénicas. El número de pacientes viviendo con un riñón trasplantado es creciente, por lo que la indicación de nuevos tratamientos inmunoterápicos también aumentará de forma progresiva.
Factores a considerar cuando se indican ICP en pacientes con trasplante renalLos nuevos tratamientos como los ICP producen rechazo celular y humoral del injerto en un 30-40% de los que hasta un 60% motiva la pérdida del riñón41. Hay varios factores a considerar cuando se usan ICP en receptores de trasplante de riñón. Aunque inicialmente en estudios observacionales se marcaban diferencias en la inducción de rechazo agudo con los diferentes ICP se precisan más estudios42–44.
Gupta et al.5 en una revisión de casos y series de casos publicados encontraron que la tasa de rechazo con monoterapia con anti-cTLA-4 (ipilimumab) fue del 33% en comparación con el 52% en pacientes que recibieron monoterapia con anti-PD-1. Es difícil sacar una conclusión definitiva porque los pacientes habían sufrido diferentes reducciones o cambios en la inmunosupresión en el momento del diagnóstico de cáncer metastásico, lo que podría influir fuertemente en las tasas de rechazo. Se precisan pues más estudios.
Se ha visto que un aumento de la inmunosupresión en el momento del inicio del ICP o el uso de inhibidores de mTOR se asoció con un menor riesgo de rechazo41. Factores como la duración del trasplante, historia de anticuerpos donante específicos o una historia previa de rechazo son también importantes para considerar los riesgos.
El estudio de Murakami et al. es un estudio observacional multicéntrico reciente que examinó la seguridad y eficacia de los ICP en 69 pacientes con trasplantes de riñón de 23 instituciones41. El estudio mostró que el 42% de los pacientes experimentaron un rechazo agudo del aloinjerto con una mediana de aparición de 24 días desde el inicio de la ICP hasta el rechazo. Una vez que se produjo el rechazo, el 65% de los pacientes experimentaron fracaso del aloinjerto y requirieron diálisis. Un reciente estudio multicéntrico de un solo brazo analizó 17 pacientes de >18 años con trasplante renal, tratados con nivolumab por cáncer incurable, localmente avanzado o tumores sólidos metastásicos con un nivel de creatinina <180mmol/L, y ninguna o bajas concentraciones de anticuerpos HLA específicos del donante. No se realizaron modificaciones en su inmunosupresión basal, lo que no afectó a la eficacia tumoral del ICP (similar a la descrita en esta población), obteniendo además unas tasas de rechazo inferior (12%) a lo previamente publicado. No hubo muertes relacionadas ni eventos adversos graves relacionados con el tratamiento45.
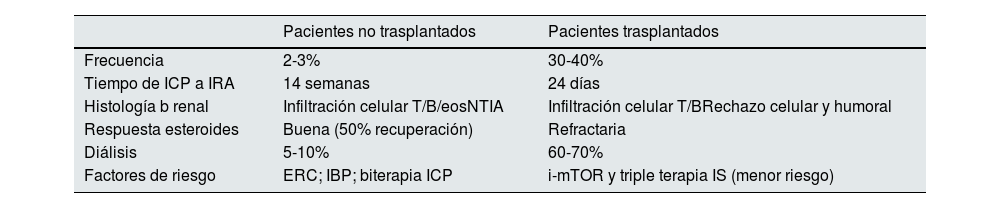
En la tabla 6 podemos ver las características diferenciales de la IRA entre los pacientes no trasplantados (NTIA generalmente) y los trasplantados (rechazo celular y humoral). En estos es mucho más frecuente, aparece más precozmente, es resistente a esteroides y con alto porcentaje de pérdida del injerto46.
Características clínicas de IRA asociada a tratamiento con ICP
| Pacientes no trasplantados | Pacientes trasplantados | |
|---|---|---|
| Frecuencia | 2-3% | 30-40% |
| Tiempo de ICP a IRA | 14 semanas | 24 días |
| Histología b renal | Infiltración celular T/B/eosNTIA | Infiltración celular T/BRechazo celular y humoral |
| Respuesta esteroides | Buena (50% recuperación) | Refractaria |
| Diálisis | 5-10% | 60-70% |
| Factores de riesgo | ERC; IBP; biterapia ICP | i-mTOR y triple terapia IS (menor riesgo) |
eos: eosinófilos; ERC: enfermedad renal crónica; IBP: inhibidores de la bomba de protones; ICP: inhibidores de los check-point; IRA: insuficiencia renal aguda; NTIA: nefritis túbulo intersticial aguda.
El bloqueo de CTLA-4 y PD-1 aumenta la activación de las células T, no sólo contra las células malignas, sino también contra otras células que expresan antígenos extraños, como los antígenos de donantes de aloinjertos renales. PD-1 y PD-L1 se pueden encontrar en el aloinjerto y sus células T reactivas43. Esta activación de las células T podría conducir a un rechazo celular agudo y las células T CD4 activadas podrían conducir a la proliferación y activación de las células B a través de ligandos coestimuladores (p. ej., CD40L) y citocinas (p. ej., IL-4, IL-21 e interferón-γ) que conducen a rechazo mediado por anticuerpos, especialmente si se reduce la inmunosupresión47. Las células B también pueden activarse como un efecto directo sobre las células B de memoria que expresan PD1 si hubo una sensibilización previa del órgano trasplantado o una disminución de los medicamentos inmunosupresores44.
Estrategias preventivas para control del rechazo en pacientes trasplantados con cáncer bajo tratamiento con ICPHasta el momento hay muy pocos casos publicados, pero parece que los inhibidores de PD-1 podrían ser más propensos que los antagonistas de CTLA-4 a causar rechazo en el riñón trasplantado. Esto es especialmente cierto cuando los pacientes reciben agentes anti-CTLA-4 antes del tratamiento con inhibidores de PD-148.
Hay contradicción en el efecto que los corticoides puedan hacer sobre la respuesta antitumoral de los ICP en estos casos. En algunos ensayos, podría haber disminuido la respuesta antitumoral de los ICP49, mientras que en otros la supervivencia general y el tiempo hasta el fracaso del tratamiento no se vieron afectados por el uso de glucocorticoides sistémicos50.
Barnett et al.48 publicaron el caso de un paciente trasplantado de riñón con nefrectomía bilateral previa por cáncer renal y con diagnóstico de adenocarcinoma metastásico en tratamiento con nivolumab. Recibió pauta de esteroides descendente, iniciada una semana antes de la introducción del ICP y el tacrolimus fue sustituido por sirolimus con buena evolución del cáncer y función renal estable. El uso de inhibidores de mTOR (everolimus, temsirolimus y sirolimus) ha sido bien estudiado en muchos tipos de cáncer y en este paciente, sirolimus pudo haber jugado un papel antitumoral sinérgico además de ser un agente inmunosupresor. Jhaveri refiere una decena de pacientes con este enfoque terapéutico con buena evolución46.
Sin embargo, los inhibidores de mTOR están asociados con un mayor riesgo de rechazo que los anticalcineurínicos. Dependiendo del riesgo inmunológico entre el órgano donante y el receptor, la decisión de reducir o interrumpir la inmunosupresión debe equilibrarse con el mayor riesgo de rechazo con ICP. Se necesitan más estudios, y de hecho hay varios ensayos clínicos, entre ellos para evaluar el efecto potencial de los minipulsos de esteroides profilácticos con ciclos ICP y la conversión de CNI a inhibidores de mTOR, tanto en la tasa de rechazo como en la respuesta del cáncer.
Posicionamiento del grupo de Onconefrología de la SEN sobre el manejo del paciente trasplantado renal con cáncer recibiendo tratamiento con IPC- 1.
La decisión de iniciar tratamiento con ICP en pacientes trasplantados de riñón es compleja y debe ser multidisciplinar, con la correcta información al paciente acerca de los riesgos y beneficios.
- 2.
Debe considerarse en la decisión: la duración del trasplante, historia de anticuerpos donante específicos, historia previa de rechazo o el tipo de inmunoterapia a utilizar (mayor riesgo de rechazo en anti-PD1 y anti-PDL1).
- 3.
Desestimar el tratamiento con inmunoterapia si hay tratamiento alternativo.
- 4.
Considerar aumentar o reiniciar corticoides previamente al tratamiento y valorar la idoneidad de inhibidores mTOR.
Sin financiación.
Conflicto de interesesM.J. Soler declara haber recibido honorarios por conferencias y asesoría científica de Astra Zeneca, Novo Nordsik, Esteve, Vifor, Bayer, Mundipharma, Ingelheim Lilly, Jansen, Fresenius, ICU Medical, Travere Therapeutics, y Boehringer.
El resto de autores no declara ningún conflicto de interés para este trabajo.