El adecuado control del fósforo sérico en pacientes con enfermedad renal crónica (ERC) sigue siendo un gran desafío. Durante los últimos 5 años se han buscado distintas alternativas terapéuticas para solucionar este problema. Dentro de ellas el carbonato de lantano ha demostrado su eficacia, estudios recientes sugieren un efecto beneficioso sobre el sistema óseo y vascular y sobre supervivencia.
LA BÚSQUEDA DEL CAPTOR DE FÓSFORO IDEAL
La hiperfosforemia tiene una prevalencia elevada en pacientes con enfermedad renal crónica (ERC)1, siendo un factor patogénico de gran importancia dentro del campo de las alteraciones del metabolismo mineral y óseo en la ERC (CKD-MBD). La hiperfosforemia se ha asociado con el hiperparatiroidismo secundario1, calcificaciones vasculares2, rigidez vascular3, disfunción miocárdica y mortalidad1, por lo que históricamente se han buscado captores de fósforo eficaces y seguros para poder solucionar este importante problema de las fases más avanzadas de la ERC.
Entre 1975 y 1990, el hidróxido de aluminio fue el captor de fósforo utilizado con mayor frecuencia; tras dicho período prolongado de uso, se constató un riesgo elevado de acumulación y toxicidad del aluminio, que se manifestaba como demencia, supresión de hormona paratiroidea (PTH), osteomalacia y anemia4. Las sales de calcio (carbonato y acetato) fueron sustituyendo progresivamente al hidróxido de aluminio como captor de fósforo, pero posteriormente también se pusieron de manifiesto los efectos nocivos de su uso prolongado. La administración de captores de fósforo cálcicos produce con frecuencia hipercalcemia, más aún cuando se asocia con el uso de distintas formas de vitamina D4, tanto en sus formas nativa como activa. Además, se ha demostrado que con gran frecuencia su utilización se asocia con supresión excesiva de PTH, inducción de enfermedad ósea adinámica (EOA)5 y riesgo de progresión de calcificaciones vasculares.
En consecuencia, tanto el hidróxido de aluminio como las sales cálcicas pueden favorecer la aparición de formas de osteodistrofia renal de bajo remodelado, de las que se conocen dos formas histológicas: la osteomalacia y la EOA6. En la osteomalacia existe un defecto importante de mineralización sin alteración en la formación de matriz ósea; en consecuencia, se acumula osteoide no mineralizado. En la EOA existe una mínima o nula formación de matriz ósea con pocos o ningún osteoblasto y la mineralización está disminuida en similar magnitud a la disminución de matriz ósea, debido a que no hay osteoide para poder ser mineralizado6,7.
El uso de hidróxido de aluminio fue responsable del incremento de osteomalacia y de EOA inducidas por aluminio observada en pacientes con insuficiencia renal crónica en los años antes citados. A partir de la generalización del uso de tratamientos de agua adecuados y de la progresiva reducción de la utilización de hidróxido de aluminio como captor de fósforo, las formas de osteodistrofia renal inducidas por aluminio se redujeron de un modo importante. Esto no ha significado que otras formas de osteodistrofia de bajo remodelado hayan seguido una evolución similar. Por el contrario, en las últimas dos décadas la prevalencia de la EOA ha aumentado, siendo en la actualidad el tipo de lesión ósea más frecuente en pacientes con ERC estadio 3-5. Este incremento se ha debido no al aluminio, sino a otros factores, algunos no modificables, como son la mayor prevalencia de diabetes y el envejecimiento de la población de diálisis, pero también a otros modificables, como son la utilización de captores de fósforo con calcio, análogos de vitamina D a dosis elevadas y líquidos de hemodiálisis con alta concentración de calcio. Todos estos factores favorecen una excesiva supresión de PTH condicionando una baja actividad ósea y una capacidad reducida de incorporación de calcio al hueso, con el consecuente aumento del riesgo de fracturas y de calcificaciones extraesqueléticas, hechos que pueden redundar en una mayor morbimortalidad.
Las complicaciones y limitaciones asociadas al uso de captores de fósforo que contienen aluminio o calcio ha llevado a la búsqueda de nuevos captores que permitan reducir la absorción intestinal de fósforo sin producir los efectos nocivos a nivel óseo y vascular descritos con el uso prolongado de los primeros. Varios estudios han demostrado una menor progresión de las calcificaciones vasculares en pacientes que reciben captores de fósforo no cálcicos, como sevelamer y carbonato de lantano8-11. El objetivo de esta revisión es aportar información sobre el efecto del uso del carbonato de lantano sobre el remodelado óseo, calcificación vascular y supervivencia.
CARBONATO DE LANTANO Y REMODELADO ÓSEO
El lantano, base fundamental de esta sal, es un elemento que se encuentra en la naturaleza y pertenece al grupo «tierras raras» que forman sales de baja solubilidad y escasa absorción, propiedad que se ha aprovechado para su uso como captor intestinal de fósforo12. En humanos, la absorción sistémica del lantano es muy baja (0,00089 %)13 y no difiere significativamente entre pacientes en diálisis y en personas con función renal normal14. El lantano se elimina casi exclusivamente por vía biliar y solo menos de un 2 % lo hace por vía renal. Estudios experimentales han demostrado que la utilización crónica de carbonato de lantano se puede asociar con presencia de lantano a nivel de canalículos biliares y lisosomas hepáticos y que, tras períodos prolongados de uso, el lantano se deposita en concentraciones bajas en el hueso (concentraciones medias de 1,8 µg/g)14-16. Si bien inicialmente algunos estudios alertaron sobre posibles riesgos de toxicidad hepática debido a su metabolización y eliminación hepática, publicaciones recientes han mostrado un perfil hepático satisfactorio sin signos de toxicidad. Además, otros estudios han demostrado su buen perfil de seguridad a nivel de eritropoyesis, funciones cognitivas y remodelado óseo17,18.
Dado que el carbonato de lantano se deposita en concentraciones bajas en el hueso, se ha especulado sobre su posible impacto sobre el remodelado óseo. Estudios diseñados específicamente para esclarecer el perfil de absorción, metabolización y depósito del carbonato de lantano han demostrado que la absorción y el depósito de lantano son limitados, alcanzando una meseta después de un año de uso; posteriormente los niveles de lantano en hueso se mantienen dentro del rango antes mencionado19-21.
Corroboran este comportamiento los datos publicados por Spasovski et al.22, quienes compararan niveles séricos y óseos de lantano en pacientes en diálisis que recibieron carbonato de lantano durante un año, y posteriormente carbonato de calcio dos años, con un grupo que únicamente recibió carbonato de calcio durante los tres años. El primer grupo mostró aumento inicial de lantano sérico que se estabilizó en 0,6 ng/ml, acorde con la ya referida baja absorción del lantano en humanos23,24. Al suspender el tratamiento, la concentración plasmática de lantano disminuyó rápidamente, siendo no obstante detectable en suero hasta dos años después de la administración de este, hallazgo explicable por las dos fases del perfil de eliminación hepática del lantano, una inicial rápida y otra prolongada y lenta. Además, al año de tratamiento ningún paciente tratado con carbonato de lantano presentó bajo remodelado, en contraste con el grupo de carbonato de calcio, donde tres pacientes desarrollaron EOA.
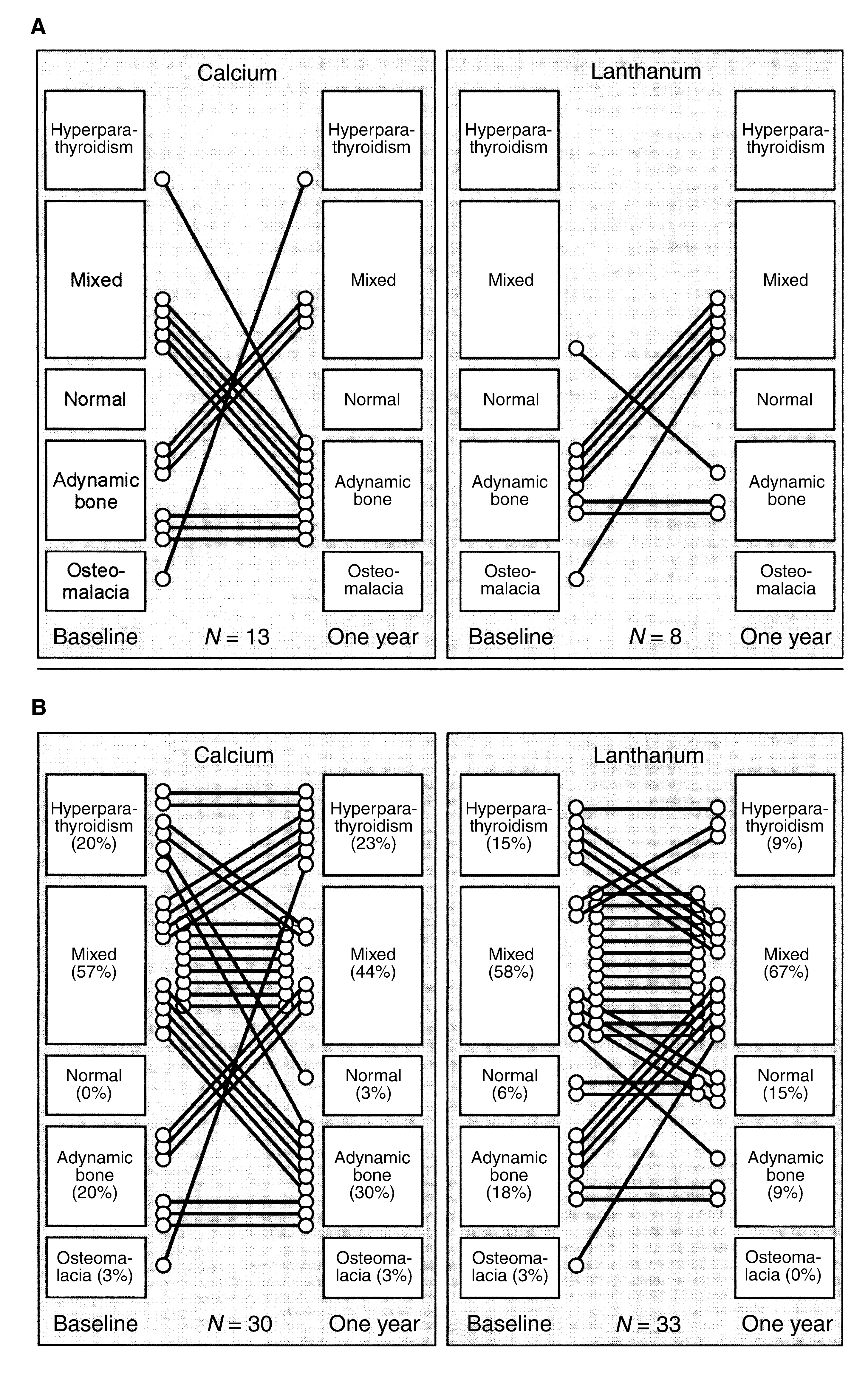
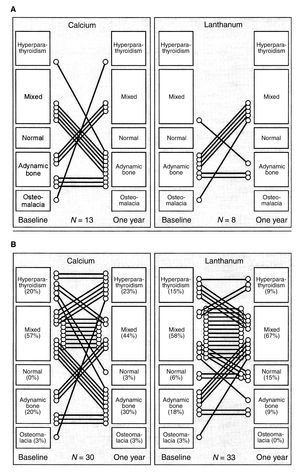
A nivel óseo, tanto en estudios en humanos22 como experimentales25, el carbonato de lantano ha demostrado que no modifica ni el número ni la actividad de los osteoblastos. Además, la concentración de lantano en hueso no se relaciona con defectos en remodelado óseo ni en mineralización19,20,22,26. Por el contrario, se ha demostrado un efecto beneficioso del carbonato de lantano sobre el hueso, con una tendencia a la normalización de los parámetros histomorfométricos óseos y una mejora del recambio óseo19,20 (figura 1).
Los primeros datos sobre seguridad y un efecto positivo del carbonato de lantano sobre el remodelado óseo fueron publicados por D’Haese et al.19, quienes mostraron en un estudio realizado con biopsias óseas pareadas que tras un año con carbonato de lantano no se observó disminución del remodelado óseo. Por el contrario, la utilización de carbonato de lantano se asoció con una mejora en este, en contraste con el descenso del remodelado observado en los pacientes que recibieron carbonato cálcico (figura 1). Similares resultados a más largo plazo fueron publicados posteriormente por Malluche et al.20, confirmando que el uso prolongado de carbonato de lantano se asocia con mejoría del remodelado óseo, objetivado por un aumento en la frecuencia de activación y en la velocidad de formación ósea. La mayoría de estos cambios positivos se observaron durante el primer año de tratamiento, si bien los efectos sobre volumen óseo se observaron después de dos años de uso. Estos datos indican que el tratamiento con carbonato de lantano representa una opción segura y beneficiosa para el manejo de pacientes con EOA7.
A nivel bioquímico, los cambios secundarios al uso de carbonato de lantano han sido poco relevantes. Si bien en ocasiones se han observado incrementos de fosfatasa alcalina y fosfatasa ácida tartrato resistente20,27, estas variaciones no se han detectado si los pacientes recibían análogos de vitamina D28. No se han observado cambios en otros marcadores bioquímicos, incluidos los niveles de osteoprotegerina27. A nivel experimental, el cloruro de lantano ha mostrado ser capaz de activar al sensor del calcio y modular la PTH29; no obstante, en clínica, las implicaciones de este efecto probablemente sean irrelevantes. De hecho, en pacientes en hemodiálisis, el efecto del carbonato de lantano sobre la PTH es mínimo comparado con el habitual efecto supresor sobre la PTH que ejercen los captores de fósforo que contienen calcio19,22,28. Por último, y en relación con los niveles de factor de crecimiento fibroblástico 23 (FGF-23) que son estimulados por elevaciones de fósforo y calcitriol30, el carbonato de lantano ha mostrado ser capaz de disminuirlos, respuesta que no se observó con la utilización de carbonato cálcico administrado de forma aislada, pero sí cuando se asoció con carbonato de lantano31.
CARBONATO DE LANTANO Y CALCIFICACIÓN VASCULAR
Muchos estudios han analizado las causas de calcificación vascular acelerada en pacientes con ERC, analizando el papel que podrían jugar el fósforo y los captores de fósforo. En general se ha observado que, independientemente del control de fósforo sérico, parece existir una relación directa de sobrecarga de calcio –secundaria al uso de captores de fósforo cálcicos– con progresión de la calcificación vascular32,33 y con rigidez vascular. No obstante, recientemente un estudio en pacientes con ERC 3-4 ha mostrado resultados contradictorios34, dado que la reducción de los niveles de fósforo sérico se ha asociado paradójicamente con incremento en calcificación coronaria y aórtica34.
Si bien la mayor parte de los beneficios atribuidos a la utilización de captores de fósforo siempre se han puesto en relación con el control del fósforo sérico, otra parte del beneficio podría deberse a otros factores, tales como la reducción de colesterol ligado a lipoproteínas de baja densidad (LDL)10 y a otros efectos pleiotrópicos que podrían colaborar en la reducción de la progresión de calcificaciones vasculares8,9. La utilización de carbonato de lantano se ha asociado con estos posibles beneficios, como lo demuestra un trabajo reciente en pacientes en hemodiálisis seguidos durante 18 meses mediante tomografía axial computarizada, en los que se observó una menor progresión en calcificación aórtica y una tendencia al descenso de calcificación en la arteria femoral superficial en aquellos que recibieron carbonato de lantano comparados con los que recibieron carbonato de calcio, pese al similar control en ambos grupos de los niveles de fósforo sérico11.
Otro estudio reciente en hemodiálisis centrado en la evolución de las calcificaciones coronarias y función endotelial demostró que, tras 12 meses y similar control de fósforo sérico, los pacientes que recibieron carbonato de lantano tuvieron una menor progresión de calcificaciones coronarias, comparados con la terapia estándar, que incluía tratamiento con captores cálcicos y/o sevelamer, aunque no se observaron diferencias en la función endotelial35.
Resultados positivos con carbonato de lantano también se han publicado en experimentación animal, donde se ha observado una menor progresión de calcificaciones aórticas y un menor grado de ateroesclerosis, beneficios atribuidos al descenso de la fosforemia y a la menor producción de colágeno tipo I en la pared arterial36. No solo los estudios realizados en ratas con insuficiencia renal crónica37 sino también los realizados en células de músculo liso vascular han coincidido en observar que el lantano se asocia con disminución de la progresión de calcificación vascular38.
En resumen, tanto a nivel clínico como experimental los estudios con carbonato de lantano sugieren un efecto beneficioso de este captor de fósforo sobre la aparición y/o progresión de calcificación vascular.
CAPTORES DE FÓSFORO Y SUPERVIVENCIA
Los niveles elevados de fósforo se han asociado con mayor mortalidad cardiovascular1 en pacientes con enfermedad renal crónica; no obstante, existen todavía pocos datos sobre el posible beneficio del uso de captores de fósforo. Se ha sugerido que su administración podría aumentar la supervivencia de pacientes en diálisis incluso en pacientes con fósforo sérico normal. Isakova39, en una larga cohorte de pacientes incidentes en hemodiálisis, observó que el tratamiento con cualquier tipo de captor de fósforo se asoció de forma independiente con una menor mortalidad en comparación con pacientes que no recibían captores de fósforo.
Dos ensayos clínicos han comparado el efecto de sevelamer y captores de fósforo cálcicos en pacientes en hemodiálisis incidentes y prevalentes40,41 observando, tras uno y dos años de seguimiento, beneficios del sevelamer. Otro estudio reciente en pacientes con ERC 3-5 también ha observado ventajas42. Parte del efecto beneficioso se ha asociado a la reducción del colesterol (total y LDL)43, de la hemoglobina glicosilada y de parámetros inflamatorios44.
También hay datos en el mismo sentido con carbonato de lantano, que ha mostrado, en pacientes en hemodiálisis seguidos durante 2 años45, que los mayores de 65 años obtuvieron beneficios en supervivencia. Tanto en este estudio como en otro previo41 se ha observado un mayor efecto en la población más añosa, posiblemente en relación con una mayor posibilidad de eventos cardiovasculares a esa edad. Datos recientes del estudio COSMOS46 también han mostrado, tras 3 años de seguimiento, que la utilización de captores de fósforo, excepto los que contienen aluminio, se asoció con mejor supervivencia.
Dada la importancia del posible impacto positivo del uso de captores de fósforo sobre supervivencia y el hecho de que la información disponible se basa en estudios prospectivos pero de asociación, parece necesario estimular la realización de estudios clínicos prospectivos aleatorizados y controlados que permitan confirmar estas interesantes ventajas de la utilización de captores de fósforo en la ERC39,46,47.
Agradecimientos
A M.ª Luisa Rodríguez González, por su colaboración en la preparación de este manuscrito.
A ISCIII, REDinREN, FICYT y FRIAT por su apoyo a la investigación sobre Metabolismo Óseo y Mineral (FIS: 07/0893;08/90136;08/9008;09/00415;10/00896;11/00667, RD06/0016/1013, FICYT: IB09-033; COF 11-02 ; COF11-05).
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Figura 1. Evolución de la enfermedad ósea tras un año de tratamiento con carbonato de lantano