En los últimos años se está observando un aumento de la incidencia de fracaso renal agudo, así como un incremento en la morbimortalidad asociada con el mismo. Recientes estudios revelan que el fracaso renal agudo es un factor de riesgo mayor para el desarrollo de complicaciones no renales y que contribuye d emanera independiente a la mortalidad del paciente. Esto, junto con el mejor conocimiento de las fases evolutivas y de los mecanismos moleculares de disfunción renal, ha suscitado el interés por conseguir una detección precoz de la lesión renal mediante nuevos biomarcadores de daño renal, que pudieran contribuir en un futuro a una nueva definición universal de fracaso renal agudo. De momento, nuevas clasificaciones funcionales (RIFLE, AKIN y cinética) avanzan para establecer una definición consensuada, pero en la práctica continuamos basándonos en el descenso del filtrado glomerular y/o en la elevación de productos nitrogenados. Se ha clasificado el fracaso renal agudo en tres categorías de severidad, con probado valor pronóstico. No obstante, sigue estando vigente la clasificación según el elemento funcional alterado: prerrenal, parenquimatoso y obstructivo. La existencia de una concentración elevada de productos nitrogenados y/o disminución de la diuresis nos obliga a iniciar un proceso deductivo que nos permita conocer el tipo de insuficiencia renal y averiguar su etiología. Para ello nos basaremos en una historia clínica cuidadosa, con una anamnesis precisa de los antecedentes personales, una exploración física detallada y la utilización secuencial y ponderada de pruebas complementarias. Abordaremos el diagnóstico diferencial desde cuatro puntos de vista: sindrómico, funcional, fisiopatológico y etiológico.
INTRODUCCIÓN
El fracaso renal agudo (FRA) es un síndrome clínico, secundario a múltiples etiologías, que se caracteriza por un deterioro brusco de la función renal, cuya expresión común es un aumento de la concentración de los productos nitrogenados en sangre, con/sin disminución del volumen urinario.
Ante todo deterioro de la función renal, debemos poder distinguir ante qué tipo de insuficiencia renal nos encontramos, y al mismo tiempo, intentar descubrir su etiología. Para ello, nos apoyaremos en tres actuaciones básicas1:
1. La realización de una historia clínica detallada que incluya la anamnesis de los antecedentes personales.
2. Una exploración física minuciosa.
3. La utilización de las diferentes pruebas diagnósticas complementarias de forma escalonada en función de su eficacia e inocuidad para el enfermo.
Es importante recordar que el fracaso renal agudo en múltiples ocasiones es multifactorial, especialmente aquel que se desarrolla en el ámbito hospitalario. Y, además, es un proceso dinámico y puede evolucionar de un estadio a otro más grave.
Debemos abordar el diagnóstico diferencial del FRA desde cuatro puntos de vista (tabla 1):
1. Diagnóstico sindrómico, ¿deterioro agudo o crónico?
2. Diagnóstico funcional, ¿cuánto se ha deteriorado la función renal?
3. Diagnóstico fisiopatológico, ¿prerrenal, parenquimatoso u obstructivo?
4. Diagnóstico etiológico, ¿qué causa lo produce?
DIAGNÓSTICO SINDRÓMICO
Un aspecto importante en la evaluación del paciente con enfermedad renal es conocer la duración la enfermedad, de tal forma que conociendo ésta, el diagnóstico diferencial puede limitarse con frecuencia. Habitualmente, cuando la elevación de productos nitrogenados o bien las alteraciones en los parámetros urinarios se desarrollan en el plazo de horas o días estaremos ante un proceso agudo; si la evidencia de enfermedad renal se extiende a varias semanas representa un proceso rápidamente progresivo (subagudo) y, por último, cuando es conocido desde meses o años llevará un curso crónico, pero que puede asociarse con exacerbaciones agudas.
La etiología del FRA es muy amplia y debemos considerar que su distribución puede variar con la región geográfica e incluso con el tipo de hospital. En el estudio de Madrid (GEFRAM), en el que se evaluaron 748 casos de FRA en 13 hospitales, las causas más frecuentes fueron: necrosis tubular aguda en el 45%, prerrenal en el 21%, enfermedad crónica agudizada en el 13% (principalmente por necrosis tubular aguda o enfermedad prerrenal) y obstructiva en el 10% de los casos2. En otro estudio, realizado en 5 unidades de cuidados intensivos en Estados Unidos: Program to Improve Care in Acute Renal Disease (PICARD), incluyen a 618 pacientes, siendo las principales causas de FRA: necrosis tubular aguda (isquémica y tóxica), en torno al 70%, prerrenal en el 16%, y la patología obstructiva representó apenas el 1% de los casos3. Se han realizado pocos estudios sobre la etiología del FRA en pacientes con enfermedad renal crónica. En un estudio retrospectivo, realizado sobre 104 casos de enfermedad renal crónica en China, las causas del FRA se atribuyeron a necrosis tubular aguda/nefritis intersticial por fármacos en el 36% de los casos y a enfermedad prerrenal en el 24%. La necesidad de diálisis, el antecedente de hipertensión y los niveles más elevados de creatinina sérica fueron factores predictores independientes de escasa recuperación renal4.
Por todo ello, ante un paciente con elevación de los productos nitrogenados en sangre, la primera pregunta que debemos plantearnos es si nos encontramos ante un caso de insuficiencia renal crónica o de FRA. La distinción entre estas dos situaciones, en ocasiones, resulta difícil.
Inicialmente, deberemos averiguar la posible existencia de controles analíticos previos de la función renal obtenidos en controles rutinarios, o bien por procesos patológicos anteriores, que nos permitan conocer si el deterioro actual es agudo o crónico, así como conocer antecedentes personales o familiares de enfermedad renal u otras enfermedades sistémicas con afectación renal frecuente (p. ej., diabetes). Por otro lado, los controles analíticos posteriores serán muy orientativos: en casos de FRA el incremento diario de la creatinina sérica debe ser mayor a 0,3 mg/dl/día, mientras que en la insuficiencia renal crónica los valores de creatinina continuarán siendo constantes.
En ausencia de datos previos de la función renal, la existencia de síntomas como anorexia, astenia, calambres, náuseas, vómitos matutinos, poliuria, nicturia, etc., de larga evolución, orientan hacia un proceso crónico. El tinte urocromo prácticamente descarta el FRA. La anemia bien tolerada, la hipocalcemia, la hiperfosforemia y la acidosis metabólica no justificadas por otros motivos indican habitualmente un proceso crónico, aunque no hay que olvidar que estas alteraciones analíticas también pueden observarse en un paciente con FRA5.
Con todas las consideraciones previas, la distinción entre enfermedad renal aguda o crónica puede seguir siendo incierta. Necesitamos del apoyo de otras pruebas complementarias, así como de la observación de la evolución clínica del paciente.
FASES DEL FRACASO RENAL AGUDO
La forma más severa de FRA es la necrosis tubular aguda (NTA) y se caracteriza por la lesión subletal y letal de las células tubulares, principalmente en las porciones distales del túbulo proximal y en la porción ascendente gruesa del asa de Henle. En la fisiopatología de la isquemia renal aguda están implicados factores hemodinámicos, lesión tubular y procesos inflamatorios.
Clásicamente, el FRA isquémico se ha dividido en tres fases: iniciación, mantenimiento y recuperación. Recientemente Sutton et al. han establecido una fase de extensión de vital importancia en la fisiopatología del FRA6. Con ello se reconocen cinco estadios fisiopatológicos en el curso de la NTA (figura 1):
1. Agresión hemodinámica o tóxica (prerrenal, en inglés). Realmente podemos considerar que forma un continuo con la fase de iniciación. Ocurre cuando disminuye el flujo sanguíneo renal, pero se mantiene la integridad celular.
2. Fase de iniciación. Aparece cuando el descenso del flujo sanguíneo renal provoca una depleción de ATP. Se produce la lesión de la célula tubular epitelial (pérdida de microvilli, exfoliación, etc.).
3. Fase de extensión. Se caracteriza por la persistencia de la hipoxia y la repuesta inflamatoria, ambos eventos más pronunciados en la unión corticomedular. Es en esta fase en la que la disfunción de la célula endotelial desempeña un papel fundamental: alteración de la permeabilidad, estado procoagulante, alteración en la regulación de las células proinflamatorias, liberación de citoquinas, etc. Se produce muerte celular: necrosis y apoptosis.
4. Fase de mantenimiento. En ella, las células comienzan a repararse: desdiferenciación, migración, apoptosis, proliferación en un intento de mantener la integridad celular y tubular.
5. Fase de recuperación. Se mantiene la diferenciación celular y se restablece la polaridad epitelial.
DIAGNÓSTICO FUNCIONAL
No existe una definición universal de insuficiencia renal aguda. En general, todas las definiciones de insuficiencia renal aguda subrayan el carácter inmediato del deterioro funcional renal y la importancia del descenso brusco del filtrado glomerular y/o la elevación de los productos nitrogenados en sangre, como marcador universal de la insuficiencia renal aguda independiente de su etiología7.
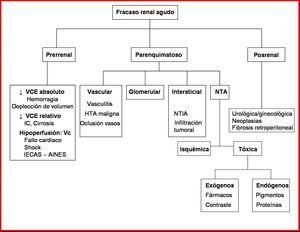
El conocimiento de que el funcionamiento renal requiere tres premisas: una perfusión sanguínea adecuada, la integridad del parénquima renal y la permeabilidad de las vías excretoras, nos permite clasificar la insuficiencia renal aguda, dependiendo del elemento funcional alterado, como prerrenal si lo que falla es la perfusión renal; parenquimatosa, si la alteración se produce en las estructuras renales, y obstructiva o posrenal si el flujo urinario está obstruido. Esta clasificación ha sido utilizada de modo universal en los últimos 50 años y continúa vigente en la actualidad, además ha servido de base para la mayoría de los estudios epidemiológicos realizados en este período8.
Desde un punto de vista operativo, cada autor utiliza una definición particular para identificar el grupo de enfermos que incluye en su estudio (definición instrumental)7. Estas definiciones varían desde considerar el valor absoluto de creatinina sérica, el incremento de ésta, la determinación del filtrado glomerular o el volumen de diuresis. En ocasiones sólo se estudian situaciones particulares, como enfermos ingresados en la UCI o sólo los tratados con técnicas dialíticas.
Ante esta disparidad de criterios, en la última década se han formado diferentes grupos de estudio como Acute Dialysis Quality Initiative (ADQI) y de redes de trabajo como Acute Kidney Injury Network (AKIN) para desarrollar recomendaciones consensuadas y guías clínicas basadas en la evidencia sobre el tratamiento y prevención de la insuficiencia renal aguda. Reconocen la necesidad de unificar la definición del FRA, pero hasta la fecha sólo han consensuado diferentes clasificaciones funcionales.
Por su universalidad, bajo coste y frecuencia de uso, la determinación de creatinina ha sido el patrón utilizado para la práctica clínica en el diagnóstico y tratamiento de la insuficiencia renal aguda. Sin embargo, adolece de varios inconvenientes: se eleva cuando el filtrado glomerular ha descendido a la mitad; su concentración se ve muy influida por los cambios en la masa muscular, por el aumento de la secreción tubular en presencia de deterioro funcional y por numerosos factores extrarrenales como peso corporal, raza, edad, sexo, etc. En resumen, el filtrado glomerular por el aclaramiento de creatinina no parece una herramienta exacta en situaciones metabólicas inestables como las que acompañan a la insuficiencia renal aguda. Sin embargo, los datos de Herrera et al., que utilizan aclaramientos de creatinina realizados en 2 horas en enfermos críticos, es sencillo y puede ser de utilidad9.
Los inconvenientes referidos asociados con el empleo uso de la creatinina posiblemente condicionan el retraso en el diagnóstico precoz de la alteración renal aguda, de forma que cuando ésta se detecta nos encontramos en una fase de daño establecido, particularmente en la forma más grave de FRA, que es la NTA. Tratando de solventar esta situación, gracias a los avances tecnológicos, proteómica, genómica y una nueva consideración fisiopatológica establecida por Sutton et al., el interés por el desarrollo y utilización de nuevos biomarcadores con mayor sensibilidad, especificidad, capacidad pronóstica, localización del daño producido y monitorización de la respuesta al tratamiento se ha disparado en los últimos años.
En resumen, debemos encontrar una o varias sustancias que en el ámbito del FRA cumplan con la definición de biomarcador: «una característica capaz de ser medida de forma objetiva y evaluada como indicador de procesos biológicos normales, o de las respuestas farmacológicas a un tratamiento»10. Las características ideales de un marcador de FRA se resumen en la tabla 211.
Avanzando en este enfoque, varios autores han propuesto el desarrollo de biomarcadores de fase, que conceptualmente hacen referencia a sustancias de un tejido que se liberan en un momento específico con respecto al tiempo en que se produce la lesión12,13. De esta forma, podemos distinguir cuatro tipos de biomarcadores dependiendo de la fase en la que se detecten:
1. Fase 1 o prelesiva: el marcador servirá para identificar sujetos en riesgo.
2. Fase 2 o lesiva precoz: el marcador servirá para identificar la aparición de la lesión.
3. Fase 3 o lesión tardía: servirán para monitorizar la evolución de la lesión y su reparación (3a) y para evaluar la función (3b).
4. Fase 4 o de recuperación: el marcador se utilizará con fines pronósticos.
CLASIFICACIÓN FUNCIONAL DE LA INSUFICIENCIA RENAL AGUDA
Sistema RIFLE
Se desarrolló durante la Segunda Conferencia de Consenso de ADQI celebrada en Vicenza en 200214. RIFLE es el acrónimo de las palabras inglesas correspondientes a riesgo (risk), daño (injury), fallo (failure), pérdida prolongada de función renal (loss) y fallo final e irreversible de la función renal (end). Por tanto, incluye tres etapas de lesión renal y gravedad creciente (risk-injury-failure) y dos de pronóstico clínico (loss-end).
Los parámetros utilizados para estratificar la lesión renal aguda son descensos porcentuales del filtrado glomerular, elevaciones relativas de la creatinina sérica con respecto a un valor basal y el descenso de la diuresis (tabla 3). Tiene en cuenta la presencia de insuficiencia renal crónica previa, así aquellos pacientes con valores de creatinina sérica >4 mg/dl son considerados en estadio F, siempre que el aumento haya sido de, al menos, 0,5 mg/dl.
Para clasificar a un paciente se debe utilizar el peor criterio (creatinina, filtrado glomerular o diuresis) que le sitúe en un mayor estadio de gravedad. El período de tiempo considerado para evaluar los cambios es de 7 días.
Esta clasificación ha demostrado ser útil para diagnosticar la insuficiencia renal aguda y clasificar a los pacientes según su gravedad funcional, pero también ha demostrado su correlación como marcador pronóstico. En una revisión sistemática15 que incluían a más de 71.000 pacientes, se han encontrado 13 estudios que comparan la mortalidad de los pacientes sin y con FRA estimado por el sistema RIFLE. La mortalidad fue del 6,95 y del 31,2%, respectivamente. Cuando analizan el riesgo relativo respecto a los enfermos que no desarrollaron FRA, éste aumentó con la gravedad en la escala RIFLE (R = 2,40; I = 4,15; F = 6,15). Resultados similares se han publicado en España (R = 2,77; I = 3,7; F = 3,52)16.
Clasificación AKIN
Es una modificación del sistema RIFLE, propuesta por la Acute Kidney Injury Network17. Se fundamenta en la aparición de nuevos datos epidemiológicos que demuestran un incremento del 80% en el riesgo de mortalidad con cambios tan mínimos en la concentración de creatinina sérica como de 0,3 a 0,5 mg/dl18. En lugar de utilizar las letras de un acrónimo emplean un sistema de estadios funcionales identificados por números que se corresponden con los tres primeros estadios del RIFLE (tabla 4).
Por tanto, sólo hay dos diferencias entre ambos sistemas: la clasificación AKIN incluye en su estadio 1 pequeños incrementos de la creatinina sérica (0,3 mg/dl) y los cambios observados en la función renal deben producirse en 48 horas.
Añaden dos premisas:
1. Los criterios diagnósticos únicamente deben aplicarse después de optimizar el estado de volemia del paciente.
2. Cuando sólo consideremos la oliguria como criterio diagnóstico, previamente se debe descartar la existencia de uropatía obstructiva.
Cinética de la creatinina
Recientemente se ha cuestionado el empleo de cambios porcentuales de la creatinina en el diagnóstico de insuficiencia renal aguda. Es conocida la relación inversa entre filtrado glomerular y creatinina, pudiendo estimar la elevación de la segunda en función del descenso de la primera, siendo independiente de la función renal basal de la que se parta.
Utilizando un modelo matemático de cinética de la creatinina, Waikar y Bonventre demuestran que los cambios absolutos de la creatinina son capaces de detectar cualquier descenso de la tasa de filtrado glomerular antes que los cambios porcentuales, especialmente en pacientes con enfermedad renal crónica previa19.
Proponen una clasificación que contempla también tres estadios (tabla 5) basados en cambios absolutos fácilmente recordables (0,3, 0,5, 1 y 1,5 mg/dl) en dos intervalos de tiempo definidos (24 y 48 horas). Cada estadio se corresponde con un descenso aproximado del aclaramiento de creatinina: estadio 1, 19-39%; estadio 2, 30-57%; estadio 3, 49-68%.
BIOMARCADORES
Cistatina C
Es un inhibidor de las cisteín proteasas. Es una proteína de bajo peso molecular (13 kD) y carga positiva que se sintetiza y se libera a la sangre de forma relativamente constante por todas las células nucleadas. Se filtra libremente en el glomérulo, se reabsorbe completamente en el túbulo proximal y no es secretada. Los niveles de cistatina no están modificados por la edad, sexo, raza o masa muscular. Es mejor predictor de función glomerular que la creatinina sérica en pacientes con enfermedad renal crónica20.
En el contexto de insuficiencia renal aguda se ha usado en la detección precoz en pacientes críticos. Algunos autores encuentran que un incremento del 50% en la cistatina C sérica predice 1-2 días antes la aparición de insuficiencia renal aguda que la elevación de la creatinina sérica21.
Gelatinasa asociada con lipocalina del neutrófilo (N-GAL)
Es una proteína de 25 kD conocida como siderocalina o lipocalina 2. Habitualmente se expresa a niveles bajos en varios tejidos humanos como riñón, pulmón, estómago y colon. Pertenece a la familia de las lipocalinas. En general son proteínas de pequeño tamaño que tienen la capacidad de unirse a pequeñas moléculas hidrófobas y transportarlas al interior de la célula22. Su expresión está fundamentalmente inducida por el daño epitelial.
N-GAL está emergiendo como un importante biomarcador en la detección precoz de lesión renal aguda tanto isquémica como tóxica, por su rápida expresión y detección en orina. La medición de N-GAL puede verse influida por numerosas variables, como la enfermedad renal previa e infecciones sistémicas y del tracto urinario.
Kidney Injury Molecule (KIM-1)
Es una glicoproteína transmembrana tipo 1 perteneciente a la familia de las inmunoglobulinas, altamente expresada en las células del túbulo proximal tras el daño isquémico o tóxico en modelos animales de FRA23, que puede detectarse en orina a las pocas horas. Por tanto, no es detectable en tejido sano.
Su papel principal se ecnuentra, sin duda, en el diagnóstico diferencial de la necrosis tubular aguda de origen isquémico y secundaria a determinados tóxicos como el cis-platino frente a otros tipos de insuficiencia renal aguda (prerrenal, nefropatía por contraste) o enfermedad renal crónica24, dada su localización específica. Su uso puede venir limitado porque tarda de 12-24 horas en detectarse en orina tras la agresión.
Interleukina 18 (IL-18)
Es una citoquina proinflamatoria mediadora de la inflamación de numerosos órganos. Se induce en el túbulo proximal en respuesta a la isquemia, y se detecta en orina a las pocas horas de la agresión. Sería un biomarcador de diagnóstico precoz, sería de utilidad en el diagnóstico diferencial y tendría valor pronóstico en pacientes con insuficiencia renal aguda. La IL-18 es más específica de necrosis tubular aguda isquémica que de otras formas de necrosis tubular. No se ha visto afectada por la insuficiencia renal prerrenal, la enfermedad renal crónica o la infección del tracto urinario25.
DIAGNÓSTICO FISIOPATOLÓGICO
Las causas principales de FRA se dividen en tres categorías (figura 2)26.
Los pasos que deben seguirse ante la constatación de la elevación de los productos nitrogenados se recogen en la tabla 65.
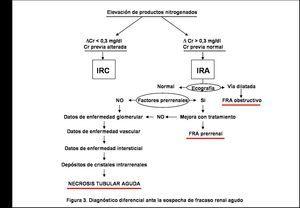
La primera prueba diagnóstica que debe realizarse en todo paciente con deterioro de la función renal es una ecografía abdominal para descartar la existencia de un FRA obstructivo. Además, nos ofrecerá información sobre la morfología renal. Así, la evidencia de unos riñones disminuidos de tamaño nos hará sospechar la existencia de una enfermedad renal crónica (aunque ésta puede cursar con riñones normales e incluso aumentados de tamaño: amiloidosis, poliquistosis, etc.).
El siguiente paso será saber si nos encontramos ante un FRA prerrenal o parenquimatoso. La disminución del volumen circulante, por pérdidas extracorporales (hemorragia, diarrea, diuréticos, etc.), o por redistribución del líquido extracelular (estados edematosos, pancreatitis, etc.) o bien clínica de hipoperfusión renal (insuficiencia cardíaca y shock) nos harán pensar en un origen prerrenal. En estas situaciones pueden observarse hipotensión arterial, ortostatismo y taquicardia. En la exploración podremos apreciar signo del pliegue, sequedad de mucosas e hipotonicidad ocular, aunque su ausencia no descarta una disminución del volumen circulante, a veces sólo apreciable con la medida de la presión venosa central o de la presión capilar pulmonar (estarán disminuidas), o bien valorando la respuesta diurética a la expansión de volumen tras la administración de líquidos intravenosos.
En el FRA prerrenal, como se mantiene la integridad celular y tubular, la función renal mejorará cuando lo haga la causa que lo condiciona. Una vez pautado el tratamiento adecuado si no hay aumento de diuresis y/o descenso de productos nitrogenados, estaremos ante una NTA de origen isquémico.
Si descartamos el origen hemodinámico del FRA, deberemos indagar sobre el antecedente de realización reciente de pruebas diagnósticas (con contraste yodado), administración de nuevos fármacos, hábitos tóxicos (drogas, alcohol, etc.), o el uso de productos de herbolario, por ejemplo, para descartar una etiología medicamentosa y/o tóxica.
Debemos excluir otras causas de FRA parenquimatoso. Sospecharemos enfermedad tromboembólica fundamentalmente en personas mayores, con antecedentes de arterioesclerosis o de patología cardíaca potencialmente embolígena. Cualquier fármaco, con independencia de la dosis, puede dar lugar a una reacción de hipersensibilidad y nos llevará a la sospecha de una nefritis túbulo-intersticial aguda (NTIA), en especial si se acompaña de fiebre, artralgias y exantema morbiliforme. Las NTIA también pueden ser secundarias a infecciones y a enfermedades sistémicas. Las enfermedades glomerulares pueden cursar con FRA si son agudas o si siendo crónicas sufren una exacerbación, especialmente tras un brote extracapilar. En aquellas enfermedades glomerulares que cursan con hematuria (como la nefropatía IgA) el origen del FRA viene determinado por el efecto tóxico directo de los hematíes sobre el epitelio tubular. Si, además, el paciente presenta síntomas sistémicos (anorexia, fiebre, pérdida de peso, artralgias, dolores óseos, hemoptisis, etc.) se sospechará la existencia de una enfermedad glomerular secundaria a enfermedad sistémica: conectivopatías, neoplasias, vasculitis, etc. En un paciente afectado de FRA es fundamental el análisis de orina. La existencia de proteinuria moderada-severa es más frecuente en el FRA parenquimatoso secundario a glomerulonefritis, vasculitis, enfermedades sistémicas y NTIA. El sedimento en la NTA puede mostrar cilindros granulosos y/o hialinos de coloración parduzca debido a detritos celulares del epitelio tubular y la presencia de proteína de Tamm-Horsfall. Un sedimento más activo con diversos cilindros, hematuria y leucocitaria orienta hacia otras formas de FRA parenquimatoso. La eosinofiluria es típica de la NTIA inducida por fármacos.
Existen diferentes índices urinarios que nos pueden ayudar en la distinción entre FRA prerrenal y NTA. Cuando el sodio urinario sea inferior a 20 mmol/l, la osmolaridad urinaria mayor de 500 mOsm/l, la excreción fraccional de sodio (EFNa) menor del 1% y el cociente urinario/plasmático de la urea superior a 10 nos indica un origen prerrenal del FRA (tabla 7). La EFNa es el índice con mayor sensibilidad y especificidad, en general se considera que valores inferiores a 1 sugieren un origen prerrenal y los superiores a 2 se verían en la NTA. Existen excepciones a esta regla, el uso de diuréticos, la insuficiencia renal crónica, la bicarbonaturia, la glucosuria y en la enfermedad de Addison pueden aparecer valores de EFNa superiores a 2 en situaciones de fracaso prerrenal. Y, por el contrario, en las NTA secundarias a mioglobina, hemoglobina y contrastes yodados, la EFNa en muchas ocasiones es inferior a 1. Por ello algunos autores promueven que la excreción fraccional de urea <35% es un índice más fidedigno de FRA prerrenal27. En los casos excepcionales en los que se sospeche una oclusión total bilateral de las arterias renales o bien unilateral en pacientes con riñón único anatómico o funcional, si de forma precoz se puede analizar la orina (ya que rápidamente el paciente queda en anuria) observaremos que las concentraciones urinarias (sodio, creatinina, etc.) son similares a las plasmáticas28.
Completaremos el estudio con la solicitud de diferentes determinaciones sanguíneas más selectivas si sospechamos FRA en el seno de enfermedades sistémicas (pruebas inmunológicas, serologías, marcadores tumorales, entre otras). Ante la sospecha de una causa vascular del FRA se realizará una ecografía-Doppler, y posterior angio-TC o estudios angiográficos convencionales si fueran necesarios, evaluando el riesgo-beneficio por la toxicidad añadida del contraste. En la NTA, con el Doppler evidenciamos un aumento de la resistencia y disminución del flujo arterialen las arterias interlobares, que revierte durante la fase de recuperación. Se procederá a la realización de TC principalmente en los cuadros obstructivos para visualización completa de uréteres y posibilidad de definir la causa de la obstrucción. La biopsia renal se valorará ante la sospecha de enfermedades glomerulares primarias o secundarias, NTIA y en el FRA de más de 2 semanas de evolución.
El diagnóstico de NTA sigue siendo un diagnóstico de exclusión (figura 3).
DIAGNÓSTICO ETIOLÓGICO
Fracaso renal agudo prerrenal
El FRA aparece como consecuencia de multitud de procesos que conduzcan a la disminución de la perfusión renal (tabla 8)17,29,30:
Hipovolemia verdadera
La depleción de volumen intravascular verdadera puede ser secundaria a pérdidas sanguíneas (hemorragia traumática, quirúrgica, digestiva, o del posparto), pérdidas digestivas (diarrea, vómitos, laxantes, abundante débito por sonda nasogástrica), pérdidas renales (diuréticos, diuresis osmótica, diabetes insípida, insuficiencia suprarrenal aguda), aumento de las pérdidas insensibles (fiebre, quemaduras, taquipnea) o incluso la escasa ingesta de alimentos (ancianos, enfermedades neurológicas degenerativas). La depleción del volumen intravascular puede ocurrir también como consecuencia de su paso al espacio intersticial como sucede en el síndrome nefrótico, la malnutrición, la pancreatitis, la peritonitis o el síndrome por aplastamiento.
Hipovolemia efectiva
La disminución del volumen circulante eficaz con volumen intravascular conservado o incluso aumentado puede aparecer en el seno de patologías cardíacas (insuficiencia cardíaca, arritmias, taponamiento cardíaco), patologías pulmonares que afectan al gasto cardíaco (TEP, HTP) o fenómenos que produzcan vasodilatación sistémica y alteración de la permeabilidad vascular (hepatopatía, sepsis, shock anafiláctico, hipoxemia, síndrome de hiperestimulación ovárica y fármacos como la IL-2 o el IFN)31-34.
Vasoconstricción renal
La caída de la perfusión renal se puede producir como consecuencia de la vasoconstricción directa de la circulación renal. Esto ocurre en procesos como el síndrome hepatorrenal, la sepsis, el uso de sustancias alfaadrenérgicas y la hipercalcemia.
Alteración de las respuestas adaptativas renales
Los mecanismo que intentan compensar la disminución de la presión de perfusión renal mediante la vasodilatación de la arteria aferente y la vasoconstricción de la arteria eferente se pueden ver interferidos a uno u otro nivel o a ambos. La causa fundamental es el uso de fármacos, siendo éstos un desencadenante cada vez más frecuente de FRA prerrenal.
Antiinflamatorios no esteroideos
Cuando se detecta el descenso de la presión de perfusión renal en la arteria aferente se produce un aumento de la secreción de prostaglandinas. Éstas promueven, entre otros mecanismos compensadores, la dilatación de la arteria aferente a fin de garantizar la presión de filtración glomerular. Los antiinflamatorios no esteroideos (AINE) actúan inhibiendo la producción de las prostaglandinas y, por lo tanto, impiden la vasodilatación compensadora de la arteria aferente. Los anticalcineurínicos suponen otro grupo de fármacos que producen la vasoconstricción de la arteriola aferente. En ambos casos (AINE y anticalcineurínicos) la vasoconstricción es reversible tras la retirada del fármaco en la mayoría de ocasiones35.
Inhibidores de la enzima de conversión de la angiotensina y antagonistas de los receptores de la angiotensina II
La acción deletérea de los inhibidores de la enzima de conversión de la angiotensina (IECA) y de los antagonistas de los receptores de la angiotensina II (ARA-II) se produce fundamentalmente en la arteriola eferente. Estos fármacos disminuyen la síntesis y la acción de la angiotensina II. Ésta es la principal responsable de la vasoconstricción de la arteriola eferente en las situaciones de hipovolemia, de manera que el bloqueo de su acción impide que se produzca la vasoconstricción compensadora de la arteria eferente, con lo que desciende la presión de perfusión glomerular y secundariamente disminuye el filtrado glomerular. La suspensión del IECA suele revertir la alteración de la función renal.
FRACASO RENAL AGUDO PARENQUIMATOSO
El fracaso renal agudo parenquimatoso puede definirse como un deterioro brusco de las funciones renales condicionado por la lesión anatómica de las distintas estructuras: glomérulos, túbulos, intersticio y vasos.
Este síndrome engloba, por tanto, enfermedades glomerulares agudas o agudizaciones de enfermedades glomerulares crónicas, las diferentes formas de necrosis tubular aguda, enfermedades túbulo-intersticiales agudas y patología vascular como vasculitis, enfermedad ateroembólica o fenómenos de trombosis vascular que condicionan infarto renal.
NECROSIS TUBULAR AGUDA
Es la causa más frecuente de FRA parenquimatoso en general y de forma específica en los pacientes hospitalizados, tal y como se recoge en un estudio realizado en la comunidad de Madrid2. Obedece al daño estructural de las células tubulares, del componente intersticial y de la microvasculatura renal36. Estas alteraciones están condicionadas fundamentalmente por dos tipos de mecanismos:
1. Por isquemia prolongada en el caso de la NTA isquémica.
2. Por tóxicos en el caso de NTA nefrotóxica.
La NTA posee una etiología muy diversa y debido a la creciente complejidad y comorbilidad de los pacientes que tratamos, en la mayoría de los casos, es un proceso multifactorial (tabla 9)37.
FORMAS CLÍNICAS DEL FRACASO RENAL AGUDO PARENQUIMATOSO
Necrosis tubular aguda isquémica
La hipoperfusión renal, fundamentalmente en formas severas o prolongadas de isquemia, puede condicionar la NTA. Los pacientes que presentan hipotensión en el seno de cirugías, sangrado o sepsis, presentan riesgo aumentado para desarrollar NTA isquémica, sobre todo en presencia de otras patologías asociadas. También las formas de FRA prerrenal por hipovolemia o disminución del volumen circulante efectivo por insuficiencia cardíaca o hepatopatía, pueden perpetuarse y condicionar una NTA isquémica.
El proceso subyacente de la NTA isquémica se desarrolla en varias fases, que incluyen la alteración de la perfusión renal (prerrenal), la iniciación, la ampliación, el mantenimiento y la reparación. Estas fases tienen como resultado una importante variedad de cambios histológicos como son la pérdida del borde «en cepillo» epitelial y de las células tubulares, dilatación focal del túbulo proximal, presencia de cilindros intratubulares y áreas de regeneración celular que aparecen durante la recuperación funcional. No obstante, es habitual que exista una disociación entre la severidad del fallo renal y los hallazgos histológicos, por lo que factores se han descrito otros factores que pueden influir en el descenso del filtrado glomerular, como son los siguientes38-41:
1. La obstrucción de los túbulos colectores que podría condicionar descenso de filtrado en un número importante de nefronas.
2. La activación del mecanismo de feedback túbulo-glomerular y la consiguiente vasoconstricción arteriolar por el aumento de concentración de cloruro sódico detectado en la mácula densa.
3. La retrodifusión del fluido tubular en el epitelio dañado.
4. Apoptosis en epitelio proximal y distal.
5. Descenso del flujo sanguíneo en los capilares peritubulares por obstrucción por acumulación leucocitaria.
Clínicamente, se diferencia del FRA prerrenal en que la hipoperfusión renal ocasiona daño en las células tubulares y no se produce recuperación tras la reposición de volumen. La NTA es una complicación frecuente en la isquemia severa y puede observarse en pacientes que han sido sometidos a cirugía mayor o en casos de sepsis, fundamentalmente en pacientes mayores con otras comorbilidades como insuficiencia renal crónica previa, diabetes mellitus, arteriosclerosis o desnutrición42.
Necrosis tubular aguda nefrotóxica
El riñón es un órgano muy vascularizado y presenta una gran capacidad de concentración de sustancias tóxicas en el túbulo. Por ello es especialmente vulnerable a la acción tóxica de numerosas sustancias, fármacos y compuestos orgánicos. También es importante destacar la sinergia que existe entre la hipoperfusión renal y la exposición a determinados agentes nefrotóxicos. Además de la NTA nefrotóxica, los fármacos pueden inducir FRA por otros mecanismos (tabla 10).
Nefrotoxicidad por antibióticos
Los aminoglicósidos son policationes, por lo tanto, presentan una pobre absorción digestiva, una escasa unión a albúmina y una rápida excreción renal mediante filtración glomerular. Producen nefrotoxicidad en el 10-20% de los casos por acumulación en la corteza renal. Se presenta como una NTA no oligúrica entre 7-10 días tras el inicio del tratamiento. En general tiene buen pronóstico, presentando lenta recuperación de función renal, aunque se han descrito casos de nefritis túbulo-intersticial irreversible en pacientes con tratamientos prolongados a altas dosis37,43. Parece que tobramicina es menos nefrotóxica que gentamicina y que estreptomicina es poco nefrotóxica, pero dado el importante riesgo de ototoxidad se utiliza muy poco. De forma experimental, amikacina es la menos nefrotóxica. Para limitar el riesgo de nefotoxicidad se recomienda la administración de los fármacos en una dosis única diaria, a excepción de tobramicina, con la que no se han evidenciado diferencias en cuanto a su acumulación renal en dosis única respecto a infusión continuada.
Las cefalosporinas, la anfotericina B y polimixinas pueden condicionar NTA. La anfotericina B característicamente produce nefrotoxicidad cuando se administra una dosis acumulada por encima de los 2 g. Las formas liposomales de fármaco parece que pueden ser menos nefrotóxicas37.
Otros
Los pigmentos orgánicos como hemoglobina y mioglobina pueden causar FRA. El primer caso se produce en situaciones que condicionen anemia hemolítica como la exposición a ciertos metales, trasfusiones incompatibles o circuitos de circulación extracorpórea. En estas situaciones no suele visualizarse orina sonrosada (ya que el pm de la Hb es de 65.000). En el caso de la rabdomiólisis, tanto el plasma como la orina son sonrosados y es característica la detección de «hemoglobina», en realidad mioglobina, en la tira de orina sin visualización de hematíes en el sedimento. En ambas situaciones deben instaurarse medidas encaminadas a la prevención del FRA como la alcalinización de la orina y el aumento de volumen urinario (mediante expansión de volumen y diurético, si es preciso).
La lista de fármacos nefrotóxicos es larga y en ella se incluyen fármacos inmunusupresores, como el grupo de los anticalcineurínicos; los solventes orgánicos que clásicamente se han empleado en intentos autolíticos; metales, herbicidas o antivirales como el foscarnet.
NEFRITIS TÚBULO-INTERSTICIAL AGUDA
La nefritis túbulo-intersticial aguda (NTIA) se define como la inflamación aguda de los túbulos e intersticio renales. La causa más frecuente de NTIA es farmacológica, con una incidencia de hasta el 71% en algunas series, fundamentalmente la NTIA ligada a antibióticos (hasta en un tercio de los casos), aunque también puede asociarse con trastornos autoinmunes, infecciosos o neoplásicos44.
Las manifestaciones clínicas suelen ser inespecíficas, como náuseas y vómitos o malestar general. La tríada clásica consistente en exantema, fiebre y eosinofilia se presenta sólo en el 10% de los casos. Habitualmente se llega al diagnóstico a través de la historia de exposición a un determinado fármaco (lo que resulta muy complicado en muchas ocasiones, ya que los pacientes suelen estar polimedicados), y a los hallazgos de laboratorio característicos (datos de FRA, eosinofilia, EFNa alrededor del 1% y presencia en el sedimento urinario de leucocitos, hematíes, cilindros leucocitarios y en algunas ocasiones eosinofiluria y manifestaciones similares a las del síndrome de Fanconi)45. El diagnóstico únicamente puede confirmarse mediante biopsia renal, que en ocasiones se retrasa en espera de que la función renal pueda recuperarse tras la suspensión del fármaco, aunque algunos estudios afirman que la instauración precoz de tratamiento con corticoesteroides mejora el pronóstico y se evidencia una mayor recuperación funcional46.
FRACASO RENAL AGUDO VASCULAR
Embolia renal
Se trata de una entidad poco frecuente, pero es importante la realización de un diagnóstico precoz ya que se trata de una entidad con mal pronóstico (con una mortalidad cercana al 30%), y es potencialmente reversible. Cursan con FRA los casos de oclusión completa de las 2 arterias renales y de la arteria en caso de riñón único. Clínicamente se presenta como FRA anúrico, y las concentraciones urinarias de sodio, creatinina y urea se acercan a las concentraciones plasmáticas. En las situaciones de oclusión parcial, puede presentarse deterioro funcional en relación con la zona renal infartada. Pueden asociarse también dolor abdominal en los flancos, periumbilical o en la fosa lumbar, fiebre, náuseas o vómitos47. En la analítica sanguínea suelen evidenciarse datos de citólisis: elevación de LDH, fosfatasa alcalina y GOT. Son útiles para el diagnóstico técnicas como el eco-Doppler y el renograma isotópico, aunque el diagnóstico de certeza se realiza por TC de alta resolución o arteriografía48.
Enfermedad ateroembólica
Es la consecuencia de la liberación de émbolos de colesterol procedentes de placas ateroscleróticas de grandes vasos y se depositan y ocluyen los vasos distales del torrente circulatorio. Como consecuencia de ello se producen manifestaciones clínicas renales, oculares, cerebrales, intestinales, pancreáticas o cutáneas. Suele presentarse como un FRA subagudo con microhematuria, en ocasiones con cilindros hemáticos, leucocituria, eosinofiluria y discreta proteinuria. Además, en la analítica sanguínea puede detectarse consumo de complemento y eosinofilia49. Es importante realizar una historia clínica completa que recoja si el paciente ha tenido antecedentes de manipulación endovascular (cirugía vascular, angiografías o cateterismos cardíacos), habitualmente en las 8 semanas previas, y la confirmación diagnóstica viene dada por la visualización de cristales de colesterol en el análisis histológico de los órganos afectados (generalmente piel, por la menor morbilidad de las biopsias cutáneas) o en los vasos retinianos (placas de Hollenhorst)50.
OTROS
Hay que considerar en el diagnóstico diferencial del FRA parenquimatoso otras entidades como son las siguientes:
1. Microangiopatía trombótica, en la que se produce trombosis arteriolar y capilar como sustrato histológico del espectro clínico que engloba al síndrome hemolítico-urémico (en el que predomina la afectación renal) y a la púrpura trombótica trombocitopénica51.
2. Hipertensión arterial maligna, en la que pueden producirse obliteración y necrosis fibrinoide arteriolar.
3. Glomerulonefritis: suele producirse FRA en el seno de glomerulonefritis proliferativas como las postinfecciosas, que cursan habitualmente como un síndrome nefrítico y suelen tener buen pronóstico, con recuperación funcional completa. Otros cuadros glomerulares pueden cursar como una insuficiencia renal rápidamente progresiva asociada a proteinuria y a hematuria. En el estudio histológico se visualizan semilunas como reflejo del daño severo de las paredes capilares glomerulares52; en este grupo se encuentran las glomerulonefritis mediadas por anticuerpos antimembrana basal glomerular, las mediadas por inmunocomplejos, las formas pauciinmunes y una variante combinante el primer tipo con la forma pauciinmune.
4. Vasculitis sistémica: el FRA en estos casos suele venir dado por la afectación glomerular en forma de glomerulonefritis necrosante con formación de semilunas, necrosis cortical por oclusión arterial (en vasculitis de grandes vasos) o hipertensión acelerada como en el caso de la esclerodermia.
En todos estos cuadros, la confirmación diagnóstica se realizará siempre mediante biopsia renal.
FRACASO RENAL AGUDO OBSTRUCTIVO
Las causas de FRA obstructivo difieren según la edad. En la infancia predominan las anomalías anatómicas, en la edad adulta, la litiasis y en pacientes mayores las causas son la hiperplasia prostática y las neoplasias pelvianas: vejiga, próstata, útero y recto (tabla 11). El FRA obstructivo es más prevalente en pacientes de edad avanzada53.
El origen de la obstrucción puede ser intraluminal, intramural o extraluminal. Entre las causas intraluminales se incluyen la obstrucción intratubular (hematuria, mioglobinuria, cristaluria asociada con fármacos como sulfamidas y aciclovir, etc.) y la obstrucción del tracto urinario por litiasis, coágulos, necrosis papilar o agregados fúngicos. Las causas intramurales son el adenoma prostático, las estenosis ureterales, las anomalías congénitas, tumores y la microvejiga secundaria a tuberculosis o radioterapia.
Las causas extraluminales se deben fundamentalmente a neoplasias y fibrosis retroperitoneal.
La clínica es variable y va a depender del lugar de la obstrucción, de si es completa o parcial, del carácter agudo o crónico de la obstrucción, etc. Es frecuente el dolor debido a la distensión de la vejiga, sistema colector o cápsula renal, aunque suele ser mínimo o ausente en las obstrucciones parciales o en aquellas que se establecen lentamente. El sitio de la obstrucción determinará la localización del dolor.
El volumen urinario es variable. Ante toda anuria brusca o bien si existen períodos alternativos de anuria/poliuria se debe descartar, en primer lugar, un FRA osbtructivo. El flujo urinario normal o incluso elevado no excluye un cuadro obstructivo como origen del FRA.
La ecografía abdominopélvica es la primera prueba diagnóstica que debe realizarse para valorar la morfología y el tamaño renal y prostático, descartar signos que indiquen dilatación de las vías urinarias y litiasis, y valorar la existencia de retenciones agudas de orina o de importantes residuos posmiccionales. Posteriormente, se valora la realización de una TC para tener una mejor definición de la etiología de la obstrucción o bien en aquellos casos que por la clínica sean altamente sospechosos de FRA obstructivo, pero en los que aún no se observa dilatación pielocalicial en la ecografía.
Los índices urinarios son poco específicos en este tipo de FRA, son similares al FRA prerrenal en la etapas iniciales de la obstrucción y se asemejan a los de la NTA cuando se reinstaura la diuresis.
Figura 1. Las cinco fases evolutivas propuestas por Sutton et al. para la necrosis tubular aguda de origen isquémico.
Figura 2. Causas más frecuentes de fracaso renal agudo.
Figura 3. Diagnóstico diferencial ante la sospecha de fracaso renal agudo.
10548_18107_7046_es_10548_12475_7046_es_tabla_1.doc
Tabla 1. Enfoque diagnóstico de la insuficiencia renal aguda (IRA)
10548_18107_7049_es_10548_12475_7049_es_tabla_2.doc
Tabla 2. Características ideales de un biomarcador de fracaso renal agudo
10548_18107_7050_es_10548_12475_7050_es_tabla_3.doc
Tabla 3. Sistema RIFLE
10548_18107_7051_es_10548_12475_7051_es_tabla_4.doc
Tabla 4. Clasificación AKIN
10548_18107_7052_es_10548_12475_7052_es_tabla_5.doc
Tabla 5. Clasificación cinética (CK)
10548_18107_7053_es_10548_12475_7053_es_tabla_6.doc
Tabla 6. Metodología diagnóstica en la insuficiencia renal aguda
10548_18107_7054_es_10548_12475_7054_es_tabla_7_copy2.doc
Tabla 7. Índices urinarios
10548_18107_7056_es_10548_12475_7056_es_tabla_8.doc
Tabla 8. Etiología del fracaso renal agudo prerrenal
10548_18107_7057_es_10548_12475_7057_es_tabla_9.doc
Tabla 9. Causas de necrosis tubular aguda
10548_18107_7058_es_10548_12475_7058_es_tabla_10.doc
Tabla 10. Mecanismos de necrosis tubular aguda nefrotóxica
10548_18107_7059_es_10548_12475_7059_es_tabla_11.doc
Tabla 11. Causas principales de fracaso renal agudo obstructivo