Las enfermedades mitocondriales, considerando aquellas que afectan a los procesos de la cadena respiratoria (CR) y fosforilación oxidativa mitocondrial (OXPHOS), constituyen un grupo relativamente frecuente dentro de las enfermedades raras que habitualmente tienen afectación multisistémica, una expresión fenotípica muy variable y una base genética compleja. La afectación renal es poco común, siendo el túbulo, y más concretamente su porción proximal, el principal afectado, desarrollándose un síndrome de Toni-Debré-Fanconi completo en las formas más graves. No obstante, en algunos casos existe afectación glomerular, fundamentalmente en forma de glomeruloesclerosis segmentaria y focal (GESF), manifestada por proteinuria e insuficiencia renal. Es importante que el nefrólogo tenga presente la posibilidad de una enfermedad mitocondrial en pacientes con esta forma de afectación renal que presenten datos clínicos acompañantes característicos, sobre todo diabetes mellitus y sordera. En los casos con GEFS, un diagnóstico correcto evitará el uso inapropiado de medicación inmunosupresora. No existen tratamientos específicos para la mayoría de las enfermedades mitocondriales, pero es probable que la intensa investigación actualmente existente sobre estas patologías lleve finalmente a posibilidades terapéuticas eficaces.
Mitochondrial diseases, taking into account those that affect the processes of the respiratory chain (RC) and mitochondrial oxidative phosphorylation system (OXPHOS), make up a relatively frequent group within rare diseases that usually have multisystem involvement, a very variable phenotypic expression and a complex genetic base. Renal involvement is uncommon, with the tubule being the most affected, specifically its proximal portion, developing into full Toni-Debré-Fanconi syndrome in the most serious cases. However, in some cases the glomerulus is involved, fundamentally in focal segmental glomerulosclerosis form (FSGS), expressed by proteinuria and renal failure. It is important that the Nephrologist keeps in mind the possibility of a mitochondrial disease in patients with this type of renal involvement that present clinical data with these characteristics, especially diabetes mellitus and deafness. In cases with FSGS, a correct diagnosis will avoid the inappropriate use of immunosuppressive medication. Specific treatments do not exist for the majority of mitochondrial diseases, but it is likely that the intense research that currently exists for these diseases will eventually produce effective treatment possibilities.
INTRODUCCIÓN
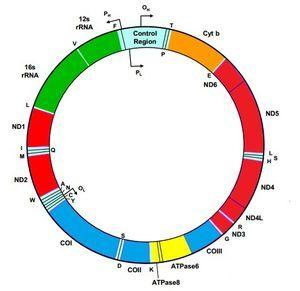
El ácido desoxirribonucleico mitocondrial (ADNmt) humano es una molécula circular compuesta por dos cadenas y contiene 37 genes (figura 1). De estos genes, 24 codifican proteínas de la maquinaria de traducción mitocondrial, 22 ácidos ribonucleicos de transferencia (ARNt), uno para cada aminoácido a excepción de leucina y serina, que contienen 2 ARNt y 2 ácidos ribonucleicos ribosómicos (ARNr). Los genes restantes codifican 13 polipéptidos que forman parte de los complejos enzimáticos de la cadena respiratoria (CR). Los genes MTND1 – MTND6 y MTND4L forman parte del complejo I (NADH-coenzima Q oxidorreductasa), el gen MTCYB, citocromo b, del complejo III (ubiquinol-citocromo C reductasa), los genes MTCO1, MTCO2 y MTCO3, del complejo IV (citocromo c oxidasa). Por último, los genes MTATP6 y MTATP8, del complejo V (ATP sintasa). El complejo II (succinato deshidrogenasa) está exclusivamente formado por subunidades codificadas en el ADN nuclear (ADNn). La mayoría de las proteínas estructurales y de ensamblaje de los complejos de la CR, como aquellas que intervienen en procesos de mantenimiento del ADNmt o en la biogénesis, son codificadas por genes nucleares e importadas al interior de la mitocondria1. Con esto se puede deducir que las enfermedades mitocondriales podrán deberse a mutaciones esporádicas o heredadas tanto en el ADNmt como en el ADNn. De la localización de la mutación, como veremos más adelante, dependerá la forma de herencia.
Las afectaciones renales descritas en el seno de una enfermedad mitocondrial incluyen un amplio espectro cuya diana más frecuente es la célula tubular, debido al elevado gasto energético requerido para el intercambio iónico, que se manifiesta como tubulopatía proximal, tubulopatía distal o acidosis tubular renal. Sin embargo, cada vez son más numerosos los casos descritos en la literatura acerca de la afectación glomerular en forma de glomeruloesclerosis segmentaria y focal (GESF)2-20 y otras glomerulopatías menos frecuentes como la enfermedad por cambios mínimos13,14, la nefropatía IgA11 o la glomerulonefritis extracapilar21. También se han descrito enfermedades quísticas renales12,22,23.
ENFERMEDADES MITOCONDRIALES DEBIDAS A MUTACIONES EN EL ADNmt
Las mitocondrias son heredadas exclusivamente por vía materna, por lo que mutaciones en su genoma serán transmitidas de madres a hijos sin contribución paterna. A diferencia del ADNn, el ADNmt presenta miles de copias dentro de una célula, pudiendo coexistir ADN mutado con ADN normal; este estado es conocido como heteroplasmia. Las manifestaciones clínicas en una enfermedad mitocondrial se producirán cuando el ADN mutado exceda un límite, determinado por las necesidades energéticas de cada célula, que conlleve la disfunción celular24. Por todo ello, las enfermedades mitocondriales tienen una amplia variabilidad en su expresión fenotípica incluso dentro de una misma familia.
Las mutaciones que ocurren en el genoma mitocondrial pueden ser mutaciones puntuales, pequeñas y grandes deleciones y duplicaciones. Dado que el genoma mitocondrial es muy susceptible a ser mutado, este presenta un gran número de variantes genéticas neutras o adaptativas, los polimorfismos. Otras mutaciones, una buena parte de ellas heteroplásmicas, son deletéreas, especialmente aquellas que ocurren en las 13 proteínas codificadas en el genoma mitocondrial, o en los ARNr y ARNt. Aunque la mayoría de las enfermedades mitocondriales debidas a mutaciones en el ADNmt son de herencia materna, algunas son de carácter esporádico, pues se producen durante la oogénesis o embriogénesis temprana, siendo las más representativas las grandes deleciones simples (únicas) de ADNmt.
Maternally inherited diabetes and deafness (MIDD)
La diabetes y sordera de herencia materna es una de las enfermedades mitocondriales más frecuentes. Como su propio nombre indica, los pacientes presentan una diabetes mellitus no insulinodependiente (DMNID) producida por una disminución en la liberación de insulina por parte de la célula beta pancreática, así como una hipoacusia neurosensorial lentamente progresiva. Otras manifestaciones clínicas acompañantes son miocardiopatías (hipertrófica o dilatada), alteraciones en la conducción cardíaca en forma de bloqueos o arritmias10, miopatías proximales o alteraciones en el fondo de ojo, como la maculopatía pigmentada, que en raras ocasiones produce disminución de la agudeza visual. Cerca del 80 % de los pacientes tiene hipoacusia neurosensorial o diabetes en el momento del diagnóstico2-14,25. La mutación más frecuentemente hallada en el ADNmt en esta enfermedad es una mutación puntual (m.3243A>G), en el gen MT-TL1 [tRNALeu(UUR)], que conlleva una traducción inadecuada de las proteínas mitocondriales que conforman las subunidades de la CR. En cuanto a la afectación renal, se han descrito casos de nefritis intersticiales12,26, riñones poliquísticos12 y GESF2-14,25.
La asociación entre GESF y enfermedades mitocondriales no es muy conocida aún en el ámbito nefrológico. El diagnóstico temprano de esta forma de afectación renal es particularmente relevante para evitar al paciente la exposición a tratamientos inmunosupresores ineficaces y frecuentemente tóxicos. Para un diagnóstico temprano es fundamental, además del conocimiento del trastorno, una historia clínica y exploración física detalladas que pueden revelar la existencia de datos clínicos característicos de estos trastornos y que se resumen en la tabla 1. En esta forma de GESF, la presentación más frecuente es una proteinuria en rango no nefrótico con escasa respuesta al tratamiento antiproteinúrico, que evoluciona lentamente a la insuficiencia renal crónica terminal (IRCT). Aproximadamente el 50 % de los casos desarrollará IRCT en los primeros diez años desde el diagnóstico. Debido a la asociación de sordera y enfermedad renal, puede diagnosticarse erróneamente a estos pacientes de enfermedad de Alport. La ausencia de hematuria en esta forma de GESF es importante para el diagnóstico diferencial, dado que la hematuria es un hallazgo constante en el Alport.
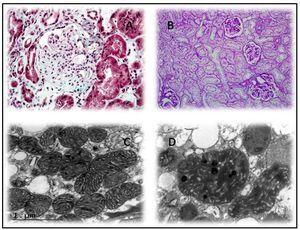
En cuanto a la histología, ni las lesiones de GESF observadas en la microscopía óptica ni la ausencia de depósito de inmunocomplejos en la inmunofluorescencia (IF) permiten sospechar una forma secundaria a enfermedad mitocondrial, puesto que ninguno de los subtipos es predominante. Sin embargo, es frecuente encontrar, si se dispone de material para microscopía electrónica, mitocondrias anormales con distorsión de la membrana interna y las crestas y con diferentes formas y tamaños (figura 2). La acumulación de estas mitocondrias se localiza a nivel de las células tubulares y los podocitos, estando ausentes en las células mesangiales y endoteliales de los capilares. Además, los podocitos con frecuencia son binucleados y presentan fusión pedicelar focal. Otra alteración frecuentemente observada es una llamativa hialinosis de las células de músculo liso de arteriolas aferentes y de pequeñas arterias. De hecho, en función de los hallazgos observados al microscopio se han planteado dos mecanismos fisiopatogénicos de la GESF en esta enfermedad, que todavía están por esclarecer. Por un lado, los autores que encontraron una intensa hialinosis arteriolar en la biopsia renal, postulan que la esclerosis del glómerulo podría deberse a una alteración en el mecanismo de autorregulación que conduciría a una hiperpresión glomerular y la consecuente hiperfiltración7,9. Igual que ocurre en el MELAS (Mitochondrial Encephalomyopathy, Lactic Acidosis and Stroke-like Episodes), estos autores creen que el daño principal se produce a nivel del músculo liso vascular, donde también se han encontrado mitocondrias anormales27. Sin embargo, los autores que encontraron las megamitocondrias a nivel podocitario8,10-13,25 especulan que la lesión glomerular es producida por un daño podocitario directo secundario a la disfunción mitocondrial de estas células.
A continuación resumimos tres casos clínicos diagnosticados entre los años 2012-2014 en el Servicio de Nefrología del Hospital 12 de Octubre que ilustran, por una parte, las manifestaciones clínicas más frecuentes en esta enfermedad y, por otra, las dudas diagnósticas que pueden plantear.
Primer caso14: varón de 38 años, con antecedentes de DMNID e hipertensión arterial (HTA) de tres años de evolución, así como hipoacusia neurosensorial desde la juventud y una miocardiopatía hipertrófica. Es remitido a la consulta de nefrología por proteinuria no nefrótica e insuficiencia renal crónica con creatinina de 2,4 mg/dl, con la sospecha de síndrome de Alport. Como antecedentes familiares, su madre es diabética, con hipoacusia y una insuficiencia renal crónica no filiada. Tras realizar un estudio completo con un sedimento de orina sin microhematuria, y autoinmunidad y serologías para virus de la hepatitis B, virus de la hepatitis C y virus de la inmunodeficiencia humana que resulta negativo, se practica una biopsia renal. Esta muestra ocho glomérulos, de los cuales tres están esclerosados, dos presentan lesiones de esclerosis segmentaria y focal con hialinosis, otros dos marcada fibrosis capsular y el restante una ligera hipercelularidad mesangial. Además, a nivel arteriolar se observa una intensa hialinosis subendotelial con marcada reducción luminal. La IF es negativa y en la ultraestructura se observan megamitocondrias en los podocitos (figura 2 A y figura 2 C). Debido a la asociación de DMNID, sordera, enfermedad renal y miocardiopatía hipertrófica en un paciente que además presenta un sedimento sin hematuria, se sospecha una enfermedad mitocondrial que queda confirmada tras realizar el estudio genético.
Segundo caso14: mujer de 19 años con antecedentes de HTA, hipoacusia neurosensorial desde la juventud, hipotiroidismo no autoinmune y una maculopatía pigmentada en el fondo de ojo. Sin antecedentes familiares de interés, es remitida a la consulta de nefrología por proteinuria no nefrótica. El estudio realizado que incluye un sedimento urinario sin microhematuria, autoinmunidad y serologías resultó negativo. En ese momento, se realiza una biopsia renal con material insuficiente, por lo que se repite cinco años después. Esta nueva biopsia presenta ocho glomérulos, ópticamente normales, IF sin hallazgos relevantes y con una microscopía electrónica no compatible con enfermedad de Alport, con megamitocondrias que presentan distorsión de las crestas y una matriz interna desestructurada (figura 2 B y figura 2 D). En su tercer embarazo (los dos primeros fueron abortos precoces) desarrolla una diabetes y un síndrome nefrótico masivo. Con el diagnóstico de probable GESF descompensada por el embarazo, se inicia tratamiento con esteroides y tacrolimus, a pesar de lo cual no se consigue un adecuado control del síndrome nefrótico y se evidencia un deterioro de la función renal. Finalmente, se decide interrumpir el embarazo por el sufrimiento fetal y el riesgo vital de la madre. La proteinuria regresó a valores no nefróticos y la función renal se normalizó, suspendiéndose la inmunosupresión. De nuevo, ante la asociación de diabetes, sordera, síndrome nefrótico corticorresistente (SNCR) y maculopatía pigmentada en el fondo de ojo, se solicita estudio genético de enfermedad mitocondrial, que confirma la sospecha clínica.
Tercer caso: mujer de 66 años, diabética desde los 34 años de edad, actualmente insulinodependiente, con hipoacusia neurosensorial y una importante carga familiar de diabetes mellitus tipo 2 por parte materna. Es remitida a la consulta de nefrología por proteinuria no nefrótica con función renal normal. Debido a que la paciente no tiene retinopatía diabética en el fondo de ojo y ante la presencia de diabetes, hipoacusia y proteinuria con antecedentes familiares por parte materna, se solicita estudio genético de enfermedad mitocondrial, que, nuevamente, confirma la sospecha clínica. No se realizó biopsia renal.
En los tres casos expuestos, el cuadro clínico fue similar: pacientes diabéticos, con hipoacusia y afectación renal en forma de proteinuria no nefrótica y sedimento sin microhematuria. El estudio genético demostró la misma mutación en el ADNmt (m.3243A>G en el ARNtLeu(UUR)), con un nivel de heteroplasmia muy diferente en ADN de sangre periférica (primer caso 79 %, segundo caso 37 % y tercer caso 17 %) detectado por secuenciación Sanger directa del gen MTTL1 y cuantificado por reacción en cadena de la polimerasa y análisis de restricción (PCR-RFLP) en un chipDNA 1000 en Bioanalizador2100 (Agilent Technologies), lo que confirma el diagnóstico de MIDD. Esta variabilidad puede deberse al alto índice de recambio mitótico de la serie blanca y la segregación mitótica del ADNmt. Muestras más fiables para esta determinación serían tejidos posmitóticos, como músculo-esquelético, o lentamente mitóticos, como las células del sedimento urinario. En los tres casos se instauró tratamiento con bloqueantes del sistema renina angiotesina con muy escasa respuesta en la reducción de la proteinuria. El primer caso, tras cinco años de seguimiento, continúa con creatinina 2,4 mg/dl y proteinuria no nefrótica. El segundo caso, tras dieciséis años de evolución, mantiene función renal normal y proteinuria no nefrótica. Y el tercer caso, en seguimiento desde 2011, tiene función renal normal y proteinuria no nefrótica.
En la tabla 2 se resumen las series clínicas publicadas con casos de MIDD y GESF. De los 135 pacientes publicados, 106 (78,5 %) tenían DMNID. De estos 135 pacientes, en 9 (4) no se describió si presentaban o no hipoacusia, pero de los 126 restantes, 120 la presentaron (95,2 %). En cuanto a la afectación renal, sólo 51 pacientes presentaron proteinuria, en 4 de los cuales no se especifica la cuantía. De los 47 restantes 40 (85,1 %) presentaban proteinuria no nefrótica, y 7 (14,9 %), proteinuria nefrótica. Solamente tres de ellos se manifestaron como síndrome nefrótico completo. En los datos obtenidos de 83 de ellos, la primera manifestación de la enfermedad fue la hipoacusia neurosensorial en 49 pacientes (59 %), la diabetes en 25 (30,1 %) y proteinuria en 9 (10,8 %). El 42,3% (22/52) de los que mostraron afectación renal terminaron en diálisis a lo largo del seguimiento. De los 11 pacientes trasplantados renales descritos (3,7,9,12), como era de esperar, ninguno presentó recidiva de la enfermedad en el injerto. No obstante, ninguna de las publicaciones mencionadas se diseñaron para describir su evolución.
Mitochondrial Encephalorryopath, lactic acidosis and stroke-like episodes (MELAS)
El síndrome de MELAS es una encefalomiopatía con acidosis láctica y episodios de ictus-like que cursa con crisis convulsivas y demencia. Un buen número de diferentes mutaciones se han asociado a este síndrome (www.mitomap.org), aunque en el 80 % de los casos es debido a la mutación ya mencionada (m.3243A>G en el ARNtLeu(UUR))28. Como sucede en el síndrome MIDD, la afectación renal más característica es la GESF29, aunque también se han descrito tubulopatías y nefritis intersticiales.
Kearns-Sayre
Síndrome caracterizado por una oftalmoplejia externa crónica progresiva, ptosis, alteraciones del ritmo cardíaco, diabetes, sordera, retinopatía pigmentada y anomalías cerebelosas que, en ocasiones, se acompaña de afectación renal, fundamentalmente en forma de tubulopatía28,30, aunque también se han descrito casos de afectación glomerular30. Esta enfermedad mitocondrial se produce generalmente por grandes deleciones a nivel del ADNmt (tabla 3). Martín-Hernández et al. publicaron una serie de 42 pacientes con enfermedad mitocondrial, 21 de los cuales presentaban afectación renal. De estos, 6 mostraban una afectación renal bien definida: 3 síndromes de Toni-Debré-Fanconi en el seno de un síndrome de Pearson, otro en un paciente con síndrome de Kearns-Sayre y un último secundario a una mutación en el gen BCS1L. En el caso restante, el paciente presentaba un síndrome nefrótico secundario a GESF como consecuencia de una deficiencia del complejo III de la CR44.
Pearson
Síndrome que aparece durante la infancia y que característicamente se manifiesta en forma de anemia sideroblástica, insuficiencia pancreática exocrina y afectación renal similar a la comentada en el síndrome de Kearns-Sayre19. También se han descrito grandes deleciones a nivel del ADNmt como causantes de la enfermedad.
ENFERMEDADES MITOCONDRIALES DEBIDAS A MUTACIONES EN EL ADNn
Al contrario de lo que ocurre en las mutaciones del ADNmt, las producidas en el ADNn presentan una herencia mendeliana, aunque se conocen mutaciones de transmisión autosómica autosómica dominante y ligadas al cromosoma X, la mayor parte son autosómicas recesivas y, por tanto, serán los hermanos del probando, y no sus padres, los que pueden presentar la enfermedad.
Biosíntesis de coenzima Q10
Defectos primarios de la coenzima Q, sustrato intermediario del proceso de óxido-reducción de los complejos I, II y III de la CR, están asociados a una disminución en la fosforilación oxidativa mitocondrial (OXPHOS) que afecta fundamentalmente al riñón con muy poca expresión extrarrenal. El mecanismo por el cual en estas mutaciones se afecta específicamente el riñón, más concretamente el podocito en lugar de la célula tubular y no otros órganos más fuertemente dependientes de la OXPHOS, es todavía desconocido. Se han descrito seis casos con mutaciones en el gen COQ221,45,46, que presentaban un SNCR, así como una encefalopatía progresiva; 11 casos más con mutaciones en el gen COQ6 que también mostraban un SNCR asociado a sordera y convulsiones47; y 2 casos más, uno con una mutación en PDSS2 que tenía SNCR y encefalopatía48, y otro con una mutación en COQ9 con encefalopatía y una tubulopatía renal49 (tabla 4). Lo más importante de este conjunto de mutaciones es que son las únicas enfermedades mitocondriales que presentan buena respuesta al tratamiento suplementario con coenzima Q oral. En cuanto a la afectación renal, la proteinuria mejora cuando el diagnóstico y el tratamiento son precoces y todavía no se ha establecido un daño renal crónico. Algunos casos publicados fallaron en demostrar estos beneficios porque se inició el tratamiento cuando presentaban daño renal avanzado50,51. Sin embargo, Montini et al.52 describen una niña de 12 meses con una mutación en el gen COQ2 que debuta con un síndrome nefrótico completo y deterioro de función renal. Tras el inicio inmediato del tratamiento suplementario (coenzima Q10 30 mg/kg/día) presenta una recuperación progresiva, alcanzando una función renal normal y proteinuria no nefrótica que mantiene tras 50 meses de seguimiento52.
Traducción de proteínas mitocondriales
Las aminoacil ARNt sintetasas, necesarias para la aminoacilación de los ARNt mitocondriales, son codificadas en el genoma nuclear. De las 20 ARNt sintetasa, solo una ha sido asociada con enfermedad renal, la serilARNt sintetasa. Mutaciones en el gen SARS2, que codifica esta aminoacil sintetasa, dan lugar a un síndrome conocido como HUPRA (hiperuricemia, pulmonary hypertension, renal failure and alkalosis), que produce fracaso renal y disfunción tubular distal (tabla 4)53.
El genoma mitocondrial codifica dos moléculas de ARNr; sin embargo, todas las subunidades proteicas del ribosoma se codifican en el genoma nuclear, por lo que mutaciones a ese nivel causan mitocondriopatías. Mutaciones en la proteína ribosomal MRPS22 se han asociado a tubulopatía renal en un individuo con miocardiopatía e hipotonía (tabla 4).
Ensamblaje y funcionamiento de la cadena respiratoria
Defectos en la CR debidos a mutaciones en distintos genes codificados en el genoma nuclear conducen a un descenso en la actividad de los complejos, fundamentalmente, el III y el IV. Mutaciones en el factor de ensamblaje mitocondrial BCS1L necesario para el ensamblaje del complejo III54, en el gen SURF1 que codifica una proteína implicada en la biogénesis del complejo IV, o mutaciones en el gen COX10, factor de ensamblaje de este último complejo, han sido descritas en niños con acidosis tubular renal o tubulopatías proximales, además de otras alteraciones sistémicas. Asimismo, mutaciones en el gen TMEM70 que codifica una proteína de membrana fundamental para el funcionamiento del complejo V han sido asociadas con riñones hipoplásicos en 5 de 25 neonatos que además presentaban hipotonía, miocardiopatía y acidosis láctica (tabla 4).
Procesamiento postraducción de proteínas mitocondriales y síndromes de depleción de ADNmt
Defectos en el procesamiento postraducción de las proteínas mitocondriales, así como los síndromes de depleción de ADNmt, se han asociado a una enfermedad renal en muy pocos casos, causando atrofia tubular con fibrosis intersticial e insuficiencia renal crónica y disfunción tubular proximal, respectivamente (tabla 3)44.
ORIENTACIÓN DIAGNÓSTICA
Conocer la asociación entre enfermedad mitocondrial y enfermedad renal es muy importante, especialmente en aquellos casos de síndrome nefrótico o GESF, en los que el diagnóstico de la enfermedad mitocondrial evitará la exposición de los pacientes a tratamiento inmunosupresor, así como en aquellos en los que la mutación afecta a la biosíntesis de coenzima Q10, donde el tratamiento precoz con dicho cofactor podrá evitar la progresión de la enfermedad renal y la muerte del paciente.
Como toda enfermedad génetica, la presencia de familiares con cuadros clínicos similares a los del paciente debe ponernos en la pista de que estamos ante una enfermedad mitocondrial, aunque, en ocasiones, la amplia variabilidad fenotípica de estos trastornos puede dificultarnos este trabajo. En función de dónde se encuentre la mutación, ADNmt o ADNn, la herencia será por vía exclusivamente materna y deberemos realizar la búsqueda de familiares afectos en la rama materna de la familia, o bien será una herencia autosómica recesiva, en cuyo caso buscaremos familiares con la enfermedad entre los hermanos; sin olvidar que las grandes deleciones del ADNmt suelen producirse de forma espontánea. Además, otro dato que debe hacernos sospechar una mitocondriopatía con afectación renal, es la implicación de distintos órganos, especialmente el sistema nervioso central y el músculo esquéletico, en un paciente con tubulopatía proximal, tubulopatía distal o proteinuria. La mayoría de las enfermedades mitocondriales, aunque no todas, presentan acidosis láctica. Por tanto, la presencia de ácido láctico elevado tanto en sangre como en orina puede ayudarnos. Es importante recordar que no todo paciente con sordera y enfermedad renal es un síndrome de Alport y que para el diagnóstico diferencial entre este síndrome y las enfermedades mitocondriales es fundamental el análisis del sedimento urinario.
No hay que olvidar que las enfermedades mitocondriales pueden afectar a cualquier órgano y que la presencia de síntomas en alguno de ellos puede ser tardía o asintomática, por lo que una vez tengamos el diagnóstico deberemos solicitar algunas exploraciones complementarias para conocer la afectación global de la enfermedad: cardiológicas (ecocardiografía, Holter), oftalmológicas (fondo de ojo, agudeza visual), neurológicas (electromiograma, pruebas de neuroimagen), endocrinas (hormonas tiroideas, glucemias, etc.), renales (sedimento urinario, proteinuria, excreciones de calcio, magnesio, sodio, potasio, aminoácidos, glucosa, etc.), de otorrinolaringología (audiometría).
Existe un software, www.simulconsult.com, que compara los hallazgos encontrados en nuestro paciente con los de más de 5000 enfermedades genéticas, ayudándonos a realizar un diagnóstico diferencial, además de sugerirnos pruebas complementarias para llegar al diagnóstico.
Conflictos de interés
Los autores declaran los siguientes conflictos de interés potenciales:
Reciben becas: Trabajo financiado parcialmente por el proyecto de investigación PI12/01683 del Instituto de Salud Carlos III-Ministerio de Economía y Competitividad.
CONCEPTOS CLAVE
1. Las enfermedades mitocondriales son una causa rara de trastornos renales, pero que todo nefrólogo debería tener presente. Su prevalencia puede ser mayor de lo actualmente estimado, dado que un número elevado de casos no son diagnosticados adecuadamente.
2. Se manifiestan principalmente como tubulopatías (tipo Toni-Debré-Fanconi o Bartter-like) o por cuadros glomerulares (principalmente glomeruloesclerosis segmentaria y focal).
3. La presencia de manifestaciones extrarrenales, sobre todo DMNID, sordera, trastornos musculares y neurológicos, debe hacer sospechar una enfermedad mitocondrial.
4. De la localización de la mutación en el ADN mitocondrial o nuclear dependerá que la transmisión sea por vía materna o con herencia mendeliana (autosómica recesiva), respectivamente. Un estudio genético en sangre periférica nos dará el diagnóstico de enfermedad mitocondrial.
5.Aunque no existen tratamientos específicos para la mayoría de las enfermedades mitocondriales, un diagnóstico correcto es fundamental de cara al pronóstico y para evitar tratamientos agresivos e ineficaces (por ejemplo, inmunosupresión en pacientes con glomeruloesclerosis).
Figura 1. Molécula de ácido desoxirribonucleico mitocondrial
Figura 2. Anatomía patológica
12728_19115_61789_es_12728_tabla1_copy1.doc
Tabla 1. Manifestaciones clínicas más frecuentes y pruebas complementarias recomendadas en pacientes con sospecha de MIDD (maternally inherited diabetes and deafness)
12728_19115_61790_es_12728_tabla2_copy1.doc
Tabla 2. Revisión de casos de maternally inherited diabetes and deafness con afectación renal en forma de glomeruloesclerosis segmentaria y focal
12728_19115_61791_es_12728_tabla3_copy1.doc
Tabla 3. Enfermedades renales asociadas a mutaciones en el ácido desoxirribonucleico mitocondrial
12728_19115_61792_es_12728_tabla4.doc
Tabla 4. Enfermedades renales asociadas a mutaciones en el ácido desoxirribonucleico nuclear