■ Tipo de diseño y seguimiento
Estudio farmacocinético, prospectivo, abierto y aleatorizado, de 2 brazos y cruzado con 3 secuencias de tratamiento que compara las 3 formulaciones de tacrolimus en pacientes estables tras trasplante renal (TR).
■ Asignación
Aleatorización 1:1 a cada una de las 2 secuencias de tratamiento. En la postaleatorización todos los pacientes comenzaron con tacrolimus de liberación inmediata —IR-Tac— (Prograf®) como fármaco de referencia.
■ Enmascaramiento
Estudio abierto.
■ Ámbito
Treinta y dos pacientes con TR y al menos 6 meses de evolución en 2 centros de Cincinnati (EE. UU.).
■ Pacientes
Criterios de inclusión
Mayores de 18 años, receptores de primer o segundo TR, con más de 6 meses de evolución, estables y sin modificación de la dosis de tacrolimus (7 días previos), en tratamiento con tacrolimus 2 dosis/día y micofenolato con o sin prednisona, con índice de masa corporal (IMC) >19 kg/m2 y sin tener previsto inicio de nueva medicación que interfiera con los valores de tacrolimus.
Criterios de exclusión
Episodio de rechazo agudo en los 3 meses previos, trasplante de otro órgano sólido distinto de riñón, filtrado glomerular estimado < 25 ml/min, gastroparesia o afectación intestinal que pueda alterar absorción de tacrolimus y mujeres embarazadas o lactantes.
■ Intervenciones
Tras aleatorización, los 32 pacientes siguieron tratamiento con IR-Tac durante 1 semana, modificándose en la segunda y tercera semanas, respectivamente, a:
– Nueva formulación MeltDose de tacrolimus (LCPT) (Envarsus®) y tacrolimus de liberación retardada (ER-Tac) (Advagraf®) (secuencia 1).
– ER-Tac y LCPT (secuencia 2).
En ambas secuencias, el día primero de cada período de cruce (días 8 y 15), los pacientes cambiaron a la otra formulación de tacrolimus mediante un factor de conversión miligramo a miligramo de la dosis total diaria de 1:1 para IR-Tac a ER-Tac y de 1:0,80 para IR-Tac o ER-Tac a LCPT. No se permitió modificar la dosis de tacrolimus, micofenolato y prednisona, en su caso, a lo largo del estudio. La hora de la toma de la medicación fue asignada previamente y se mantuvo constante.
Se realizó un estudio farmacocinético (FC) al final de cada período de cruce (días 7, 14 y 21) mediante la extracción de 21 (IR-Tac) o 17 (ER-Tac y LPTC) muestras de sangre a lo largo de 24 h. Para el IR-Tac se incrementó el número de muestras para una mejor valoración del perfil FC tras la segunda dosis diaria.
La adherencia de los pacientes se comprobó mediante: a) recuento de pastillas; b) revisión de un diario del paciente donde debía apuntar hora y dosis, y c) punción en un dedo, antes de cada dosis de la mañana, aplicando la sangre en una tarjeta que era entregada al investigador los días del estudio FC.
Los valores valle de tacrolimus en sangre se analizaron localmente por radioinmunoanálisis y las muestras de las tarjetas y las del estudio FC, mediante espectrometría de masas tándem (MS/MS y LC-MS/MS, respectivamente) en laboratorio central.
■ Variables de resultado
Variables principales
Se evaluaron, tras definirse previamente, los siguientes parámetros FC: área bajo la curva concentración-tiempo (AUC0-24 h), concentración máxima (Cmax), tiempo en alcanzar máxima concentración (Tmax), concentración mínima (Cmin), concentración predosis (C0), concentración media (Cmed) y porecentaje de fluctuación del fármaco durante las 24 h (% fluctuación, calculado como (100 × [(Cmax – Cmin)/Cmed]).
Variables secundarías
Los valores FC observados se utilizaron para estimar el factor de conversión necesario para garantizar la igualdad de exposición. Estos factores de conversión se aplicaron entonces a las AUC0-24 h, Cmax y Cmin para cada uno de los pacientes del estudio (obteniendo así sus valores normalizados).
■ Tamaño muestral
Se consideró necesario un número de al menos 14 pacientes por secuencia, para, considerando la conversión de ficha técnica de la Food and Drug Administration (FDA) entre IR-Tac y LCPT (1:0,80), que la relación de las medias geométricas fueran bioequivalentes (según criterio FDA, 0,80-1,25) con un poder estadístico del 85%.
■ Estadística
Se utilizó un software (WinNonlin 6.3) usado para análisis de parámetros FC y adaptaciones de modelos no lineales. Todos los parámetros FC (excepto Tmax) se evaluaron utilizando análisis de covarianza (ANCOVA). El Tmax se analizó utilizando el test de los rangos de Wilcoxon. La correlación entre AUC0-24 h y Cmin se calculó mediante el coeficiente de correlación lineal de Pearson. Con el fin de validar los factores de conversión, se aplicaron herramientas estadísticas para confirmar si la ratio de medias geométricas (RGM) para AUC0-24 h fue aproximadamente del 100% posnormalización.
■ Promoción
El estudio fue patrocinado por Veloxis Pharmaceuticals Inc., Edison NJ.
■ RESULTADOS PRINCIPALES
Los 32 pacientes incluidos tenían una edad media de 48 ± 12 años, el 60% eran varones, el 58%, caucasianos y el 23%, afroamericanos, con un IMC: 31 ± 5 kg/m2, un tiempo postrasplante de 6 años (0,7-14 años), predominando el TR de donante vivo (90%). Se excluyó 1 paciente (secuencia 1) postaleatorización en la visita de inicio por leucopenia y otro (secuencia 2) por no adherencia.
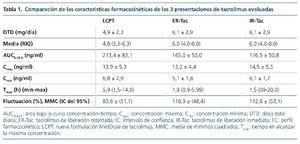
Al comparar los datos observados se apreció (tabla 1):
– El AUC0-24 h fue significativamente mayor para LCPT frente a IR-Tac y ER-Tac (RGM: 117%, p < 0,002, y RGM: 125,7%, p < 0,001, respectivamente).
– La Cmin fue significativamente inferior para ER-Tac frente a LCPT e IR-Tac (p < 0,001).
– El Tmax fue significativamente más prolongado para LCPT frente a IR-Tac y ER-Tac (p < 0,001).
– Las fluctuaciones diarias fueron significativamente inferiores para LCPT frente a IR-Tac y ER-Tac (–29%, p < 0,004, y –35,3%, p < 0,001, respectivamente).
En general, LCPT mostró una biodisponibilidad de ~50% superior (p < 0,001) frente a IR-Tac y ER-Tac en una comparación miligramo a miligramo.
Utilizando un factor de corrección del –30 y el –36% para convertir de IR-Tac y ER-Tac, respectivamente, a LCPT, se garantizó la igualdad de exposición: AUC0-24 h comparables con RGM de 102,4% (intervalo de confianza [IC] del 90%, 94-111) y 100,6% (IC del 90%, 92,7-109,1). Los datos normalizados mostraron:
– La Cmax de LPCT se redujo de forma significativa mientras que IR-Tac y ER-Tac no variaron. Estas diferencias en la Cmax mostraron diferencias estadísticamente significativas (p < 0,002 y p < 0,006, respectivamente).
– El factor de conversión para las 3 formulaciones sería de 1, 1,08 y 0,70 (IR-Tac, ER-Tac y LCPT, respectivamente).
En los datos observados, la correlación entre la AUC0-24 h y Cmin fue excelente en las 3 formulaciones, con unos valores de 0,92 para LCPT y ER-Tac (p < 0,001) y 0,81 para IR-Tac.
■ CONCLUSIONES DE LOS AUTORES
En TR estable, LCPT comparado con IR-Tac y ER-Tac presenta un perfil FC diferente, con mayor exposición al fármaco, menor fluctuación diaria en sus valores y mayor Tmax para alcanzar Cmax. A igualdad en la exposición al fármaco, la Cmax es significativamente inferior.
Para las 3 presentaciones, un coeficiente de conversión de 1, 1,08 y 0,70 es aplicable para IR-Tac, ER-Tac y LCPT, respectivamente.
■ COMENTARIOS DE LOS REVISORES
Tacrolimus es la piedra angular del tratamiento inmunosupresor en el TR1. Sin embargo, presenta estrecho margen terapéutico, escasa biodisponibilidad, diferencias importantes entre valores pico y valle y perfil farmacocinético con elevada inter- e intravariabilidad2,3. En 2008 y 2015 aparecieron 2 nuevas formulaciones de tacrolimus de liberación retardada en una sola dosis/día (Advagraf® [ER-Tac])4 y LCP-tacrolimus (Envarsus® [LCPT])5-7, con un perfil similar de eficacia y seguridad al compararse con IR-Tac4-7.
Las características de las formulaciones pueden producir variaciones en la exposición al fármaco con repercusión en la evolución del injerto. Advagraf® resulta de añadir etilcelulosa, reduciendo la tasa de difusión de tacrolimus y prolongando su liberación2,3. Por su parte, Envarsus® reduce las partículas de tacrolimus a nivel molecular, produciendo una matriz polimérica con una absorción más distal a nivel intestinal3,7. Las recomendaciones para la conversión de Prograf® a Advagraf® es de 1:1, mientras que de Prograf® a Envarsus® es de 1:0,80 (FDA) y de 1:0,70 (European Medicines Agency). La mayor dosis recomendada por la FDA se debe a un mayor porcentaje de población afroamericana en Estados Unidos.
En el presente estudio FC ofrece interesantes resultados a tener en cuenta. Su diseño abierto y aleatorizado, con un número adecuado de pacientes, medidas estrictas en cuanto a horario y dosificación del fármaco, control de la adherencia y de toma de muestras y 2 métodos para determinación de valores de tacrolimus muy sensibles y específicos (MS/MS y LC-MS/MS), lo hacen fundamental a la hora de prescribir o realizar conversiones entre las distintas formulaciones de tacrolimus. Si bien basándose en el presente estudio, los resultados no pueden trasladarse a otro perfil de pacientes (niños y adolescentes, diabéticos, postrasplante inmediato, etc.), los estudios en fases II y III para la comercialización de LCPT presentaron, al compararse con IR-Tac y con un amplio número de pacientes, una mayor biodisponibilidad y un mejor perfil FC, con no inferioridad en cuanto a eficacia y seguridad5-7.
Uno de los problemas de IR-Tac y ER-Tac es la fluctuación de los valores en sangre a lo largo del día, que conlleva la existencia temporal de valores tóxicos con otros subterapéuticos. Si bien se ha descrito que la variabilidad intraindividual en la FC de tacrolimus se asocia a un peor pronóstico del injerto8, está por demostrar que las 2 formulaciones retardadas de 1 dosis/día reduzcan esta variabilidad3.
En principio, el perfil FC más homogéneo con LCPT, como el observado en el presente estudio, frente a las otras presentaciones podría tener consecuencias importantes. La reducción de efectos adversos se ha comprobado recientemente, y se ha apreciado menor severidad del temblor en pacientes tras conversión a LCPT8, asimismo se ha observado un menor número de fallo de tratamiento, frente a IR-Tac, en ciertas poblaciones, como mujeres, afroamericanos y mayores de 65 años6. Futuros estudios determinarán si estos hechos reflejan situaciones puntuales o permanecen en el tiempo.
■ CONCLUSIONES DE LOS REVISORES
Los resultados a más largo plazo de los estudios realizados, además de nuevos estudios aleatorizados con objetivos más específicos y la experiencia de los equipos de trasplante, permitirán responder si una mayor biodisponibilidad y menor Cmax de tacrolimus en los pacientes con TR en tratamiento con LCPT conllevan un menor desarrollo de efectos secundarios sin reducir la supervivencia del injerto y paciente.
■ CLASIFICACIÓN DEL ARTÍCULO
Subespecialidad: Trasplante renal
Tema: Inmunosupresión
Tipo de artículo: Tratamiento
Palabras clave: Tacrolimus. Trasplante renal. Inmunosupresión. Farmacocinética. Adherencia. Área bajo la curva. Efectos secundarios
NIVEL DE EVIDENCIA: Alto
GRADO DE RECOMENDACIÓN: Moderado
(Levels of Evidence CEBM. Universidad de Oxford: http://www.cebm.net/oxford-centre-evidence-based-medicine-levels-evidence-march-2009/)