Es difícil estimar clínicamente la eficacia de los captores de fósforo (CP). Este estudio analiza los cambios que se producen en la fosfatemia y excreción urinaria de fósforo tras la administración de CP a pacientes con enfermedad renal crónica, y la utilidad de la relación entre la excreción urinaria de fósforo y la tasa de catabolismo proteico (Po/TCP) en la estimación de la eficacia de estos fármacos.
MétodosEstudio retrospectivo de observación en una cohorte de pacientes adultos con enfermedad renal crónica en estadios 4-5. Se compararon parámetros bioquímicos basales y 45-60 días después de un tratamiento con dieta baja en fósforo más CP (subgrupo «captor»=260 pacientes) o solo con los consejos dietéticos (subgrupo «control»=79 pacientes).
ResultadosLa carga de fósforo (excreción urinaria total) por unidad de función renal (Po/GFR) fue el parámetro mejor relacionado con la fosfatemia (R2=0,61). La cifra media de Po/TCP fue de 8,2±2,3mg de fósforo por gramo de proteína. Tras la administración de CP, la fosfatemia descendió un 11%, la fosfaturia un 22%, la tasa de catabolismo proteico un 7% y la Po/TCP un 15%. En el subgrupo control la Po/TCP se incrementó un 20%. La excreción urinaria de fósforo y de nitrógeno ureico se correlacionaron fuertemente de forma lineal antes y después del tratamiento con CP o tras los consejos dietéticos en el subgrupo control.
ConclusionesLa Po/TCP es un parámetro que podría reflejar la absorción intestinal de fósforo y, por tanto, sus variaciones tras la administración de CP podrían servir para estimar la eficacia de estos fármacos.
The efficacy of phosphate binders is difficult to be estimated clinically. This study analyzes the changes in serum phosphate and urinary phosphate excretion after the prescription of phosphate binders (PB) in patients with chronic kidney disease stage 4-5 pre-dialysis, and the usefulness of the ratio between total urinary phosphate and protein catabolic rate (Pu/PCR) for estimating the efficacy of PB.
MethodsThis retrospective observational cohort study included adult chronic kidney disease patients. Biochemical parameters were determined baseline and after 45-60 days on a low phosphate diet plus PB (“binder” subgroup=260 patients) or only with dietary advice (“control” subgroup=79 patients).
ResultsPhosphate load (total urinary excretion) per unit of renal function (Pu/GFR) was the best parameter correlated with serum phosphate levels (R2=0.61). Mean±SD level of Pu/PCR was 8.2±2.3mg of urinary phosphate per each g of estimated protein intake. After treatment with PB, serum phosphate levels decreased by 11%, urinary phosphate 22%, protein catabolic rate 7%, and Pu/PCR 15%. In the control subgroup, Pu/PCR increased by 20%. Urinary phosphate and urea nitrogen excretion correlated strongly, both baseline and after PB or dietary advice.
ConclusionsThe proposed parameter Pu/PCR may reflect the rate of intestinal phosphate absorption, and therefore, its variations after PB prescription may be a useful tool for estimating the pharmacological efficacy of these drugs.
La alteración del metabolismo del fósforo asociada a la enfermedad renal crónica (ERC) es un importante elemento patogénico involucrado tanto en el desarrollo de la enfermedad óseo-metabólica como en las complicaciones cardiovasculares y en la progresión de la insuficiencia renal1–4.
Una disminución de la reabsorción tubular de fosfatos (aumento de la fracción de excreción) es el mecanismo fisiológico compensatorio único para mantener el balance de fósforo en el organismo cuando se produce un descenso del filtrado glomerular5. Sin embargo, este mecanismo tiene un límite que se suele alcanzar en los estadios más avanzados de la ERC. Reducir la carga dietética e impedir la absorción intestinal de fósforo mediante captores son las únicas medidas terapéuticas de las que se dispone en la actualidad para intentar mantener el balance de fósforo en la ERC avanzada6.
Desde un punto de vista clínico es difícil valorar la eficacia de un captor del fósforo. El descenso del fósforo sérico tras la administración del captor podría ser un sencillo método de valoración, pero, teniendo en cuenta los otros muchos factores que condicionan la fosfatemia (p. ej. ingesta, excreción renal, reabsorción ósea, intercambio extraóseo, cumplimiento del tratamiento), resulta muy imprecisa su utilización.
Si se asume un balance neutro en los intercambios del fósforo entre compartimentos corporales y pool óseo en pacientes con ERC, la excreción urinaria puede reflejar de forma fiable la cantidad de fósforo ingerido y absorbido en el intestino7–11. Así, los cambios del fósforo urinario tras la administración de un captor podrían utilizarse para valorar su eficacia. Sin embargo, este método no tiene en cuenta las posibles variaciones en la ingesta dietética de fósforo. De esta forma, se podría calificar erróneamente como muy eficaz un captor que, provocando irritación digestiva, causara en el paciente una reducción de la ingesta total de fósforo dietético por anorexia o vómitos.
Por otra parte, la estimación de la ingesta de fósforo mediante encuesta dietética puede resultar también imprecisa debido a la disociación entre la cantidad de fósforo que contiene un alimento y su disponibilidad de absorción intestinal12,13. La medición fecal del fósforo para obtener un balance de la absorción intestinal es incuestionablemente un método engorroso en la práctica clínica.
Se ha observado una fuerte correlación lineal positiva entre las excreciones urinarias de nitrógeno ureico y fósforo, y se ha demostrado un estrecho vínculo entre la ingesta de proteínas y la ingesta-absorción intestinal de fósforo11,14,15. Así, el cociente entre la excreción urinaria de fósforo y la tasa de catabolismo proteico (calculada por la excreción total de nitrógeno ureico) podría ser un parámetro útil para estimar la absorción intestinal de fósforo y la eficacia de un captor, asumiendo que el efecto farmacológico del captor solo influye en la absorción de fósforo, pero no en la de nitrógeno.
Los objetivos de este estudio fueron: analizar los cambios que se producen en la fosfatemia y en la excreción urinaria de fósforo tras la administración de captores a pacientes con ERC avanzada, y determinar la utilidad de diferentes parámetros en la estimación de la eficacia de estos fármacos.
Material y métodosSe realizó un estudio retrospectivo de observación en una cohorte de pacientes adultos incidentes en una consulta de ERC avanzada durante el periodo comprendido entre febrero de 2008 y octubre de 2015. Los criterios de selección fueron: edad mayor de 18 años, filtrado glomerular estimado (eGFR)<30ml/min/1,73 m2, no haber sido tratado previamente con captores de fósforo y tener la capacidad de recoger correctamente la orina de 24 h.
Se excluyó a pacientes con inestabilidad clínica (insuficiencia cardiaca o de otros órganos, oncológicos, o en estados hipercatabólicos), con fracaso renal agudo reciente, o en tratamiento activo por enfermedad glomerular o vasculitis, tratamiento con corticoides, así como a aquellos tratados con fármacos con influencia potencial sobre el remodelado óseo (análogos de vitamina D, corticoides, difosfonatos, denosumab, etc.).
Incluidos en la rutina clínica de esta consulta de ERC avanzada, además de los parámetros bioquímicos convencionales en sangre —urea, creatinina, albúmina, calcio total, calcio iónico, fósforo, magnesio, bicarbonato y PTH— también se determinaron en todos los pacientes las concentraciones de creatinina, urea, calcio y fósforo en orina recogida durante las 24 h previas a la extracción de muestras de sangre.
Las determinaciones bioquímicas se realizaron por métodos de laboratorio convencionales (Advia Chemistry, Siemens Healthcare Diagnostics). Los niveles de PTH (molécula 7-84) fueron determinados mediante inmunoanálisis quimioluminiscente automatizado (DiaSorin, Italia).
Con estos datos bioquímicos se calcularon los siguientes parámetros: 1) Aclaramiento de urea y creatinina, y aproximación del filtrado glomerular (mGFR: mitad de la suma de aclaramientos de urea y creatinina). 2) Excreción urinaria total de nitrógeno ureico. 3) Tasa de catabolismo proteico mediante la fórmula de Maroni et al.16. 4) Excreción urinaria total de calcio y fósforo (mg/24 h). 5) Fracción de excreción de fósforo (en %). 6) Carga de fósforo ajustada a función renal: excreción urinaria total de fósforo/filtrado glomerular medido (mg de fósforo por cada ml/min/1,73 m2). 7) Parámetro de estimación de la absorción intestinal de fósforo: excreción urinaria total de fósforo/tasa de catabolismo proteico (mg de fósforo por cada gramo de ingesta proteica estimada).
El grupo total de pacientes estudiados se dividió en 2subgrupos: pacientes «caso», aquellos tratados con captores de fósforo tras la visita inicial, y pacientes «control», aquellos que no fueron tratados con captores por criterios clínicos, o en los que sí se les había prescrito el captor pero refirieron no haberlo tomado por intolerancia u otras razones.
Diseño del estudio y análisis estadísticoEn este estudio de observación se compararon los parámetros bioquímicos basales y 45-60 días después de tratamiento. En el subgrupo «caso», los pacientes fueron tratados con dosis convencionales de captores de fósforo (ver apartado resultados para información específica sobre los captores utilizados), además de consejos dietéticos para reducir la ingesta dietética de fósforo. En el grupo «control» solo se prescribieron los consejos dietéticos.
Para la comparación de variables continuas se utilizó la prueba t de Student (datos emparejados o no apareados). El test chi-cuadrado fue utilizado para la comparación de variables categóricas entre subgrupos.
Para determinar la existencia de asociación entre variables continuas y representarla gráficamente se utilizó el análisis de regresión lineal simple. Para cuantificar la bondad de ajuste del modelo se calculó el coeficiente de determinación (R2).
Los datos se presentan como media±desviación estándar. Una p inferior a 0,05 indicó significación estadística. El análisis estadístico y los gráficos se realizaron con el programa SPSS versión 21.0 (IBM Corp. Armonk, EE. UU.).
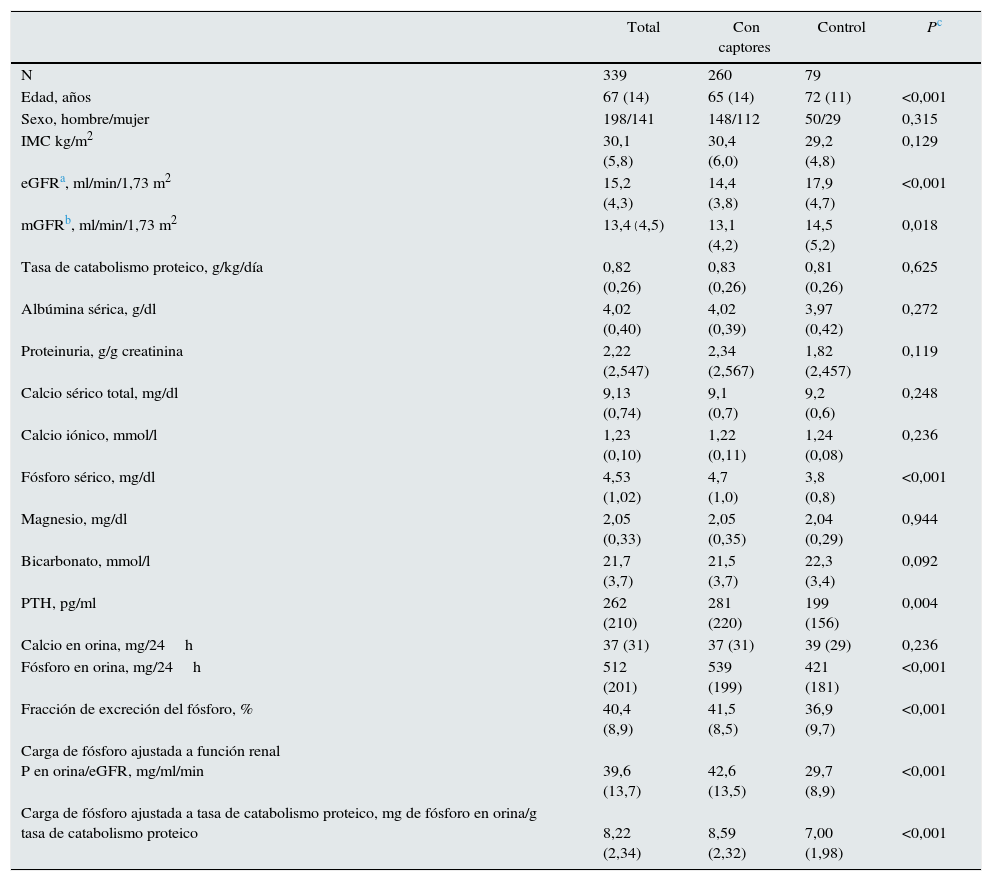
ResultadosSe incluyó a un total de 339 pacientes con las características demográficas, clínicas y bioquímicas basales que se muestran en la tabla 1.
Características demográficas, clínicas y bioquímicas basales (antes del tratamiento) del grupo de estudio y diferencias según subgrupos tratados o no con captores
| Total | Con captores | Control | Pc | |
|---|---|---|---|---|
| N | 339 | 260 | 79 | |
| Edad, años | 67 (14) | 65 (14) | 72 (11) | <0,001 |
| Sexo, hombre/mujer | 198/141 | 148/112 | 50/29 | 0,315 |
| IMC kg/m2 | 30,1 (5,8) | 30,4 (6,0) | 29,2 (4,8) | 0,129 |
| eGFRa, ml/min/1,73 m2 | 15,2 (4,3) | 14,4 (3,8) | 17,9 (4,7) | <0,001 |
| mGFRb, ml/min/1,73 m2 | 13,4(4,5) | 13,1 (4,2) | 14,5 (5,2) | 0,018 |
| Tasa de catabolismo proteico, g/kg/día | 0,82 (0,26) | 0,83 (0,26) | 0,81 (0,26) | 0,625 |
| Albúmina sérica, g/dl | 4,02 (0,40) | 4,02 (0,39) | 3,97 (0,42) | 0,272 |
| Proteinuria, g/g creatinina | 2,22 (2,547) | 2,34 (2,567) | 1,82 (2,457) | 0,119 |
| Calcio sérico total, mg/dl | 9,13 (0,74) | 9,1 (0,7) | 9,2 (0,6) | 0,248 |
| Calcio iónico, mmol/l | 1,23 (0,10) | 1,22 (0,11) | 1,24 (0,08) | 0,236 |
| Fósforo sérico, mg/dl | 4,53 (1,02) | 4,7 (1,0) | 3,8 (0,8) | <0,001 |
| Magnesio, mg/dl | 2,05 (0,33) | 2,05 (0,35) | 2,04 (0,29) | 0,944 |
| Bicarbonato, mmol/l | 21,7 (3,7) | 21,5 (3,7) | 22,3 (3,4) | 0,092 |
| PTH, pg/ml | 262 (210) | 281 (220) | 199 (156) | 0,004 |
| Calcio en orina, mg/24h | 37 (31) | 37 (31) | 39 (29) | 0,236 |
| Fósforo en orina, mg/24h | 512 (201) | 539 (199) | 421 (181) | <0,001 |
| Fracción de excreción del fósforo, % | 40,4 (8,9) | 41,5 (8,5) | 36,9 (9,7) | <0,001 |
| Carga de fósforo ajustada a función renal P en orina/eGFR, mg/ml/min | 39,6 (13,7) | 42,6 (13,5) | 29,7 (8,9) | <0,001 |
| Carga de fósforo ajustada a tasa de catabolismo proteico, mg de fósforo en orina/g tasa de catabolismo proteico | 8,22 (2,34) | 8,59 (2,32) | 7,00 (1,98) | <0,001 |
* Subgrupo con captores vs. subgrupo control.
El número total de pacientes tratados con captores fue de 260. A estos pacientes se les prescribieron dosis convencionales de carbonato cálcico (1-1,5g/día), acetato cálcico (1-1,5g/día), acetato cálcico con carbonato magnésico (1.305mg/705mg/día), carbonato de lantano (1.000-2.250mg/día), sevelamer (2.400-4.800mg/día) o hidróxido de aluminio (466-699mg/día solo o en combinación con otros captores). Para estimar la potencia captora total de la prescripción se utilizó el coeficiente de captación relativa de fósforo descrito por Daugirdas et al.17. Brevemente, cada mg de una sal de calcio (carbonato o acetato) se multiplicaba×1; cada mg de carbonato de lantano×2; cada mg de sevelamero×0,75; cada mg de carbonato magnesio pesado×1,3; y cada mg de hidróxido de aluminio por 1,5. De esta forma se obtuvo en cada paciente una referencia de la eficacia de las dosis diarias prescritas del captor o de los captores.
En fase basal, se observaron diferencias significativas entre los que fueron tratados o no con captores de fósforo (tabla 1). El subgrupo tratado era significativamente más joven, con una peor función renal residual. Las concentraciones de fósforo sérico y PTH fueron más elevadas que las del subgrupo control, así como las concentraciones de fósforo en orina, la fracción de excreción de fósforo, la carga de fósforo por unidad de función renal, y el parámetro de estimación indirecta de la absorción intestinal de fósforo (tabla 1). Sin embargo, no hubo diferencias significativas en la tasa de catabolismo proteico ni en la concentración de albúmina sérica entre los subgrupos.
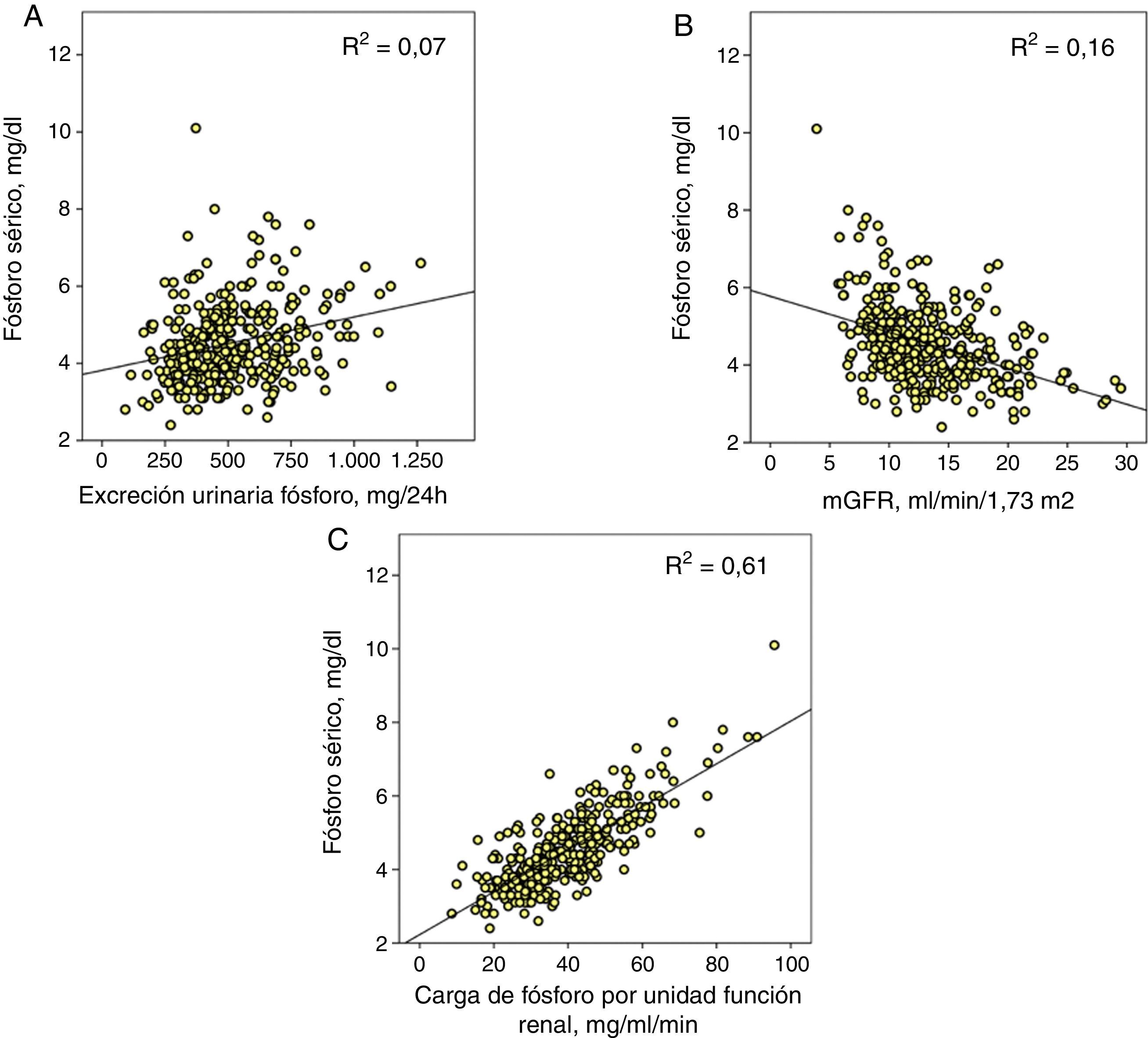
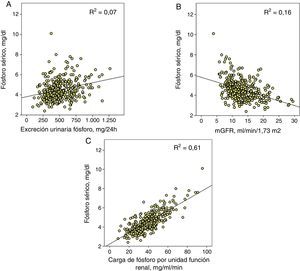
Determinantes de la fosfatemiaEn el conjunto de pacientes, la correlación entre la excreción urinaria total de fósforo y la fosfatemia se ajustaba con un modelo de regresión lineal positivo y, aunque estadísticamente significativo (p<0,0001), el coeficiente de determinación era pequeño (R2=0,07) (fig. 1A).
A) Correlación lineal entre fósforo sérico y excreción urinaria total de fósforo. B) Aproximación del filtrado glomerular (mGFR) y C) el parámetro propuesto como carga de fósforo por unidad de función renal (excreción urinaria total de fósforo/mGFR).
Las 3correlaciones tienen una significación estadística p<0,0001 y se muestra en cada una su coeficiente de determinación (R2).
La correlación entre fosfatemia y función renal (mGFR) se ajustaba con una regresión lineal inversa (R2=0,16) (fig. 1B).
Pero la mejor correlación se obtuvo entre fosfatemia y carga de fósforo ajustada a la función renal (R2=0,61) (fig. 1C). Una excreción urinaria total de fósforo de entre 35 y 40mg por cada ml/min de filtrado glomerular marcaba el límite para el desarrollo de hiperfosfatemia (fósforo sérico>4,5mg/dl).
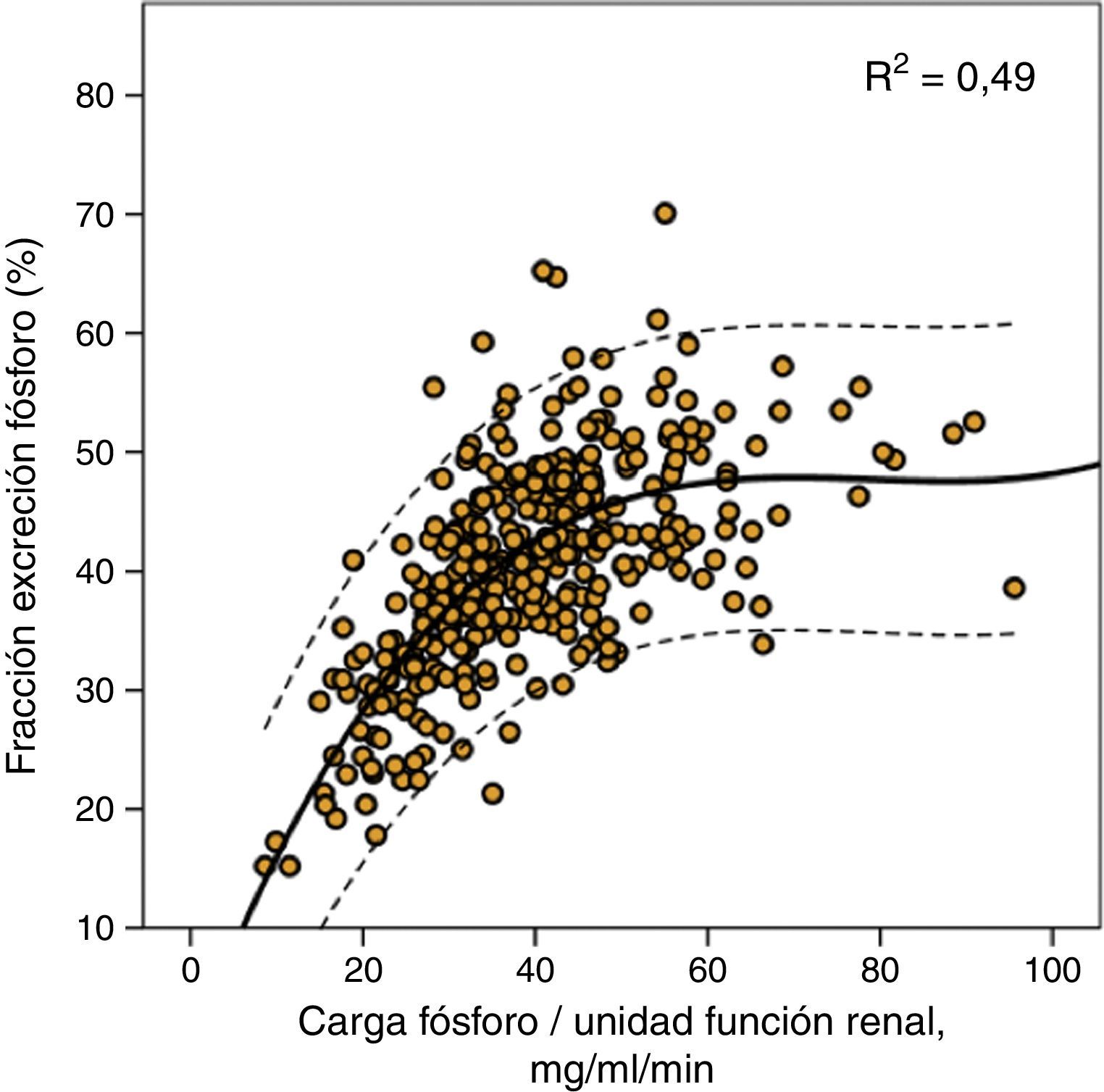
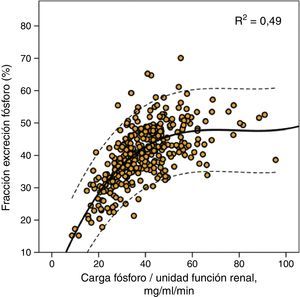
Esta misma carga de fósforo era también la que marcaba el límite máximo de la fracción de excreción de fósforo como se muestra en la figura 2, aunque es reseñable los amplios intervalos de confianza de esta regresión de tercer orden, lo que indica que además de la carga de fósforo por sí misma existirían otros factores modificadores de la excreción fraccional de fósforo.
Correlación entre fracción de excreción urinaria de fósforo y carga de fósforo por unidad de función renal (excreción urinaria de fósforo/mGFR). Se muestra la curva de regresión (trazo continuo) con los intervalos de confianza del 95% (trazo discontinuo), así como el coeficiente de determinación (R2).
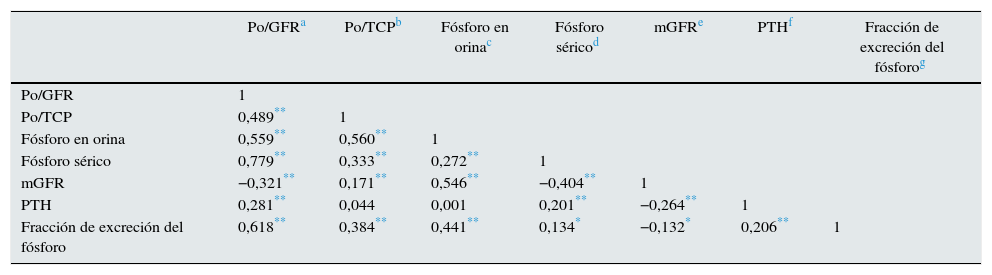
La correlación bivariada entre todos los parámetros de interés se muestra en la tabla 2.
Matriz de coeficientes de correlación entre parámetros de interés
| Po/GFRa | Po/TCPb | Fósforo en orinac | Fósforo séricod | mGFRe | PTHf | Fracción de excreción del fósforog | |
|---|---|---|---|---|---|---|---|
| Po/GFR | 1 | ||||||
| Po/TCP | 0,489** | 1 | |||||
| Fósforo en orina | 0,559** | 0,560** | 1 | ||||
| Fósforo sérico | 0,779** | 0,333** | 0,272** | 1 | |||
| mGFR | −0,321** | 0,171** | 0,546** | −0,404** | 1 | ||
| PTH | 0,281** | 0,044 | 0,001 | 0,201** | −0,264** | 1 | |
| Fracción de excreción del fósforo | 0,618** | 0,384** | 0,441** | 0,134* | −0,132* | 0,206** | 1 |
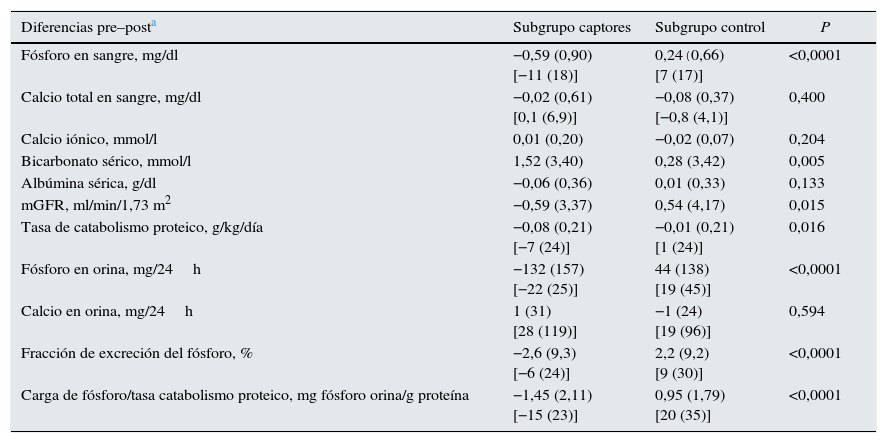
En la tabla 3 y la figura 3 se muestran los cambios de los parámetros estudiados tras la administración de captores de fósforo comparados con los observados en el grupo control.
Diferencias en los parámetros bioquímicos antes y después del tratamiento con captores (subgrupo captores) o consejos dietéticos (subgrupo control). Se muestran los valores absolutos de estos cambios y en porcentaje con respecto a los valores basales
| Diferencias pre–posta | Subgrupo captores | Subgrupo control | P |
|---|---|---|---|
| Fósforo en sangre, mg/dl | −0,59 (0,90) [−11 (18)] | 0,24(0,66) [7 (17)] | <0,0001 |
| Calcio total en sangre, mg/dl | −0,02 (0,61) [0,1 (6,9)] | −0,08 (0,37) [−0,8 (4,1)] | 0,400 |
| Calcio iónico, mmol/l | 0,01 (0,20) | −0,02 (0,07) | 0,204 |
| Bicarbonato sérico, mmol/l | 1,52 (3,40) | 0,28 (3,42) | 0,005 |
| Albúmina sérica, g/dl | −0,06 (0,36) | 0,01 (0,33) | 0,133 |
| mGFR, ml/min/1,73 m2 | −0,59 (3,37) | 0,54 (4,17) | 0,015 |
| Tasa de catabolismo proteico, g/kg/día | −0,08 (0,21) [−7 (24)] | −0,01 (0,21) [1 (24)] | 0,016 |
| Fósforo en orina, mg/24h | −132 (157) [−22 (25)] | 44 (138) [19 (45)] | <0,0001 |
| Calcio en orina, mg/24h | 1 (31) [28 (119)] | −1 (24) [19 (96)] | 0,594 |
| Fracción de excreción del fósforo, % | −2,6 (9,3) [−6 (24)] | 2,2 (9,2) [9 (30)] | <0,0001 |
| Carga de fósforo/tasa catabolismo proteico, mg fósforo orina/g proteína | −1,45 (2,11) [−15 (23)] | 0,95 (1,79) [20 (35)] | <0,0001 |
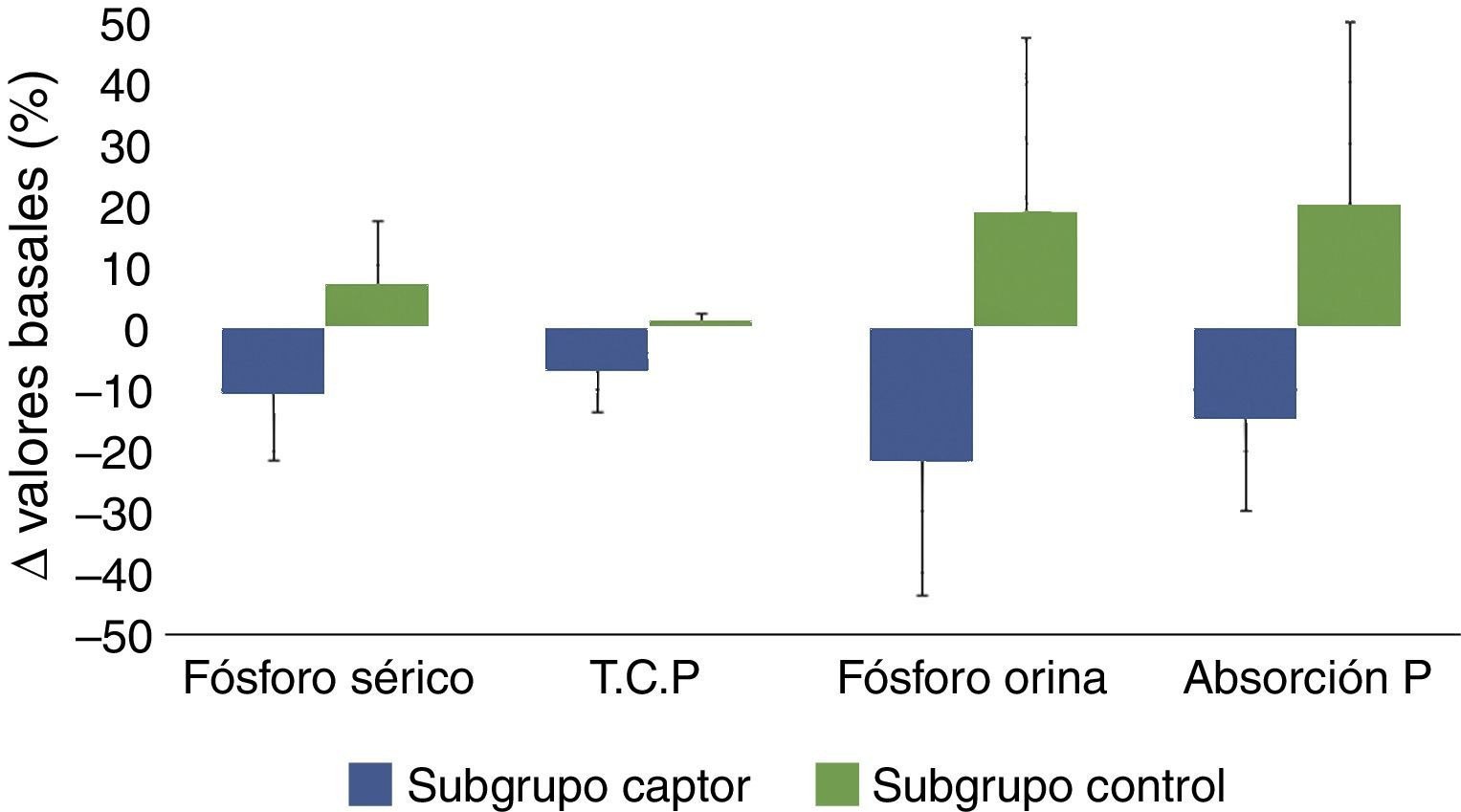
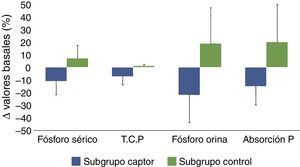
Diagrama de barras en el que se muestran los cambios porcentuales evolutivos de los siguientes parámetros: fósforo sérico, tasa de catabolismo proteico (T.C.P.), excreción urinaria de fósforo (fósforo en orina) y el parámetro propuesto de estimación de absorción intestinal de fósforo (excreción urinaria total/tasa de catabolismo proteico), en pacientes tratados con captores de fósforo (subgrupo captor) o con dieta (subgrupo control). La significación estadística de estas comparaciones se muestran en la tabla 2.
Expresadas estas variaciones como porcentaje de las cifras basales, la fosfatemia en el grupo tratado con captores se redujo en un 11% de media, mientras que la fosfaturia descendió un 22%. Teniendo en cuenta que la tasa de catabolismo proteico en este subgrupo fue un 7% menor después del tratamiento con captores, la eficacia que podría atribuirse más directamente al efecto farmacológico de los captores y cuantificada por los cambios de fósforo excretado por cada gramo de tasa de catabolismo proteico fue de un 15% de media (tabla 2, fig. 3).
En el subgrupo control, a pesar de los consejos dietéticos, se observó un incremento de las concentraciones de fósforo en sangre y orina y, teniendo en cuenta las mínimas variaciones en la tasa de catabolismo proteico, el parámetro de absorción de fósforo intestinal aumentó una media del 20%.
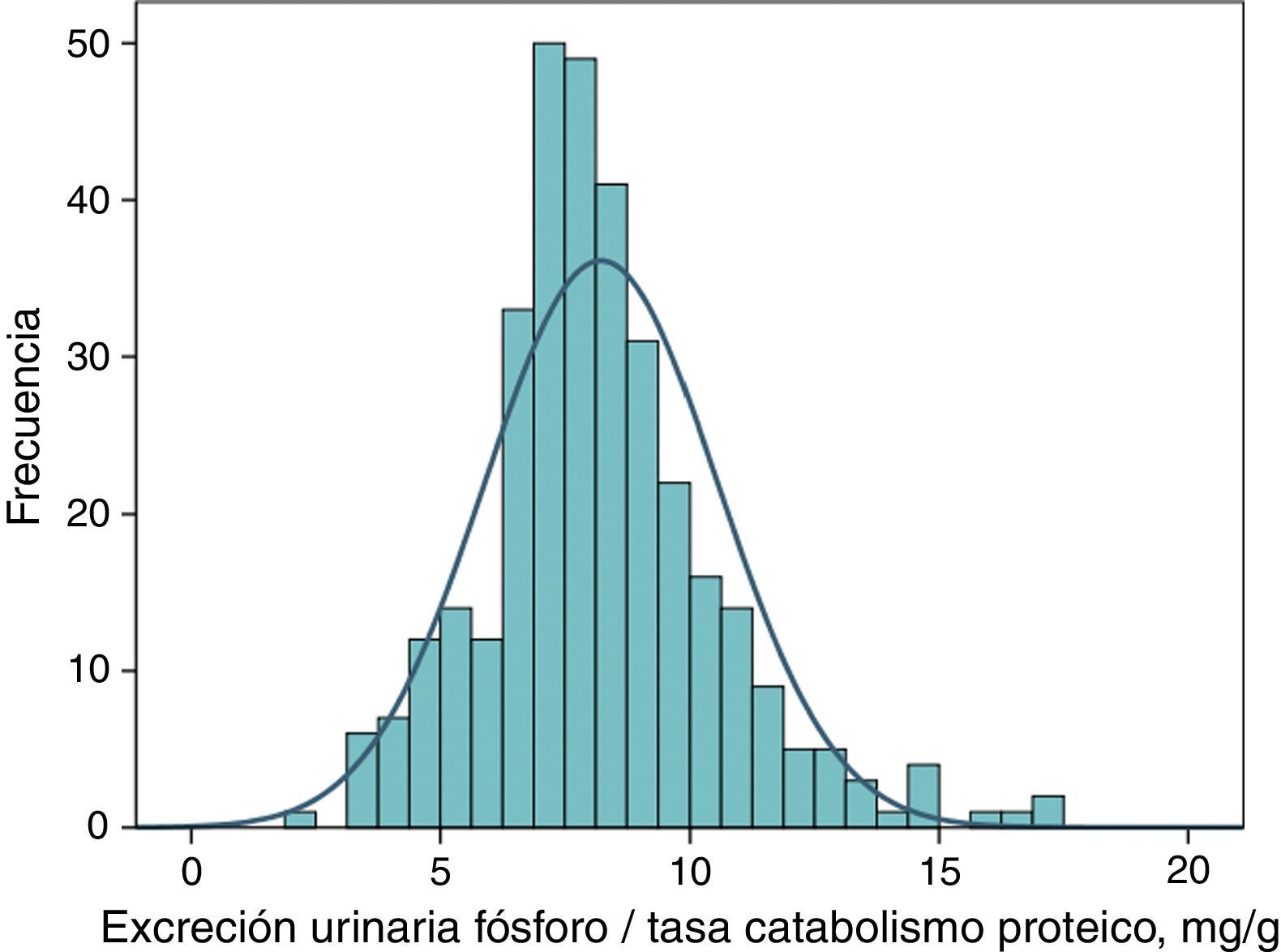
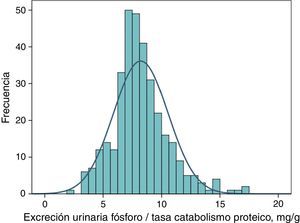
Excreción urinaria de fósforo ajustada a ingesta proteica como marcador de eficacia de un captorLa distribución de frecuencias de este parámetro en fase basal (antes de tratamiento) en el conjunto de pacientes estudiados se muestra en la figura 4. El valor medio fue de 8,2mg por cada gramo de tasa de catabolismo proteico, con unos intervalos de confianza del 95% entre 4,5 y 12,6.
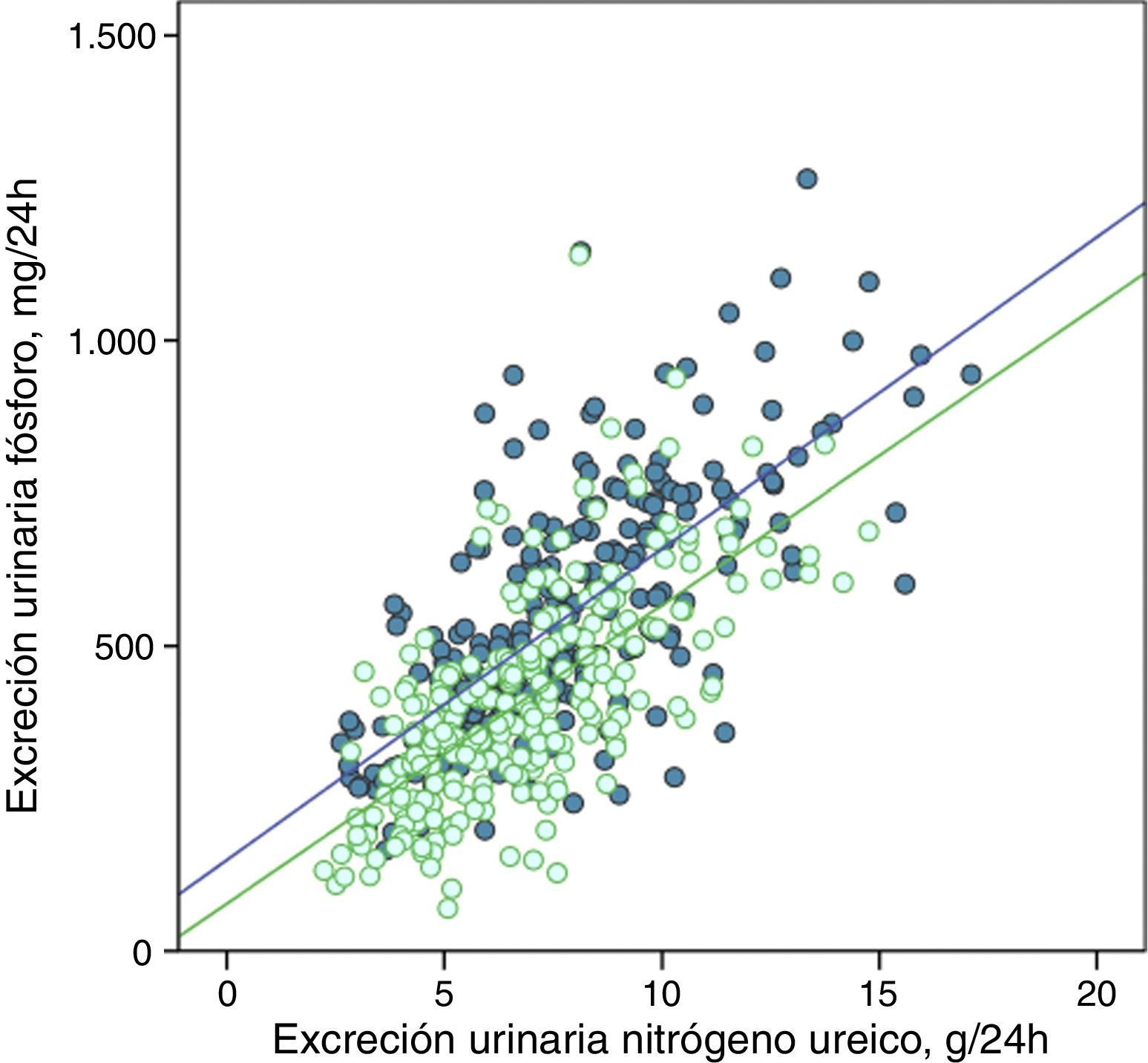
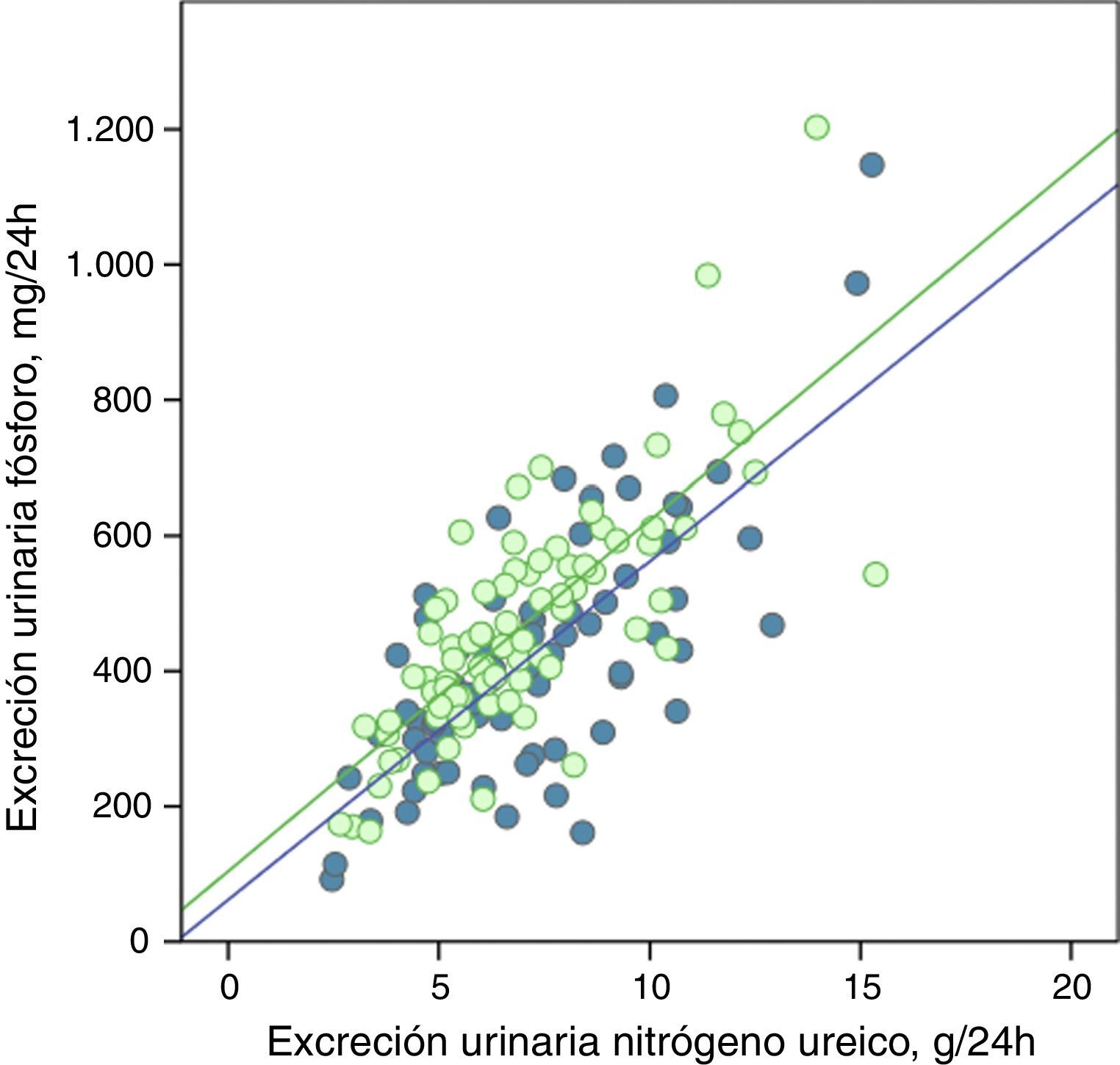
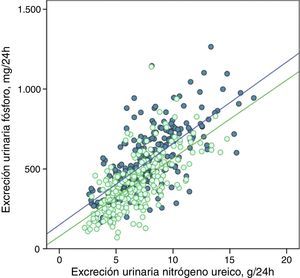
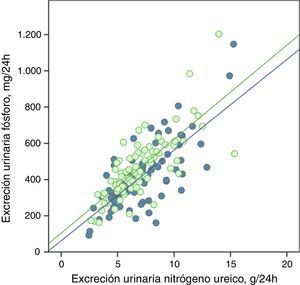
La excreción urinaria de fósforo y de nitrógeno ureico estaban fuertemente correlacionadas de forma lineal antes y después del tratamiento con captores de fósforo (fig. 5), o tras los consejos dietéticos en el subgrupo control (fig. 6).
Correlación lineal entre la excreción urinaria de fósforo y la excreción urinaria de nitrógeno ureico en periodo basal y después del tratamiento con captores de fósforo (subgrupo «captores»). Se representan las rectas de regresión correspondientes a los 2periodos de estudio (basal y después del tratamiento).
R2 en fase basal=0,50; p<0,0001; R2 después del tratamiento=0,47; p<0,0001.
Correlación lineal entre la excreción urinaria de fósforo y la excreción urinaria de nitrógeno ureico en periodo basal y tras consejos dietéticos (subgrupo «control»). Se representan las rectas de regresión correspondientes a los 2periodos de estudio (basal y después del tratamiento).
R2 en fase basal=0,55; p<0,0001; R2 después del tratamiento=0,56; p<0,0001.
Las rectas de regresión fueron paralelas en ambos casos, y con coeficientes de determinación muy similares (figs. 5 y 6). En el subgrupo tratado con captores, a cualquier valor de excreción urinaria de nitrógeno ureico la excreción de fósforo fue menor después del tratamiento.
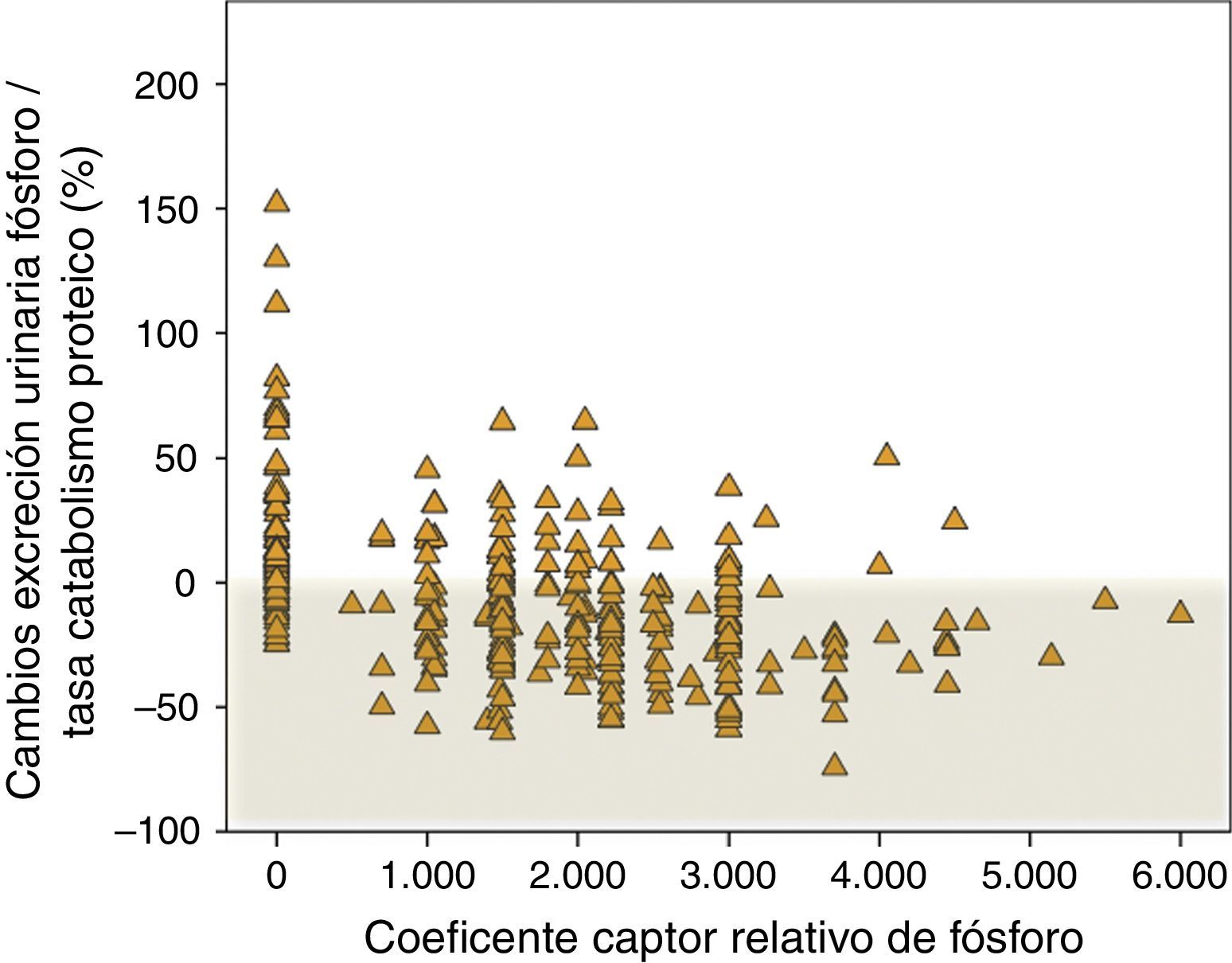
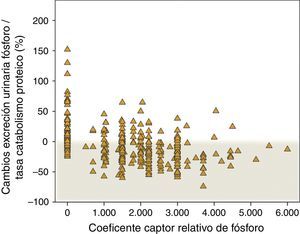
En la figura 7 se muestran los cambios porcentuales de la excreción urinaria de fósforo por cada gramo de tasa de catabolismo proteico en pacientes controles que no recibieron captores y en los tratados con captores, especificándose la potencia captora. Mientras que el incremento de este parámetro fue muy frecuente en los pacientes controles, la mayoría de los tratados con captores lo redujo. No obstante, es reseñable la falta de respuesta al tratamiento con captores de fósforo según este parámetro en un 22% de los pacientes, y la pérdida de progresividad de la respuesta con las dosis más elevadas de potencia captora prescrita.
Cambios porcentuales en la excreción urinaria de fósforo/tasa de catabolismo proteico según el coeficiente captor relativo de fósforo descrito por Daugirdas et al.17. Un coeficiente captor de 0 corresponde a pacientes que no fueron tratados con captores (subgrupo «control»).
Los cambios porcentuales de la fosfatemia después del tratamiento captor se correlacionaron fuertemente (R2=0,47) con los cambios porcentuales en la «carga de fósforo» (excreción urinaria de fósforo por unidad de función renal), pero de una forma más débil (R2=0,09), con los cambios porcentuales de la excreción urinaria de fósforo no ajustada.
DiscusiónLos principales resultados de este estudio son: 1) La carga de fósforo por unidad de función renal es el parámetro que mejor se correlaciona con la fosfatemia en la ERC. 2) La fracción de excreción de fósforo máxima se alcanza con una carga media de fósforo de aproximadamente 40mg por cada ml/min de filtrado glomerular. 3) Existe una fuerte correlación lineal entre la excreción de fósforo y el nitrógeno ureico, que se mantiene después del tratamiento con captores. 4) La excreción urinaria de fósforo por cada gramo de tasa de catabolismo proteico podría utilizarse como estimador de la eficacia de un captor. 5) Según este parámetro, la eficacia de los captores en dosis convencionales fue de tan solo un 15% de reducción media en la estimación de la absorción intestinal de fósforo en nuestra población de estudio con ERC avanzada.
La excreción urinaria total de fósforo se considera un método fiable de la ingesta-absorción de fósforo dietético en humanos y en animales de experimentación7–11. Sin embargo, a diferencia de las concentraciones de fósforo sérico, la carga de fósforo dietética en pacientes con ERC no ha demostrado una asociación con variables resultado de máximo interés (mortalidad, progresión de la ERC)8,18,19: estos estudios muestran, además, una débil relación entre fosfatemia y excreción urinaria total de fósforo.
En este estudio aportamos algunos datos que podrían ayudar a explicar de forma sencilla estos hallazgos paradójicos. Es cierto que la relación entre fosfatemia y excreción urinaria total de fósforo, aunque estadísticamente significativa, es más bien débil en su bondad de ajuste, al igual que se ha observado en otros estudios8,18,19. Sin embargo, el parámetro que resulta fuertemente correlacionado con la fosfatemia es la carga de fósforo (excreción urinaria total de fósforo) por cada unidad de función renal. Según estos hallazgos, lo importante no sería la cantidad total de fósforo que se ingiere sino la cantidad de fósforo ingerida-absorbida que es capaz de ser manejada por una determinada función renal. Una persona que absorbe 1.000mg de fósforo diarios con un filtrado glomerular de 100ml/min, tendría una carga de fósforo por unidad de función renal de 10mg/ml/min, mientras que un paciente con un filtrado glomerular de 10ml/min, la misma absorción de fósforo le causaría una carga de 100mg/ml/min. A igual cantidad de fósforo absorbida las consecuencias son diferentes, ya que la capacidad de excreción de fósforo se incrementa de forma lineal, pero hasta un límite que se alcanza aproximadamente a los 35-40mg de fósforo por cada ml/min de filtrado glomerular, como se muestra en la figura 2. La fracción de excreción de fósforo alcanza su máximo grado de compensación (una media de alrededor del 50%) con estas cargas de fósforo y, de esta forma, cargas superiores podrían causar un balance positivo de fósforo, como queda reflejado en nuestro estudio, por el desarrollo de hiperfosfatemia.
El parámetro que se propone en este estudio como estimador de la absorción intestinal de fósforo y, por tanto, como potencial parámetro de control de la eficacia de los captores es la relación entre la excreción urinaria de fósforo y la tasa de catabolismo proteico, es decir, cuánto fósforo se excreta en orina por cada gramo de ingesta proteica estimada.
Las ventajas potenciales que tiene este parámetro son: 1) Medición sencilla y económica de todos los datos bioquímicos que lo componen. 2) Compensación del posible error en la recogida de la muestra de orina de 24 h al calcular el parámetro como una relación entre 2determinaciones sujetas a idéntica imprecisión. 3) Excelente correlación entre excreción urinaria de fósforo y nitrógeno ureico, que se mantiene tras el tratamiento con captores, y que permite valorar la reducción de ingesta dietética (proteica) como respuesta no deseable a la prescripción de un captor. 4) Mejor identificación y valoración del no cumplimiento de tratamiento. Con referencia a este punto, cabe señalar la precisa identificación de los pacientes que no cumplen con el tratamiento captor, pero que sí muestran una reducción del fósforo en la dieta, que puede resultar en reducciones de la fosfatemia, pero que obviamente no deben ser atribuibles al efecto farmacológico del captor. En estos pacientes se observa una reducción de la excreción urinaria total de fósforo, pero sin variaciones significativas en la relación fósforo urinario/tasa de catabolismo proteico.
Las principales desventajas de este parámetro de estimación de la eficacia captora podrían ser: 1) La necesidad de medición de estos parámetros en orina y, por tanto, no aplicable en pacientes en diálisis. 2) El error en la recogida de muestras, muy dependiente de la colaboración del paciente, aunque como ya se ha comentado más arriba, la utilización de una relación entre 2datos bioquímicos sujetos a la misma imprecisión anula el posible error. 3) Imprecisión o variación en la relación de fósforo absorbido por cada gramo de proteína ingerida dependiente de las características de la dieta12,13 o de las diferencias interindividuales de absorción intestinal de fósforo20,21. 4) La imprecisión en la interpretación de este parámetro cuando se mide en situaciones clínicas asociadas a un aumento de la generación endógena de fósforo (alto remodelado, osteolisis, o lisis celular), o de nitrógeno ureico no dietético (estado hipercatabólico o tratamiento con corticoides).
En este estudio se observó una distribución basal gaussiana de este parámetro, y estas diferencias entre pacientes podrían ser debidas a estos factores individuales. Ya que las diferencias que se utilizan para determinar la eficacia de un captor se calculan entre 2muestras del mismo paciente, las características individuales de absorción intestinal de fósforo no deberían influir en el resultado.
La estimación de la eficacia global de los captores utilizados en nuestro estudio mediante el parámetro propuesto fue de tan solo un 15%, aunque cabe señalar que este fue el resultado en condiciones clínicas habituales («vida real»), sin tener en cuenta el cumplimiento. Como se muestra en la figura 7, todos los pacientes tratados con captores tuvieron una reducción de la excreción urinaria de fósforo por cada gramo de ingesta proteica, menos un 22% a los que se les podría atribuir la calificación de falta de cumplimiento, por la similitud que mostraron sus datos bioquímicos con los de aquellos que se declararon explícitamente como no cumplidores. De este modo, el parámetro que se propone también podría ser utilizado como control de cumplimiento del tratamiento.
Excluyendo los que en teoría pueden ser considerados no cumplidores, la eficacia de los captores estudiados alcanzaría el 24±14%.
Aunque existía una correlación lineal inversa significativa entre el parámetro de absorción de fósforo con la potencia captora prescrita, esta relación estaba atenuada en el extremo de mayor potencia captora, hallazgo que podría apoyar la hipótesis propuesta en otros estudios sobre el efecto negativo entre la cantidad de medicación prescrita y el cumplimiento efectivo del tratamiento22.
Otro hallazgo inesperado y sorprendente en este estudio fue el incremento significativo del parámetro del fósforo urinario por gramo de tasa de catabolismo proteico (Po/TCP) en los pacientes con dieta baja en fósforo sin captores. Este resultado podría explicarse por un incumplimiento generalizado de las recomendaciones dietéticas, improbable por la ausencia de un incremento concordante de nitrógeno ureico, o por un cambio cualitativo importante en el contenido de fósforo en los alimentos, sobre todo aquellos procesados industrialmente con fosfatos añadidos, hipótesis también improbable teniendo en cuenta los hábitos y costumbres culinarias de una sociedad rural a la que pertenecían la mayoría de los pacientes. Una hipótesis alternativa que podría ayudar a explicar este hallazgo, así como la eficacia por debajo de las expectativas teóricas que se observa con la mayoría de los captores en la práctica clínica, estaría relacionada con la eficacia de la absorción intestinal de fósforo cuando se realiza una dieta con bajo contenido en este mineral. En animales de experimentación se ha demostrado que una dieta baja en fósforo incrementa los transportadores intestinales específicos (NaPi-IIa y NaPi-IIb) por mecanismos independientes a la vitamina D23. Serían necesarios más estudios en pacientes con ERC para confirmar si, al igual que en los animales de experimentación, una reducción del fósforo en la dieta incrementa su eficacia absortiva y, si se confirmara, redirigir la estrategia en la investigación de nuevos fármacos para el control más satisfactorio del fósforo en la uremia.
La aplicación clínica práctica de este parámetro de estimación de eficacia captora queda limitada a los pacientes con ERC avanzada prediálisis. Según nuestra experiencia, este parámetro es una herramienta muy útil para ajustar el tratamiento y diferenciar entre hiperfosfatemia de origen dietético, por absorción intestinal, o por falta de cumplimiento.
Este parámetro también podría ser utilizado en estudios clínicos y análisis de eficacia farmacológica de los captores de fósforo, así como para determinar cuáles son las dosis mínimas más eficaces de estos fármacos para obtener un determinado rendimiento terapéutico.
Con los datos recogidos en este estudio se podría plantear la cuestión de cuál debería ser la eficacia mínima de un captor para ser útil en el control del balance de fósforo en un paciente en diálisis. Poniendo como ejemplo un paciente anúrico en hemodiálisis con un peso de 70kg, una ingesta proteica diaria de 0,8g/kg y una absorción intestinal media aproximada de 8mg de fósforo por cada gramo de proteína (extrapolación de la cifra media observada en el presente estudio), la carga total diaria de fósforo resultante sería de 448mg. La carga semanal de fósforo, por tanto, sería de 3.136mg y, sustrayendo 1.600-2.600mg de fósforo como cantidades que han sido estimadas como balance negativo con las 3sesiones semanales de una hemodiálisis convencional24,25, se necesitaría un rendimiento en la reducción de la absorción de fósforo intestinal con el captor de entre 536 y 1.536mg de fósforo (17-49% menor que la absorción basal). Estos datos subrayan la importancia de mantener un adecuado aclaramiento y balance negativo de fósforo mediante la depuración extrarrenal si se pretende mantener el balance de fósforo con una adecuada ingesta proteica, y no esperar a que sean los captores disponibles en la actualidad los que tengan que lograr por sí solos este objetivo terapéutico.
Este estudio tiene limitaciones. Es un análisis retrospectivo de datos en el que se utilizó una gran variedad de agentes captores de fósforo, sin control efectivo sobre el cumplimiento, en un único centro, y en un grupo de pacientes solo representativo de la población local, con sus peculiaridades dietéticas. El estudio tampoco estaba diseñado para comparar la eficacia específica de cada captor prescrito, por lo que se optó por presentar la potencia teórica de los captores y sus asociaciones, pero no los preparados comerciales.
En conclusión, la excreción urinaria de fósforo ajustada al filtrado glomerular o a la ingesta proteica son 2parámetros que podrían reflejar la carga y la absorción intestinal de fósforo, respectivamente. Además de sus usos clínicos en pacientes con ERC prediálisis, podrían ser herramientas útiles para valorar el papel del fósforo en las complicaciones de la ERC, y en la estimación de la eficacia farmacológica de los captores de fósforo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.