Presentamos el caso de una paciente mujer de 19 años de edad, mexicana, que desarrolla anemia progresiva a las tres semanas de recibir aloinjerto renal, la cual se acentúa con un cambio del nivel de hemoglobina de 11,3 a 3,7 g/dl, desarrollando síndrome anémico, por lo que se decide transfundir. Todos los laboratorios de rutina se comunicaron como normales, excepto la línea eritrocitaria con anemia normocítica normocrómica y reticulocitopenia severa, que motivó la búsqueda de infección por parvovirus B19 y la realización de un aspirado de médula ósea que mostró una aplasia pura de serie roja. La cuantificación del ADN viral se comunicó con > 100 000 000 copias/ml, por lo que se inició tratamiento con gammaglobulina intravenosa durante cinco días, con lo cual se resolvió completamente sin recidiva del cuadro. En todo momento la función renal se mantuvo normal. Como parte del estudio se realizó una tomografía torácica, considerando la asociación de aplasia de serie roja con timoma, la cual confirmó la sospecha. Sin embargo, valorando el riesgo/beneficio y debido a la ausencia de síndrome de debilidad o algún otro hallazgo paraneoplásico, se decidió seguimiento imagenológico con programación de timectomía de forma electiva.
INTRODUCCIÓN
El parvovirus B19 (PVB19) es el único virus ADN patogénico entre humanos de la familia Parvoviridae, con tropismo por las células progenitoras eritroides, que ocasiona una destrucción lítica de los proeritroblastos y conduce a una anemia leve en la persona inmunocompetente1. Aunque es conocido que únicamente afecta a la serie roja sanguínea, se han encontrado restos de partículas virales en granulocitos de pacientes con pancitopenia postrasplante de médula ósea. En una persona inmunocompetente, el cuadro clínico ocasionado va desde un exantema eritematoso asociado a anemia leve en niños (eritema infeccioso o quinta enfermedad) hasta una poliartropatía simétrica que semeja una artritis reumatoidea en adultos2,3. En pacientes inmunosuprimidos, la única manifestación es un descenso en el nivel de hemoglobina (Hb), ocasionando una anemia persistente y progresiva con reticulocitopenia que evoluciona a una aplasia pura de serie roja adquirida (APSR). Esta infección suele suceder durante el primer año postrasplante, período en que la inmunosupresión alcanza su máximo estado. El tratamiento estándar que se ha descrito para este tipo de infecciones es la administración de inmunoglobulina intravenosa (IGIV), bajo la premisa de aportar anticuerpos neutralizantes de los que carecen estos pacientes4-8.
Presentamos una revisión corta acompañando el caso de una paciente con APSR desarrollada a tres semanas postrasplante de recibir un aloinjerto renal, pero que se resolvió completamente con IGIV a las cuatro semanas de administrada. Como parte del estudio se encontró un timoma coexistente sin repercusión clínica en nuestra paciente.
CASO CLÍNICO
Se trata de una mujer de 19 años, procedente del área rural del Estado de México, caucásica, sin antecedentes patológicos familiares, con enfermedad renal crónica de etiología no determinada, quien permaneció en diálisis peritoneal continua ambulatoria durante 18 meses previa a su cirugía de trasplante, la cual se llevó a cabo sin complicaciones transoperatorias, que recibió inducción con basiliximab y metilprednisolona, y tuvo a su madre como donadora renal en el contexto de un panel reactivo de anticuerpos del 0 % para ambas clases, pruebas cruzadas negativas, serología para citomegalovirus IgG (+)/IgM (-), perfil viral completo negativo. La paciente egresó con creatinina de 0,76 mg/dl, Hb de 9,1 g/dl y niveles de tacrolimus de 12 ng/ml una semana posterior al trasplante, con esquema inmunosupresor a base de micofenolato de mofetilo 1 g cada 12 horas, tacrolimus 5 mg cada 12 horas y prednisona 30 mg cada 24 horas.
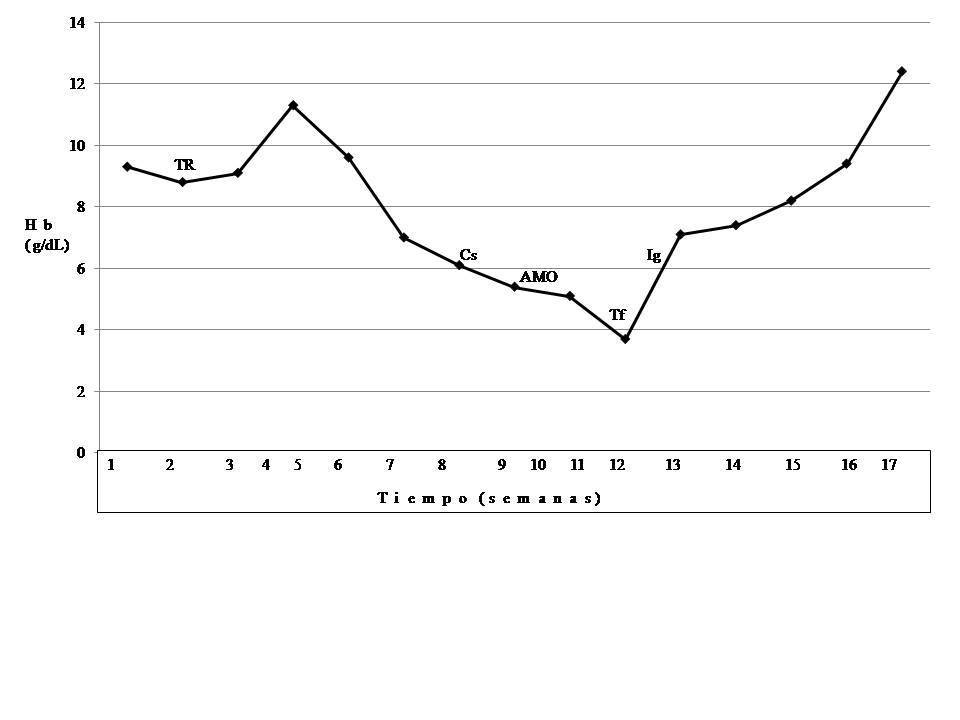
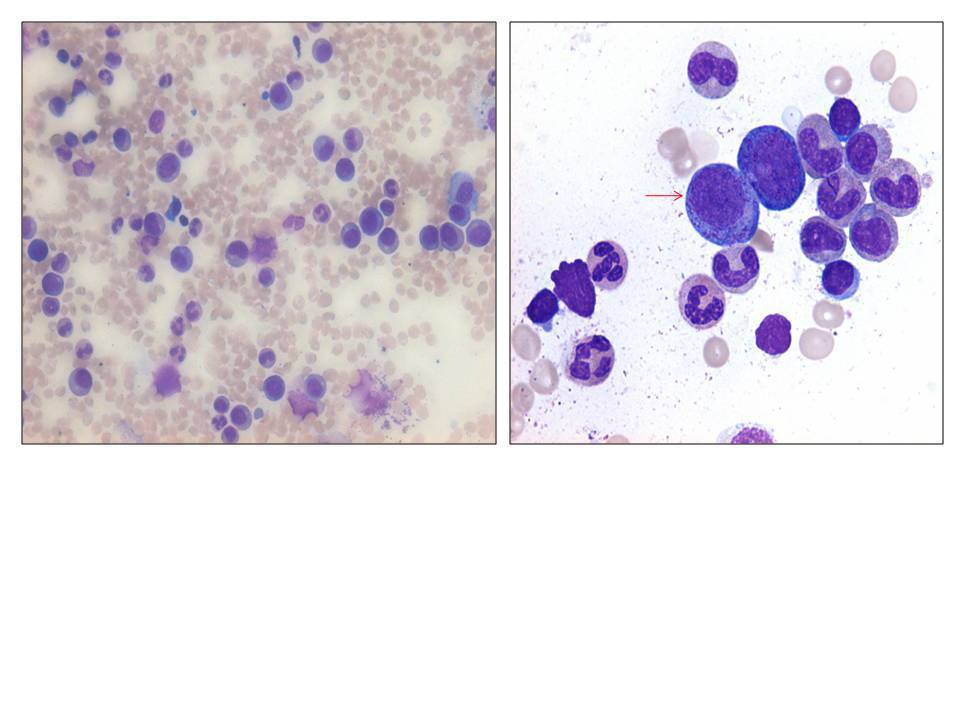
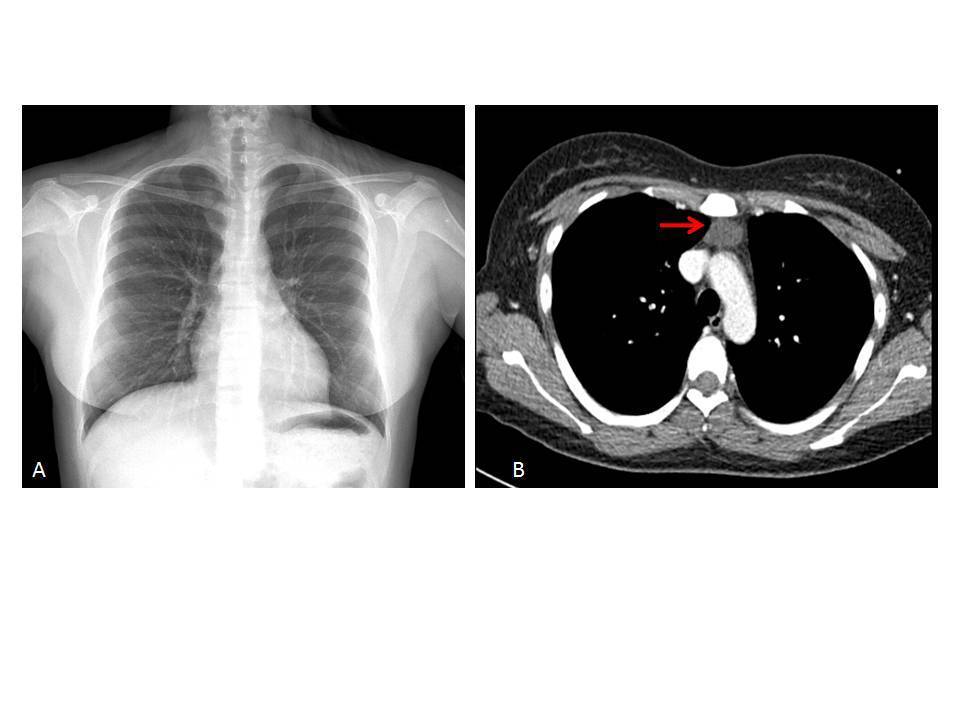
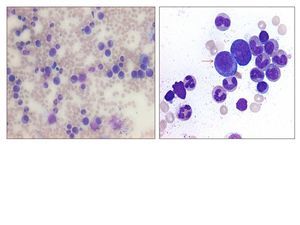
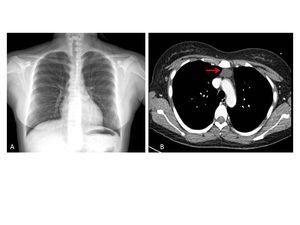
En su seguimiento en consulta externa alcanzó un nivel máximo de Hb 11,3 g/dl a las dos semanas de su egreso y al cumplir cuatro semanas se notó un descenso de esta hasta 9,6 g/dl, sin existir al momento una causa evidente. Se decidió seguimiento estrecho con solicitud de estudios de laboratorios para descartar causas comunes, que se comunicaron como normales, aunque con descenso progresivo de las cifras de Hb hasta 6,1 g/dl, por lo que se decidió su internamiento para estudio. Tenía una presión arterial sin cambios posturales de 105/64 mmHg, frecuencia cardíaca de 92 latidos/minuto, frecuencia respiratoria de 16 ciclos/minuto, con el único hallazgo en el examen físico de una palidez generalizada 3+/4+. Se solicitaron laboratorios de rutina, que mostraron una anemia normocítica normocrómica con reticulocitopenia severa y leve leucopenia asociada, con marcadores de hemólisis negativos, perfil de hierro normal y sin evidencia de sangrado (tabla 1, figura 1). Ante tales hallazgos, se sospechó la posibilidad de anemia por infección asociada a PVB19, se decidió reducir la inmunosupresión y cambiar de tacrolimus a ciclosporina por el potencial mielosupresivo y la asociación que ha sido comunicada; es importante mencionar que esto favoreció el incremento en la cuenta leucocitaria hasta rangos normales; además, se envió a medir la reacción en cadena de la polimerasa (PCR) cuantitativa para ADN de PVB19 en sangre periférica y se solicitó valoración a hematología, que realizó aspirado y biopsia de médula ósea, el cual se reportó con una citometría reducida en 40 %, pronormoblastos 1 %, normoblastos 2 %, blastos 0 %, neutrófilos 70 %, linfocitos 16 %, monocitos 3 %, células plasmáticas 3 %, eosinófilos 5 %, basófilos 1 %, concluyendo en una médula ósea compatible con APSR (figura 2). Ante tal diagnóstico y considerando la asociación conocida con timomas, se solicitó una tomografía torácica, en la que fue evidente una imagen isodensa en mediastino anterior de 31 x 16 x 23 mm, con densidades entre 22-34 unidades Hounsfield sin realzar con aplicación de material contrastado, sugiriendo un timoma (figura 3). La cuenta eritrocitaria continuó reduciendo hasta alcanzar un valor de Hb 3,7 g/dl, por lo que se decidió transfundir 2 paquetes eritrocitarios desleucocitados, teniendo un valor postransfusión de 7 g/dl. Una semana después se comunica PCR PVB19 con un valor de > 100 000 000 copias/ml, por lo que se decidió la administración de IGIV a 0,5 g/kg/día (27 g) durante 5 días. Con dicho tratamiento se estabilizó la Hb y luego se incrementó progresivamente en las siguientes semanas, con un valor de 12,4 g/dl a las cuatro semanas de su egreso. Durante su seguimiento en consulta externa, a los seis meses del evento ya no ha presentado reducción en la Hb, su función renal está en óptimas condiciones y con niveles de ciclosporina en rangos normales. No fue posible cuantificar nuevamente el ADN viral por motivos económicos de la paciente. Debido a la buena respuesta observada con la IGIV y la carencia de otros síntomas asociados a la aplasia, como síndrome de debilidad, se decidió un seguimiento imagenológico del timoma, con programación electiva de su cirugía a mediano plazo.
DISCUSIÓN
Presentamos el caso de una mujer trasplantada que desarrolló anemia en período postrasplante temprano, a las tres semanas posteriores a la cirugía, coincidiendo con el inicio de inmunosupresión. La anemia postrasplante es una complicación más común de lo que se tiene registrado en la literatura, con una prevalencia variable entre 30-40 %, existiendo múltiples causas como la debida al déficit de vitaminas o ferropénica, disfunción del injerto, sangrados crónicos de tubo digestivo, hemólisis mecánica o autoinmune, mielotoxicidad por fármacos, neoplásicas e infecciosas9,10. Las primeras cuatro causas fueron descartadas a su ingreso en nuestra paciente, lo que permitió reducir nuestro espectro de posibilidades para estudiar, descritas a continuación.
Mielotoxicidad por fármacos
Se han comunicado unos pocos casos de anemia severa en receptores de trasplante que recibían tacrolimus, pero en un estudio multicéntrico con tacrolimus en receptores de trasplante hepático no fueron informados efectos adversos hematopoyéticos, aunque vale aclarar que la detección de ADN para PVB19 no fue realizada en estos casos11. Ha sido comunicado por algunos autores que el micofenolato de mofetilo como bloqueador selectivo y reversible de la vía sintética de purina puede conducir a una leve a moderada disminución de la Hb y leucopenia. Este efecto puede ser visto en pacientes con dosis de 2 g/día y desaparecer al reducir la dosis al 50 %, es decir, 1 g/día12. Así, se ha informado de algunos casos en los que la anemia se corrige con el cambio de esquema y la reducción en la dosis de terapia inmunosupresora13. Esto motivó cambiarle el tacrolimus por ciclosporina y reducirle la dosis de micofenolato a nuestra paciente en cuanto se descartaron otras causas más comunes de anemia. Ello favoreció el incremento en la cuenta leucocitaria sin corrección de la eritrocitaria.
Anemia y neoplasias
Se ha descrito la asociación que existe entre neoplasias y anemia, específicamente la APSR con timoma. Al respecto, nosotros lo buscamos intencionadamente al realizarle la tomografía. Sin embargo, al analizar el caso, teniendo en cuenta que el mecanismo de la anemia en estas es autoinmune y que se presenta en < 5 % de los timomas, que no tenía otros hallazgos paraneoplásicos como miastenia gravis (presente en un 25-50 % de los timomas), lupus, dermatomiositis, enfermedad de tejido conectivo u otra neoplasia, las cuales han sido descritas como comorbilidades en series de casos de APSR en pacientes con timomas14,15, no se consideró su tratamiento agudo basado en este hallazgo. Por otro lado, considerando que el tratamiento implicaba timectomía radical e intensificar el esquema inmunosupresivo con ciclosporina, corticosteroides y/o ciclofosfamida en dosis de inducción, existiendo la sospecha de una causa infecciosa de la anemia y el riesgo de complicación mayor en la paciente, se adoptó una conducta expectante al respecto del timoma.
Anemias de origen infeccioso
En lo que respecta a las infecciones como causa de anemia, es importante diferenciar dos tipos:
Fue esto precisamente lo que llamó la atención de nuestra paciente, el patrón de establecimiento y progresión de la anemia, habiendo descartado una hemólisis activa.
La infección por PVB19 clásicamente causa eritema infeccioso en niños. El sobrenombre de «quinta enfermedad» deriva de ser una infección que suele surgir después de que el niño ha pasado por el sarampión, la rubeola, las paperas y la viruela. En una persona inmunocompetente, la infección por parvovirus suele causar una aplasia eritropoyética que dura de 5-10 días, ya que el sistema inmunológico controla la infección, y, considerando la vida media de 120 días de los eritrocitos, la anemia no se vuelve manifiesta en los pacientes20. En pacientes inmunocomprometidos por cualquier causa, sea inducida por inmunosupresores como nuestra paciente, asociados a virus de la inmunodeficiencia humana o desórdenes linfoproliferativos, la infección puede persistir más de este tiempo, conduciendo a una anemia aplásica crónica. El diagnóstico se realiza en la presencia de una anemia persistente, con conteo celular de otras líneas normales, una reticulocitopenia, proeritroblastos gigantes con inclusiones virales eosinofílicas prominentes en la médula ósea, IgM/IgG séricas antiparvovirus y PCR anti-ADN parvovirus positiva21.
Los parvovirus son difíciles de cultivar, pero pueden crecer en medios de médula ósea. En los huéspedes inmunocomprometidos, los anticuerpos contra parvovirus (APV) podrían ser difíciles de demostrar; por ello, la presencia de IgG antiparvovirus hace la infección persistente activa poco probable. La APSR causada por otras causas etiológicas, como el timoma, la leucemia linfocítica granular, el lupus eritematoso sistémico y la artritis reumatoidea, no presenta gigantoproeritroblastos, además de que puede coexistir con glomerulonefritis y un síndrome nefrótico22.
En una serie de casos estudiada con 98 pacientes trasplantados, la mediana de tiempo para que aparecieran manifestaciones clínicas por infección de PVB19 fue de 1,75 meses postrasplante, siendo las principales manifestaciones clínicas anemia en el 98 %, con disnea y astenia asociadas, y fiebre en el 54,9 % de los casos. En otros se han descrito también disfunción del injerto en el 10 % secundario a microangiopatía trombótica y glomerulopatía colapsante, hepatitis aguda en el 4,1 %, encefalitis, miocarditis con choque cardiogénico como principal causa de muerte, poliartritis simétrica de inicio súbito en el 8,3 %, rash malar en infancia hasta en el 74,6 %, hydrops fetalis, muerte intrauterina y abortos espontáneos en el 14 % de las pacientes infectadas. Es importante mencionar que la sintomatología puede ser muy sutil en los pacientes trasplantados, constituyendo la anemia la manifestación más prominente23-27. Los riesgos de desarrollar esta infección son mayores en pacientes que han sido tratados con esquemas de inducción de anticuerpos, aquellos tratados para rechazo agudo o los que han presentado infección oportunista por citomegalovirus o virus de Epstein-Barr, recordando que el período de mayor riesgo lo constituye el postrasplante temprano y, de este, el período inmediato16,19.
En cuanto al diagnóstico, la detección sérica de anticuerpos contra el PVB19 tal como IgM en infección aguda, aunque tiene una sensibilidad del 89 % y una especificidad del 99 % en inmunocompetentes, no es útil en pacientes trasplantados por su estado de inmunosupresión, en quienes la prueba de elección constituye la PCR ADN viral en sangre periférica o médula ósea. Esta última se utiliza para confirmar el diagnóstico en los pacientes, sobre todo en los que la PCR resulta negativa, pero persiste la alta sospecha clínica28. Aunque su uso como forma de monitorización o evaluación de la respuesta al tratamiento podría ser útil, no ha sido estudiada y no se ha establecido una asociación entre los títulos y la actividad de la enfermedad19.
Los APV son altamente prevalentes en la población normal, con una seroprevalencia que alcanza el 80-100 % a los 70 años, por lo que su diagnóstico basado solamente en serología no puede ser sostenible. En el otro extremo, un estado de anticuerpos negativos no descarta la infección en receptores de trasplantes, ya que muchos de estos utilizan un triple y potente esquema inmunosupresor. Es aquí cuando cobra importancia la detección de ADN viral en suero o médula ósea por técnica de PCR cuando la sospecha es alta21,29.
La infección por PVB19 puede teóricamente ser tratada por reducción en la inmunosupresión. Algunos autores han descrito el defectuoso aclaramiento del virus en los pacientes tratados con tacrolimus, informando de una mejoría con el cambio a ciclosporina30. Sin embargo, cuando la reducción en la inmunosupresión o el cambio han resultado inefectivos al cabo de dos semanas, la administración de IGIV es el tratamiento de elección. Esto funciona bajo un mecanismo de inmunización pasiva, con aporte de un alto título de anticuerpos que neutralizan al PVB19, lo cual ha sido demostrado en preparados comerciales. Aunque se han propuesto diferentes regímenes y en la década de los noventa se usaban altas dosis hasta durante 15 días31, en la última década se ha recomendado una dosis de 0,4-0,5 g/kg de 2 a 10 días21,32, corrigiéndose la anemia en > 90 % con un único ciclo de IGIV, pero con un riesgo de recurrencia que oscila entre 23-33 %, siendo esta más frecuente en los pacientes sobreinmunosuprimidos23,33. Gosset et al. comunican dos casos de pacientes trasplantados, con 9 y 7 recurrencias de anemia relacionada con incremento en carga viral de PVB19, respondiendo de forma efectiva a la administración de inmunoglobulinas, pero que han obligado a tratarlas con profilaxis secundaria cada tres meses para evitarlas34. Aquí cobra importancia el estudio de los reservorios virales en el cuerpo, que podrían jugar un importante papel, así como la reducción de la inmunosupresión para permitir que se formen APV circulantes de forma permanente IgG, a pesar de lo cual la erradicación completa de la viremia podría no ocurrir de persistir el estado de alta inmunosupresión posterior a la resolución de la crisis de anemia aplásica.
No existen directrices establecidas en el seguimiento de este tipo de pacientes luego de ser tratados, ya que se desconoce si la persistencia o no de la viremia está asociada a la recurrencia clínica o si tiene algún impacto en la supervivencia del paciente o en su morbilidad a largo plazo35,36.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Figura 1. Evolución clínica del caso
Figura 2. Frotis de médula ósea
Figura 3. Imágenes de gabinete
11915_19115_45082_es_11915_tabla1_copy1.docx
Tabla 1. Laboratorios generales a su ingreso a hospitalización
11915_19904_51991_es_11915_copy1.pdf
Edición versión impresa