El síndrome de Sjögren (SS) es un trastorno autoinmune caracterizado por la infiltración linfocitaria de las glándulas exocrinas. Aproximadamente la mitad presentarán síntomas sistémicos y en torno a un 5% desarrollarán un linfoma1,2.
La afectación renal es una complicación sistémica que se produce en un 5-14% de los casos, siendo la nefritis tubulointersticial crónica la nefropatía asociada al SS más prevalente. La afectación glomerular es infrecuente pero potencialmente grave y se relaciona con vasculitis crioglobulinémica en más de la mitad de los casos3,4.
Sin embargo, el diagnóstico diferencial de las manifestaciones renales en el SS es amplio, teniendo en cuenta la posible asociación con otras enfermedades inmunomediadas o trastornos linfoproliferativos3. Presentamos el caso de una paciente con SS y sospecha inicial de nefritis tubulointersticial crónica que requirió un abordaje multidisciplinar para llegar al diagnóstico.
Se trataba de una mujer de 62 años con antecedente de SS con afectación sistémica (neumonía intersticial linfoide, vasculitis leucocitoclástica y trombocitopenia inmune) que ingresó en el hospital por dolor abdominal, vómitos y diarrea de 2 meses de evolución.
En la exploración física destacaba ascitis y edema en miembros inferiores con púrpura no palpable. En la analítica se objetivó deterioro agudo de la función renal, elevación del factor reumatoide (62,6UI/mL), hipoalbuminemia e hipocomplementemia (C3 26,8mg/dL, C4 1,7mg/dL), presentando un cociente proteínas/creatinina en orina elevado (1.071mg/g).
La tomografía computarizada mostraba hepatomegalia, esplenomegalia y adenopatías toracoabdominales sin captaciones patológicas en la tomografía por emisión de positrones. Las endoscopias digestivas con biopsias de estómago, íleon y colon no mostraron alteraciones.
Al cuarto día de ingreso desarrolló anemia y trombocitopenia graves (4.000 plaquetas/μL), sin evidencia de hemólisis ni de microangiopatía trombótica, recibiendo pulsos de metilprednisolona y romiplostim subcutáneo. A las 2 semanas asoció empeoramiento de la función renal con aumento de proteinuria y sobrecarga de volumen refractaria a diuréticos, precisando terapia renal sustitutiva.
Dada la evolución clínica se sospechó una enfermedad glomerular, planteando el diagnóstico diferencial entre vasculitis crioglobulinémica y gammapatía monoclonal. De forma multidisciplinar con Hematología y Nefrología se inició plasmaféresis e inmunoglobulinas intravenosas. La respuesta fue subóptima, por lo que se administró una dosis de rituximab.
Se completó el estudio solicitando β2-microglobulina (13,2mg/L), actividad del ADAMTS13 (>10%), anticuerpos antifosfolípidos (negativos) y crioglobulinas en suero (repetidamente negativas). La electroforesis e inmunofijación sérica y urinaria detectaron un pico monoclonal IgG lambda en suero y de caderas ligeras kappa en orina, con un cociente kappa/lambda patológico (−8,59). El frotis de sangre periférica fue normal y en la biopsia de médula ósea se identificaron un 8% de células plasmáticas (CD138/kappa).
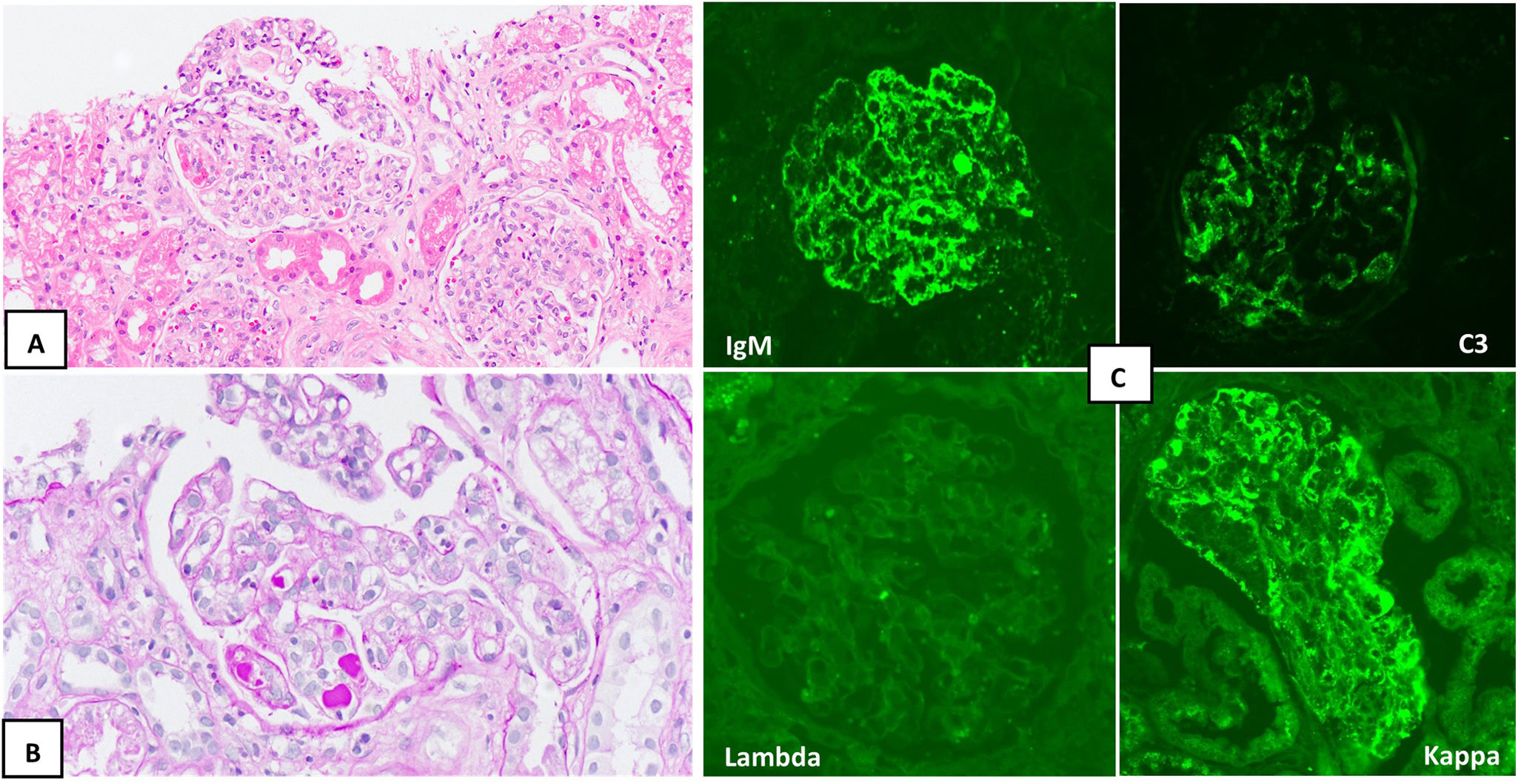
Tras la resolución de la trombocitopenia se realizó una biopsia renal que evidenció una glomerulonefritis membranoproliferativa con pseudotrombos focales y restricción de cadenas ligeras kappa (IgM/C3/kappa) (fig. 1). Ante estos hallazgos se estableció el diagnóstico de gammapatía monoclonal de significado renal (GMSR), sin poder descartar una vasculitis crioglobulinémica asociada.
Biopsia renal. A) Se identifican 2 glomérulos con aumento de celularidad mesangial (hematoxilina-eosina, ×20). B) Se reconocen pseudotrombos focales e imágenes de doble contorno (PAS, ×20). C) Inmunofluorescencia directa, en donde se objetiva positividad frente a IgM (arriba a la izquierda) y C3 (arriba a la derecha), con predominio kappa (abajo a la derecha) frente a lambda (abajo a la izquierda).
La función renal y la proteinuria mejoraron progresivamente, por lo que recibió el alta, permaneciendo estable en el seguimiento ambulatorio.
La afectación renal en el SS se produce por 2 mecanismos inmunopatológicos: la infiltración del epitelio tubular por linfocitos activados y la glomerulopatía mediada por inmunocomplejos. La primera suele producir nefritis tubulointersticial crónica y la segunda glomerulonefritis membranoproliferativa secundaria a vasculitis crioglobulinémica1,3.
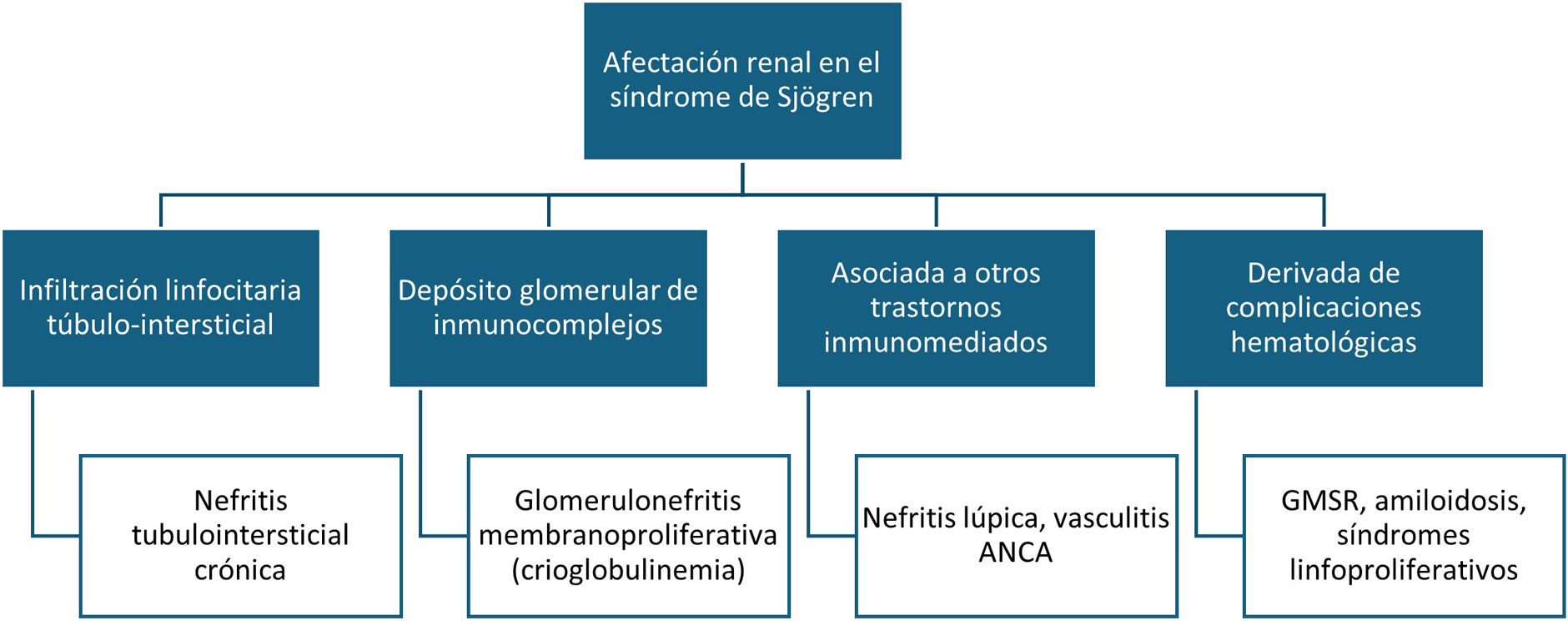
Sin embargo, en el SS pueden aparecer manifestaciones renales secundarias a otros trastornos inmunomediados o como consecuencia de complicaciones hematológicas derivadas de la activación crónica de linfocitos B3,5 (fig. 2).
Afectación renal en el síndrome de Sjögren (SS). Clásicamente se distinguen 2 tipos de manifestaciones renales en el SS: la nefritis tubulointersticial y la glomerulopatía por depósito de inmunocomplejos. Sin embargo, la afectación renal del SS también incluye las nefritis secundarias a otras enfermedades inmunomediadas asociadas (como el lupus eritematoso sistémico) o las complicaciones renales derivadas de trastornos linfoproliferativos (como la gammapatía monoclonal de significado renal [GMSR] o el linfoma renal). ANCA: anticuerpos anticitoplasma de neutrófilos.
Se estima que un 20% de los pacientes con SS tienen gammapatía monoclonal de significado incierto (GMSI), la cual se asocia con una mayor prevalencia de hipergammaglobulinemia, crioglobulinemia y neoplasias hematológicas. La coexistencia de SS y GMSI presenta un peor pronóstico, por lo que se recomienda la realización periódica de inmunoelectroforesis sérica en aquellos con SS6.
En los últimos años se han descrito casos de GMSR asociada al SS, principalmente en forma de infiltrado monotípico de células plasmáticas en el intersticio renal7. En una serie de casos de glomerulonefritis crioglobulinémica mixta publicada recientemente, se vio que los 4 pacientes incluidos tenían una GMSI, con paraproteína IgM-kappa. Curiosamente, 3 de los 4 estaban diagnosticados de SS8.
La presentación simultánea de SS, glomerulonefritis membranoproliferativa y GMSI es un escenario complejo. El caso de nuestra paciente es compatible analítica e histológicamente con una GMSR. Sin embargo, la afectación sistémica y multiorgánica se explica mejor por una vasculitis crioglobulinémica incompleta, al presentar manifestaciones clínicas y patológicas típicas en ausencia de crioglobulinas detectables en suero9,10. En ambas entidades se emplean corticoides y anti-CD20, lo que explicaría la mejoría de nuestra paciente tras el inicio de rituximab.
En conclusión, es posible que la GMSR esté infradiagnosticada y represente una manifestación más del espectro linfoproliferativo del SS. Ante un paciente con GMSI y SS con afectación renal se debe sospechar la posibilidad de una GMSR, ya que el inicio precoz del tratamiento podría mejorar el pronóstico.
FinanciaciónEste artículo no tiene fuentes de financiación.
Conflicto de interesesLos autores declaran no tener conflictos de intereses.




![Afectación renal en el síndrome de Sjögren (SS). Clásicamente se distinguen 2 tipos de manifestaciones renales en el SS: la nefritis tubulointersticial y la glomerulopatía por depósito de inmunocomplejos. Sin embargo, la afectación renal del SS también incluye las nefritis secundarias a otras enfermedades inmunomediadas asociadas (como el lupus eritematoso sistémico) o las complicaciones renales derivadas de trastornos linfoproliferativos (como la gammapatía monoclonal de significado renal [GMSR] o el linfoma renal). ANCA: anticuerpos anticitoplasma de neutrófilos. Afectación renal en el síndrome de Sjögren (SS). Clásicamente se distinguen 2 tipos de manifestaciones renales en el SS: la nefritis tubulointersticial y la glomerulopatía por depósito de inmunocomplejos. Sin embargo, la afectación renal del SS también incluye las nefritis secundarias a otras enfermedades inmunomediadas asociadas (como el lupus eritematoso sistémico) o las complicaciones renales derivadas de trastornos linfoproliferativos (como la gammapatía monoclonal de significado renal [GMSR] o el linfoma renal). ANCA: anticuerpos anticitoplasma de neutrófilos.](https://static.elsevier.es/multimedia/02116995/unassign/S0211699525000517/v1_202506230520/es/main.assets/thumbnail/gr2.jpeg?xkr=ue/ImdikoIMrsJoerZ+w94GCRvdQBB6xyQjMrWMzrts=)



