Bevacizumab es un anticuerpo monoclonal, recombinante, dirigido frente al factor de crecimiento del endotelio vascular que se emplea en quimioterapia de cánceres avanzados o metastásicos. En algunos casos, su administración se ha asociado a aparición de proteinuria e hipertensión arterial, como efecto adverso. En la biopsia renal puede encontrarse glomerulonefritis con aspecto muy variado, asociada con datos de microangiopatía trombótica y depósitos de inmunoglobulinas variadas. Presentamos un caso de glomerulonefritis con patrón membranoproliferativo asociado con depósitos de inmunocomplejos y datos de microangiopatía trombótica. Postulamos que los depósitos observados con glomerulonefritis asociadas al bevacizumab pueden ser simplemente expresión del daño endotelial y no tener un significado patogénico.
INTRODUCCIÓN
Bevacizumab es un anticuerpo monoclonal, recombinante, humanizado, dirigido frente al factor de crecimiento del endotelio vascular (VEGF), capaz de reducir la angiogénesis tumoral, por lo que es empleado en la quimioterapia de cánceres avanzados o metastásicos de pulmón, colon, recto, mama y riñón. El VEGF es producido a nivel renal por podocitos y células del epitelio tubular, y actúa sobre las células endoteliales de las arteriolas preglomerulares a nivel glomerular y en capilares peritubulares. Se considera que es necesario para la proliferación y supervivencia de las células mesangiales y endoteliales.
El uso de bevacizumab se asocia al desarrollo de hipertensión arterial en el 3-36% de los casos, y en el 21-64% de los pacientes puede cursar con proteinuria en cuantía importante1-4 y en raras ocasiones presentarse como un síndrome nefrótico5,6. La función renal suele estar preservada, aunque a veces se presenta con un deterioro renal progresivo o incluso como un fracaso renal agudo7. La incidencia exacta es variable, lo que depende de las líneas de tratamiento empleadas, se relaciona con las dosis más altas empleadas y es más frecuente en carcinomas renales. El momento de su aparición es también variable, y puede surgir tras 2-4 dosis o tras años de tratamiento con bevacizumab5-7.
El patrón histológico más descrito es el de una microangiopatía trombótica (MAT)8, aunque también se han descrito patrones muy variados como proliferativos focales9, glomerulonefritis membranoproliferativa8, nefropatía con depósitos de Ig (inmunoglobulina) A7,10 o glomerulonefritis proliferativas extra-capilares11.
Presentamos un caso clínico cuyos detalles histológicos ayudan a discutir su etiopatogenia.
CASO CLÍNICO
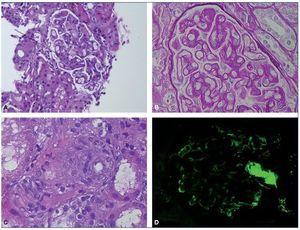
Mujer de 44 años, con historia previa de asma y alergia a ácaros en la infancia, y diagnosticada de adenocarcinoma ovárico de células claras IIIC tras intervención (22-7-2006), sometida luego a histerectomía, anexectomía derecha y omentectomía (22-9-2006). Recibió primero quimioterapia con paclitaxel + CBCA (ácido cannabicrómico) durante 6 ciclos y se observó incremento de masa quística compatible con recidiva local. Se realizó nueva resección de la masa con omentectomía y linfadenectomía (24-8-2007). Tras ello recibió carboplatino y gemcitabina (desde octubre de 2007 a febrero de 2008), y en tomografía computarizada se encontró nueva recidiva, por lo que se cambió a topotecán + bevacizumab en abril de 2009 durante 8 ciclos y luego continuó solamente con bevacizumab (dosis de mantenimiento 15 mg/kg cada 21 días), que se administró sin incidencias hasta mayo de 2014, cuando se descubrió proteinuria de 100 mg/dl, que ascendió hasta 2.615 mg/dl en agosto de 2014, con sedimento negativo, función renal normal (creatinina 0,91 mg/dl), colesterol 368 mg/dl, con hemograma, proteinograma, inmunología y albúmina sérica normales. La presión arterial fue normal (133/87 mmHg). Se suspendió bevacizumab en septiembre de 2014, se prescribió atorvastatina 20 mg/día y se realizó biopsia renal percutánea. La muestra contenía 28 glomérulos, con 4 (14%) en esclerosis completa. Los glomérulos mostraban un diferente grado de afectación con engrosamiento moderado de asas capilares acompañado de incremento de matriz y celularidad mesangial, dando lugar a algunos con aspecto lobulado (fig. 1A); se apreciaban adherencias capsulares focales y glóbulos hialinos subendoteliales e intracapilares, sin observar cambios proliferativos intra- o extracapilares. Con las técnicas histoquímicas se apreciaban imágenes de doble contorno en asas capilares (fig. 1B), aspecto vacuolado del mesangio con interposición mesangial, con glóbulos hialinos débilmente PAS (reacción del ácido peryódico)-positivos y de color anaranjado pálido con el tricrómico de Masson, detectándose tan solo en 2 focos aislados fuchinofilia marcada. Muy focalmente se apreciaban imágenes de mesangiólisis con formación de microaneurismas sin imágenes oclusivas vasculares. Los glomérulos en esclerosis global mostraban colapso del penacho glomerular con fibrosis colágena de la cápsula de Bowman. En el compartimiento tubulointersticial se detectaron tan solo vacuolización tubular focal y ocasionales histiocitos espumosos intersticiales. A nivel vascular se apreciaba hialinosis arteriolar focal, zonas con edema en pared arteriolar, sin observar claros cambios trombóticos (fig. 1C). En la inmunofluorescencia sobre 9 glomérulos se observaban depósitos irregulares siguiendo el contorno capilar, con disposición granular intermitente y a veces en localización mesangial, positivos para IgM, C3, kappa y lambda y, con menor intensidad, C1q. Los glóbulos hialinos fueron positivos para todos estos marcadores (fig. 1D). El diagnóstico anatomopatológico fue de glomerulonefritis con patrón mesangiocapilar asociada a inmunocomplejos, sugestivamente secundaria. Se indicó la necesidad de realizar también un diagnóstico diferencial con una MAT subaguda.
Figura 1. A) Engrosamiento moderado de las asas capilares acompañado de un incremento en matriz mesangial, dando imagen de lobulación y presencia de un glóbulo hialino intracapilar (HE, 10×). B) Imágenes de doble contorno en asas capilares, vacuolización del mesangio y PAS (reacción del ácido peryódico)-positividad del glóbulo hialino (PAS-diastasa, 40×). C) Imagen de arteriola con edema parietal focal e hinchazón endotelial (HE, 40×). D) Depósitos de inmunoglobulina M (IgM) en disposición pericapilar y en glóbulo hialino (inmunofluorescencia anti-IgM, 10×).
Tras la retirada del bevacizumab se observó reducción progresiva de la proteinuria: a los 2 meses, albuminuria 1.175 mg/día y proteinuria 1.824 mg/día; a los 3 meses, albuminuria 385 mg/día y proteinuria 673 mg/día; a los 9 meses, albuminuria 30,8 mg/día y proteinuria 540 mg/día; a los 15 meses, albuminuria 107 mg/día y proteinuria 348 mg/día; a los 26 meses, albuminuria 13,7 mg/día y proteinuria 170 mg/día. No se administraron inhibidores de la enzima de conversión de la angiotensina ni bloqueadores del receptor de la angiotensina durante el seguimiento de la paciente.
DISCUSIÓN
El patrón histológico renal más frecuentemente observado en pacientes tratados con bevacizumab incluye lesiones similares a la MAT: mesangiólisis, trombosis intracapilar glomerular, patrón de dobles contornos con inmunofluorescencia negativa, depósitos subendoteliales, microaneurismas capilares. Clínicamente no suelen presentar datos de hemólisis periférica ni trombopenia, por lo que el cuadro de MAT parece limitarse al riñón5,7. En las zonas de mesangiólisis se ha podido demostrar reducción o ausencia de podocitos, con persistencia de los pedicelios sin cuerpos podocitarios acompañantes5. En ocasiones pueden observarse con la inmunofluorescencia depósitos de IgM y C3, especialmente en las formas más crónicas7,12, y a veces también depósitos de IgA7,10, en localización mesangial pero sobre todo en localización anómala, subendotelial7 o paramesangial10. Se han descrito también otros patrones histológicos que sugieren una patogenia inmune como patrones proliferativos focales6, glomerulonefritis membranoproliferativa8, glomerulonefritis crioglobulinémicas, nefropatía membranosa, nefropatía con depósitos de IgA10 o glomerulonefritis proliferativa extracapilar11.
En un modelo experimental con ratones mutantes a los que se frenó la producción de VEGF se observó que desarrollaban lesiones similares de MAT con edema endotelial, trombos capilares intraglomerulares y con demostración con inmunohistoquímica de fibrina intraglomerular y negatividad para complemento e inmunocomplejos7. Además se observó hemólisis en sangre periférica sin trombopenia, que indicó que el proceso es puramente intrarrenal. La presión arterial también ascendió al suprimir la producción de VEGF, lo que demostró la implicación de este factor en su aparición. La administración exógena de VEGF recombinante no logró revertir el cuadro. De ello se deduce que la lesión inicial radica en la propia célula endotelial tras el bloqueo del VEGF, provocando con ello un incremento de la permeabilidad glomerular y trasudación de proteínas plasmáticas desde los capilares hacia las zonas lesionadas subendoteliales, sin que estos depósitos, por tanto, lleguen a tener un significado patogénico propio.
La existencia de depósitos inmunes en las biopsias de pacientes tratados con bevacizumab ha llevado a postular algún tipo de sensibilización frente a los anticuerpos que constituyen el bevacizumab como mecanismo patogénico de la lesión glomerular. Pero esto parece poco plausible, ya que se han observado depósitos inmunes similares en casos asociados al uso de otros factores antiangiogénicos como el sunitinib5,13. En nuestro caso observamos acúmulos proteicos intracapilares y subendoteliales que fueron identificados como depósitos inmunes (IgM y C3), con una apariencia que recuerda más bien a los agregados que se forman en cuadros crioglobulinémicos (las crioglobulinas fueron negativas en nuestro caso). Estos depósitos se han observado a veces conformando verdaderas “gotas” intraglomerulares, con tinción positiva para IgA10, con aspecto que no tiene nada que ver con la nefropatía mesangial IgA clásica. A la luz de los datos experimentales y la histología es razonable postular que tales agregados proteicos con inmunoglobulinas no tengan significado patogénico, sino que sean simplemente expresión de la lesión de la permeabilidad endotelial y sean el resultado de trasudación de proteínas, explicando también su posterior reabsorción con el tiempo10. Los patrones histológicos serían reflejo de la respuesta del glomérulo a la trasudación de proteínas y al diferente daño observado en podocitos y células endoteliales en cada caso. La proliferación extracapilar podría incluso explicarse por la presencia de fibrina en el espacio de Bowman, que activaría la proliferación de células epiteliales y/o infiltración local por monocitos. Por todo ello, parece conceptualmente más correcto considerar como lesión de base una MAT, que en nuestro caso, además del ensanchamiento mesangial y del patrón lobular glomerular, mostraba lesiones más típicas (mesangiólisis, microaneurismas glomerulares, edema en paredes arteriolares), con insudación proteica concomitante y no con depósitos inmunes patogénicos, como sería el caso de una glomerulonefritis mesangioproliferativa.
Habitualmente, la retirada del fármaco se acompaña de mejoría del cuadro renal con reducción progresiva de la proteinuria y mejoría de la función renal7. En casos en los que se ha realizado una segunda biopsia se observa reducción de los depósitos de inmunocomplejos, tanto en la inmunofluorescencia como en los depósitos electrondensos en la microscopia electrónica10, casi desaparición completa de los depósitos subendoteliales y solo glomeruloesclerosis residual en un pequeño porcentaje glomerular. Esto explicaría un leve deterioro final del filtrado glomerular y/o la proteinuria residual que se observa con el tiempo, como ocurrió en nuestro caso. En casos con hemólisis periférica y trombopenia se ha llegado a realizar plasmaféresis observando un cese muy rápido del proceso hemolítico y una reducción de la proteinuria5,7. El uso de enalapril o losartán tiene un efecto negativo sobre la expresión de VEGF en ratas, por lo que no está claro si debería evitarse en estos casos para reducir la proteinuria.
Por tanto, en pacientes con proteinuria tras tratamiento con bevacizumab pueden descubrirse patrones histológicos variados, con cambios glomerulares proliferativos diferentes, con depósitos inmunes con características algo atípicas diferentes a las formas primarias. Deben buscarse con insistencia lesiones propias de una MAT, que pueden ser muy sutiles, y analizar la apariencia, distribución y naturaleza de los depósitos inmunes porque probablemente no tengan significado patogénico y sean simplemente resultado de la trasudación de proteínas en un glomérulo con gran lesión endotelial.
Conflicto de intereses
Los autores declaran que no tienen conflicto de intereses potencial relacionado con los contenidos de este artículo.
Correspondencia: Francisco José Borrego Utiel
Servicio de Nefrología.
Complejo Hospitalario de Jaén.
Avda. Ejército Español, 10. 23007 Jaén.
fborregou@senefro.org